El carcinoma de células de Merkel (CCM) es una tumoración de origen neuroendocrino muy poco frecuente y de crecimiento rápido y agresivo, que origina con frecuencia recidivas locorregionales y metástasis a distancia. Suele presentarse sobre áreas fotoexpuestas, principalmente cabeza, cuello y extremidades superiores, y entre los factores de riesgo asociados a su desarrollo se encuentran la inmunosupresión, la edad avanzada, la piel clara y la presencia de neoplasia previa1. Dentro de las pruebas de imagen utilizadas para su estadificación y planificación quirúrgica figuran la TC y la RMN2,3, si bien son escasas las referencias en la literatura donde se recojan las características ecográficas de este carcinoma.
Presentamos los hallazgos ecográficos encontrados en 5 pacientes con carcinoma primario de células de Merkel utilizando una sonda lineal de 18MHz. En todos los casos se confirmó el diagnóstico mediante biopsia cutánea preoperatoria.
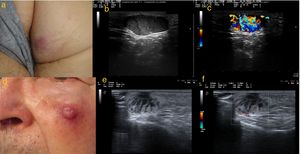
En modo B todos los tumores se presentaron como lesiones hipoecoicas bien delimitadas y localizadas a nivel dermo-hipodérmico. En 2 de los tumores se apreciaba un contenido homogéneo, mientras que los 3 restantes presentaban contenido heterogéneo (en un caso con septos hiperecoicos en su interior, y en 2 casos con líneas hipoecoicas perpendiculares a la superficie cutánea). Además 3 de las lesiones presentaban refuerzo acústico posterior, y en 2 se apreciaba un adelgazamiento de la epidermis suprayacente.
En modo Doppler color, las lesiones se presentaron en su mayoría con importante vascularización intralesional. La vascularización se distribuía predominantemente en la zona basal en las lesiones excepto en el tumor que presentaba líneas hiperecogénicas en modo B, donde la señal Doppler fue intensamente positiva en dichos septos (figs. 1 y 2).
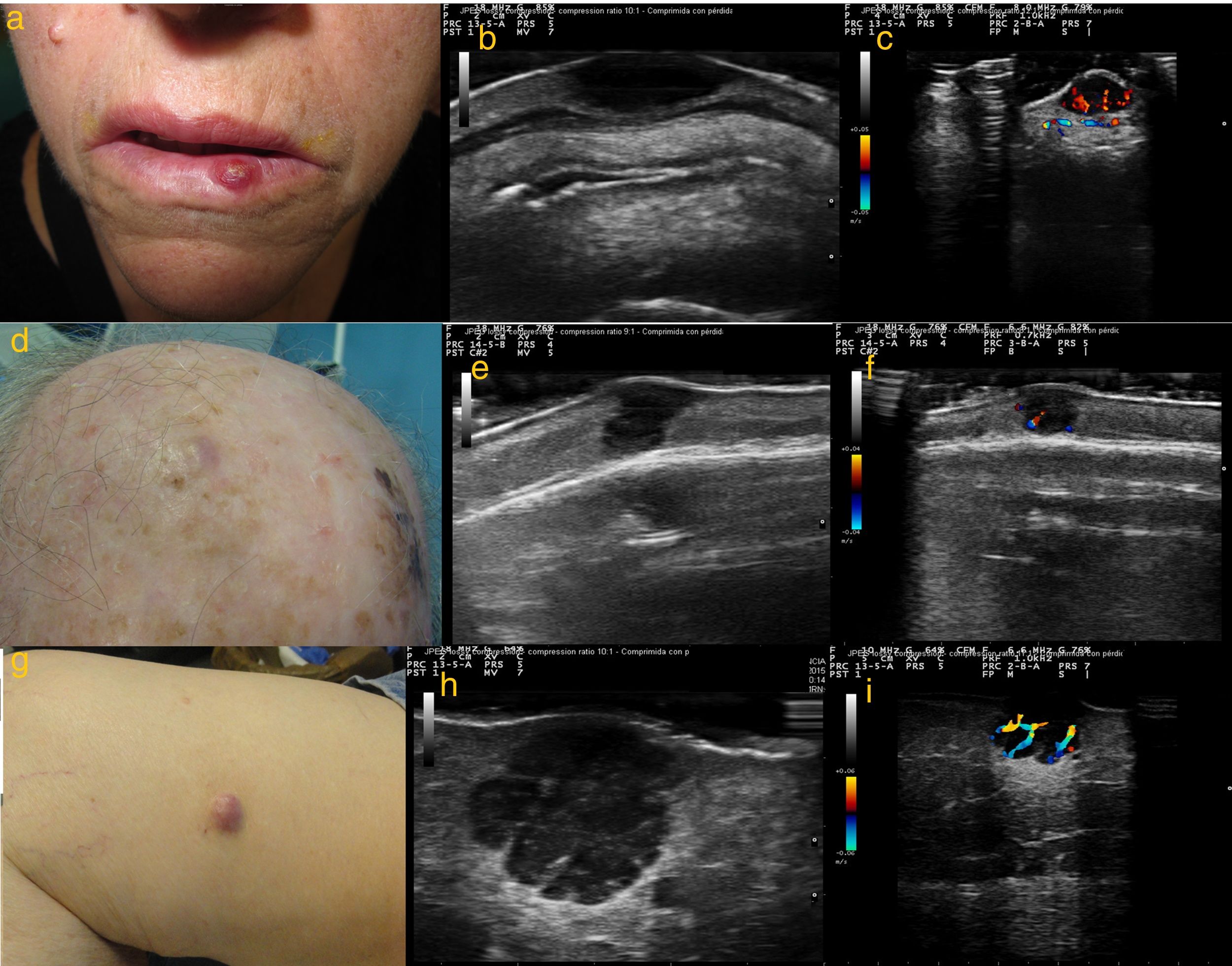
a) Caso 1: lesión eritematosa e infiltrada, de consistencia firme, de 1cm de diámetro en hemilabio inferior izquierdo; b) Modo B: lesión hipoecoica homogénea localizada en dermis, con bordes bien delimitados; c) Modo Doppler color: importante vascularización de predominio en la zona basal; d) Caso 2: nódulo subcutáneo con piel suprayacente de coloración rosada de 8mm de diámetro, localizado en región parietal derecha; e) Modo B: lesión hipoecoica dermoepidérmica; f) Modo Doppler color: señal Doppler leve perilesional; g) Caso 3: nódulo de coloración rosada de 18mm de diámetro en cara interna de muslo derecho; h) Modo B: lesión hipoecoica polilobulada localizada a nivel dermo-hipodérmico, con bordes bien delimitados y refuerzo acústico posterior. En su interior se visualizan septos hiperecoicos; i) Modo Doppler color: vascularización intralesional de predominio en septos.
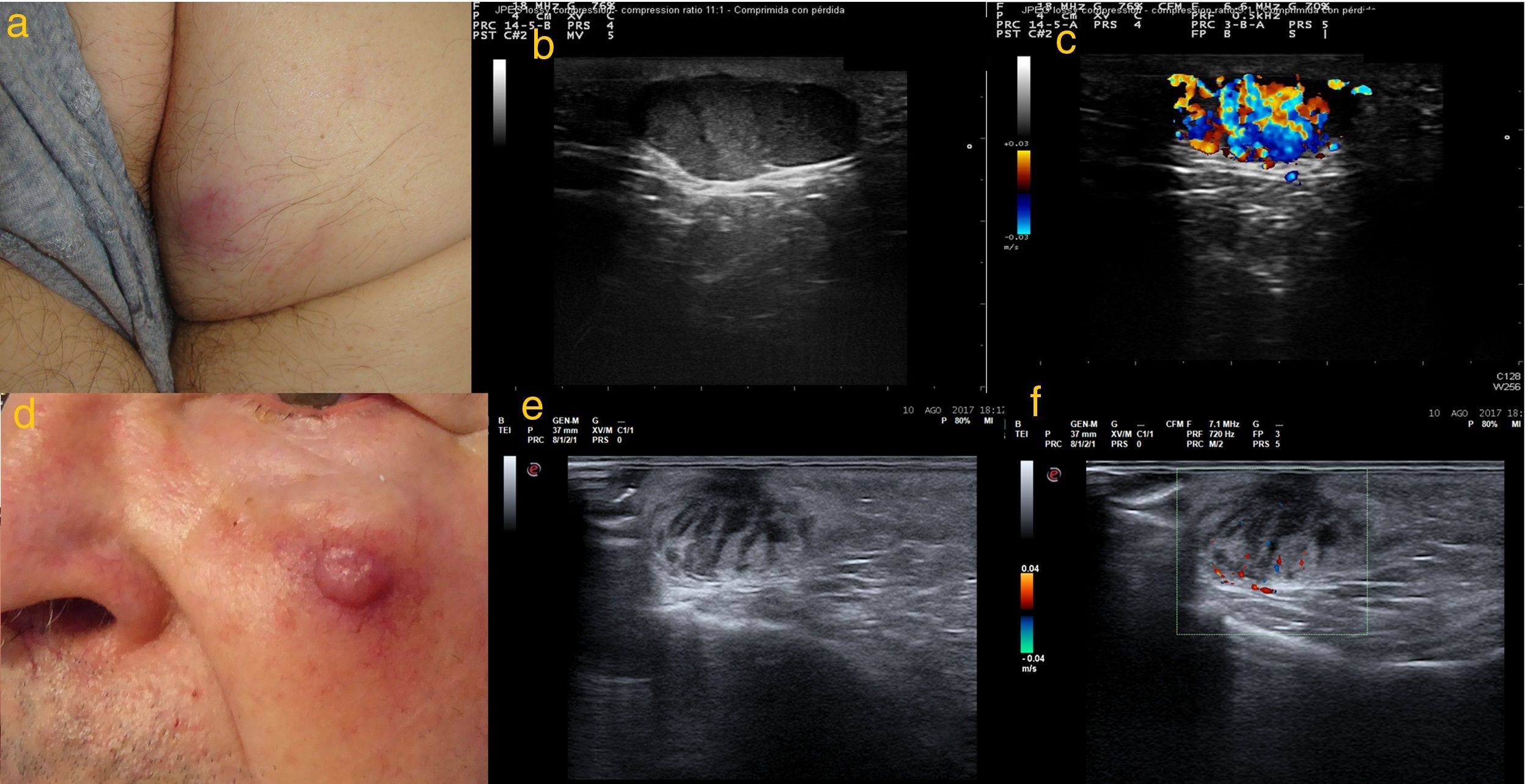
a) Caso 4: lesión subcutánea de consistencia elástica de 20mm de diámetro en glúteo derecho, con tonalidad epidérmica violácea; b) Modo B: lesión hipoecoica localizada a nivel hipodérmico, de contenido heterogéneo y líneas hipoecoicas perpendiculares a la epidermis en «columna de humo», bordes bien delimitados y refuerzo acústico posterior; c) Modo Doppler color: vascularización intralesional; d) Caso 5: nódulo eritematoso sobre lesión subcutánea de 22mm de diámetro en mejilla izquierda; e) Modo B: lesión hipoecóica localizada en dermis de contenido heterogéneo y líneas hipoecóicas perpendiculares a epidermis en «columnas de humo»; f) Modo Doppler color: vascularización intralesional de predominio en zona basal.
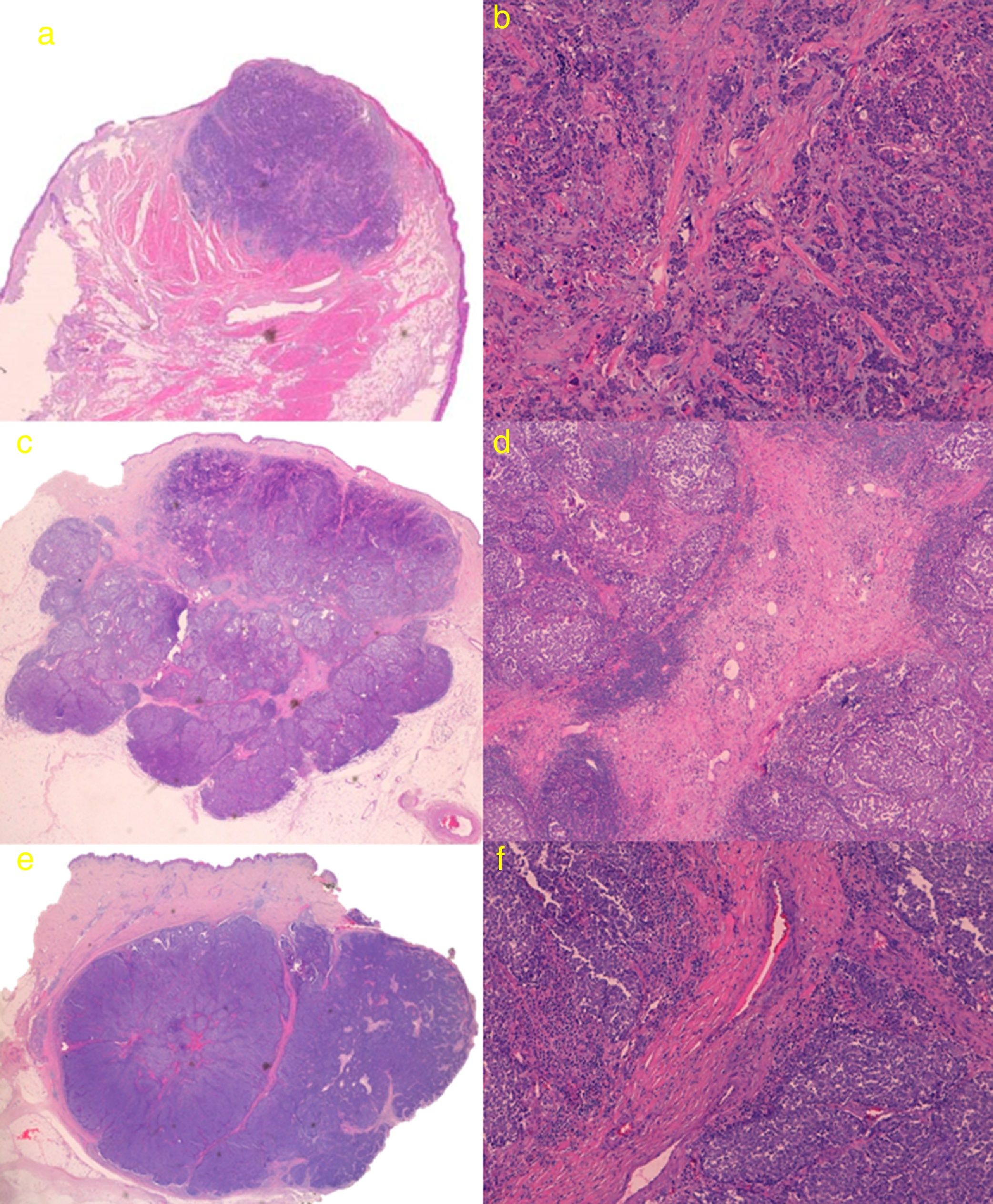
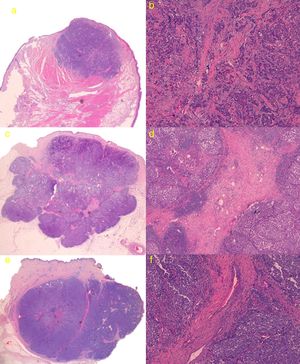
El estudio histológico de la tumoración completa se pudo llevar a cabo en 3 de los pacientes, debido a que 2 de las lesiones (casos 2 y 5) regresaron de forma espontánea tras la biopsia cutánea (confirmándose mediante estudio histológico de pieza quirúrgica). En los 3 casos la tumoración presentó un patrón sólido de crecimiento, uno de los casos con bordes espiculados y los otros 2 tumores con bordes mejor delimitados y estructura lobulada. Los 3 tumores presentaban trabéculas fibrosas separando las células, el primer caso presentó tractos finos con escasas estructuras vasculares, mientras que los 2 tumores restantes presentaron tractos fibrosos gruesos con numerosas estructuras vasculares en su interior (fig. 3). Se realizó inmunohistoquímica en los 5 casos resultando positivas para cromogranina, sinaptofisina, CD56 y paranuclear con citoqueratina 20, siendo negativas para CD45, proteína S100 y TTF-1.
a) Caso 1: lesión con patrón sólido de crecimiento con bordes ligeramente espiculados. Hematoxilina-eosina (H&E); b) Detalle de trabéculas fibrosas en forma de tractos finos con escasas estructuras vasculares (H&E ×100); c) Caso 3: tumoración con bordes mejor delimitados y estructura lobulada, con tractos fibrosos que se parece corresponder con las líneas intralesionales hiperecogénicas que se visualizan en la ecografía cutánea en modo B (H&E); d) Detalle de tractos fibrosos gruesos con numerosas estructuras vasculares en su interior (H&E ×40); e) Caso 4: lesión lobulada con tracto fibroso grueso perpendicular a la epidermis, que parece corresponderse ecográficamente con línea hipoecoica visualizada en modo B; f) Detalle de tracto fibroso grueso central con estructuras vasculares de mayor calibre que en el caso 3 (H&E ×100).
Clásicamente se ha utilizado la ecografía en pacientes con CCM para el estudio de cadenas ganglionares locorregionales, encontrándose pocas referencias en la literatura donde se recojan las características ecográficas de este carcinoma4,5. Wortsman et al. describieron ecográficamente el CCM como lesiones hipoecoicas localizadas en la región dermo-hipodérmica, con bordes mal delimitados e importante vascularización intralesional6. Aunque existe bastante diversidad entre los hallazgos ecográficos de nuestros casos, todos presentaban características similares a lo descrito salvo los bordes de la lesión tumoral, donde en nuestros casos todas las lesiones presentaron bordes bien delimitados.
Otros autores han descrito como hallazgos ecográficos frecuentes en estos tumores un refuerzo acústico posterior y un adelgazamiento de la epidermis suprayacente7–9, siendo nuestros casos concordantes con lo descrito en estas series. Recientemente Hernández-Aragüés et al.7 han descrito la presencia de bandas hipoecoicas lineales que describen en «columna de humo», perpendiculares a la superficie cutánea en 2 casos de CCM primarios, con presencia de vascularización en el modo Doppler. En nuestra serie, 2 de los casos presentaban estas bandas hipoecoicas, si bien la vascularización de estos tumores no se focalizaba en estas bandas.
En relación con el estudio histológico de los tumores, pudimos observar que tanto uno de tumores con imagen ecográfica en «columnas de humo» y en aquel que presentaba septos hiperecogénicos en el interior de la lesión, mostraban tractos fibrosos gruesos separando las células. Si bien la presencia de estas trabéculas fibrosas con abundantes estructuras vasculares parecían corresponderse en la imagen ecográfica con las líneas hipoecoicas perpendiculares y con los septos hiperecogénicos, respectivamente, no encontramos otras diferencias histológicas que expliquen la diferente ecogenicidad de estas estructuras en ambos tumores.
En conclusión, tras el análisis de nuestros casos además de los descritos en la literatura no podemos afirmar que exista un patrón ecográfico distintivo de esta entidad ni tampoco qué peso pueden tener algunas de las características ecográficas encontradas para el diagnóstico o pronóstico de estos pacientes. Aun así, no cabe duda de que la ecografía cutánea resulta útil para conocer la localización del tumor, su extensión, su vascularización y la relación con estructuras adyacentes, facilitando el abordaje quirúrgico. Además nos permite precisar de forma objetiva el tamaño del tumor, el grado de infiltración de estructuras profundas, así como la identificación de posibles metástasis subcutáneas o en tránsito, lo cual posibilita una mejor estadificación de estos tumores y una primera aproximación sobre el pronóstico de los mismos10.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.