Las neoplasias anexiales cutáneas malignas constituyen un grupo de carcinomas poco frecuentes, habitualmente de bajo grado de malignidad, que muestran diferenciación folicular, sebácea, apocrina o ecrina o una combinación de las 3 primeras. Clínicamente suelen ser neoplasias con características poco distintivas, siendo necesaria una biopsia que permitirá establecer el tipo de diferenciación y el diagnóstico definitivo. Al tratarse de una enfermedad poco frecuente, no existe un claro consenso sobre el tratamiento más eficaz. En la mayoría de casos se considera la microcirugía de Mohs como la opción más efectiva para prevenir recidivas. La radioterapia y quimioterapia han sido escasamente estudiadas y solo se han mostrado eficaces en escasas ocasiones.
Malignant cutaneous adnexal neoplasms form a group of rare, typically low-grade-malignancy carcinomas with follicular, sebaceous, apocrine, or eccrine differentiation or a combination of the first 3 subtypes. Their clinical presentation is usually unremarkable, and biopsy is required to establish the differentiation subtype and the definitive diagnosis. Due to their rarity, no clear consensus has been reached on which treatment is most effective. Mohs micrographic surgery is considered to be the best option to prevent recurrence in the majority of patients. Radiotherapy and chemotherapy have been studied in very few cases and have rarely been shown to be effective.
Las neoplasias anexiales cutáneas malignas constituyen un grupo de carcinomas poco frecuentes, habitualmente de bajo grado de malignidad. Aunque la mayoría de ellas tiene escaso potencial de producir metástasis a distancia, se trata de neoplasias muy destructivas localmente y que requieren extirpaciones amplias para asegurar márgenes libres de tumoración. Si bien las características histopatológicas nos permiten identificarlas, las características clínicas en general son muy inespecíficas. El tipo de diferenciación en cada neoplasia se establece mediante la identificación de hallazgos histopatológicos de la misma que reproducen alguna de las estructuras del anejo cutáneo normal correspondiente. En general, como neoplasias malignas que son, estos hallazgos de diferenciación son poco evidentes, y habitualmente se requiere el estudio de cortes seriados o de algunas técnicas inmunohistoquímicas para poder establecer el tipo de diferenciación en un determinado carcinoma anexial. Muchos de estos carcinomas únicamente muestran diferenciación ductal, y como el ducto ecrino y el apocrino hoy por hoy son indistinguibles desde el punto de vista histológico, inmunohistoquímico y ultraestructural, lo único que podemos decir en estos casos es que se trata de un carcinoma ductal, sin que podamos establecer una diferenciación más concreta. Si bien la diferenciación es escasa, existen algunas características histopatológicas que nos pueden orientar a que nos encontremos ante una enfermedad maligna, como se describe en la tabla 1. En este trabajo revisaremos las neoplasias anexiales cutáneas malignas, que se enumeran en la tabla 2.
Diagnóstico diferencial histopatológico entre neoplasia benigna y neoplasia maligna
| Neoplasias benignas | Neoplasias malignas |
|---|---|
| Simétrica | Asimétrica |
| Bien circunscrita | Mal circunscrita |
| A menudo, forma de V abierta hacia arriba | A menudo, sin forma de V abierta hacia arriba |
| A menudo, orientación vertical | A menudo, orientación horizontal |
| Bordes lisos | Bordes dentados |
| Tejido fibroso periférico dispuesto de manera compacta | Tejido fibroso periférico dispuesto de manera no compacta |
| Grietas de separación entre el estroma de la neoplasia y la dermis sana adyacente | Grietas de separación entre epitelio y estroma de la neoplasia |
| A menudo, se enuclea fácilmente tras la incisión | A menudo, no se enuclea fácilmente tras la incisión |
| El estroma predomina sobre el epitelio | El epitelio predomina sobre el estroma |
| Tiende a estar localizada superficialmente | Tiende a infiltrar en profundidad |
| No ulcera la epidermis | A menudo, ulcera la epidermis |
| Los islotes tumorales están separados por abundante estroma | Los islotes tumorales están separados por escaso estroma |
| Los islotes tumorales son relativamente uniformes en forma y tamaño | Los islotes tumorales varían en forma y tamaño |
| Islotes tumorales individuales y de pequeño tamaño | Islotes tumorales confluentes «en sábana» |
| Bien diferenciada | Mal diferenciada |
| Estructuras anexiales preexistentes conservadas | Estructuras anexiales preexistentes destruidas por la neoplasia |
| Habitualmente, no necrosis en masa | A menudo, necrosis en masa |
| No células neoplásicas en localización perineural | A menudo, células neoplásicas en localización perineural |
| No células neoplásicas en localización intravascular | A veces, células neoplásicas en localización intravascular |
| No se observan cordones de células epiteliales entre los haces de colágeno | Cordones epiteliales entre los haces de colágeno |
| Los islotes tumorales tienden a disminuir de tamaño a medida que penetran en la dermis | Los islotes tumorales no tienden a disminuir de tamaño a medida que penetran en la dermis |
Clasificación de las neoplasias anexiales malignas según su tipo de diferenciación
| Neoplasias anexiales malignas con diferenciación folicular |
| Pilomatrixcarcinoma |
| Neoplasias anexiales malignas con diferenciación sebácea |
| Carcinoma sebáceo |
| Neoplasias anexiales malignas con deferenciación ecrina o apocrina |
| Siringocistodenocarcinoma papilífero |
| Carcinoma tubular |
| Carcinoma papilar |
| Hidroadenocarcinoma papilífero |
| Hidroadenocarcinoma apocrino |
| Tumor mixto maligno |
| Cilindrocarcinoma |
| Espiradenocarcinoma |
| Carcinoma siringoide |
| Porocarcinoma |
| Carcinoma anexial microquístico |
| Carcinoma adenoide quístico |
| Carcinoma mucinoso |
| Carcinoma de células en anillo de sello |
| Enfermedad de Paget extramamaria |
El pilomatrixcarcinoma (PMC) es una neoplasia que aparece en forma de un nódulo solitario casi siempre en la mitad superior del cuerpo1, con predominio en varones de edad media o avanzada. La mayoría de los casos publicados muestran un comportamiento biológico poco agresivo, aunque también existen ejemplos de PMC que han producido metástasis a los ganglios linfáticos regionales y a los órganos internos causando la muerte del paciente2.
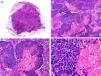
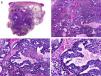
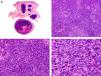
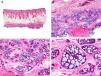
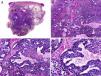
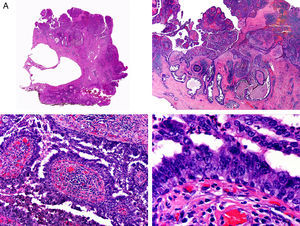
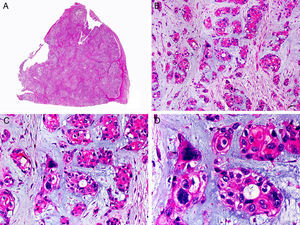
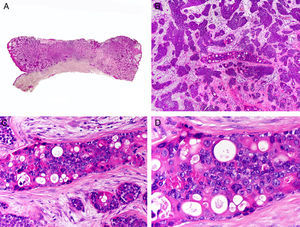
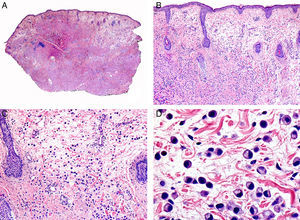
Desde el punto de vista histopatológico es una neoplasia asimétrica y mal delimitada, que con frecuencia ulcera la epidermis que la recubre. Está constituida por una proliferación de células basaloides inmaduras, que recuerdan a las de la matriz folicular, agrupadas bien en islotes sólidos bien en forma de cordones que infiltran la dermis profunda, el tejido celular subcutáneo e incluso la fascia y el músculo (fig. 1). El hallazgo más característico consiste en la presencia de islotes de células sombra como evidencia de diferenciación matricial3.
Características histopatológicas del pilomatrixcarcinoma. A. Visión panorámica mostrando una lesión constituida por numerosos islotes tumorales infiltrando la dermis. B. Islotes de células matriciales con células sombra en su centro. C. Detalle de las células matriciales y las células sombra. D. Detalle a gran aumento de las células neoplásicas con diferenciación matricial. (Hematoxilina-eosina, A ×10, B ×40, C ×200, D ×400).
El PMC es un tumor maligno que habitualmente muestra una agresividad local, con invasión de las estructuras adyacentes y persiste en el 60% de los casos debido a una extirpación incompleta de la lesión primitiva4. Cuando producen metástasis puede ser por vía hematógena o linfática, habiéndose descrito pacientes que han fallecido como consecuencia de metástasis diseminadas5. La mayoría de publicaciones recomiendan extirpaciones amplias con márgenes entre 5mm y 2cm6,7, siendo la cirugía de Mohs (CMM) una opción con buenos resultados al obtener márgenes libres con mayor frecuencia8,9. Los casos en los que se ha utilizado radioterapia adyuvante presentan resultados variables, sin mejoría clara de la tasa de recurrencias. Los tratamientos quimioterápicos intravenosos no se han mostrado efectivos9. Debido a la alta tasa de recurrencias y de metástasis, principalmente linfáticas, se recomienda el seguimiento periódico cada 4-6 meses con examen clínico, incluyendo el de los ganglios linfáticos regionales9.
Carcinoma sebáceoExisten 2 variantes clínicas de carcinoma sebáceo, el ocular y el extraocular. Esta distinción se basa no solo en la distinta localización anatómica de la tumoración, sino también en que clásicamente se ha considerado que el carcinoma sebáceo ocular tenía mayor potencial metastásico que el extraocular. Sin embargo, estudios recientes parecen cuestionar esta distinción10.
En general, el carcinoma sebáceo (CS) de párpado es una neoplasia que se desarrolla en pacientes de edad avanzada y frecuentemente se interpreta clínicamente como una lesión inflamatoria, retrasando el diagnóstico. La mayoría de las lesiones de CS extraocular se desarrollan en la cara y el cuello de pacientes de edad avanzada. Clínicamente la lesión aparece como un nódulo o una placa indurada, que en ocasiones ulcera la epidermis.
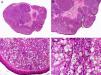
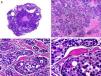
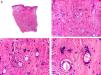
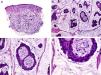
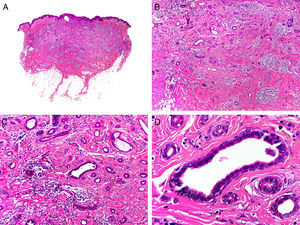
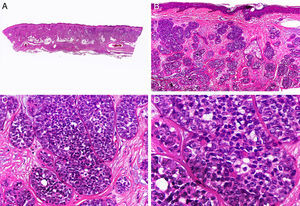
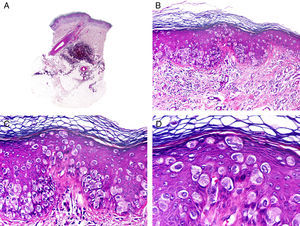
Histopatológicamente, el CS se presenta como una lesión mal delimitada, constituida por islotes epiteliales que infiltran la dermis o el corion de la mucosa conjuntival, en el caso de los de párpado, y frecuentemente se extiende al tejido celular subcutáneo (fig. 2). El grado citológico de diferenciación sebácea en estas neoplasias es variable, y algunas muestran células neoplásicas con una morfología de sebocitos completamente maduros con su citoplasma repleto de vacuolas lipídicas y el núcleo retraído con contorno espiculado, debido a la presión que ejercen las vacuolas lipídicas del citoplasma sobre la membrana nuclear, y otras aparecen como células basaloides inmaduras. La presencia de conductos con morfología similar a la del conducto sebáceo, con cutícula aserrada, puede ser una buena clave diagnóstica11. En la actualidad, la adipofilina constituye un marcador inmunohistoquímico muy útil de diferenciación sebácea que se puede investigar en material fijado en formol e incluido en parafina12.
Características histopatológicas del carcinoma sebáceo. A. Visión panorámica mostrando islotes de células neoplásicas infiltrando todo el espesor de la dermis. B. Tendencia a confluir de algunos agregados de células neoplásicas. C. Detalle de la diferenciación sebácea en forma de sebocitos en distintos estadios de maduración. D. Sebocitos en distintos estadios madurativos. (Hematoxilina-eosina, A ×10, B ×40, C ×200, D ×400).
El tratamiento de elección es la extirpación quirúrgica, y existen varios trabajos proponiendo la CMM como la mejor alternativa terapéutica13. La radioterapia adyuvante en casos recurrentes o con metástasis se ha mostrado efectiva14. Un diagnóstico de carcinoma sebáceo obliga a descartar un síndrome de Muir-Torre en el paciente15.
Siringocistoadenocarcinoma papilíferoParece ser que la mayoría de las siringocistoadenocarcinomas papilíferos (SCAP) descritos se han originado por degeneración maligna de un siringocistoadenoma papilífero preexistente, casi siempre en un nevus de Jadassohn16. Es más frecuente en mujeres, con preferencia por el cuero cabelludo. Clínicamente aparece como una placa formada por la confluencia de múltiples pápulas amarillentas, que en algunas áreas se ulceran y se cubren de costras.
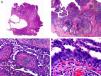
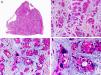
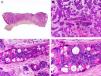
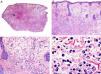
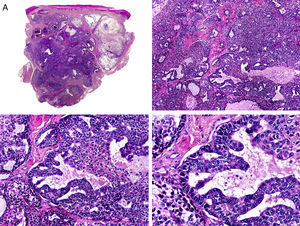
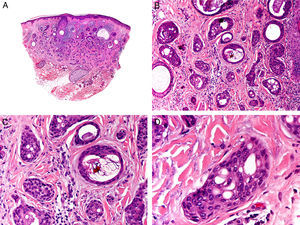
Es similar histopatológicamente a su contrapartida benigna, ya que aparece constituido por grandes estructuras papilares, pero se diferencia por tratarse de una neoplasia asimétrica, mal delimitada y que invade la hipodermis y los tejidos subyacentes. Las formaciones papilares se proyectan en el interior de cavidades quísticas, que a su vez están conectadas con el epitelio de infundíbulos foliculares preexistentes y están revestidas por un epitelio con signos claros de atipia y frecuentes figuras de mitosis (fig. 3)17.
Características histopatológicas del siringocistoadenocarcinoma papilífero. A. Visión panorámica mostrando agregados de células neoplásicas de forma y tamaño variable infiltrando la dermis. B. Formaciones papilares conectadas con la superficie epidérmica. C. Las estructuras papilares están tapizadas por una doble hilera de células epiteliales. D. Imágenes de atipia y pleomorfismo nuclear en las células epiteliales que tapizan las papilas. (Hematoxilina-eosina, A ×10, B ×40, C ×200, D ×400).
El SCAP se comporta como un adenocarcinoma de bajo grado de malignidad. De los 36 casos descritos en la literatura 5 han desarrollado metástasis linfáticas regionales y solo uno de estos pacientes murió como consecuencia de la enfermedad18–22. La CMM ha demostrado buenos resultados, pero la extirpación con márgenes amplios sigue siendo el tratamiento más utilizado. La efectividad de la radioterapia no está clara al presentar resultados variables22,23.
Carcinoma tubularEl carcinoma tubular apocrino es más frecuente en mujeres en edad media, apareciendo como un nódulo subcutáneo de consistencia firme, que a veces se adhiere a los tejidos subyacentes. La localización preferente es la axila.
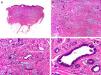
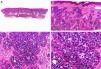
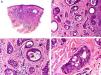
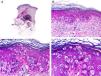
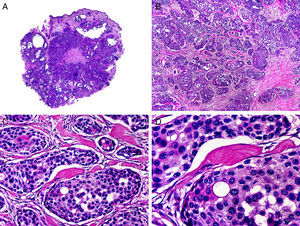
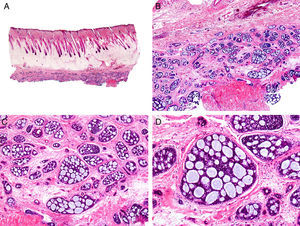
Desde el punto de vista histopatológico se caracteriza por tratarse de una neoplasia constituida por múltiples estructuras ductales que se agrupan muy próximas unas a otras ocupando todo el espesor de la dermis y el tejido celular subcutáneo, disminuyendo el tamaño de las luces glandulares y los agregados tumorales a medida que la lesión penetra en la dermis (fig. 4). Antes de establecer un diagnóstico de carcinoma tubular primitivamente cutáneo debemos descartar que la lesión se trate de una metástasis cutánea de un adenocarcinoma visceral o un carcinoma tubular en la prolongación axilar de la mama.
Características histopatológicas del carcinoma tubular. A. Visión panorámica mostrando estructuras tubulares que infiltran la dermis. B. Estructuras tubulares inmersas en un estroma esclerótico. C. Estructuras tubulares de forma y tamaño variable. D. Indicios de secreción por decapitación en uno de los túbulos. (Hematoxilina-eosina, A ×10, B ×40, C ×200, D ×400).
La lesión debe extirparse quirúrgicamente en su totalidad. El carcinoma tubular muestra un comportamiento biológico más maligno que otros carcinomas anexiales, con varios casos descritos con metástasis a distancia y muerte del paciente como consecuencia de enfermedad diseminada24.
Carcinoma papilar (adenocarcinoma papilar digital agresivo)El carcinoma papilar (CP) es más frecuente en hombres y muestra una llamativa predilección por asentar en dedos en forma de nódulo subcutáneo de consistencia firme, que en ocasiones ulcera la epidermis que lo recubre.
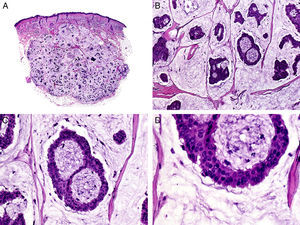
Histopatológicamente el CP, a pesar de esta denominación, es una neoplasia predominantemente sólida, y solo focalmente las estructuras tubulares con papilas en su interior pueden ser predominantes25. Las células neoplásicas son células basaloides con núcleo hipercromático que se agrupan mayoritariamente en agregados sólidos (fig. 5).
Características histopatológicas del carcinoma papilar. A. Visión panorámica mostrando una neoplasia que infiltra todo el espesor de la dermis y se extiende al tejido celular subcutáneo. B. Agregados de células neoplásicas de forma y tamaño variable. C. Esbozos de formaciones papilares en algunos de los agregados neoplásicos. D. Detalle de las formaciones papilares. (Hematoxilina-eosina, A ×10, B ×40, C ×200, D ×400).
El CP es una neoplasia maligna de crecimiento lento, con alta tasa de persistencia tras extirpaciones incompletas. Se ha descrito la muerte de 3 pacientes como consecuencia de enfermedad metastásica diseminada muchos años después del diagnóstico, demostrando el bajo grado de malignidad de esta neoplasia26. Cuando el tumor se extirpa de forma radical o se realiza amputación digital en los casos en dicha localización, las recidivas bajan del 50% tras extirpaciones conservadoras hasta un 5%27. Debido a la frecuencia de diseminación se recomienda el estudio de ganglios linfáticos regionales y placa de tórax tras el diagnóstico, y en las revisiones anuales al menos durante 10 años después de la extirpación, sin que se haya establecido con seguridad la utilidad de la biopsia de ganglio centinela.
Hidroadenocarcinoma papilíferoEs frecuente que el hidroadenocarcinoma papilífero (HACP) se origine en un hidroadenoma papilífero preexistente. La mayoría de los casos descritos estaban localizados en la región anogenital de mujeres en edad media. Las lesiones consistían en tumoraciones excrecentes o nódulos subcutáneos, que a veces ulceraban la superficie que los recubría drenando un material sanguinolento, y en la mayoría de los casos se consideraron clínicamente como quistes sobreinfectados.
A pequeño aumento, el HACP muestra una apariencia que recuerda a la del hidroadenoma papilífero, ya que aparece constituido por una estructura quística con formaciones papilares protruyendo hacia el interior de este quiste. Una observación más cuidadosa demuestra una arquitectura irregular, con infiltración de los tejidos adyacentes. Las formaciones papilares están constituidas por un eje central de tejido fibrovascular tapizado por una doble hilera de células epiteliales, entre las que se observa pleomorfismo nuclear y frecuentes figuras de mitosis28.
TratamientoEl HACP tiene potencial metastásico, debiendo extirparse en su totalidad. De los 9 ejemplos descritos en la literatura, 3 mostraban metástasis en los ganglios linfáticos regionales en el momento del diagnóstico, y en 2 se produjo la muerte como consecuencia de enfermedad metastásica diseminada.
Hidroadenocarcinoma apocrinoEl hidroadenocarcinoma apocrino es más frecuente en varones alrededor de los 50 años. La neoplasia aparece como un nódulo subcutáneo asintomático con características clínicas inespecíficas.
El hidroadenocarcinoma apocrino aparece histopatológicamente como una neoplasia multilobulada, con islotes sólidos de células neoplásicas que varían en forma y tamaño, y que infiltran en profundidad de manera asimétrica (fig. 6). La presencia de formaciones tubulares es evidente en la mayoría de las lesiones, mostrando en ocasiones secreción por decapitación en el borde luminal29.
Características histopatológicas del hidroadenocarcinoma apocrino. A. Visión panorámica de una neoplasia que infiltra todo el espesor de la dermis. B. Variabilidad de agregados neoplásicos en forma y tamaño. C. Algunos agregados neoplásicos están constituidos por células de citoplasma pálido. D. Detalle de uno de los agregados neoplásicos mostrando diferenciación ductal. (Hematoxilina-eosina, A ×10, B ×40, C ×200, D ×400).
A día de hoy el tratamiento de la enfermedad localizada es la extirpación quirúrgica completa. En los pocos casos publicados se ha observado que estos carcinomas presentan comportamiento biológico agresivo, con altas tasas de recurrencia local, así como metástasis con pronóstico desfavorable en general. Existe una publicación con buena respuesta a quimioterapia y radioterapia en un paciente con enfermedad diseminada30.
Tumor mixto malignoEl tumor mixto maligno (TMM) no muestra características clínicas distintivas, apareciendo como un nódulo subcutáneo que en ocasiones ulcera la epidermis. A veces, la neoplasia infiltra los tejidos subyacentes, apareciendo adherida a planos profundos. El TMM muestra histopatológicamente una arquitectura irregular con presencia de un doble componente, epitelial y mesenquimal, con formación de ductos y pequeños túbulos en el interior del componente epitelial. Habitualmente el componente mesenquimal del tumor mixto maligno es mixoide (fig. 7) y, más rara vez, condroide u osteoide31.
Características histopatológicas del tumor mixto maligno. A. Visión panorámica mostrando una neoplasia mal delimitada. B. Agregados de células epiteliales neoplásicas inmersas en un estroma mixoide. C. Los agregados neoplásicos están constituidos por células de núcleo atípico y pleomórfico. D. Alguno de los agregados neoplásicos muestra evidencia de diferenciación ductal. (Hematoxilina-eosina, A ×10, B ×40, C ×200, D ×400).
Más de la mitad de los ejemplos descritos de TMM han dado lugar a metástasis, tanto a los ganglios linfáticos regionales como a distancia, ocasionando la muerte a varios pacientes. Por lo tanto, únicamente la extirpación quirúrgica completa de la neoplasia, antes de que el proceso metastásico se haya iniciado, consigue la curación.
CilindrocarcinomaEl cilindrocarcinoma es más frecuente por degeneración maligna de un cilindroma preexistente que originado de novo, siendo más frecuente en pacientes con lesiones múltiples. Son lesiones que tras años de estabilidad presentan un crecimiento rápido, incluso ulcerando la epidermis. Es frecuente que en el momento de la consulta la lesión ya infiltre la tabla ósea del cráneo subyacente.
Histopatológicamente, el cilindrocarcinoma (CC) aparece constituido por múltiples islotes de células basaloides dispuestas con un patrón en rompecabezas (fig. 8), recordando a un cilindroma. A veces, ambas neoplasias, cilindroma y CC, están presentes en la misma lesión y puede observarse una transición gradual entre ellas. La asimetría arquitectural, así como la atipia citológica, con presencia de áreas de necrosis debe llevar al diagnóstico de CC32.
Características histopatológicas del cilindrocarcinoma. A. Visión panorámica mostrando una neoplasia mal delimitada que infiltra todo el espesor de la dermis. B. La neoplasia está constituida por agregados de células neoplásicas basaloides. C. Estos agregados se distribuyen con un patrón en «rompecabezas» acoplándose unos con otros. D. Detalle de uno de los agregados de células neoplásicas rodeados por una gruesa membrana basal. (Hematoxilina-eosina, A ×10, B ×40, C ×200, D ×400).
El CC es un carcinoma de alto grado de malignidad y debe ser extirpado quirúrgicamente con márgenes amplios. De los 29 casos descritos en la literatura 11 dieron lugar a metástasis a distancia y 9 pacientes murieron como consecuencia de la enfermedad metastásica diseminada. La CMM ha sido propuesta como la mejor alternativa terapéutica33.
EspiradenocarcinomaClínicamente suele presentarse como un espiradenoma de larga evolución, que repentinamente comienza a crecer. Es más frecuente en las extremidades, aunque puede aparecer en cualquier área corporal.
Histopatológicamente, los espiradenocarcinomas (EAC) se dividen en bien y mal diferenciados. Los primeros presentan hallazgos en común con el espiradenoma, apareciendo constituidos por agregados epiteliales de células basaloides, con múltiples formaciones ductales en su interior (fig. 9). Sin embargo, se trata de lesiones asimétricas y mal delimitadas, en las que los islotes de células epiteliales muestran gran variabilidad en forma y tamaño, con frecuentes áreas de necrosis e infiltración de los tejidos adyacentes. En los EAC mal diferenciados solo puede establecerse con seguridad el diagnóstico cuando se observan restos de un espiradenoma en la vecindad de un carcinoma indiferenciado, porque la neoplasia está muy pobremente diferenciada y en algunos casos compuesta por células fusiformes y puede confundirse con un sarcoma34.
Características histopatológicas del espiradenocarcinoma. A. Visión panorámica mostrando un espiradenoma en la dermis y un nódulo de espiradenocarcinoma en el tejido celular subcutáneo. B. El nódulo de espiradenocarcinoma está constituido por una sábana de las células neoplásicas. C. Estas células neoplásicas muestran núcleos pleomórficos y frecuentes figuras de mitosis. D. Detalle a gran aumento de las células neoplásicas, varias de ellas en mitosis. (Hematoxilina-eosina, A ×10, B ×40, C ×200, D ×400).
El EAC debe extirparse quirúrgicamente en su totalidad, al ser un carcinoma de alto grado de malignidad. De los 31 casos descritos en la literatura, 12 presentaban metástasis a distancia en el momento del diagnóstico, y al menos 5 pacientes murieron como consecuencia de enfermedad metastásica. Establecer el grado de diferenciación en el momento del diagnóstico es crucial para el pronóstico, ya que las neoplasias mejor diferenciadas muestran un comportamiento biológico más indolente y prácticamente nunca desarrollan metástasis35.
Carcinoma siringoideEl carcinoma siringoide (CSi) se presenta como una lesión de crecimiento lento, con preferencia por localizarse en la cabeza. Aparece como una placa o nódulo subcutáneo de llamativa dureza a la palpación.
Histopatológicamente, el CSi aparece constituido por múltiples estructuras ductales y pequeños quistes que ocupan todo el espesor de la dermis, y a menudo infiltran el tejido celular subcutáneo con destrucción de estructuras adyacentes36 (fig. 10).
Características histopatológicas del carcinoma siringoide. A. Visión panorámica mostrando una neoplasia mal delimitada que infiltra todo el espesor de la dermis. B. La neoplasia está constituida por pequeñas formaciones ductales inmersas en un estroma esclerótico. C. Estas formaciones ductales están tapizadas por una hilera de células epiteliales y en algunas de ellas se observa una prolongación «en renacuajo» de la pared epitelial. D. Detalle a gran aumento de las células epiteliales que tapizan los ductos sin mostrar imágenes de atipia citológica. (Hematoxilina-eosina, A ×10, B ×40, C ×200, D ×400).
El CSi muestra un carácter destructivo local y el tratamiento debe conseguir la extirpación quirúrgica completa, siendo la CMM el tratamiento de elección, con mejores resultados siempre que no existan áreas en las que aparentemente la neoplasia «salta» zonas de la dermis, sin evidencia de agregados tumorales, que no deberán interpretarse como un origen multifocal. En general la quimioterapia y la radioterapia se han utilizado para tratar tumores metastásicos. Se han descrito casos en los que la radioterapia consiguió un control local de la enfermedad36–39. Existe poca experiencia con la quimioterapia, habiéndose obtenido solo respuesta temporal en algunos casos37–41.
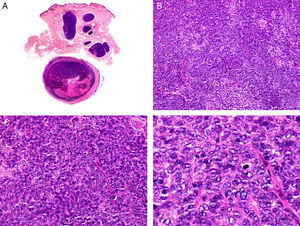
PorocarcinomaEl porocarcinoma (PC) es una neoplasia de adultos y personas de edad avanzad, que se desarrolla más frecuentemente en las extremidades inferiores (fig. 9) como una lesión nodular o tumoral, a veces de superficie verrugosa y otras veces ulcerada. La mayoría de los casos de PC aparecen de novo, aunque también hay casos que provienen de una malignización de un poroma preexistente de largo tiempo de evolución.
Histopatológicamente el PC muestra características arquitecturales típicas de lesiones malignas, con asimetría en forma y tamaño y mala delimitación. Está compuesto por agregados de células neoplásicas de 2 tipos: poroides y cuticulares. En algunos agregados neoplásicos se observan pequeñas formaciones ductales rodeadas de células cuticulares (fig. 11). En algunos casos de PC la neoplasia es tan indiferenciada que no es posible distinguir estos 2 tipos citológicos. Es frecuente el epidermotropismo y en algunos casos es tan marcado que es difícil establecer desde el punto de vista histopatológico si estamos ante una lesión primaria o ante una metástasis epidermotropa42.
Características histopatológicas del porocarcinoma. A. Visión panorámica mostrando una neoplasia ulcerada que infiltra todo el espesor de la dermis. B. Agregados neoplásicos de forma y tamaño variable. C. Algunos agregados neoplásicos muestran diferenciación ductal. D. Detalle de los pequeños ductos tapizados por células cuticulares. (Hematoxilina-eosina, A ×10, B ×40, C ×200, D ×400).
Aproximadamente el 20% de los PC descritos produjeron metástasis a los ganglios linfáticos regionales42. En este grupo con metástasis la mortalidad fue del 67%42. La extirpación mediante la CMM es el tratamiento de elección, observándose menor tasa de recurrencias y metástasis43. Se ha postulado el papel de los genes HRAS y EGFR en la histogénesis de algunas variantes de PC, lo que podría implicar la aparición de nuevas terapias dirigidas en un futuro cercano44.
Carcinoma anexial microquísticoEl carcinoma anexial microquístico (CAM) es una neoplasia de crecimiento lento localizada preferentemente en la piel de la región nasolabial y periorbitaria45. Consiste en un nódulo o placa solitaria de consistencia firme, cuya superficie puede presentar aspecto de piel normal, atrófica o descamativa, y raramente se ulcera.
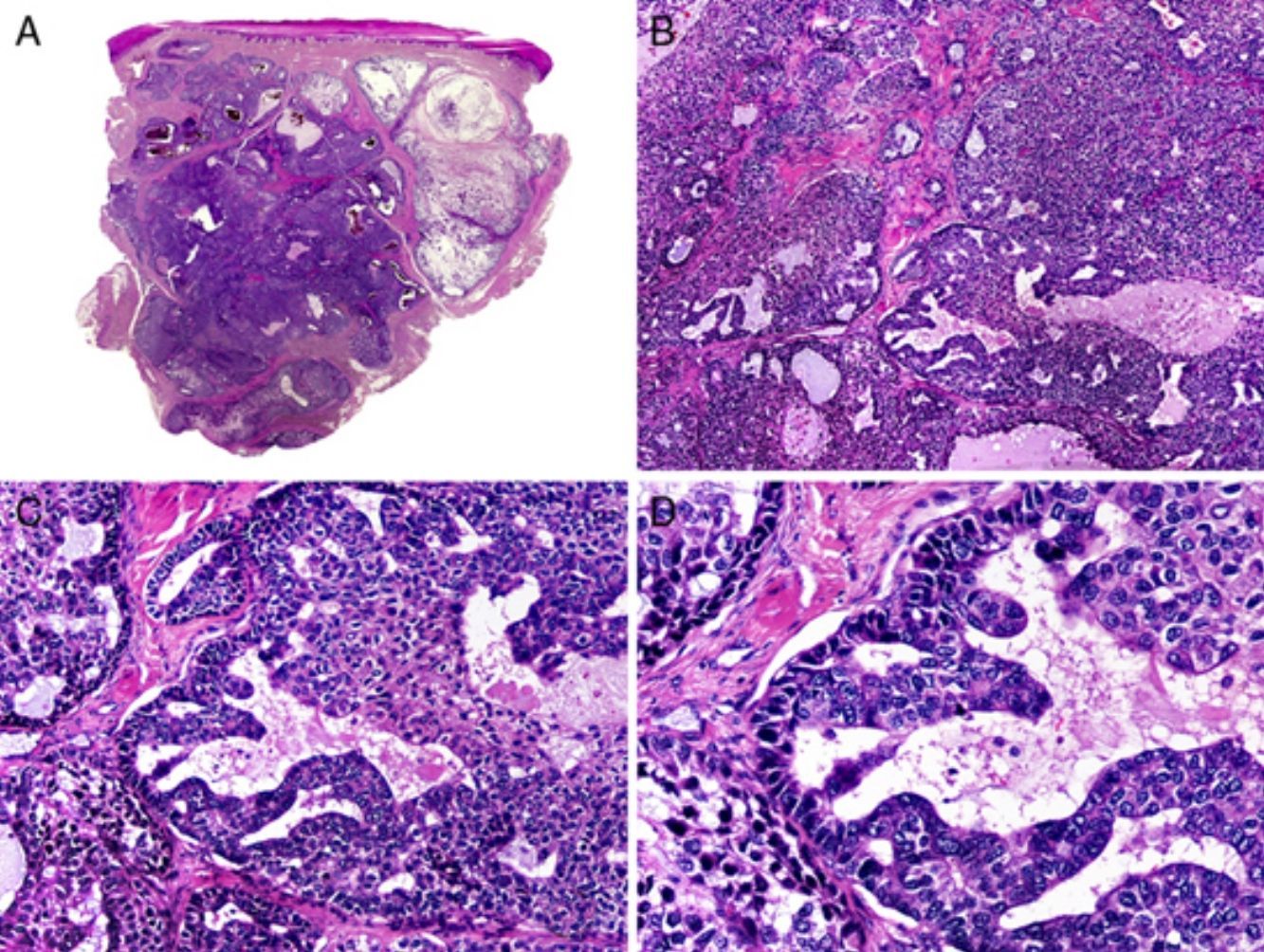
Histopatológicamente el CAM se extiende profundamente en la dermis (fig. 12) y, con frecuencia, infiltra el tejido celular subcutáneo, pudiendo afectar incluso a la fascia y al músculo esquelético subyacente, con frecuente infiltración perineural en las áreas profundas de la lesión. El CAM está constituido por 3 componentes, dispuestos de forma estratificada horizontal. Las áreas superficiales presentan estructuras quísticas rodeadas de células escamosas eosinófilas y/o pálidas. En los estratos centrales de la neoplasia se observan islotes sólidos de células pálidas o eosinófilas, de forma y tamaño variable entremezclados con pequeñas formaciones ductales redondeadas inmersas en un estroma esclerótico, y en la profundidad de la neoplasia existen estructuras tubulares alargadas, con material eosinófilo homogéneo en su interior. Todas estas estructuras epiteliales están inmersas en un estroma densamente desmoplásico o esclerótico45.
Características histopatológicas del carcinoma anexial microquístico. A. Visión panorámica mostrando una neoplasia que infiltra todo el espesor de la dermis. B. Agregados sólidos y pequeños quistes conteniendo queratina. C. Algunos agregados tumorales muestran formaciones ductales diminutas. D. Detalle de las pequeñas formaciones ductales en algunos de los agregados neoplásicos. (Hematoxilina-eosina, A ×10, B ×40, C ×200, D ×400).
El CAM es localmente destructivo. Debido a su mala circunscripción y la extensión en profundidad invadiendo el tejido celular subcutáneo, musculoesquelético e incluso al hueso, la CMM es el tratamiento de elección46. Como consecuencia de su estroma es relativamente resistente a la radioterapia y no hay experiencia con quimioterapia47, aunque en casos que no se consiguen márgenes libres de tumoración se puede utilizar radioterapia adyuvante en dicha área48. Las metástasis son muy raras, pero no es rara la recurrencia, habiéndose descrito hasta 30 años después de la extirpación original, lo que refuerza la importancia del seguimiento de estos pacientes a largo plazo46.
Carcinoma adenoide quísticoEsta neoplasia aparece como uno o varios nódulos dérmicos que confluyen formando una placa indurada que con frecuencia infiltra el tejido celular subcutáneo y aparece adherida a tejidos profundos. El cuero cabelludo es la localización más frecuente, aunque también puede desarrollarse en otras áreas corporales.
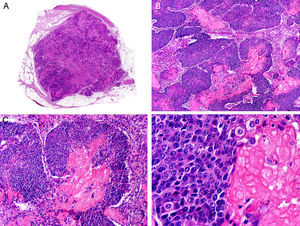
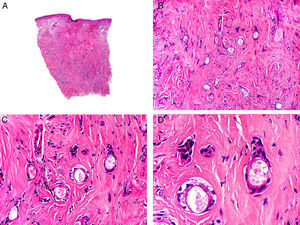
El carcinoma adenoide quístico (CAQ) primitivamente cutáneo aparece histopatológicamente como una neoplasia mal delimitada, constituida por agregados epiteliales que infiltran en profundidad. Estos agregados, compuestos de células basaloides, varían mucho en forma y tamaño de unas zonas a otras (fig. 13), y de manera casi constante presentan infiltración peri y/o endoneural en las áreas profundas de la lesión. Las células neoplásicas se disponen con un patrón en el que alternan áreas sólidas con otras cribiformes, y es frecuente observar depósitos de membrana basal en el espesor de los agregados tumorales49.
Características histopatológicas del carcinoma adenoide-quístico. A. Visión panorámica mostrando una neoplasia mal delimitada que infiltra la fascia subcutánea. B. A mayor aumento los agregados de células neoplásicas muestran un patrón adenoide-quístico. C. Agregados neoplásicos con patrón adenoide-quístico de forma y tamaño variable. D. Detalle a mayor aumento de las células neoplásicas. (Hematoxilina-eosina, A ×10, B ×40, C ×200, D ×400).
El carcinoma adenoide quístico cutáneo es un carcinoma de bajo grado de malignidad, que habitualmente se comporta de manera destructiva local, pero que también posee capacidad para metastatizar. Debe realizarse una extirpación quirúrgica completa de la tumoración, con márgenes de al menos 2cm49 o mediante CMM como mejor opción50. La radioterapia adyuvante o incluso definitiva en casos no extirpables o con invasión perineural se ha mostrado de utilidad51.
Carcinoma mucinosoEl carcinoma mucinoso primitivamente cutáneo (CMPC) es algo más frecuente en varones, localizándose casi siempre en la cabeza. Se presenta generalmente como un nódulo solitario, con una apariencia variable de la epidermis que lo recubre y que raramente se ulcera. Un dato clínico al que se le ha dado valor es el carácter translúcido de la lesión al observarla por transiluminación, y que se debe al alto contenido de mucina en el estroma tumoral.
Histopatológicamente, el CMPC muestra una arquitectura muy característica, apareciendo constituida por pequeños islotes de células neoplásicas basaloides rodeados por lagos de mucina, que están separados unos de otros por delgados septos conectivos, compartimentalizando la tumoración (fig. 14). A veces pueden observarse agregados epiteliales neoplásicos en la dermis profunda o en el tejido celular subcutáneo, a cierta distancia del componente principal de la neoplasia, lo que explicaría la tendencia a persistir de este carcinoma después de una extirpación quirúrgica incompleta.
Características histopatológicas del carcinoma mucinoso. A. Visión panorámica mostrando una neoplasia con abundante estroma mixoide. B. Delgados tabiques de tejido conectivo compartimentalizan la neoplasia. C. Las células neoplásicas son basaloides y están rodeadas de un estroma mixoide. D. Detalle a gran aumento de las células neoplásicas. (Hematoxilina-eosina, A ×10, B ×40, C ×200, D ×400).
El carcinoma mucinoso es poco frecuente como neoplasia primitivamente cutánea. La mayoría de los casos localizados en la piel son metastásicos. Hoy en día no disponemos de ninguna técnica histopatológica o inmunohistoquímica que nos permita diferenciar un CMPC de uno metastásico, hecho que es de vital importancia, ya que las metástasis cutáneas de un carcinoma mucinoso son indicativas de muy mal pronóstico, mientras que el carcinoma mucinoso primario cutáneo, aunque capaz de causar metástasis en los ganglios linfáticos regionales o a distancia, generalmente presenta un comportamiento biológico indolente. Por lo tanto, ante cualquier paciente con un carcinoma mucinoso en la piel debe descartarse que se trate de una metástasis cutánea desde un carcinoma mucinoso visceral, sobre todo de mama o de colon. Estudios recientes han postulado un diferente patrón de citoqueratinas entre el carcinoma mucinoso primario cutáneo y el carcinoma mucinoso metastásico en la piel52.
TratamientoEl CMPC es un carcinoma de bajo grado de malignidad, localmente destructivo, pero solo rara vez metastatiza. La extirpación con márgenes amplios de al menos 1cm genera una tasa de recurrencias de aproximadamente el 34%, pudiéndose reducir al 13% cuando se utiliza CMM53.
Carcinoma de células en anillo de selloEste raro tumor se presenta generalmente en personas de edad avanzada, afectando sobre todo a los párpados y más rara vez a las axilas, en forma de nódulo o engrosamiento difuso de la piel, lo que con frecuencia motiva que se confunda clínicamente con procesos inflamatorios.
Lo más característico de este carcinoma es la morfología en anillo de sello de las células neoplásicas (fig. 15). Estas células son bastante monomorfas y sin atipia evidente, por lo que pueden ser mal interpretadas como histiocitos espumosos simulando un proceso inflamatorio54. La neoplasia está constituida por cordones de células, pequeños islotes sólidos e incluso células neoplásicas aisladas inmersas en un estroma esclerótico.
Características histopatológicas del carcinoma de células en anillo de sello de párpado. A. Visión panorámica mostrando una neoplasia mal delimitada que infiltra todo el espesor de la dermis. B. La neoplasia está constituida por células aisladas salpicadas por la dermis. C. En algunas áreas el estroma de la neoplasia es mixoide. D. Detalle a gran aumento de las células neoplásicas con morfología en anillo de sello. (Hematoxilina-eosina, A ×10, B ×40, C ×200, D ×400).
Antes de establecer un diagnóstico de carcinoma de células en anillo de sello (CCAS) primario de párpado se debe descartar que la lesión corresponda a una metástasis palpebral desde un CCAS de otra localización.
TratamientoParece ser que el CCAS de párpado es una neoplasia con un alto potencial para producir metástasis a distancia39. El tipo de tratamiento va a depender de la localización de la neoplasia, pudiendo realizarse con facilidad la extirpación amplia en casos axilares, mientras que aquellos que aparecen en los párpados van a requerir márgenes amplios, y con frecuencia requieren la exenteración orbitaria. La CMM ha mostrado mejor capacidad de conseguir márgenes libres. En casos en que no se consiguen márgenes libes parece que la radioterapia adyuvante es de utilidad55.
Enfermedad de Paget extramamariaEsta rara neoplasia es más frecuente en mujeres de edad avanzada. Se presenta como una mácula o placa eritematosa de bordes netos y superficie descamativa, cuya localización preferente es el área genital.
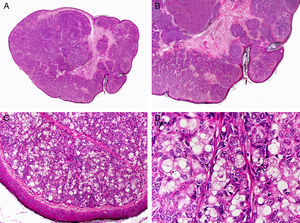
Histopatológicamente, la enfermedad de Paget extramamaria (EPEM) se caracteriza por la presencia intraepitelial de células de Paget que son células grandes, con un citoplasma amplio y pálido y un núcleo redondo y pleomórfico con nucléolos prominentes. A veces estas células muestran evidencia de vacuolización citoplasmática o incluso formaciones glandulares intraepidermicas. Así mismo, la distribución de estas células neoplásicas también es característica, distribuyéndose como células aisladas o en pequeños grupos salpicadas por todas las capas del epitelio de la epidermis y los anejos conformando un patrón pagetoide (fig. 16).
Características histopatológicas de la enfermedad de Paget extramamaria. A. Visión panorámica mostrando una lesión intraepidérmica. B. La neoplasia está constituida por células neoplásicas aisladas salpicando la epidermis. C. Estas células neoplásicas muestran un núcleo pleomórfico y abundante citoplasma pálido. D. Detalle de las células neoplásicas salpicando la epidermis. (Hematoxilina-eosina, A ×10, B ×40, C ×200, D ×400).
La enfermedad de Paget extamamaria presenta un comportamiento biológico indolente, con recurrencias frecuentes, pero son muy escasos los casos descritos que han originado metástasis a ganglios linfáticos, y solo en casos de muy larga evolución56. La extirpación completa es el tratamiento de elección, algo no siempre fácil de realizar con seguridad, ya que es frecuente que la lesión muestre áreas salpicadas de epidermis respetada en medio de la proliferación57,58. La CMM es el tratamiento de elección59, aunque se han descrito también buenos resultados tras tratamientos con imiquimod al 5% y tazaroteno tópicos60, radioterapia local61,62 y la terapia fotodinámica63. La presencia de acantólisis epidérmica58, la afectación dérmica o linfovascular64 y la positividad para Her2/neu65 se han propuesto como factores de riesgo para la recurrencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.