El síndrome LEOPARD es una enfermedad autosómica dominante producida por mutaciones germinales en la vía RAS-MAPK. El acrónimo agrupa las manifestaciones más importantes de la enfermedad (Lentiginosis, ECG conduction anomalies, Ocular hypertelorism/hypertrophic Obstructive cardiomyopathy, Pulmonary stenosis, Abnormalities of genitalia, growth Retardation and Deafness), pero ninguna de ellas es patognomónica ni constante, por lo que muchos pacientes no las presentan en el momento del diagnóstico. Presentamos 2 casos de síndrome LEOPARD sin sordera ni estenosis pulmonar en los que la detección de la mutación en el gen PTPN11 permitió confirmar la enfermedad, y señalamos la importancia del seguimiento continuado para la detección precoz de las complicaciones, ya que las mismas pueden aparecer en el transcurso de la enfermedad.
LEOPARD syndrome is an autosomal dominant disease caused by germline mutations in the RAS-MAPK (mitogen-activated protein kinase) pathway. LEOPARD is an acronym for the main manifestations of the syndrome, namely, multiple Lentigines, Electrocardiographic conduction abnormalities, Ocular hypertelorism, Pulmonary stenosis, Abnormalities of genitalia, Retardation of growth, and sensorineural Deafness. None of these characteristic features, however, are pathognomonic of LEOPARD syndrome, and since they are highly variable, they are often not present at the time of diagnosis. We describe 2 cases of LEOPARD syndrome without hearing loss or pulmonary stenosis in which diagnosis was confirmed by identification of a mutation in the PTPN11 gene. Regular monitoring is important for the early detection of complications, as these can occur at any time during the course of disease.
El síndrome LEOPARD, actualmente denominado también síndrome de Noonan con múltiples lentigines1 (SNML) (OMIM 151100), es una rasopatía autosómica dominante cuyo acrónimo resume los hallazgos fenotípicos más frecuentes (Lentiginosis, ECG conduction anomalies, Ocular hypertelorism/hypertrophic Obstructive cardiomyopathy, Pulmonary stenosis, Abnormalities of genitalia, growth Retardation and Deafness [neurosensorial])2,3. Sin embargo, ninguno de ellos es patognomónico ni constante. Presentamos 2 casos de SNML confirmados genéticamente sin miocardiopatía hipertrófica, estenosis pulmonar ni sordera.
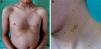
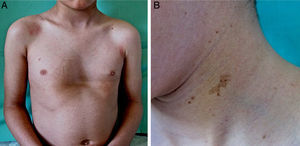
Caso 1Varón de 6 años, primogénito de padres sanos y no consanguíneos, seguido en neurología desde los 4 años y medio por retraso madurativo y retraso leve del lenguaje. En la exploración física presentaba dismorfismo facial con orejas grandes, despegadas, rotadas hacia delante y de implantación baja, hipertelorismo y puente nasal aplanado. Así mismo se apreciaban 4 máculas hiperpigmentadas de bordes irregulares de unos 5-15mm de diámetro en la región cervical de la espalda, el glúteo derecho, la axila izquierda y la rodilla derecha. En la región facial, en el tronco y en las extremidades se apreciaban múltiples lentígines menores de 5mm (fig. 1). En el examen cardiológico se observó un bloqueo de rama derecha. La audiometría fue normal. El análisis mutacional del gen protein tyrosine phosphatase non receptor 11 (PTPN11) demostró una mutación T468M (p.Thr468Met.) en el exón 12.
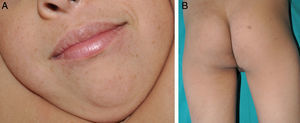
Caso 2Varón de 6 años, hijo de padres sanos y no consanguíneos, en seguimiento por logopedia por retraso en la adquisición del lenguaje y problemas en la discriminación auditiva de algunos fonemas. En la exploración presentaba dismorfismo facial con facies triangular invertida, cuello corto, orejas grandes de implantación baja, hipertelorismo ocular y megalocórnea, así como pectus excavatum. Dermatológicamente presentaba numerosas máculas café con leche y lentígines en la cara, el cuello y la parte superior del tronco (fig. 2). El estudio audiológico y cardiológico fueron normales. El análisis genético detectó la mutación R498W (p.Arg498Trp) en el exón 13 del gen PTPN11.
DiscusiónEl SNML pertenece al grupo de los síndromes neuro-cardio-facio-cutáneos, un grupo de enfermedades que presenta alteraciones germinales en la vía rat sarcoma-mitogen activated protein kinase (RAS-MAPK). Dermatológicamente, el hallazgo más característico son las lesiones pigmentadas, particularmente las lentígines, que se observan en el 90% de los pacientes. Pueden ser congénitas, pero habitualmente aparecen en torno a los 4-5 años o incluso en la pubertad2,4,5 Las máculas café con leche, de tamaño algo mayor que las lentígines, se observan en el 70-80% de los pacientes. La tonalidad de la pigmentación, más oscura que la de las máculas café con leche, justifica la denominación máculas en café negro. La cardiopatía más frecuente en el SNML (80% de los casos) es la miocardiopatía hipertrófica, que puede ser letal. También puede haber anomalías de las válvulas cardiacas y de las coronarias, siendo la estenosis pulmonar menos frecuente que las valvulopatías mitral y aórtica2. Electrocardiográficamente es típico encontrar hipertrofia ventricular izquierda, hipertrofia ventricular derecha y aumento del volumen auricular derecho, así como un gradual desarrollo de bloqueo de rama derecha. La sordera, clásicamente considerada muy específica del SNML, solo aparece en el 25-30% de estos pacientes. Es neurosensorial, puede ser uni o bilateral y a veces es profunda (>95db). Aunque generalmente se diagnostica en la niñez, la sordera puede desarrollarse tardíamente, por lo que se recomienda realizar controles auditivos periódicos4.
Otras manifestaciones incluyen la dismorfia facial, anomalías esqueléticas como pectus carinatum y excavatum, que aparecen hasta en un 75% de neonatos, el retraso puberal y anomalías urogenitales como riñón en herradura, hipoplasia ovárica, menarquia tardía, hipoplasia testicular, micropene e hipospadias2,4. El retraso del crecimiento, presente en un 25% de pacientes, no parece tener relación con alteraciones endocrinas ni enfermedades sistémicas. En un 85% de pacientes la talla final será <P252. Al contrario de lo que ocurre en otras rasopatías, la predisposición al cáncer parece mínima, pero se han descrito malignidades hematológicas6 y no hematológicas, como melanomas7,8.
El diagnóstico de certeza requiere análisis genético. El 85-90% de los pacientes con SNML presentan una mutación en los exones 7,12 y 13 del dominio PTP del oncogén PTPN-11, el cual codifica la fosfatasa SHP2. A diferencia de lo que ocurre en el síndrome de Noonan, la fosfatasa SHP2 es funcionalmente deficiente, pero su actividad se ve compensada por hipersensibilidad al estímulo de los factores de crecimiento, un mayor tiempo de contacto con el dominio C-terminal (pTyr ligandos) y el debilitamiento de la interacción del inhibidor SH2 con la zona catalítica9, produciendo un fenotipo de ganancia de función1. Hasta el momento se han descrito al menos 11 mutaciones distintas, entre las cuales hay 2 altamente recurrentes que aparecen en más de la mitad de los pacientes (Y279C y T468M)2,9,10. De los casos PTPN11 negativos la tercera parte tendrán mutaciones en el RAF1, y en menos del 5% se asociará la mutación del BRAF7. Existe cierta correlación geno-fenotípica, de tal manera los pacientes PTPN11 negativos suelen tener mayor prevalencia de trastornos de conducción cardiaca, hipertrofia ventricular o auricular izquierda, e historia familiar de muerte súbita, los pacientes PTPN11 positivos con afectación del exón 13 presentan un mayor riesgo de miocardiopatía hipertrófica y complicaciones cardiacas severas, el compromiso del exón 7 está más frecuentemente asociado a retraso del crecimiento y sordera, y las mutaciones del BRAF conllevan mayor riesgo de desórdenes cognitivos7. La mutación del RAF puede provocar lentígines, manchas café con leche, dismorfia facial, miocardiopatía hipertrófica, arritmias y pubertad retrasada2,4.
El diagnóstico diferencial incluye principalmente otras enfermedades de la vía RAS-MAPK11. La acusada superposición geno y fenotípica de las rasopatías dificulta mucho su diagnóstico diferencial clínico. Fenotípicamente, y sobre todo en la niñez, el SNML puede ser muy difícil de diferenciar del SN y de la neurofibromatosis tipo i12; el SN carece de lentígines y sordera, mientras que las máculas café con leche y la miocardiopatía hipertrófica son más frecuentes en el SNML que en el SN4,13.
En conclusión, nuestros 2 casos ponen de manifiesto que la ausencia de sordera y/o la cardiopatía no descartan el SNML. El análisis genético en esta enfermedad es muy aconsejable, ya que orienta el seguimiento y facilita información pronóstica. Sin embargo, independientemente del exón mutado, todos los pacientes con SNML deben tener una valoración dermatológica neurológica, cardiológica y auditiva periódica por la posibilidad de desarrollo tardío de complicaciones.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.