La leucemia cutis (LC), infiltración cutánea por células leucémicas, es poco frecuente y ocurre en un 3,1% de todas las leucemias. La leucemia mieloide aguda (LMA) monocítica (M5) y la mielomonocítica (M4) son las que con mayor frecuencia afectan la piel (33% y 13-18% respectivamente). El sarcoma granulocítico, más recientemente llamado sarcoma mieloide (SM)1, es una lesión tumoral extramedular constituida por células mieloides inmaduras. Aunque una de las localizaciones más frecuentes de SM es la piel, representa una forma rara de LC. Presentamos el caso de un paciente con SM cutáneo en un área de plastia.
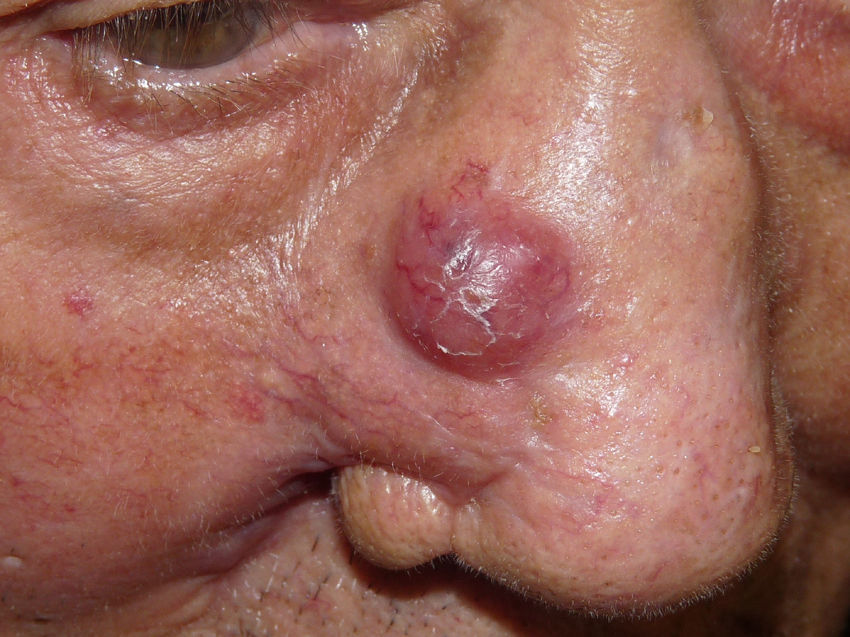
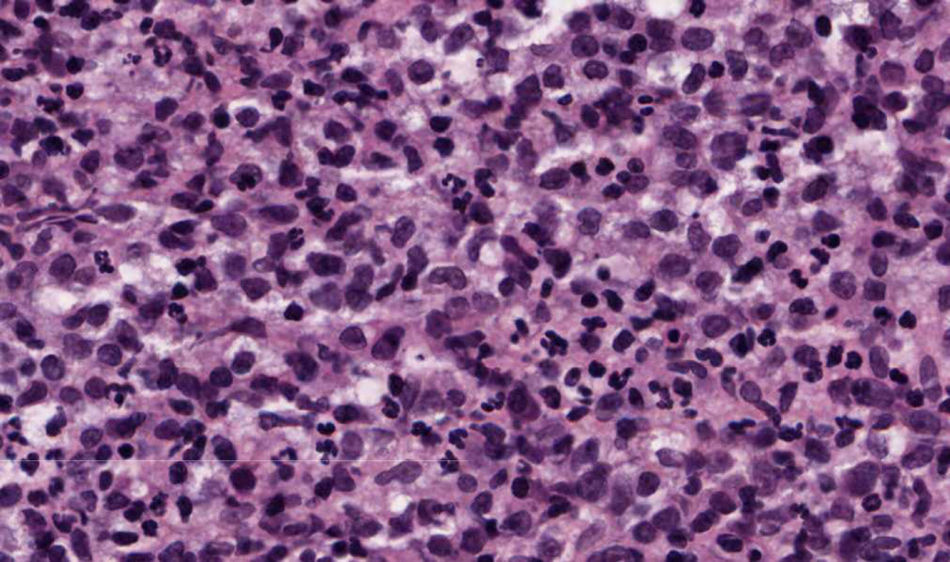
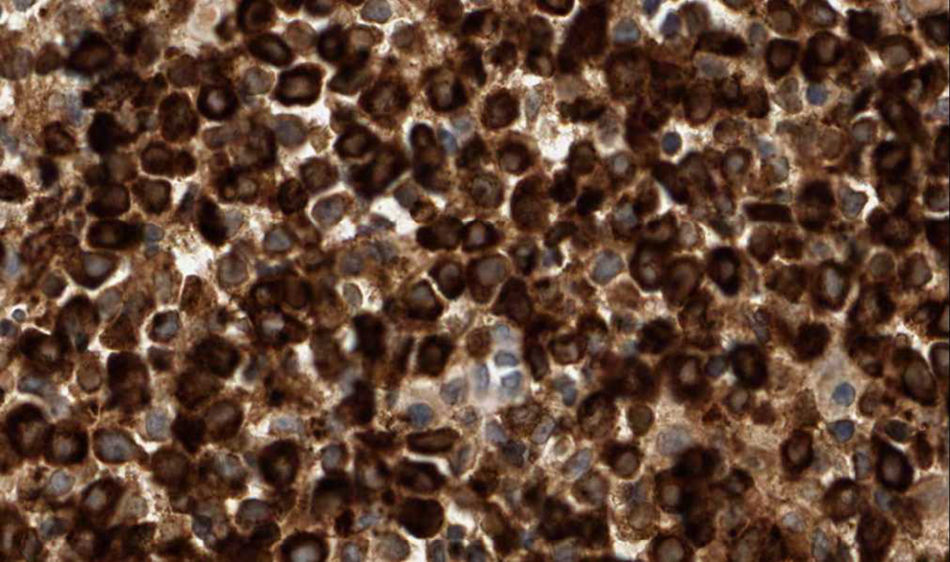
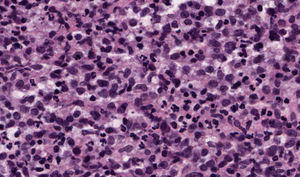
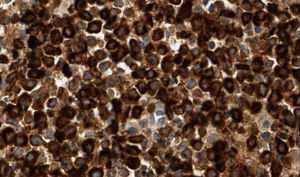
Se trata de un varón de 86 años diagnosticado de síndrome mielodisplásico (SMD) hacía dos años. Consultaba por dos carcinomas basocelulares en la sien izquierda y el ala nasal derecha. Se realizó extirpación de ambos y cierre mediante sutura directa y plastia del surco nasogeniano, respectivamente. A las pocas horas de la cirugía el paciente acudió a Urgencias por presentar un sangrado activo difuso en ambas heridas con aparición de un gran hematoma en el área de la plastia. En la analítica destacaban: leucocitos 12.200/μl (> 10.000, neutrófilos 31,2%, linfocitos 21,3%, monocitos 43,6%), hemoglobina 11,7g/dl (< 13), plaquetas 65.000/ μl (< 150.000) y creatinina 1,5mg/ dl (> 1,3) siendo la coagulación, el perfil hepático y LDH normales. Al mes de la cirugía apareció en la plastia, previamente perfectamente cicatrizada, un nódulo asintomático, de rápido crecimiento junto a la infiltración progresiva de la zona inferior de la cicatriz y ulceración (fig. 1). Las biopsias tanto del nódulo como de la cicatriz infiltrada evidenciaban una proliferación neoplásica difusa en la dermis y en el tejido adiposo, constituida por células mononucleares de mediano tamaño, de morfología redondeada-oval, citoplasma eosinófilo y núcleo basófilo (fig. 2). El estudio de inmunohistoquímica (IHQ) fue positivo para mieloperoxidasa (MPO), CD68, CD43 y focalmente para CD34, diagnosticándose de SM (fig. 3). Simultáneamente el paciente presentó una progresión clínica de su enfermedad hematológica a LMA M4 (clasificación FAB). Se inició tratamiento paliativo con tioguanina, pero finalmente el paciente falleció en tres semanas.
El SM se presenta como una o más masas tumorales, compuestas por células mieloides inmaduras, en cualquier localización anatómica distinta de la médula ósea, sobre todo en el hueso, el periostio, la piel, las encías y los ganglios, aunque realmente puede aparecer en cualquier órgano. En menos de un 10% de los casos es multifocal. Puede preceder, ser simultáneo o ser signo de recaída de una LMA, o ser la manifestación de una transformación blástica de un SMD, leucemia mieloide crónica u otro trastorno mieloproliferativo crónico. Afecta algo más a varones (relación varón-mujer 1,42:1) y en edades avanzadas (media de 56 años). En la piel se manifiesta como un tumor solitario, sólido, de rápido crecimiento (días o semanas), generalmente en la cara, el cuero cabelludo y el tronco. Se han descrito casos con lesiones múltiples e incluso diseminadas1–4. Se han publicado unos 20 casos de LC tipo SM en áreas donde previamente ha habido lesión o agresión cutánea, principalmente en puntos de venopunción de catéteres centrales (11 casos)4 y de punción de médula ósea, venosa y arterial (4 casos)5. También se han descrito casos aislados de SM en áreas de extravasación de quimioterapia6, de radioterapia7, en cicatrices traumáticas y excoriaciones8, en inoculación de test de Mantoux3, en úlceras de presión, como nódulo de la hermana Mª José, en piodermas gangrenosos9, en áreas de vacunación de tétanos10 y en el seno de un carcinoma basocelular11. En nuestro caso se reexaminaron las piezas de ambos basocelulares sin detectarse infiltración leucémica. Normalmente, el SM aparece en pacientes diagnosticados de LMA como signo de recaída y rápida progresión. En tres pacientes coincidió con la transformación de SMD a LMA9 y tan sólo en una paciente el SM fue aleucémico7. El pronóstico es en general muy malo. Llama la atención que aunque en los libros de texto se afirma que la LC ocurre en cicatrices quirúrgicas previas, revisando la literatura no hemos encontrado ninguna referencia.
El diagnóstico histológico del SM requiere un alto índice de sospecha, y puede pasar desapercibido si no existe el antecedente de LMA. Se observa un infiltrado neoplásico denso en la dermis y la grasa, con tendencia a disponerse en torno a vasos y anejos, sin epidermotropismo, y es característico que la dermis papilar esté respetada (zona Grenz). El aspecto citológico es muy variable, dependiendo del origen y grado de maduración celular. La IHQ es fundamental para el diagnóstico y se recomienda que incluya CD68, MPO, CD43, CD3, CD20 y cloracetato esterasa2,3.
La patogenia de la LC y del SM no está clara, pero parece que influyen el tipo de leucemia y factores locales. En las leucemias monocíticas se favorecería más la infiltración que en otros tipos, porque el monocito neoplásico tiene más capacidad de adherirse a las paredes vasculares, e invadir espacios extravasculares formando tumores cutáneos4,8. Por otro lado, cualquier tipo de daño local activaría los queratinocitos o los fibroblastos en lesiones antiguas, liberando factores quimiotácticos para leucocitos y células inflamatorias que provocaría el reclutamiento de células leucémicas8,9. En este caso es muy llamativo que la infiltración leucémica se limitara al área de la plastia, respetando sin embargo la zona del cierre directo. Esto podría explicarse porque el colgajo implica mayor daño tisular, lo que unido al intenso sangrado y al hematoma posterior (por su proceso hematológico de base), se habrían asociado a una mayor inflamación local, que favorecerían a su vez el reclutamiento de las células leucémicas, todo ello coincidiendo con la transformación del SMD a LMA.