La morfea es una enfermedad de la piel que se manifiesta en forma de inflamación y fibrosis. En niños y jóvenes, también se conoce como esclerodermia juvenil localizada. En edad infantil, afecta con mayor frecuencia al sexo femenino y la edad de comienzo se ha establecido en torno a los 5-7 años. Una clasificación reciente divide la morfea en: circunscrita (en placas), lineal, generalizada, panesclerótica y mixta. Alrededor de un 40% de los pacientes presentan manifestaciones extracutáneas.
Los tratamientos empleados en morfea infantil son: fototerapia, calcitriol oral, calcipotriol tópico, tacrolimus 0,1% tópico, metotrexato, glucocorticoides tópicos y sistémicos, mofetil micofenolato, bosentán e imiquimod 5% tópico. Diversas medidas de resultado pueden ayudar a monitorizar el tratamiento. Los estudios pronósticos son escasos, pero apuntan hacia una enfermedad con tendencia a un curso crónico o intermitente-recurrente y una frecuencia considerable de secuelas.
Morphea is an inflammatory, fibrosing skin disorder. When it occurs in childhood, it is also known as localized juvenile scleroderma. It is more common in girls and typically appears around the age of 5 to 7 years. According to a recent classification system, morphea is divided into 5 types: circumscribed (plaque), linear, generalized, pansclerotic, and mixed. Approximately 40% of patients present extracutaneous manifestations. Childhood morphea is treated with phototherapy, oral or topical calcitriol, topical tacrolimus 0.1%, methotrexate, topical or systemic corticosteroids, mycophenolate mofetil, bosentán, and topical imiquimod 5%. A variety of measuring tools are used to monitor response to treatment. Few prognostic studies have been conducted, but findings to date suggest that the disease tends to run a chronic or intermittent-recurrent course and frequently causes sequelae.
La morfea es una enfermedad de la piel, que se manifiesta en forma de inflamación y fibrosis. En niños y jóvenes, también se conoce como esclerodermia juvenil localizada (juvenile localized scleroderma), para distinguirla de la esclerodermia sistémica juvenil (juvenile systemic scleroderma). Por otra parte, el término «morfea» no incluye una forma específica de denominar la enfermedad en niños y jóvenes, equivalente a la «juvenile localized scleroderma». En este trabajo nos referiremos a esta como morfea en la infancia.
Epidemiología y etiopatogeniaLos estudios de incidencia y prevalencia de morfea son escasos. En Reino Unido e Irlanda, entre 2005 y 2007, se encontró una tasa de incidencia de 3,4 casos por millón de niños y por año. En el caso de la morfea lineal (ML), se encontraron 2,5 casos por millón de niños y por año1. Otro estudio realizado en el Condado de Olmsted (Minnesota, EE. UU.) encontró, entre 1960 y 1993, una tasa de incidencia de morfea, ajustada por edad y sexo de 2,7/100.000 habitantes. La tasa de incidencia de ML fue de 0,5/100.000 habitantes. Un 34% de los pacientes con morfea y un 69% de los pacientes con ML, eran menores de 18 años en el momento del diagnóstico2.
La morfea infantil afecta con mayor frecuencia al sexo femenino, con una ratio mujer: hombre de 2-3:13,4. La edad de comienzo se ha establecido en torno a los 5-7 años5,6. La edad media al diagnóstico varía entre los 7 y los 13 años3,4,6. En una serie de 750 niños con morfea, el tiempo medio de demora hasta el diagnóstico, fue de 1,6 años (mediana de 11 años, rango 0-16,7 años)3. En otra serie de 52 pacientes con ML la demora fue de 1,8 años (rango 15 días-8 años). Otros estudios han establecido una demora de 9-11 años4,5,7.
Se describen antecedentes familiares de enfermedades reumatológicas o autoinmunitarias en un 12,1%3 a un 24,3%8 de los casos, reduciéndose al 63-8,8%8 en familiares de primer grado. Las más frecuentes son la artritis reumatoide, la esclerodermia, el lupus eritematoso sistémico y las tiroiditis3,8. Entre las enfermedades cutáneas destacan la psoriasis (16,3%), el vitíligo (2,3%) y el liquen escleroso y atrófico (LEA) (0,8%)3.
Los factores ambientales próximos al inicio de la enfermedad se han registrado en un 13,2%8-13,3%3 de los pacientes. Los más frecuentes son los mecánicos (8,9%), incluyendo los traumatismos o las picaduras de insecto3.
La etiopatogenia de la morfea es desconocida. Parece basarse en una interacción entre procesos inflamatorios, fibróticos y vasculares. Una hipótesis que explicaría la activación del proceso de fibrosis sería la transformación de fibrocitos CD34+en miofibroblastos CD34- y el incremento de dendrocitos dérmicos XIIIa1+9. Se ha descrito la práctica desaparición de células dentríticas dérmicas CD34+y un incremento de dendrocitos dérmicos Factor XIIIa1+en las áreas de fibrosis en pacientes con morfea activa10.
Presentación clínica, clasificación y manifestaciones extracutáneasClásicamente, la morfea se subdivide en: morfea en placas, lineal, generalizada, ampollar y profunda (incluida la subcutánea)11. La Sociedad Europea de Reumatología Pediátrica (PReS) ha propuesto una clasificación más precisa y excluyente de morfea1213 (tabla 1). Como novedad, se propone el término morfea circunscrita (MC) en lugar de morfea en placas, pudiendo a su vez dividirse en superficial y profunda (tabla 1). En este trabajo, se ha mantenido el término morfea en placas (MPL), dado que es el empleado en los estudios citados, mayoritariamente anteriores a esta clasificación.
Formas clínicas de morfea, según la clasificación de la Sociedad Europea de Reumatología Pediátrica (PReS)
| Subtipo (PReS) (frecuencia)* | Descripción |
|---|---|
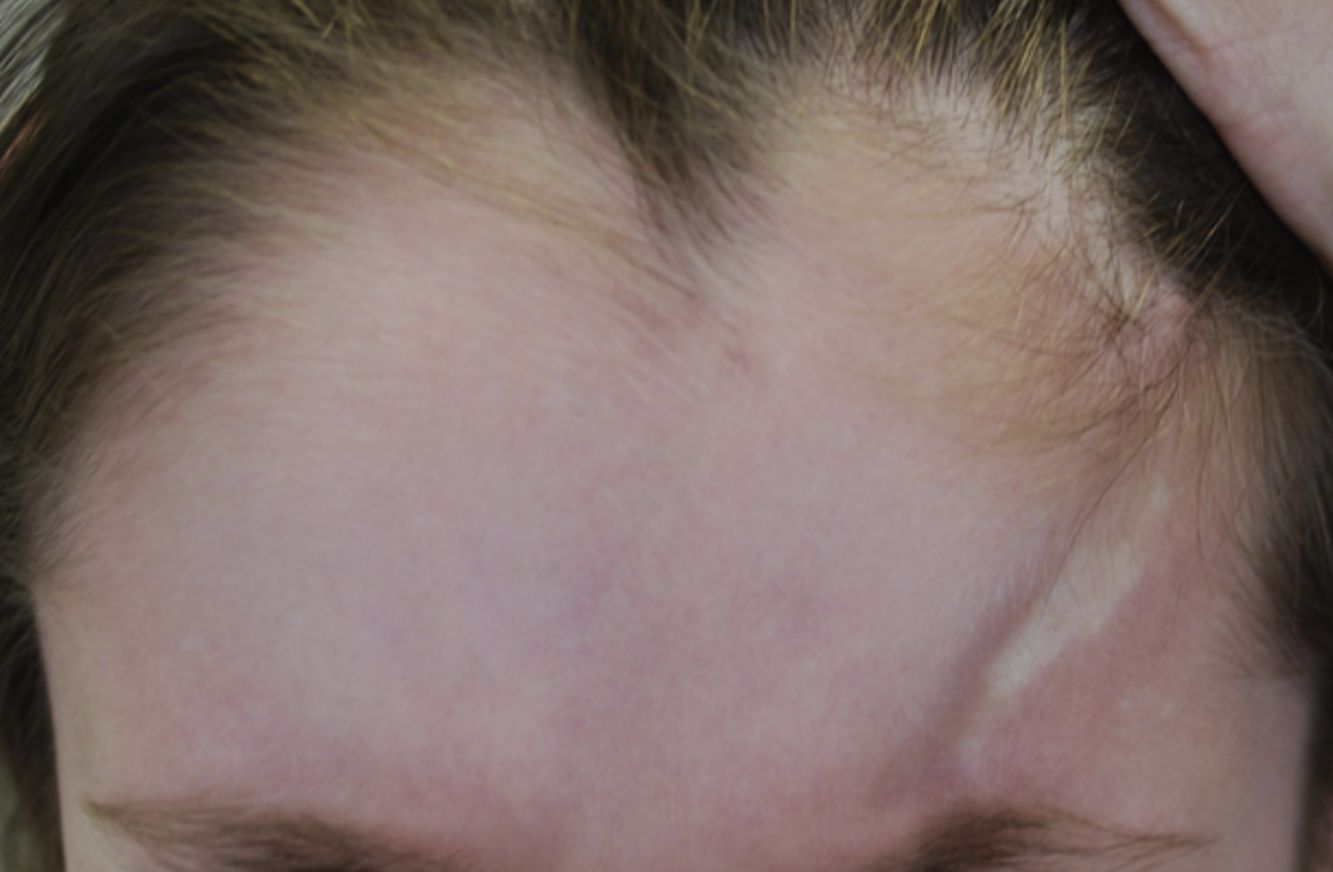
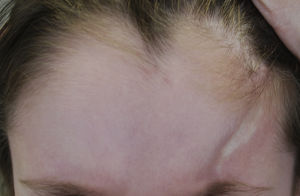
| Morfea lineal (ML) (forma más frecuente en la infancia: 51%8 -65%3) | Una o más placas lineales de localización variable: ML de las extremidades o el tronco: generalmente unilateral. Afecta a dermis, tejido celular subcutáneo y en ocasiones, músculo o hueso subyacentes. ML del cuero cabelludo y la cara: • Morfea en coup de sabre (MCDS): induración lineal en la frente y/o en el cuero cabelludo, generalmente unilateral y paramedial, pudiendo afectar al músculo y al hueso subyacente. Puede extenderse inferiormente a la frente (fig. 1) • Síndome de Parry-Romberg o atrofia hemifacial progresiva (SPR): pérdida de tejido que afecta a dermis, subcutis, musculatura facial y lingual e incluso la glándula parótida y el hueso, localizado en un lado de la cara, inferiormente a la frente. Con frecuencia sin cambios epidérmicos |
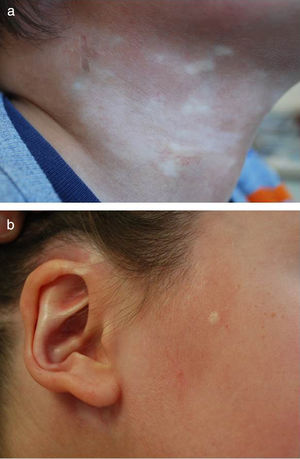
| Morfea circunscrita (MC) (morfea en placas; MPL) (26%3 - 37%8 de morfea infantil) | Placas redondeadas u ovaladas, induradas, rodeadas por un halo violáceo, generalmente en el tronco (fig. 1 a y b) Se distinguen 2 formas: • Superficial: fibrosis confinada a la dermis, aunque ocasionalmente puede afectar a la zona más superficial del tejido celular subcutáneo. • Profunda: extensión desde la dermis hasta el tejido celular subcutáneo, pudiendo alcanzar la fascia muscular o el músculo subyacente |
| Morfea mixta (MM) (hasta un 15% de los pacientes3) | Combinación de 2 o más subtipos. Se propone una nomenclatura consistente en la inclusión, entre paréntesis, de los subtipos representados en el paciente, ordenados según la extensión que representen en el mismo: p.ej. morfea mixta (lineal-circunscrita)13 (figs. 1 y 2) |
| Morfea generalizada (MG) (7%3 - 8%8 de morfea infantil) | Presencia de placas de morfea en número ≥ 4, de diámetro >3cm, que van confluyendo hasta alcanzar al menos 2 de 7 sitios anatómicos (cabeza-cuello, extremidad superior derecha, extremidad superior izquierda, parte anterior del tronco, parte posterior del tronco, extremidad inferior derecha y extremidad inferior izquierda)12,13. Algunos autores consideran necesaria una extensión mayor del 30% de la superficie cutánea8 |
| Morfea panesclerótica (MPE) (0,27%3) | Afectación circunferencial de todo el grosor de la piel, subcutis, músculo y hueso, pudiendo localizarse en el tronco, las extremidades, la cara o cuero cabelludo y respetando las palmas y las plantas. No se afectan los órganos internos. Posibilidad de complicación con la aparición de úlceras crónicas y carcinomas epidermoides |
La clasificación propuesta por la PReS incluye la morfea mixta, una forma que parece ser más frecuente de lo esperado e inclina a considerar la morfea como un espectro de manifestaciones, en las que la inflamación y la fibrosis se puede localizar en distintos niveles de profundidad (figs. 1 y 2). Esta consideración también se apoya en la superposición de la morfea en coup de sabre (MCDS) y el síndrome de Parry-Romberg (SPR) o atrofia hemifacial progresiva, encontrada en un 24-48% de los pacientes4,14,15. Por otra parte, la clasificación de la PReS no reconocería otros subtipos de morfea, como ocurre con las formas ampollar, profunda y subcutánea11. Clásicamente, la morfea profunda (MP) se define por un engrosamiento de toda piel hasta el tejido subcutáneo y fascia. Es una forma infrecuente, pudiendo aparecer en un 4% de los pacientes8. La morfea subcutánea se define por una afectación incipiente del tejido subcutáneo. La morfea ampollar se caracteriza por la aparición de edema y posteriormente ampollas tensas de localización subepidérmica o dérmica, debidos a obstrucción linfática por la fibrosis, pudiendo desencadenar edema en las extremidades16. La PReS propone la inclusión de estas formas en los nuevos subtipos de morfea, según sea la clínica del paciente12. Se excluirían de la clasificación la fascitis eosinofílica11, el LEA o la atrofodermia de Pasini y Pierini como extremos del espectro de la morfea17.
Paciente varón de 5 años con morfea mixta, circunscrita-lineal (MCDS) (clasificación de la PReS). Se muestra el componente de morfea circunscrita, con placas localizadas en a) lateral derecho del cuello y b) regiones preauricular y parotídea derechas, incluyendo afectación del pabellón auricular.
Hasta un 40% de los pacientes con morfea pueden presentar manifestaciones extracutáneas8 (tabla 2).
Manifestaciones extracutáneas de morfea
| Manifestaciones extracutáneas de morfea |
|---|
| Alteraciones musculoesqueléticas |
| • Artralgias (16,9%)8: son las más frecuentes. Posibles en casi todos los subtipos de morfea, muy frecuentes en los pacientes con ML de las extremidades y en menor medida en los pacientes con MG y MC |
| • Contracturas, dismetrías y alteraciones del crecimiento8: en la ML de extremidades |
| • Escoliosis y asimetría torácica8 |
| Alteraciones neurológicas |
| • Cefalea: es la más frecuente, predominando en pacientes con MCDS8 |
| • Crisis epilépticas: pueden aparecer en la MCDS y el SPR en un 8 a 21%3,4,7 |
| • Alteraciones en EEG: pueden aparecer en la MCDS y SPR, en forma de descargas frontales, temporales, frontotemporales y alteraciones generalizadas |
| • Alteraciones morfológicas en TC cerebral: deformidades óseas en forma de adelgazamiento en la región suprayacente afectada)4,18 |
| • Alteraciones en la RM cerebral: atrofia cerebral focal, desdibujamiento de sustancias gris y blanca y alteraciones de señal en T2 bajo la piel afectada4 |
| • Otras: ictus y neuropatías periféricas8 |
| Nota: con menor frecuencia, los pacientes sin clínica neurológica también pueden presentar alteraciones en las pruebas complementarias cerebrales7 |
| Manifestaciones gastrointestinales |
| • Se han descrito casos de reflujo y disfagia8 |
| Manifestaciones pulmonares |
| • Se ha descrito disnea por enfermedad restrictiva pulmonar, en pacientes con formas profundas de morfea, MG y ML8 |
| Enfermedades autoinmunes concomitantes |
| • Se han descrito segundas enfermedades autoinmunes en el 9,6% de los pacientes, incluyendo vitíligo, alopecia areata, psoriasis, artritis reumatoide juvenil, dermatomiositis juvenil y enfermedad de Crohn8 |
| Alteraciones oftalmológicas6 |
| • Se han descrito en el 3,2% de los pacientes, fundamentalmente con MCDS (66,7%) |
| • Alteraciones en párpados y anejos (41,7%) |
| • Alteraciones del segmento anterior (uveítis, epiescleritis) (29,2%) |
| • Otras menos frecuentes fueron: estrabismo paralítico (1 paciente), pseudopapiledema (1 paciente) y errores de refracción (2 pacientes) |
| Alteraciones odontológicas |
| • Se han descrito en SPR: hipoplasia maxilar y mandibular y maloclusión7 |
EEG: electroencefalografía; MC: morfea circunscrita; MCDS: morfea en coup de sabre; MG: morfea generalizada; ML: morfea lineal; RM: resonancia magnética; SPR: síndrome de Parry-Romberg; TC: tomografía computerizada.
Las alteraciones analíticas en los pacientes con morfea no se correlacionan con la actividad, curso ni el pronóstico de la enfermedad3,8. Las elevaciones de los reactantes de fase aguda son más frecuentes en las morfeas más profundas, en la ML y en la fase inflamatoria de la enfermedad, hallándose leucocitosis en el 37,5% y elevación de la velocidad de sedimentación globular en el 25% de los pacientes3. La eosinofilia periférica puede aparecer en el 62,6% de los pacientes con MP, descendiendo al 12-18,5% de los pacientes con otras formas clínicas3,8. La creatininfosfoquinasa puede elevarse en las formas más profundas, relacionándose con mialgias y debilidad muscular3. Se pueden encontrar alteraciones en la inmunoelectroforesis de proteínas séricas, con elevación de distintas inmunoglobulinas3. Los anticuerpos antinucleares pueden detectarse hasta en un 42,3%3 de los pacientes, siendo más relevantes en la ML, la morfea generalizada (MG) y en las formas profundas3,8. En el 16% de los pacientes con morfea infantil puede detectarse el factor reumatoide3.
TratamientoExisten múltiples opciones terapéuticas para la morfea, incluyendo la fototerapia, glucocorticoides tópicos, calcipotriol tópico, calcitriol oral, tacrolimus tópico, glucocorticoides sistémicos, metotrexato, mofetil micofenolato, interferón gamma intralesional, ciclosporina A, D-penicilamina, imiquimod, bosentán, infliximab, etanercept, adalimumab, hidroxicloroquina y fotoféresis18,19. El empleo de estos tratamientos con frecuencia no está sustentado por una evidencia científica suficiente, incluso en el caso de fármacos tan utilizados como los glucocorticoides tópicos19. Por otra parte, resulta llamativa la variabilidad de los tratamientos empleados en función de la especialidad (dermatología o reumatología) del médico prescriptor19. Hasta la fecha, una revisión sistemática ha analizado los estudios sobre tratamiento realizados en pacientes con morfea de cualquier edad20. En este trabajo nos referiremos a fármacos en cuyos estudios se han incluido a pacientes en edad infantil (tabla 3).
Alternativas terapéuticas para la morfea infantil
| Tratamiento | Nivel de evidencia (SIGN) |
|---|---|
| UVA1 a dosis bajas | 1- |
| UVA1 a dosis medias | 1- |
| UVB-BE | 1- |
| Baño PUVA | 3 |
| PUVA oral | 3 |
| Calcitriol oral | 3 |
| Calcipotriol tópico | 1- |
| Tacrolimus 0,1% tópico | 3 |
| Metotrexato / corticosteroides sistémicos | 1+ |
| Mofetil micofenolato | 3 |
| Bosentán | 3 |
| Imiquimod 5% tópico | 3 |
| Corrección quirúrgica | 3 |
Niveles de evidencia: 1++: metaanálisis de alta calidad, revisiones sistemáticas de ensayos controlados aleatorizados o ensayos controlados aleatorizados con un riesgo muy bajo de sesgo; 1+: metaanálisis bien realizados, revisiones sistemáticas de ensayos controlados aleatorizados, o ensayos controlados aleatorizados con un riesgo bajo de sesgo; 1–: metaanálisis, revisiones sistemáticas de ensayos controlados aleatorizados, o ensayos controlados aleatorizados con un alto riesgo de sesgo; 2++: revisiones sistemáticas de estudios caso-control de alta calidad, o estudios de caso-control o de cohorte de alta calidad con un riesgo muy bajo de confusión, sesgo o azar y una alta probabilidad de que la relación sea causal; 2+: estudios de caso-control o de cohortes bien llevado a cabo, con un riesgo bajo de confusión, sesgo o azar y una probabilidad moderada de que la relación sea causal; 2–: estudios de caso-control o de cohortes con un alto riesgo de confusión, sesgo o azar y un riesgo significativo de que la relación no sea causal; 3: estudios no analíticos (informes de casos, series de casos); 4: opinión de expertos, consensos.
PUVA: psoraleno-ultravioleta A; SIGN: Scottish Intercollegiate Guidelines Network; UVA1: ultravioleta A1; UVB-BE: ultravioleta B de banda estrecha.
Numerosos estudios avalan el empleo de la fototerapia en la morfea, predominando los diseños abiertos, no controlados, y las series de casos. Sin embargo, la población infantil está escasamente representada, habiéndose evaluado la eficacia de UVA1 a dosis baja (LD-UVA1), UVA1 a dosis media (MD-UVA1), UVBBE y PUVA tópico en este grupo de edad. Únicamente hemos hallado un estudio realizado exclusivamente en niños21.
El único ensayo clínico aleatorizado (ECA) de en morfea comparó la eficacia de LD-UVA1, MD-UVA1 y UVBBE22. La evaluación de la variable principal (escala Modified Skin Score) no fue ciega. Se incluyeron 66 pacientes con edades entre los 5 y 73 años, que presentaban MPL, ML, MCDS, MP y MG. Los tres tratamientos redujeron con significación estadística las puntuaciones en la escala MSS, mejorando los cambios histológicos y ecográficos. MD-UVA1 resultó ser más eficaz que UVBBE, pero no se encontraron diferencias entre LD-UVA1 y MD-UVA1, ni entre LD-UVA1 y UVBBE.
En población exclusivamente infantil, un estudio prospectivo abierto evaluó la eficacia de LD-UVA1 (20J/cm2) en 19 pacientes con MPL, ML, SPR y MP21. Además, los pacientes se aplicaban calcipotriol 0,005% 2 veces al día. Se observó una reducción estadísticamente significativa de la puntuación en la escala MSS de un 67,1% tras el tratamiento. Dos niños presentaron irritación cutánea leve, atribuida al calcipotriol.
Un estudio controlado intrapaciente comparó MD-UVA1 y LD-UVA1 en pacientes con MPL23. Únicamente se encontraron diferencias estadísticamente significativas entre ambas dosis de UVA1 en la ecografía.
El tratamiento con baño-PUVA (8-metoxipsoraleno) se ha empleado en un estudio prospectivo abierto, no controlado. Se incluyeron pacientes de 9 a 72 años con MPL, ML y MG. Se halló mejoría en 13/17 pacientes24, medida por una escala clínica, los cambios ecográficos y los cambios histológicos.
Finalmente, se han documentado casos anecdóticos de morfea panesclerótica de la infancia (MPE) tratados con PUVA oral25,26 y con UVA27.
Derivados de vitamina DEl calcipotriol se ha empleado por vía tópica en un estudio previamente mencionado, en asociación con LD-UVA121.
En edad pediátrica, un estudio prospectivo abierto, no controlado, evaluó la eficacia de calcitriol oral (1,25-dihidroxicolecalciferol) en 7 niños con ML28, de los cuales 5 experimentaron mejoría de acuerdo a una escala clínica propia. No se registraron efectos adversos. El calcitriol oral no demostró mayor eficacia que el placebo, en un ECA ciego realizado en 27 adultos29.
Inmunomoduladores tópicosEl tacrolimus 0,1% se ha empleado en adultos en varios estudios de pequeño tamaño30,31, presentando buenos resultados. Se ha publicado un caso de morfea ampollar infantil sin respuesta a tacrolimus 0,1%16.
En un estudio abierto, 9 niños con MPL fueron tratados con imiquimod crema 5% durante 9 meses. Imiquimod redujo la puntuación media en la escala visual analógica (VAS) y el grosor de la dermis en la ecografía de alta resolución. Sin embargo, la reducción en la escala de Despigmentación, Indurción, Eritema y Telangiectasias (DIET) no resultó estadísticamente significativa. Un paciente presentó una ulceración que precisó la suspensión del tratamiento32.
MetotrexatoEl metotrexato (MTX) es un fármaco frecuentemente empleado para tratar diversas formas de morfea infantil. La dosis habitual es 10 a 15mg/m2 semanales, vía oral o subcutánea33-35 (0,3-0,6mg/kg)36. Se asocian suplementos de ácido fólico, y durante las primeras semanas, una fase de inducción con corticoterapia sistémica, generalmente en bolos intravenosos de metilprednisolona a dosis de 30mg/kg/d (régimen pulsed intravenous corticosteroids plus methotrexate [PCMT])6,33,35,36. Adicionalmente, se puede añadir prednisona oral33. La asociación de MTX y corticoterapia parece ser más beneficiosa que cada fármaco por separado6. La duración del tratamiento varía según los estudios, llegando a mantenerse durante varios años6,34,37. En una revisión retrospectiva, 34 pacientes con MC fueron tratados con el régimen PCMT, manteniendo el tratamiento con MTX durante 1-3 años. Con esta pauta, en el 94% de los pacientes cesó la progresión de la enfermedad, y 24 pacientes (71%) no presentaban signos de enfermedad activa al finalizar el seguimiento (0,2-7 años)33. Tras 20±12 meses de inactividad, se suspendió MTX a 16 pacientes (47%), de los que 7 (44%) sufrieron recidiva33.
En 2011 se publicó un ECA doble-ciego, evaluando la eficacia de MTX 15mg/m2 por vía oral frente a placebo34. El tratamiento se mantuvo durante 12 meses o más, hasta fracaso del mismo. Adicionalmente, ambos grupos recibieron 1mg/kg/día de prednisona durante los primeros 3 meses. Se seleccionó una lesión diana para su evaluación mediante termografía y mediante un sistema de puntuación informatizado (skin score rate [SSR]). Se consideró una respuesta al tratamiento en aquellos pacientes que cumplían 3 criterios: 1) reducción de la temperatura en la termografía ≥10%, 2) SSR ≤1 y 3) ausencia de nuevas lesiones. Se consideró como recidiva el incumplimiento de al menos uno de los anteriores criterios. Se incluyeron 70 pacientes de entre 6 y 17 años, con diversos subtipos de morfea (44 ML, 18 MG y 8 MM). Se encontraron diferencias estadísticamente significativas en la termografía y en el SSR entre ambos grupos, pero no en la aparición de nuevas lesiones. De los pacientes que finalizaron el tratamiento a los 12 meses, 46% presentaron recidiva de la morfea, de los cuales el 32,6% se encontraban en el grupo de MTX y el 70,8% en el grupo placebo (p<0,005). Los efectos adversos fueron leves y no precisaron ninguna suspensión del tratamiento. Posteriormente, 65 pacientes fueron tratados en una fase abierta con 15mg/m2 de MTX durante 12 meses, seguidos de MTX en pauta descendente37, aplicando los mismos criterios de respuesta. Se alcanzó una remisión clínica en 35/65 pacientes, mantenida durante 25,6 meses (mediana 24 meses, rango 6-48 meses). En 10/65 pacientes no hubo respuesta al tratamiento, en 8/65 aparecieron recidivas antes de alcanzar los 12 meses de MTX, en 5/65 aparecieron recidivas al iniciar la pauta descendente de MTX y 7/65 pacientes fueron pérdidas del estudio.
Mofetil micofenolatoA pesar de la escasa evidencia científica existente, el mofetil micofenolato es frecuentemente empleado por los reumatólogos para tratar la morfea19. En una serie de 10 pacientes con morfea infantil se asoció mofetil micofenolato a casos refractarios al régimen PCMT, pasados al menos 4 meses desde el inicio del tratamiento38. Se registraron la mejoría clínica subjetiva y los cambios en la termografía. Ningún paciente desarrolló nuevas lesiones durante el tratamiento, en 9/10 se evidenció una reducción del endurecimiento y en 7/10 disminuyó el eritema de las lesiones.
Miscelánea: otros tratamientos publicados son el bosentán en MPE39 y la corrección quirúrgica de MCDS con técnicas como la escisión simple40, el injerto dermograso41 o el relleno profundo con un biomaterial de hidroxiapatita sódica42.
Monitorización del tratamiento (medidas de resultado)La morfea es una enfermedad infrecuente, por lo que el empleo de medidas de resultado estandarizadas y validadas puede ser de utilidad para evaluar y comparar la eficacia de los tratamientos43. Una encuesta realizada a dermatólogos pediátricos y reumatólogos pediátricos en el Reino Unido mostró que no siempre se utiliza la herramienta de monitorización que se considera más adecuada, existiendo una gran variabilidad en el empleo de las mismas, según la especialidad del médico19.
- •
Escalas clínicas
Numerosos estudios terapéuticos de morfea utilizan escalas clínicas, si bien son escasamente tenidas en cuenta en la práctica diaria19. Las escalas más recientes han sido validadas. Dos de las más empleadas son la Modified Skin Score (MSS)22,35,44,45 y la Modified Rodnan Skin Score (MRSS)19,46 (tabla 4).
Tabla 4.Escalas clínicas de valoración de la morfea
Autores Escala Descripción Ventajas/ inconvenientes Validación Seyger 199745 MSS
(Modified Skin Score)Se divide el cuerpo en 7 regiones anatómicas y se puntúan de 0 a 3 el engrosamiento cutáneo y el porcentaje de afectación de cada región. (puntuación 0-42) Puede no discriminar lesiones activas de inactivas, al medir solo el engrosamiento.
Mide el área afecta sin relacionarla con la superficie corporal (poco útil en niños).
Baja correlación con durómetro (por la inclusión del área afecta en el MSS)MSS vs. durómetro
Evaluación de:
Engrosamiento (0-3)
% de área afectado: 0 (0%), 1 (<33%), 2 (33-67%), 3(>67%)
MSS:
Variabilidad interobservador 2,2%
Variabilidad intraobservador 0,0%
Durómetro:
Variabilidad interobservador 0,5%
Variabilidad intraobservador 0.
Correlación entre MSS total y durómetro: 0,5Porta 201446 MRSS
(Modified Rodnan Skin Score)Evalúa el engrosamiento en 17 regiones anatómicas, puntuándolo de 0 a 3 Puede no discriminar lesiones activas de inactivas, al medir solo el engrosamiento.
Sobredimensiona la afectación de manos y dedos (para ES).
Mide el área afecta sin relacionarla con superficie corporal (poco útil en niños).
Buena concordancia con ECOmRSS vs. ecografía (18 MHz)
Evaluación de:
engrosamiento
Concordancia:
CI 0,8889; KW 0,783Zulian 200747 CSS (Computerized Skin Score) Evalúa área total afecta, área de lesión activa y área de lesión inactiva Permite el cálculo de la superficie corporal afecta (útil en niños).
Programa informático específico.
Poco útil para lesiones con bordes mal definidos o muy extensas.
Discriminar entre lesiones activas e inactivas es en ocasiones dificultosoEvaluación de:
área de actividad y área de induración
Concordancia interobservador 95%
Concordancia intraobservador 91–93%.
CI para el área indurada en los expertos 0,97 y en los residentes 0,91-0,94
Arkachaisri 200848 LoSSI (Localized Scleroderma Skin Severity Index) Puntúa de 0 a 3: extensión, eritema, engrosamiento y nuevas lesiones, en 14 áreas anatómicas Utilidad para la evaluación de la morfea durante la fase incipiente, inflamatoria LoSSI
PhysGA-A
PtGAAcuerdo interobservador LoSSI: 95,56% (KW 0,83).
Acuerdo intraobservador: 93,65%, 88,89% (KW 0,83, 0,66)
Correlación* de LoSSI con PhyGA 0,44
Correlación entre PhyGA / PtGA: 0,27 (95% CI: 0,0-0,64).Arkachaisri 200949 mLoSSI (modified LoSSI) Similar a LoSSI, sin tener en cuenta la superficie afecta Utilidad para la evaluación de la morfea durante la fase incipiente, inflamatoria.
La superficie afecta se elimina para incrementar el grado de acuerdo interobservadormLoSSI
PhysGA-A
PtGA
CDLQImLoSSI:
Acuerdo interobservador: CI 0,8
Acuerdo intraobservador: rs 0,77
PhysGA: interobservador: CI 0,90
PtGA: interobservador: CI 0,63Arkachaisri 201050 LoSDI (Localized Scleroderma Damage Index) Presencia de:
atrofia dermis,
atrofia subcutánea, despigmentación.
Puntuación de 0 a 3, en 18 áreas anatómicas
Utilidad para la evaluación del daño producido por la morfeaLoSDI
PhysGA-Damage
PtGALoSDI:
Acuerdo interobservador: CI 0,99
Acuerdo intraobservador: rs=0,96.
PhysGA-D:
Acuerdo interobservador: KW 0,90
Acuerdo intraobservador: rs=0,89
Correlación* LoSDI con PGA-D: 0,58
Correlación PhysGA-D y PtGA: 0,42 y 0,46Pope 201132 DIET (Dyspigmenta-tion, Induration, Erythema and Telangiectasia) Presencia de:
Despigmentación
Induración
Eritema
TelangiectasiasPuede no discriminar lesiones activas que se vuelvan residuales.
Buena correlación con la ecografía de alta resolución (13-MHz) y LoSSIDIET
VASDIET: acuerdo interobservador: CI 0,75
VAS: acuerdo interobservador: CI 0,59 VAS: Concordancia entre padres e investigadores: CI 0,5CDLQI: Children's Dermatology Life Quality Index; CI: coeficiente de correlación intraclase; ECA: ensayo clínico aleatorizado; ES: esclerosis sistémica; PhysGA: physician global assessment of disease activity; PtGA: patient global assessment of disease severity; Rs: coeficiente de correlación.
Se ha elaborado una escala clínica (SSR) que emplea un método computarizado (Computerized Skin Score [CSS])47. Aplicando un apósito sobre las lesiones de morfea y pintando en diferentes colores las zonas activas e inactivas, un programa informático discrimina los colores y calcula el área total, el área de actividad, el área de inactividad en las lesiones y la superficie corporal afecta47. El CSS se ha empleado en el único ECA, hasta la fecha, que evalúa la eficacia del tratamiento con MTX34,37.
El índice Localized Scleroderma Skin Severity Index (LoSSI) y el Physician Global Assessment of disease Activity (PGA-A) evalúan la morfea durante la fase inflamatoria48. El LoSSI modificado (mLoSSI) no tiene en cuenta la superficie afecta, resultando en una mayor concordancia inter- e intraobservador49. Posteriormente, se han desarrollado herramientas para determinar el daño residual (Localized Scleroderma Damage Index –LoSDI– y Physician Global Assessment of disease Damage –PGA-D–). Combinando mLoSSI, PGA-D y LoSDI se conforma la herramienta Localized Scleroderma Cutaneous Assessment Tool (LoSCAT)50, que determina tanto la actividad de la morfea como su daño residual. Existe una guía con fotografías de las lesiones en sus distintos grados, para mejorar su empleo51. El LoSCAT ha sido evaluado en una población pediátrica, evidenciando concretamente mLoSSI y PGA-A ser dos medidas válidas de la actividad de la morfea52.
La escala VAS evalúa la evolución de las lesiones de morfea, tanto por el paciente como por el investigador22,49,50. Por último, la escala DIET53,54 ha mostrado buena correlación con las escalas VAS, LoSSI y la ecografía de alta resolución (13-MHz)32,55.
- •
Escalas de calidad de vida
Los estudios acerca de la calidad de vida en pacientes con morfea en edad infantil son escasos. Un estudio de cohorte transversal, aplicando las escalas Child Health Assessment Questionnaire, Child Dermatology Life Quality Index (CDLQI), Child Quality of Life Questionnaire y Child Health Questionnaire (CHQ-PF50), encontró un efecto moderado de la morfea en la calidad de vida de los pacientes56.
- •
Parámetros de laboratorio
Los pacientes con morfea pueden presentar diversas alteraciones analíticas, si bien estas no parecen correlacionarse con la actividad, curso ni pronóstico de la enfermedad3,8. Diversas moléculas proinflamatorias se detectan en la morfea activa, correlacionándose con el número de lesiones activas y áreas afectas, pero aun sin utilidad práctica para la monitorización de los pacientes43.
- •
Ultrasonidos
Múltiples estudios han incluido la ecografía de alta resolución entre sus medidas de resultado21–24,57. Una sonda de 20MHz permite estudiar la dermis de las lesiones de morfea. Para evaluar el tejido celular subcutáneo, la fascia y el plano muscular, puede ser preciso emplear longitudes de onda de 8-15 MHz58. Con sondas lineales de 7-15MHz, se ha obtenido una sensibilidad y una especificidad para el diagnóstico ecográfico de la morfea del 100% y del 98,8%, respectivamente59,60. El aumento de la ecogenicidad en el plano subcutáneo y el incremento en el flujo vascular con Doppler fueron las medidas más exactas de la actividad (sensibilidad y especificidad del 100% para cada variable, con respecto al estudio histológico)60. Debe considerarse que las determinaciones ecográficas están sujetas a diferencias entre los equipos empleados y la subjetividad del ecografista. Para evitar estos factores, se han desarrollado protocolos, como la Ultrasound Disease Activity58.
- •
Termografía
La termografía ha sido empleada como medida de resultado en múltiples estudios33,34,38. Una lesión se define como activa en termografía cuando se detecta un área con una temperatura ≥0,5°C con respecto a la piel circundante y la piel contralateral61. Varios estudios le atribuyen una sensibilidad del 80-92% y una especificidad del 68-77% para detectar lesiones activas62,63. Su especificidad parece estar limitada por lesiones antiguas y esclerosadas, que pueden aparecer como «calientes», especialmente en zonas con atrofia del tejido celular subcutáneo o en regiones donde este es escaso, como la cara o el cráneo62,63. Un estudio eleva la sensibilidad de la termografía al 100% y su especificidad al 80% cuando se emplea en regiones sin atrofia importante del tejido celular subcutáneo y en asociación con la evaluación clínica64.
- •
Resonancia magnética
La resonancia magnética puede detectar el engrosamiento de la dermis en las fases activas de la enfermedad. El cambio se observa en dermis, fascia o músculo como una señal hipointensa en T1, sin realce con contraste. Si hay afectación ósea, la señal se detecta en T2 y en T1 con contraste. Las alteraciones se han observado en pacientes con MP, ML, MG y MPE, con y sin sospecha clínica de afectación musculoesquelética65,66. No obstante, se trata de una prueba de imagen cara, con una pobre resolución para la dermis, por lo que parece razonable limitar su uso en pacientes con formas graves de morfea.
- •
Mediciones con cutómetro y durómetro
Un cutómetro es un aparato que mide la elasticidad y relajación de la piel. Si bien se han empleado como medidas de resultado en varios estudios67,68, la cutometría no ha sido validada en la morfea.
Un durómetro es un aparato que mide la firmeza de la piel. Las mediciones con durómetro han presentado una buena concordancia inter- e intraobservador, incluso en observadores con distintos grados de formación, en pacientes con morfea infantil69. Además, permite discriminar entre lesiones activas e inactivas y detectar el cambio en las lesiones a lo largo del tiempo. Sin embargo, ha presentado una correlación moderada con las escalas MRSS, LoSSI y Modified Skin Score45,69, y una correlación débil con la escala mLoSDI69.
Si bien los estudios pronósticos de morfea son escasos, especialmente a largo plazo, parece tratarse de una enfermedad con tendencia a un curso crónico o intermitente-recurrente y con una frecuencia considerable de secuelas. A corto y medio plazo, el tratamiento sistémico con MTX y/o corticoterapia parece detener o mejorar la morfea6,33,34,37. Sin embargo, la tasa de recurrencia varía entre el 28-46%, tras un máximo de 20 meses del cese del tratamiento33,34,70. A largo plazo, la actividad de la morfea puede persistir en el 28-89% de los pacientes6,71. En el caso de la ML, tras un periodo de seguimiento máximo de 20 años, en una encuesta realizada a pacientes, todos excepto uno refirieron tener cambios residuales, el 66% refirieron secuelas estéticas, el 38% señalaron tener una limitación funcional y el 51% consideraron que los tratamientos recibidos habían sido efectivos6. Por último, los adultos con morfea de inicio en edad infantil pueden presentar una disminución en la calidad de vida y un incremento de cuadros autoinmunes71.
ConclusionesLa morfea es un espectro de variantes clínicas con un potencial importante de secuelas a largo plazo, por lo que un diagnóstico precoz y un tratamiento adecuado son obligados.
A pesar de su escaso uso en la práctica habitual, las herramientas para determinar la actividad de la morfea pueden ayudar en la toma de decisiones terapéuticas. Las escalas clínicas existentes parecen reflejar objetivamente el estado de la enfermedad y correlacionarse unas con otras, pero pueden consumir más tiempo del disponible en la práctica diaria. La ecografía de alta resolución posee elevada sensibilidad y elevada especificidad, pero requiere de tiempo, equipamiento y formación.
Los tratamientos que mayor grado de evidencia tienen en edad pediátrica, en base a estudios epidemiológicos, son la fototerapia y el régimen PCMT. Los estudios realizados con fototerapia han empleado fundamentalmente LD-UVA1, de escasa disponibilidad en nuestro medio. Sin embargo, un estudio no ha encontrado diferencias entre LD-UVA1 y UVBBE. Por otra parte, la evolución a largo plazo de los pacientes tratados con fototerapia no ha sido documentada.
Finalmente, el régimen PCMT resulta eficaz en el control de la morfea a corto y medio plazo. Sin embargo, al tratarse de una enfermedad de largo curso, con brotes intermitentes y periodos de remisión, serían necesarias nuevas estrategias de tratamiento y estudios de seguimiento a largo plazo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.