El uso de las inmunoglobulinas intravenosas en la medicina se remonta a hace más de 50 años, tras el uso como terapia sustitutiva en enfermedades inmunodeficientes. Sin embargo, las indicaciones de este tratamiento han evolucionado de tal manera que actualmente está dirigido a enfermedades donde el sistema inmune desempeña un papel relevante. En el campo de la dermatología se ha hecho un hueco interesante en algunas enfermedades, como la dermatomiositis, las enfermedades autoinmunes ampollares o la necrólisis epidérmica tóxica, entre otras. En los últimos años se ha prestado especial atención al uso de las inmunoglobulinas intravenosas, de hecho se han publicado recientemente nuevas guías sobre su uso, y qué consideraciones debemos tener en cuenta durante su uso en dermatología. Nuestra intención con este artículo es reflejar de una manera práctica el uso de las inmunoglobulinas intravenosas en la dermatología.
Intravenous immunoglobulin (IVIG) replacement therapy has been used in immune deficiency diseases for more than 50 years. The indications for this treatment have evolved, however, and IVIG therapy is now used in various diseases in which the immune system plays a prominent role. IVIG therapy has carved out a niche in dermatology for the treatment of such conditions as dermatomyositis, autoimmune bullous diseases, and toxic epidermal necrolysis. Special attention has been paid to this therapy in recent years. New guidelines have been published and should be taken into consideration in dermatology. This review provides a practical guide to IVIG use in our specialty.
El uso de las inmunoglobulinas se remonta a hace más de 50 años, a partir de su indicación en los déficits primarios o secundarios del sistema inmune. Su introducción en el tratamiento de diversas enfermedades dermatológicas es más reciente, debido sobre todo a la ausencia de ensayos clínicos controlados y aleatorizados, y también por considerarse un tratamiento de elevado precio. Fue en el año 2008 cuando se publicó la primera guía clínica en el uso de las inmunoglobulinas intravenosas (IGIV) y, desde ese momento, se han ido sumando en diferentes revistas numerosas publicaciones sobre su uso en casos aislados o en series de casos de procesos variados, hasta llegar a las nuevas guías sobre la utilización de este tratamiento. Se necesitan entre 3.000 y 10.000 donantes sanos para obtener un concentrado de inmunoglobulinas. Las normas de producción (OMS 1982) fueron actualizadas por The Committee for Propietary Medicinal Products of the EMEA (CPMP/BPWG/859/), con la finalidad de mantener un elevado nivel de calidad y la máxima seguridad en el proceso de manufacturación. El plasma se incuba durante un mínimo de 60 días para detectar posibles seroconversiones de agentes infecciosos (VHB, VHC, VIH, parvovirus B19, etc.) y se realiza un test de integridad funcional para la detección de anticuerpos neutralizantes y otras propiedades inflamatorias inmunomoduladoras, cuyo objetivo es detectar posibles anormalidades en la función de dichas inmunoglobulinas. Las autoridades nacionales son las responsables de la regulación del proceso de manufacturación, así como del testado virológico. Aquellos sueros de donantes con positividad para infecciones virales mediante detección por PCR, o alteraciones en la función normal de las inmunoglobulinas son desechados directamente para garantizar la calidad del producto.
Las preparaciones comerciales de IGIV contienen cantidades fisiológicas de todas las inmunoglobulinas, salvo IgA, dado que esta inmunoglobulina es la responsable de las reacciones anafilácticas. Se intenta que las prepraciones contengan la menor cantidad posible de esta inmunoglobulina.
La biodisponibilidad de las IGIV es del 100% en el momento de la infusión, y del 70-80% a las 24horas. Al quinto día se ha aclarado el 50% del producto administrado. Aunque la vida media se estima entre 18-32 días, procesos como la fiebre o las infecciones aumentan su catabolismo y, por tanto, disminuyen su vida media. Las IGIV atraviesan la placenta y se excretan por la leche materna. En cuanto al mecanismo de acción, la región Fc de las IgG permite cambios de señalización y signos de transducción en las células que expresan en su superficie los receptores Fcγ (gamma), lo que induce cambios inmunomediados tanto proinflamatorios como antiinflamatorios. Sin embargo, el mecanismo de acción de las IGIV no ha sido esclarecido completamente en estudios in vivo. Recientemente Pérez et al.1 han publicado una revisión muy completa sobre la evidencia existente del uso de las IGIV en humanos. En esta revisión se intenta exponer de una manera práctica para el lector el uso de este tratamiento en la dermatología.
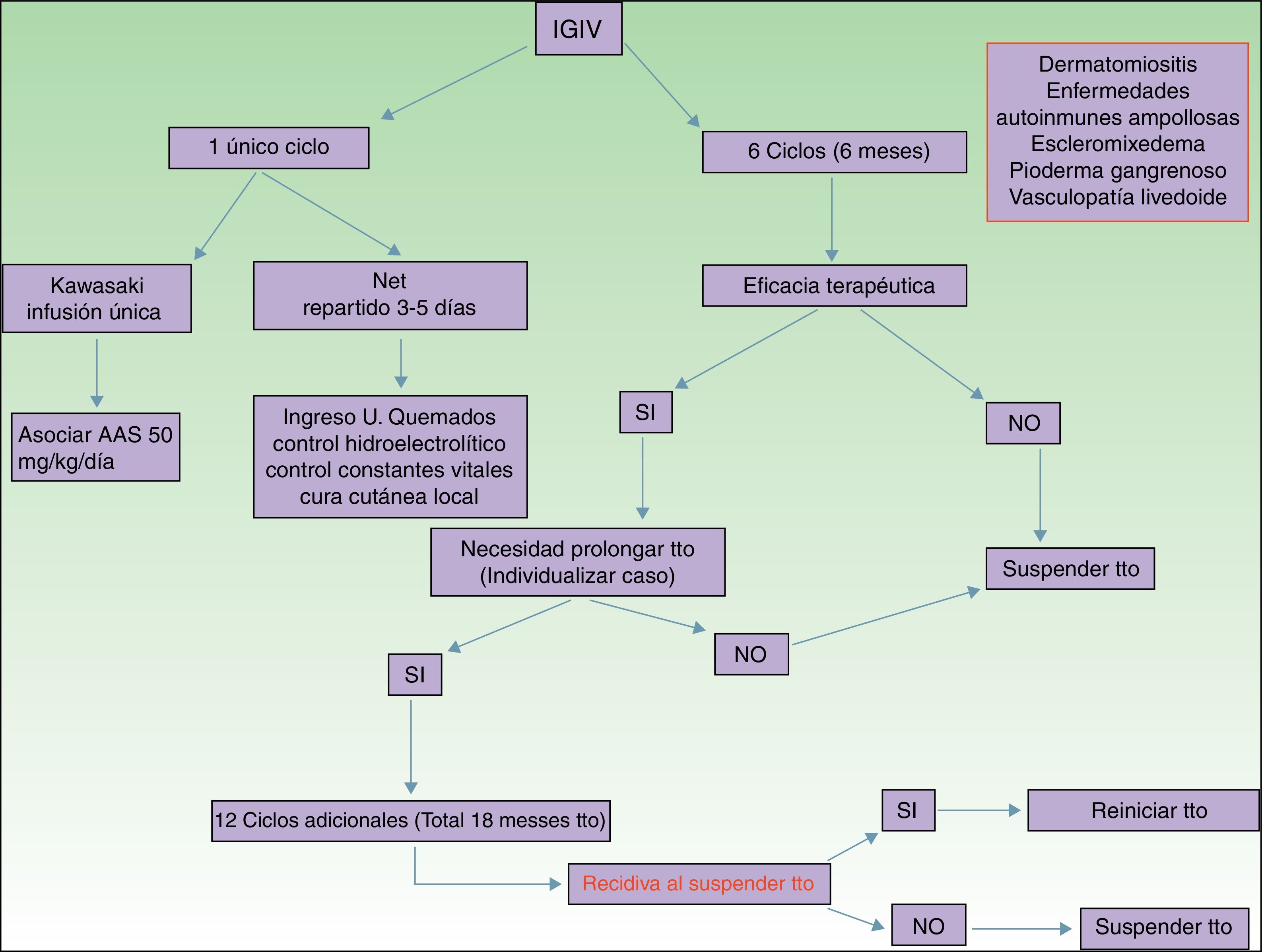
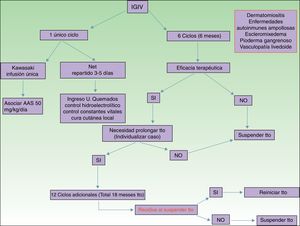
Principales indicaciones de las inmunoglobulinas intravenosas en dermatologíaSi bien es relativamente extensa la lista de enfermedades dermatológicas donde se ha descrito el uso de IGIV como una opción terapéutica (tabla 1), es cierto que prácticamente en la totalidad de ellas su indicación es off label. A pesar de esto, se han descrito buenos resultados y, por ello, vamos a destacar las más relevantes con el correspondiente nivel de evidencia y el grado de recomendación (tabla 1).
Principales enfermedades del uso de IGIV en dermatología
| Principales indicaciones off label del uso de IGIV en dermatología | Otras indicaciones |
|---|---|
| Dermatomiositis | Dermatitis atópica |
| Enfermedades autoinmunes ampollares | Urticaria autoinmune |
| Enfermedad de Kawasaki | Lupus eritematoso |
| Necrólisis epidérmica tóxica | Esclerosis sistémica |
| Escleromixedema | Vasculitis asociadas a ANCA |
| Pioderma gangrenoso | Enfermedad de Behçet |
| Vasculopatía livedoide | Sarcoma de Kaposi |
De todas las enfermedades dermatológicas que se describen en el artículo, quizá esta sea, junto con las enfermedades ampollares autoinmunes, la que reúne una mayor evidencia de su eficacia. Se han publicado estudios controlados con placebo2 y múltiples series de casos3 donde el tratamiento con IGIV ha sido satisfactorio. Está indicado como primera línea de tratamiento en aquellas dermatomiositis con afectación muscular grave (miolisis de curso fulminante), en la miositis por cuerpos de inclusión y en la polimiositis4. Se han descrito casos de dermatomiositis juvenil5, idiopática y paraneoplásica con buena respuesta al tratamiento. Las IGIV se administran de manera adyuvante, nunca en monoterapia, en aquellos pacientes que no responden adecuadamente a los corticoides sistémicos al mes de iniciarlos, o a los pacientes que al disminuir la dosis de corticoide empeoran los síntomas musculares. La posología está reflejada en la tabla 2. También resultan útiles en el tratamiento de las manifestaciones cutáneas asociadas a la DM, en especial cuando estas resultan intensas y extensas, aun en ausencia de clínica muscular6, o en el tratamiento de la calcinosis distrófica7 y refractaria a múltiples inmunosupresores8.También se han descrito buenos resultados en la DM edematosa grave9 y en la paniculitis asociada a DM10. Según la revisión sistemática realizada por Callander et al.11 las IGIV constituyen una alternativa interesante en el tratamiento de la DM amiopática, como se ha descrito en casos aislados12. En el tratamiento de la DM infantil las IGIV se posicionan como una alternativa eficaz y segura13, en especial aquellas que se administran por vía subcutánea14. Esta vía de administración ha supuesto una auténtica revolución por su seguridad, la baja tasa de efectos secundarios y evita la pérdida de días de escuela.
Posología de IGIV según la dermatosis
| Enfermedad | Posología |
|---|---|
| Dermatomiositis | Dosis: 2mg/kg peso. Repartido en 3-5 días consecutivos (400mg/día) |
| Enfermedades ampollares autoinmunes | Ciclos: 6 (6 meses) |
| Escleromixedema | Intervalo: 4-6 semanas |
| Pioderma gangrenoso | Tiempo: 18 meses |
| Vasculopatía livedoide | |
| Enfermedad de Kawasaki | Dosis: 1,6-2mg/kg peso en infusión única en 10-12h, o repartir en 3-5 días. Asociado siempre a AAS 50mg/kg de peso/día |
| Ciclos: 1 | |
| Necrólisis epidérmica tóxica | Dosis: 3 mg/kg peso. Repartido en 3-5 días consecutivos (400mg/kg/día) |
| Ciclos: 1 |
Segundo grupo de enfermedades donde las IGIV constituyen una alternativa terapéutica de interés15,16, sobre todo en las formas graves y refractarias a los glucocorticoides sistémicos asociados a inmunosupresores (azatioprina y micofenolato de mofetilo). Las IGIV en el campo de las enfermedades ampollares autoinmunes están clasificadas como segunda línea de tratamiento, aunque se han publicados casos graves de pénfigo vulgar, pénfigo foliáceo, penfigoide de membranas mucosas17 y epidermólisis ampollar adquirida18 con buena respuesta terapéutica. Otras indicaciones de menor evidencia en el uso de las IGIV son el penfigoide ampollar, la enfermedad IgA lineal, el pénfigo IgA y el pénfigo paraneoplásico. En la tabla 2 se recoge la posología de las IGIV en las enfermedades ampollares. Sin embargo, el uso del rituximab en este grupo de enfermedades ha supuesto una auténtica revolución en el tratamiento y la evolución de estos pacientes, con largos periodos libres de enfermedad19. En pacientes con una enfermedad recalcitrante la combinación de rituximab e IGIV se ha demostrado eficaz20,21, con respuestas completas y mantenidas; sin embargo, dado el elevado coste de dicha combinación, es necesario seleccionar correctamente a los pacientes subsidiarios de esta opción terapéutica. En nuestra unidad la experiencia de dicha combinación, rituximab e IGIV, en un número limitado de pacientes, hay que decirlo, ha resultado satisfactoria en aquellos casos refractarios a los fármacos de primera línea, así como de sus combinaciones permitidas.
En ciertas situaciones especiales, como cuando los glucocorticoides sistémicos puedan estar contraindicados (necrosis ósea aséptica, diabetes mellitus de difícil control u osteoporosis grave) se podría justificar el uso de las IGIV como primera línea de tratamiento, pero nunca en monoterapia, sino como adyuvante a otros fármacos inmunosupresores o rituximab, como ya se ha comentado. El cese en la aparición de nuevas lesiones, como la epitelización de las ya existentes, junto a la disminución de los títulos de autoanticuerpos (IgG medidos mediante ELISA) o la posibilidad de reducir la dosis de los glucocorticoides sistémicos sin agravamiento de la enfermedad son parámetros que permiten identificar una buena respuesta al tratamiento.
También puede tener su indicación en el penfigoide gestacional, situación especial por la limitación terapéutica que supone el embarazo, sobre todo cuando la administración de los glucocorticoides no permite un control adecuado de la enfermedad. Se ha descrito en múltiples artículos la eficacia de la administración de IGIV en casos de penfigoide gestacional refractario22,23, asociado a ciclosporina oral24 o en monoterapia25, sin ocasionar efectos secundarios en el neonato.
Enfermedad de KawasakiNivel de evidencia i. Grado de recomendación ADentro de los síndromes vasculíticos la enfermedad de Kawasaki es la única donde las IGIV se consideran de primera línea26. Quizá lo más difícil de este proceso sea sospecharlo, ya que en ocasiones el paciente no cumple todos los criterios diagnósticos, y por tanto se demora la administración del tratamiento. La posología está recogida en la tabla 2. Algunos autores defienden la administración de IGIV en una única perfusión durante 10-12horas, siempre asociada a ácido acetil salicílico. Existen factores predictivos de resistencia al tratamiento con IGIV27, actualmente el más relevante es el nivel de proteína C reactiva (PCR) antes de iniciar el tratamiento28. El objetivo del tratamiento es evitar la formación de los aneurismas coronarios, y evitar, así, las comorbilidades que éstos asocian (isquemia, alteraciones del ritmo, etc.). La disminución de las cifras de PCR en el plasma son el mejor indicador de una buena respuesta al tratamiento.
Necrólisis epidérmica tóxicaNivel de evidencia IIA. Grado de recomendación BLa necrólisis epidérmica tóxica (NET) es una toxicodermia grave con una elevada mortalidad, alcanzando un 40% según las series publicadas. La apoptosis de los queratinocitos está mediada por la acción del Fas (CD95), la granulisina y la anexina-1. La rápida identificación del proceso, retirada del fármaco sospechoso y el ingreso en la unidad de cuidados intensivos para instaurar el cuidado del paciente como si se tratase de un gran quemado son fundamentales para aumentar la supervivencia. Se han publicado numerosos metaanálisis y revisiones sistemáticas sobre el tratamiento farmacológico de la NET, dado que existen serias controversias en cuanto a la eficacia de la administración de fármacos inmunosupresores durante el ingreso hospitalario. En las últimas guías de manejo de la NET29 parece que el papel de las IGIV podrían desempeñar un rol importante si se administran de manera precoz y a dosis elevadas (3mg/kg), en un único ciclo, repartido en 3 días y con ritmo de infusión lento. Es fundamental tener en cuenta las comorbilidades del paciente, sobre todo la insuficiencia renal, las enfermedades cardiovasculares y la diabetes mellitus30, ya que fraccionar la dosis en 3-5 días evita la descompensación por sobrecarga hídrica. El mejor signo para detectar una respuesta adecuada al tratamiento es el cese del despegamiento epidérmico, así como el inicio de reepitelización de las áreas previamente afectas. A pesar de los numerosos fármacos que se han utilizado en el tratamiento de este cuadro de elevada mortalidad, los cuidados básicos de la piel y las mucosas, el control de las constantes vitales y mantener un equilibrio hidroelectrolítico adecuado parece que son las únicas intervenciones que realmente han demostrado aumentar la supervivencia del paciente31.
EscleromixedemaNivel de evidencia iii. Grado de recomendación CEl escleromixedema es una rara enfermedad que consiste en la proliferación fibroblástica y el depósito de mucina en la piel y los órganos internos, cuya consecuencia es el endurecimiento progresivo y la fibrosis. Suele ser una enfermedad de difícil tratamiento, ya que no suele responder a múltiples fármacos inmunosupresores, hecho que se asocia a una elevada morbimortalidad. En el año 2000 se describió el primer caso con buena respuesta a IGIV32. Según los datos publicados aquellos pacientes con escleromixedema en el que predomine la afectación neurocutánea las IGIV son consideradas de elección, solas o combinadas con corticoides33 o plasmaféresis34. La posología se indica en la tabla 2. Como en otras dermatosis, los factores predictivos de buena respuesta al tratamiento corresponden a los cambios cutáneos, así como a la mejora de la funcionalidad de los órganos internos.
Pioderma gangrenosoNivel de evidencia iii. Grado de recomendación CLas IGIV pueden ser consideradas como opción terapéutica en aquellos pacientes con piodermas gangrenosos graves refractarios al tratamiento habitual (glucocorticoides sistémicos y ciclosporina A oral). Solo se han publicados casos únicos o pequeñas series de casos35–37, todos con piodermas gangrenosos graves y una buena resolución del proceso. Se recomienda su administración de manera adyuvante a los glucocorticoides sistémicos y/o ciclosporina A, aunque se ha descrito algún caso administrado en monoterapia.
Vasculopatía livedoideNivel de evidencia iii. Grado de recomendación DLa vasculopatía livedoide cursa con úlceras dolorosas, sobre todo en las extremidades inferiores, que afectan gravemente a la calidad de vida del paciente. Suele ser refractaria a múltiples tratamientos. Las IGIV se han utilizado en aquellos casos graves «desesperados», con buena respuesta al tratamiento, según las series publicadas38–40. De manera creciente las IGIV se han establecido como una opción terapéutica en esta enfermedad de difícil tratamiento.
OtrasSe ha descrito en la literatura el uso de las IGIV en otras enfermedades, con respuestas clínicas variables. Sin embargo, la aparición de nuevos fármacos con tasas de respuesta mejores han desplazado su uso. Entre otras, destacamos la dermatitis atópica y el uso de dupilumab como próximo tratamiento de los casos graves41, y el uso de omalizumab en la urticaria autoinmune42. Otras enfermedades donde el papel de las IGIV no presenta respuestas terapéuticas similares a las descritas previamente son el lupus eritematoso sistémico (nivel de evidencia IIA. Grado de recomendación C), sobre todo cuando asocia afectación renal43, la esclerosis sistémica44(nivel de evidencia I. Grado de recomendación B), y el conjunto de vasculitis de pequeño vaso asociadas a ANCA45,46, como la granulomatosis con poliangeítis o la granulomatosis eosinofílica con poliangeítis, o la vasculitis tipo PAN47(nivel de evidencia IIA. Grado de recomendación B), donde el uso de las IGIV está más cuestionado, y que se reserva para aquellos casos de presentación fulminante que no mejoran con los glucocorticoides sistémicos asociados a ciclofosfamida, principalmente.
Utilización de las inmunoglobulinas intravenosasDado que dentro de la dermatología existen múltiples enfermedades que se pueden beneficiar del tratamiento con IGIV, es necesario conocer ciertas peculiaridades resumidas en los siguientes puntos. Para realizar este trabajo nos hemos basado en múltiples artículos relacionados con el uso de las IGIV en dermatología. Entre todos los trabajos queremos destacar al lector 2 de ellos, el realizado por Pérez et al.1 y la Guía europea del uso de IGIV en dermatología48, de especial interés para el lector si quiere profundizar más en el tema.
PosologíaLa dosis empleada en todas las indicaciones, salvo en la enfermedad de Kawasaki y la NET, es de 2g/kg de peso y ciclo. Esta dosis se reparte en 3 a 5 días, de modo que se administra diariamente 400mg/kg de peso y día. Es importante recordar que no precisa ajuste de dosis por comorbilidades, aunque sí se recomienda vigilar el volumen de fluido administrado en pacientes con insuficiencia renal o cardíaca.
Velocidad de infusiónLa velocidad de infusión depende del preparado comercial. Se recomienda una velocidad de perfusión inicial (primeros 30min) para preparados como Flebogamma® de 0,8 gotas/kg/min, aumentando a 1,6 gotas/kg/min si existe una buena tolerancia. Para otros preparados como Privigen 10%®, la velocidad de infusión inicial es más lenta, 0,3 gotas/kg/min, y se aumenta si hay una buena tolerancia a los 30minutos hasta un máximo de 4,8gotas/kg/min.
Monitorización antes y durante la administraciónEs fundamental realizar una anamnesis completa por órganos y aparatos para detectar antecedentes personales de cardiopatía, insuficiencia renal crónica, diabetes mellitus, hepatopatías y la toma de otros fármacos. Se recomienda realizar unos análisis con perfil renal y hepático, glucemia, hemograma, coagulación, así como los niveles de IgA, serología viral (VIH, VHB, VHC), crioglobulinas, grupo sanguíneo y estudio de trombofilias. El paciente debe firmar el consentimiento informado una vez explicado el tratamiento, los beneficios y los riesgos que asocia. Es importante guardar la etiqueta del lote, ya que permite detectar, en caso de infecciones u otras complicaciones asociadas al tratamiento, si se trata de un problema de manufacturación.
Premedicación y situaciones de suspensión. Signos de toxicidadSe recomienda administrar previa a la infusión de IGIV 1 vial de polaramine IV junto a paracetamol 1g IV. Durante el tratamiento se debe realizar un control de la tensión arterial y vigilar al paciente por si desarrolla signos o síntomas que hagan sospechar una reacción adversa, en especial sensación de opresión torácica, rubeosis, hipotensión, cefalea intensa o malestar general progresivo. Si aparece alguno de estos signos y síntomas se debe disminuir la velocidad de infusión de las IGIV, y si persiste a pesar de la administración intravenosa de polaramine, corticoides, e incluso adrenalina se debe suspender el tratamiento inmediatamente por riesgo de shock anafiláctico.
En aquellos pacientes con riesgo de tromboembolismo pulmonar se debe administrar antes y después de la infusión de IGIV 500ml de suero salino intravenoso, así como ácido acetil salicílico 100mg o heparina cálcica 1.000UI 3 días consecutivos tras el tratamiento.
Precauciones y contraindicacionesEn pacientes ancianos o con enfermedad cardiaca, renal, hipercoagulabilidad, lupus eritematoso sistémico, migraña y artritis reumatoide se debe prestar atención durante la administración del tratamiento. En cuanto a las contraindicaciones, la hipersensibilidad grave a las IGIV, la insuficiencia renal grave o el déficit de IgA son las más importantes. La FDA considera las IGIV categoría C durante el embarazo. No está contraindicada durante la lactancia. En la tabla 3 quedan registrados los efectos secundarios relacionados con la administración de IGIV49.
Principales efectos secundarios en el tratamiento de las IGIV
| Efectos secundarios49 | |
|---|---|
| Reacciones inmediatas. Primeras 24h | Generales. Cuadro pseudogripal con mialgias, artralgias, fiebre, cefalea, escalofríos. Afonía, adenopatías y palpitaciones |
| Urticaria, erupción ampollar palmoplantar | |
| Shock anafiláctico por anticuerpos anti IgA | |
| Disnea, edema agudo de pulmón | |
| Reacciones tardías | Meningitis aséptica y migrañas |
| Fenómenos tromboembólicos | |
| Insuficiencia renal aguda | |
| Hemólisis, neutropenia transitoria | |
| Hiponatremia, pseudohiponatremia | |
| Infecciones asociadas al preparado comercial | |
Grado de recomendación y nivel de evidencia del tratamiento con IGIV según enfermedad
| Enfermedad | Grado de recomendación | Nivel de evidencia |
|---|---|---|
| Dermatomiositis | B | IIa |
| Enfermedades autoinmunes ampollares | C | III |
| Kawasaki | A | I |
| Necrólisis epidérmica tóxica | B | IIa |
| Escleromixedema | C | III |
| Pioderma gangrenoso | C | III |
| Vasculopatía livedoide | D | III |
| Lupus eritematoso sistémico | C | IIa |
| Esclerosis sistémica | B | I |
| Vasculitis asociadas a ANCA | B | IIa |
Existe en la literatura múltiples publicaciones respecto al uso de las inmunoglobulinas subcutáneas como tratamiento en inmunodeficiencias, miopatías y otras enfermedades inmunomediadas50–52. El uso de esta vía de administración ha supuesto una nueva frontera en el uso de las inmunoglobulinas53,54. Como ventajas destacan que no precisan premedicación, suponen unos niveles séricos de IgG obtenidos más fisiológicos, y mejora en la calidad de vida de los pacientes, ya que no precisan el ingreso hospitalario o acudir a un hospital de día. Desde un punto de vista global, esta forma de administrar inmunoglobulinas presenta menor coste sanitario que las IGIV. Se administra mediante bombas de infusión a una velocidad entre 15-25ml/h, repartiendo la dosis total entre distintos puntos de inyección. Está contraindicada su administración vía endovascular.
Su indicación incluye, como las IGIV, las enfermedades inmunodeficientes y los procesos autoinmunes e inflamatorios. También se plantean como terapia de mantenimiento tras iniciar las IGIV. Se recomienda una velocidad de infusión máxima de 20-25ml/h. Como ejemplos se encuentran los preparados de Hizentra®, Gammanorm®, Subcuvia®, Subgam®, Gamunex-C® y Gammagard Liquid® (fig. 1).
ConclusionesEl uso de las IGIV en dermatología se ha posicionado como una alternativa terapéutica en múltiples enfermedades. A pesar de la escasez de ensayos clínicos controlados, en las publicaciones al respecto se muestran buenos resultados, con la ventaja de considerarse un tratamiento seguro. Es necesario conocer las peculiaridades en cuanto a su administración, así como los efectos secundarios que asocian, para utilizarlo de manera adecuada y evitar la aparición de efectos adversos no deseados.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses
| Grado de recomendación (Significado) |
|---|
| A Extremadamente recomendable B Recomendación favorable C Recomendación favorable pero no concluyente D Ni se recomienda ni se desaprueba |
| Nivel de evidencia (tipo de estudio) |
| I Al menos un ensayo clínico controlado y aleatorizado diseñado de forma apropiada II-1 Ensayos clínicos controlados bien diseñados, pero no aleatorizados II-2 Estudios de cohortes o de casos y controles bien diseñados, preferentemente multicéntricos II-3 Múltiples series comparadas en el tiempo, con o sin intervención, y resultados sorprendentes en experiencias no controladas III Opiniones basadas en experiencias clínicas, estudios descriptivos, observaciones clínicas o informes de comités de expertos |