La prevalencia del virus de la inmunodeficiencia humana (VIH) va en aumento en todo el mundo ya que las personas en tratamiento antirretroviral cada vez viven más años. Estos pacientes suelen ser propensos a trastornos inflamatorios debilitantes que suelen ser refractarios al tratamiento estándar. La psoriasis es un trastorno inflamatorio asociado a una carga física y psicológica, y puede ser una característica de presentación de infección por VIH. En esta población de pacientes, la psoriasis suele ser más grave, tener presentaciones atípicas e índices más altos de fracaso a los tratamientos que suelen prescribirse.
El manejo de la psoriasis asociada al VIH de carácter moderado y grave es todo un reto. Pueden considerarse agentes convencionales y biológicos, pero debe someterse a los pacientes a un meticuloso seguimiento para descartar posibles episodios adversos tales como infecciones oportunistas, así como una monitorización habitual de los recuentos de CD4 y cargas virales de VIH.
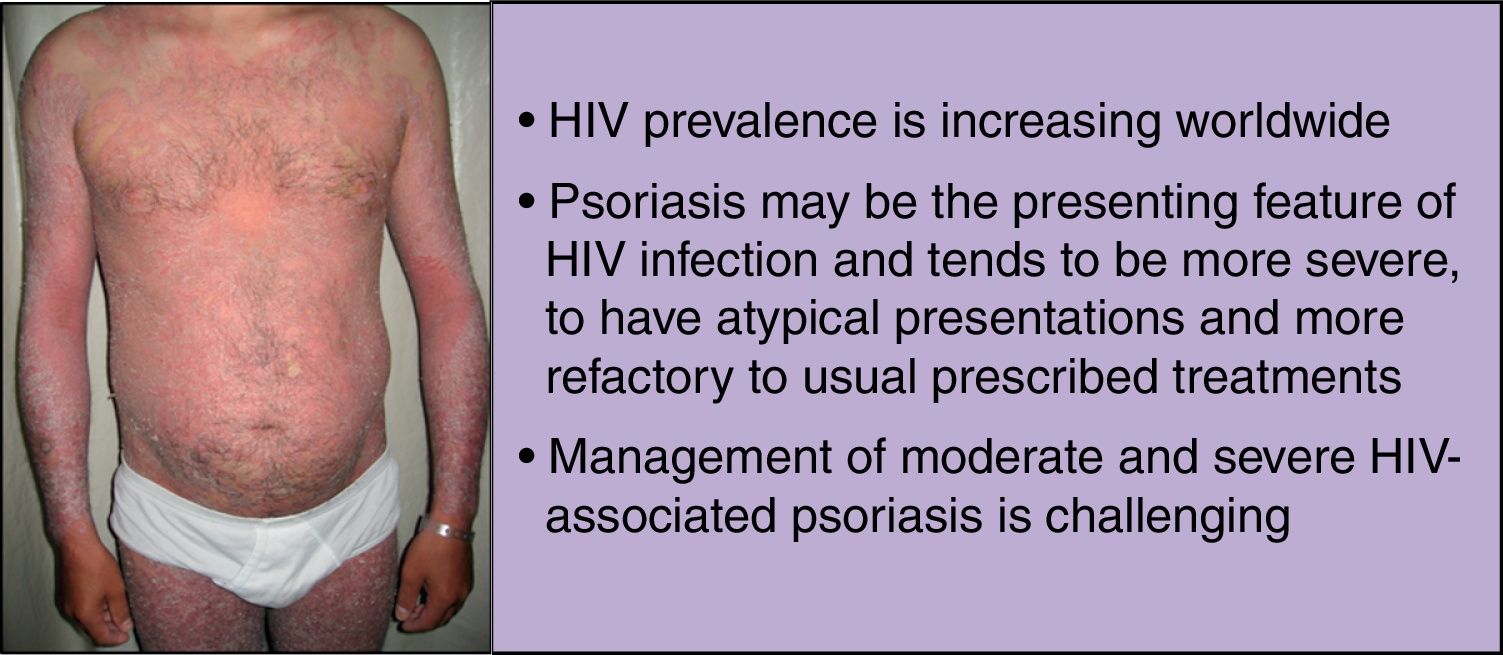
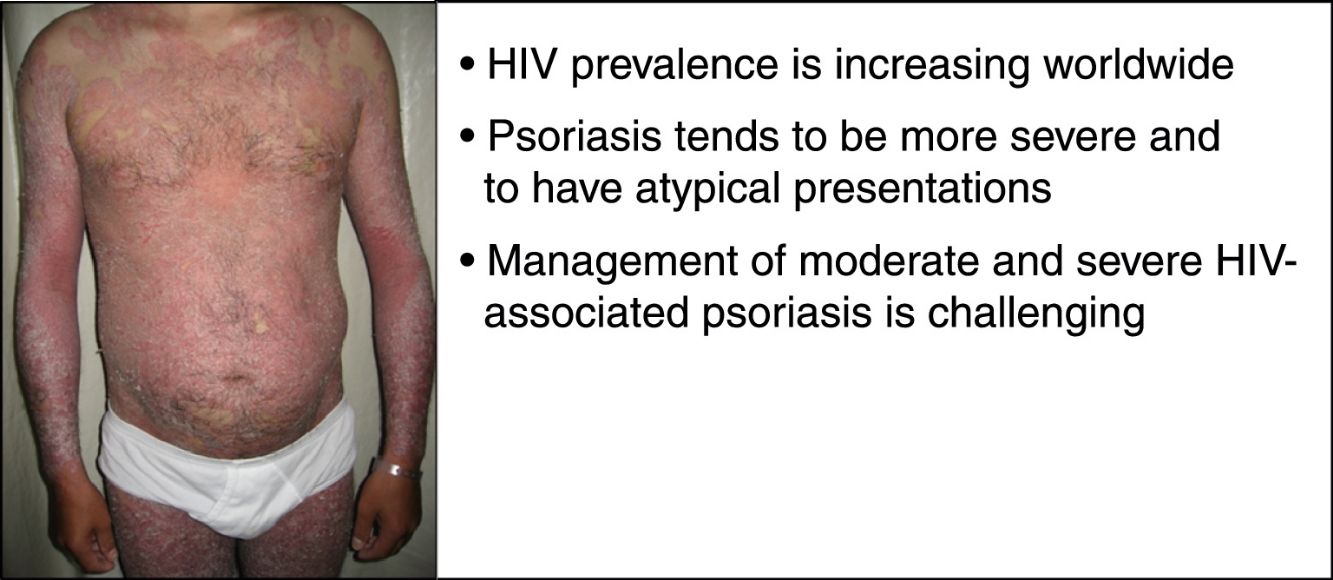
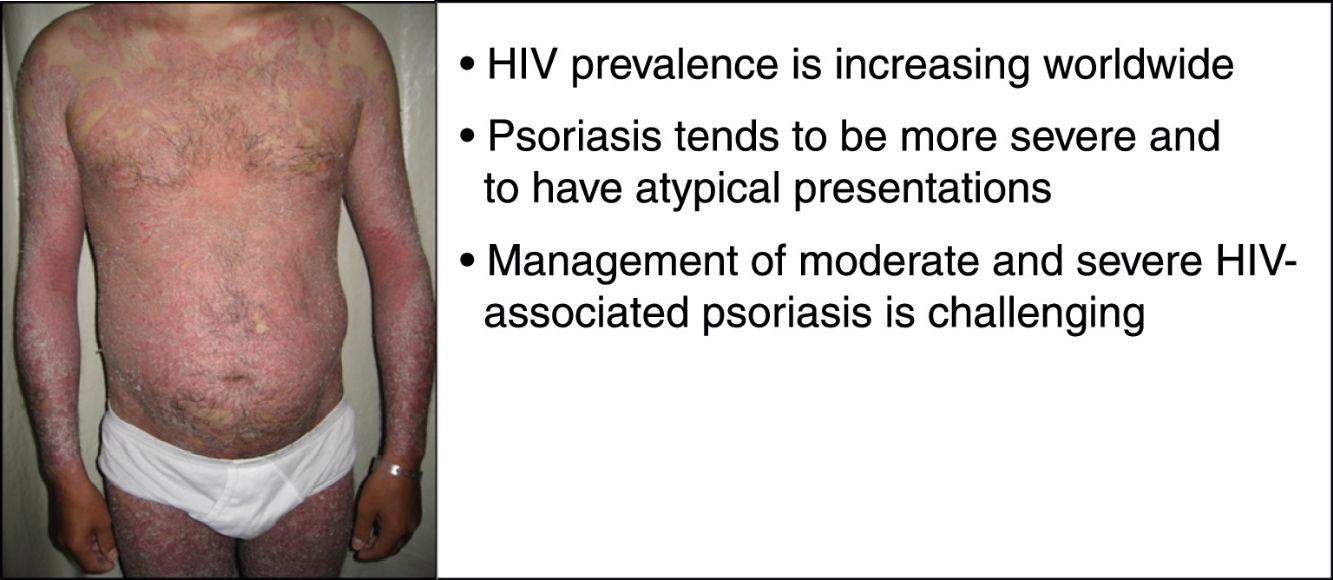
Human immunodeficiency virus (HIV) prevalence is increasing worldwide as people on antiretroviral therapy are living longer. These patients are often susceptible to debilitating inflammatory disorders that are frequently refractory to standard treatment. Psoriasis is a systemic inflammatory disorder, associated with both physical and psychological burden, and can be the presenting feature of HIV infection. In this population, psoriasis tends to be more severe, to have atypical presentations and higher failure rates with the usual prescribed treatments.
Management of moderate and severe HIV-associated psoriasis is challenging. Systemic conventional and biologic agents may be considered, but patients should be carefully followed up for potential adverse events, like opportunist infections, and regular monitoring of CD4 counts and HIV viral loads.
La prevalencia del virus de la inmunodeficiencia humana (VIH) va en aumento en todo el mundo ya que los pacientes en tratamiento antirretroviral (ARV) cada vez viven más años. Se calcula que en el año 2012, 35,2 millones de personas vivían con VIH1.
Trastornos dermatológicos como la psoriasis pueden ser la tarjeta de presentación de una infección por VIH. Además, en poblaciones infectadas con el VIH, la psoriasis suele ser más severa (correlacionándose esta enfermedad grave con una mayor inmunodepresión)2,3, tener presentaciones más atípicas e índices más altos de fracaso a los tratamientos que suelen prescribirse habitualmente4. Aunque la psoriasis de carácter leve suele ser tratable, las variantes moderadas y graves son más difíciles de tratar y lo que más preocupa, en estos casos, son los efectos secundarios de los fármacos inmunosupresores, como, por ejemplo, las infecciones oportunistas.
Esta revisión debate la patogénesis, las características clínicas y el manejo de la psoriasis asociada al VIH.
PsoriasisLa psoriasis es un trastorno inflamatorio sistémico5, asociado a una carga tanto física como psicológica6. Se han descrito 5 tipos de psoriasis: psoriasis en placa, psoriasis guttata, psoriasis inversa, psoriasis pustulosa (localizada o generalizada) y psoriasis eritrodérmica5. La artritis psoriásica concomitante sobreviene en el 30% de los pacientes7. La psoriasis también se asocia a importantes comorbilidades, tales como enfermedad de Crohn, cáncer, depresión, enfermedad del hígado graso no alcohólico, síndrome metabólico (o sus componentes) y enfermedad cardiovascular (ECV)8,9. Estas asociaciones pueden deberse a similitudes en la base genética debido a la inflamación sistémica propia de la psoriasis grave10.
El compromiso tanto del sistema inmunológico innato como del adaptativo en la psoriasis es algo comúnmente aceptado11,12. Varias células inmunológicas, incluidas las células dendríticas, los macrófagos, varios subgrupos de células T, los neutrófilos, los mastocitos, los queratinocitos y otros, producen una amplia variedad de mediadores proinflamatorios, tales como IFN-α, TNF-α, IL-1β, IL-6, IL-20, IL-23, quimiocinas y péptidos antimicrobianos, que inician, amplifican y mantienen la cascada inflamatoria psoriásica13–31.
Virus de la inmunodeficiencia humanaExisten 2 tipos de VIH: el VIH-1 y el VIH-2. El VIH-1 tiene una marcada diversidad genética fruto de la función propensa al error de la transcriptasa inversa, resultando en un alto índice de mutación. El VIH-2 es más propio de África Occidental, menos transmisible y, aunque causa enfermedades similares, la inmunodeficiencia avanza algo más despacio32.
La seña de identidad de una infección por VIH es la progresiva depleción de células CD4 debido a una menor producción y a una mayor destrucción. Las células T CD4 se eliminan mediante infección directa y efectos espectador de formación sincitial, activación inmunológica, proliferación y senescencia. Al inicio de la infección, al descenso de células T CD4 circulantes le sigue una recuperación hasta alcanzar, casi, concentraciones normales, que descienden, lentamente, a razón de 50-100cél/μL por año33. La infección por VIH también se caracteriza por un marcado aumento de la activación inmunológica, incluido tanto el sistema inmunológico adaptativo como el innato34. Los condicionantes de esta activación inmunológica incluyen los efectos directos del VIH como un ligando para los receptores tipo Toll (TLR7 y TLR 8) expresados en las células dendríticas plasmocitoides, lo que acarrea la producción de IFN-α35; la translocación microbiana, con lipopolisacáridos como potentes activadores del TLR4 que acarrea, a su vez, la producción de citocinas proinflamatorias como la IL-6 y el TNF-α36; la coinfección con virus que inducen una profunda expansión de las células T activadas37; y un menor cociente de células T-helper 17 y células T reguladoras, sobre todo en el tracto gastrointestinal38. Existen evidencias de inflamación residual o de una mayor activación inmunológica, incluso en pacientes con VIH con una adecuada restauración de células T CD4 en tratamiento ARV.
Envejecer con VIH suele asociarse a comorbilidades no infecciosas, tales como ECV, hipertensión, diabetes mellitus tipo 2, enfermedad renal crónica, osteopenia/osteoporosis y cánceres no asociados al sida. Estas comorbilidades heterogéneas comparten la edad y, presumiblemente, la infección por VIH como factores de riesgo independientes y suelen agregarse en complejos patrones de multimorbilidad39,40. La patofisiología de la ECV asociada al VIH incluye una intricada interrelación entre inflamación, efectos directos de las proteínas del VIH, disfunción inmunológica, efectos farmacológicos, malnutrición y otros factores. Tanto la inflamación como la dislipidemia condicionan la patofisiología de la enfermedad arterial coronaria en pacientes infectados por VIH. En especial, la replicación viral persistente del VIH41, las translocaciones microbianas42 y las coinfecciones (por ejemplo, citomegalovirus) contribuyen a un entorno proinflamatorio que acelera la aterosclerosis37. El desarrollo de tratamientos ARV ha transformado el VIH, que ha pasado de ser una enfermedad con un desenlace fatal a ser una dolencia crónica tratable. Los regímenes estándar combinan 2 inhibidores de la transcriptasa inversa análogos de los nucleósidos con un inhibidor de la transcriptasa inversa nucleósido, un inhibidor de la proteasa o un inhibidor de la integrasa. Tras iniciar el tratamiento ARV, la carga viral plasmática desciende hasta alcanzar concentraciones por debajo del límite de detección de las pruebas que se comercializan en la actualidad, en la mayoría de las personas en tan solo 3 meses. En cambio, la recuperación de células T CD4 en sujetos tratados es variable43. No obstante, el uso prolongado de ARV predispone a desarrollar dislipidemia, hiperglucemia y lipodistrofia, entre otros efectos secundarios44. Los inhibidores de la proteasa, en especial la vieja generación, suelen estar implicados en la dislipidemia asociada a ARV y se asocian, también, a un mayor riesgo de presentar infartos agudos de miocardio45,46. Se dice que aumentan el riesgo de padecer una ECV porque inducen dislipidemia y la producción de especies reactivas de oxígeno, con la correspondiente disfunción mitocondrial, infiltración grasa en hígado y músculos, e insulinorresistencia47. En países de rentas altas, estos efectos, sumados a los cardíacos asociados al envejecimiento y a la inflamación, contribuyen a un mayor riesgo de desarrollar numerosas ECV44. Por otro lado, en zonas en las que el inicio del tratamiento ARV se demora y el acceso a estos tratamientos es limitado, las manifestaciones predominantes siguen siendo enfermedades miopericárdicas secundarias a infecciones oportunistas48.
Psoriasis y VIHLa psoriasis asociada al VIH tiene una prevalencia similar o mayor que la psoriasis seronegativa en la población general49. Un reciente estudio de cohorte poblacional a nivel nacional realizado en Taiwán reveló que el VIH puede aumentar el riesgo de desarrollar psoriasis incidental. Este estudio incluyó 102.070 pacientes (20.294 pacientes con VIH y 81.776 controles pareados) y reveló que después de realizar los correspondientes ajustes en función de la edad, el sexo y las comorbilidades, la infección por VIH fue un factor de riesgo independiente para la psoriasis incidental (cociente de riesgos instantáneos ajustados 1,80; intervalo de confianza del 95% de 1,38 a 2,36)50.
Resulta interesante observar que las variantes genéticas que contribuyen a la inmunidad antiviral pueden, también, predisponer a desarrollar psoriasis, ya que los pacientes con esta dolencia tienen más probabilidades de presentar variantes genéticas que les protejan frente a la enfermedad del VIH-1. También se descubrió que el genotipo compuesto KIR3DS1 más HLA-B Bw4-80I, que, respectivamente, codifican un receptor activador de una célula natural killer y su ligando putativo, aumentan notablemente la propensión a la psoriasis y se asocian con un enlentecimiento del avance del sida51. Además, múltiples genes asociados a la psoriasis (RNF114, TNFAIP3,TNIP1, MDA5 y RIG-1) han demostrado ser capaces de regular la señalización antiviral52–55. No obstante, este efecto antiviral probablemente se vea limitado solo a la piel y la psoriasis tenga un efecto antiviral sistémico. De hecho, un reciente estudio retrospectivo de cohorte demostró que la concurrencia de psoriasis e infección por VIH se asoció a un punto fijo de carga viral en suero más alto, aunque irrelevante a nivel clínico, que el VIH sin psoriasis56. Además, se ha descubierto que variantes asociadas a la psoriasis en las regiones clase i y clase iii del CMH ejercen su influjo sobre el control que tiene el huésped de la infección por VIH-1. El control del VIH-1 es un raro fenotipo inmunológico (el 1% de los sujetos infectados con VIH-1) en el que los pacientes infectados por el virus VIH-1 mantienen, espontáneamente, cargas virales bajas en ausencia de tratamiento ARV. Dos polimorfismos de nucleótido único clase i del CMH asociados a la psoriasis (rs9264942 y rs3021366) se asociaron tanto con el estado del controlador del VIH-1 como con la carga viral, mientras que otra variante clase iii del CMH (rs9368699) se asoció solo a la carga viral. También se vio que otras variantes genéticas fuera del CMH (SOX5, TLR9, SDC4, PROX1, IL12B, TLR4, MBL-2, TYK2, IFIH1) posiblemente ejercieron su influjo, lo cual justifica seguir investigando sobre esta cuestión57.
La psoriasis se ha observado en todos los estadios de infección por VIH y en algunos pacientes podría ser la presentación inicial de la infección. En pacientes con psoriasis preexistente, la exacerbación de la enfermedad es algo común cuando sobreviene infección por VIH49. Las exacerbaciones psoriásicas secundarias a infecciones por estafilococo y estreptococo son también más habituales en pacientes con VIH que en aquellos sin VIH, y colonizaciones graves suelen prolongar el curso de la enfermedad58.
En el contexto del VIH, el desequilibrio de las células T podría ser, en parte, responsable del empeoramiento de la psoriasis, debido a la depleción de células T supresoras CD4, resultando en rutas proinflamatorias no comprobadas59. Además, se han identificado transcritos de ARN VIH en la piel de pacientes con psoriasis asociada al VIH y dentro de células dendríticas dérmicas factor xiiia+ CD4, lo cual evidencia un papel directo del VIH y es compatible con el empeoramiento de la enfermedad con las cargas virales más altas que se asocian al avance de la inmunodeficiencia60. El VIH podría también desencadenar directamente la psoriasis como factor coestimulador de presentación antigénica o como fuente de los superantígenos59. En la psoriasis asociada al VIH, la proteína Nef–factor regulador negativo–del VIH tiene propiedades superantígenas61. Además, las infecciones por virus y bacterias, frecuentes en el VIH, podrían contribuir a la propagación del epítope60.
La psoriasis también se ha descrito como una manifestación del síndrome inflamatorio de reconstitución inmune (IRIS) asociado al VIH. El IRIS es una exacerbación o emergencia de una enfermedad desconocida anterior resultante de la rápida restauración de respuestas inmunológicas específicas de patógeno a antígenos preexistentes combinada con la desregulación del sistema inmunológico, lo que sucede poco después de iniciar el tratamiento ARV. El IRIS suele sobrevenir cuando se inicia un tratamiento ARV en pacientes con recuentos bajos de CD4, o inmediatamente después de iniciar un tratamiento por infecciones oportunistas. Las estrategias encaminadas a minimizar el IRIS incluyen la instauración de tratamientos ARV con recuentos altos de CD4, la instauración tardía en pacientes infectados, y el cribado y prevención de infecciones oportunistas62. Empieza a haber evidencias de que uno de los mecanismos inmunopatogénicos del IRIS acarrea un cambio rápido y desregulado del estado predominante de la infección por VIH avanzada de la célula Th2 hacia un estado dominante de recuperación del sistema inmunológico de las células Th1 y Th1763.
Como se ha señalado antes, la infección por VIH y la psoriasis son afecciones en las que las ECV son un importante grupo de dolencias comórbidas. Por eso, el cribado, la monitorización y el tratamiento tanto de los factores de riesgo cardiometabólico como de las ECV es importante en pacientes con psoriasis infectados por el VIH, ya que estos individuos son más propensos a desarrollar dichas enfermedades.
Características clínicasLos índices de incidencia de la psoriasis en pacientes infectados por el VIH son similares a los de la población general4. No obstante, son características las presentaciones clínicas confusas e inusuales, cierta gravedad en la enfermedad y las frecuentes exacerbaciones58. Aunque todos los subtipos clínicos de psoriasis pueden darse en pacientes con psoriasis asociada al VIH, las variantes guttata, inversa y eritrodérmica son las más frecuentes2,3,64. Con frecuencia puede coexistir más de un tipo morfológico de psoriasis en un único paciente, lo cual es una seña de identidad clara de la psoriasis asociada al VIH3.
Al igual que ocurre en pacientes sin VIH, la psoriasis en placas es la forma más común de esta enfermedad, con hasta un 90% de los casos. No obstante, en esta población específica hay cierta predilección por las lesiones en el cuero cabelludo, el compromiso palmoplantar y flexural, así como una tendencia hacia una inmunodeficiencia grave, con recuentos de CD4 por debajo de 200cél/mm34,65. Por otro lado, pueden desarrollarse diferentes variantes clínicas durante el transcurso de la enfermedad. No suele haber antecedentes familiares de psoriasis60. En casos de exacerbación súbita de psoriasis (grave, extensa e inflamatoria), debe sospecharse de infección por VIH (fig. 1)49.
La sebopsoriasis es más frecuente en pacientes con VIH. Las características clínicas son una superposición de la dermatitis seborreica y la psoriasis66. La sebopsoriasis puede desencadenarse por la presencia de levaduras, y la efectividad de los antifúngicos sistémicos o tópicos resulta útil a la hora de distinguir esta variante de la forma clásica de psoriasis67.
La psoriasis rupioide es una de las variantes más raras conocida de la psoriasis y se ha descrito como una manifestación de la psoriasis asociada al VIH68. Esta variante se caracteriza por la presencia de nódulos hiperqueratósicos y placas con forma de cono o lapa cubiertos por una capa o costra exudativa que suele presentarse en las extremidades60.
La artritis psoriásica es mucho más destructiva y refractaria a los tratamientos convencionales en la población de pacientes con VIH, y su prevalencia es también mucho mayor que su homóloga inmunocompetente69,70. La prevalencia de la artritis reactiva es también más alta en pacientes con VIH. Esta enfermedad es una espondiloartropatía seronegativa caracterizada por una tríada de artritis, uretritis y conjuntivitis71. El síndrome de psoriasis y artritis reactiva es una presentación reconocida de la psoriasis asociada al VIH58. La presentación cutánea típica de esta variante, que se observa en más de la mitad de los pacientes, es la queratodermia blenorrágica con placas psoriasiformes palmoplantares. La histología es idéntica a la de la psoriasis pustular60.
Diagnóstico y diagnóstico diferencialLas enfermedades cutáneas son manifestaciones comunes en la infección por VIH y sida, y muchas son indicativas del grado de disfunción inmunológica. La psoriasis puede ser la tarjeta de presentación de una infección por VIH y darnos una pista clínica sobre el estado del sistema inmunológico del paciente72. La historia clínica del paciente debe incluir detalles sobre miembros de la familia con esta enfermedad y posibles factores desencadenantes, como, por ejemplo, infecciones actuales o nuevos fármacos utilizados73. Al igual que ocurre con pacientes no infectados por el VIH, el diagnóstico de psoriasis se basa en los hallazgos clínicos, siendo el uso de biopsias cutáneas raro para llegar al diagnóstico74. El compromiso de las extremidades también es algo que debe investigarse, sobre todo en pacientes con VIH. En presencia de la extraordinariamente rara variedad de psoriasis rupioide, los médicos han de sospechar una inmunodepresión como VIH/sida o cualquier otra desregulación del sistema inmunológico72.
El diagnóstico diferencial más habitual de la psoriasis incluye infección por tiña, dermatitis seborreica y eccema de varias causas. Un diagnóstico diferencial menos habitual sería liquen plano, pitiriasis rubra pilaris, pitiriasis rosada y linfoma cutáneo65. Aunque la pitiriasis rubra pilaris es una enfermedad rara que puede asociarse a infección por VIH (tipo vi) y se caracteriza por la presencia de pápulas queratósicas foliculares que pueden fusionarse y dar lugar a placas eritematosas o color salmón capaces de desarrollar escamas75, los linfomas cutáneos no Hodgkin son raros en pacientes con infección por VIH-1 y casi todos los casos descritos se relacionan con el linaje de células T con características histopatológicas de micosis fungoide o síndrome de Sézary76.
El pseudolinfoma cutáneo CD8+ asociado al VIH también debe tenerse en cuenta en pacientes con VIH, sobre todo en aquellos gravemente inmunodeprimidos, pudiendo recordarnos un cuadro de psoriasis, y suele presentarse en forma de placas extensas o eritrodermia. Histológicamente, este pseudolinfoma imita al linfoma cutáneo de células T. Como tratamiento de primera línea, suele instaurarse terapia ARV altamente activa, sobre todo en pacientes profundamente inmunodeprimidos, aunque el metotrexato ha demostrado ser seguro y eficaz en pacientes moderadamente inmunodeprimidos77,78.
La sífilis secundaria papuloescamosa también puede recordarnos, clínica e histológicamente, a un cuadro de psoriasis, pudiendo distinguirse por otros indicios clínicos de sífilis y una serología de sífilis positiva. Es necesario tener un alto índice de sospecha, ya que podemos encontrarnos con serologías falsas negativas de sífilis debido al llamado fenómeno prozona asociado a cargas altas de treponemas con VIH60.
La sarna costrosa, a la que los pacientes con VIH son propensos, es altamente contagiosa, pero caso de pasarse por alto durante el diagnóstico, puede descartarse en el microscopio. La presentación clínica imita a la psoriasis, ya que las lesiones se presentan como placas descamativas en piel, cuero cabelludo y uñas79.
En casos de psoriasis ungueal, hay que tener especial cuidado a la hora de descartar onicomicosis, ya que las características clínicas pueden ser similares, y es frecuente en pacientes con VIH60.
Algunos pacientes con psoriasis eritrodérmica presentan grandes escamas que recuerdan a la ictiosis lamelar o a las erupciones farmacológicas eritrodérmicas crónicas. Los pacientes infectados por el VIH son especialmente susceptibles a estas últimas; de ahí que debamos indagar en la historia clínica del paciente y tener un alto índice de sospecha. Estos pacientes pueden desarrollar fracaso cutáneo generalizado y una tasa más alta de mortalidad60.
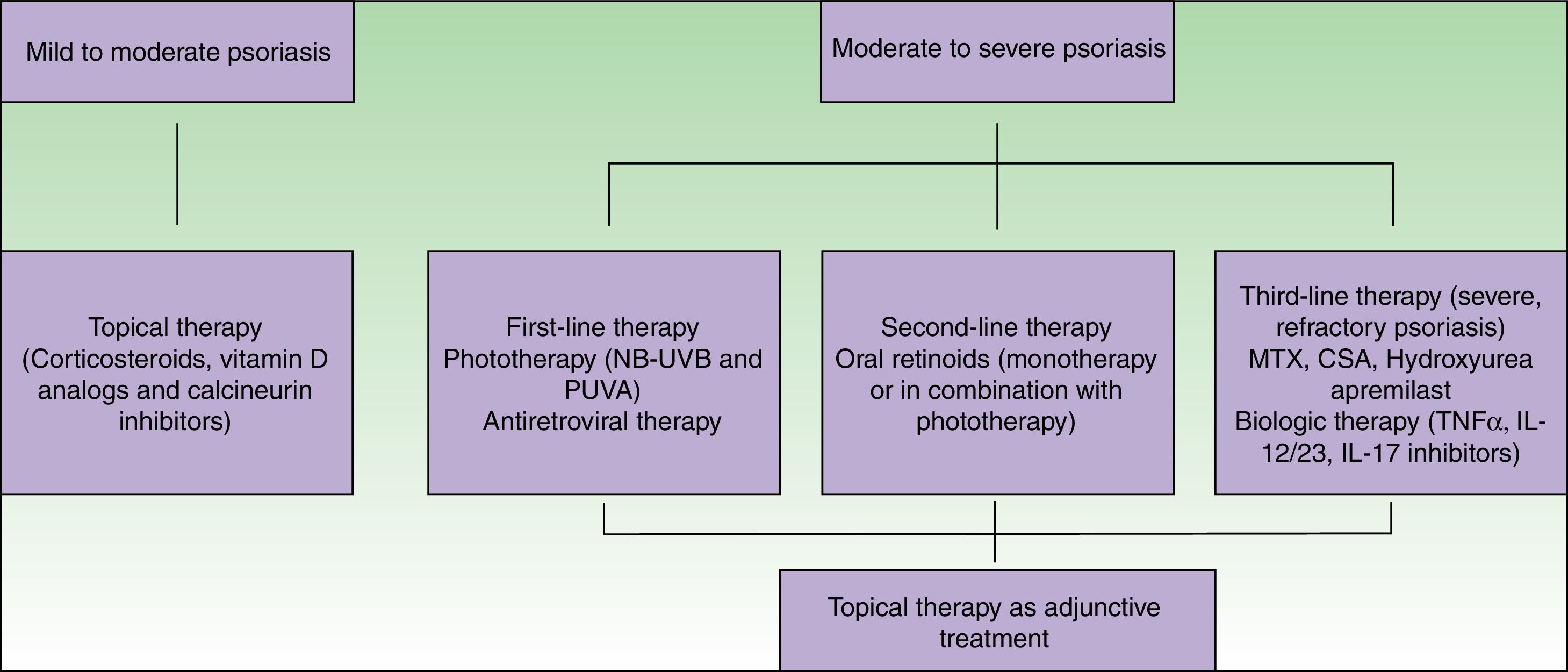
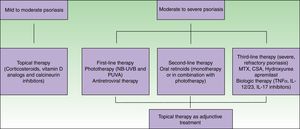
TratamientoEl tratamiento de la psoriasis en pacientes infectados por el VIH plantea diferentes desafíos terapéuticos, ya que la psoriasis asociada al VIH es una enfermedad mediada por las células T en un marco de depleción de células T. Muchos de los tratamientos sistémicos de la psoriasis son inmunosupresores y, potencialmente, pueden acarrear complicaciones serias en el marco de una infección por VIH3. Además, seguimos sin tener directrices específicas para el abordaje y tratamiento de pacientes con psoriasis asociada al VIH, y buena parte de las evidencias existentes se limitan a informes de casos clínicos y a pequeñas series de pacientes. La figura 2 resume el algoritmo de tratamiento de la psoriasis asociada al VIH.
Pueden utilizarse tratamientos tópicos, solos o junto a otras modalidades de tratamiento, como fototerapia y agentes sistémicos. Estas terapias son apropiadas para el tratamiento de la enfermedad de carácter leve a moderado, o como tratamiento adyuvante de la enfermedad de carácter moderado a grave80.
Los corticosteroides, los derivados de la vitamina D o la combinación de ambos suelen bastar para el manejo de la enfermedad de carácter leve. Los inhibidores tópicos de la calcineurina se utilizan para tratar zonas como, por ejemplo, áreas intertriginosas o el rostro65. Los efectos secundarios de los tratamientos tópicos en pacientes con VIH son parecidos a los de la población no infectada por el VIH, por lo que hay que tener un especial cuidado a la hora de utilizar estos agentes80.
La fototerapia (luz ultravioleta B de banda estrecha y PUVA) y las terapias sistémicas están recomendadas para el manejo de pacientes con enfermedad de carácter de moderado a grave. Tanto la luz ultravioleta B de banda estrecha como el PUVA se utilizan en el tratamiento de la psoriasis asociada al VIH. Al igual que ocurre en la población no infectada por el VIH, la fototerapia es clínicamente efectiva y ofrece un notable alivio a pacientes con enfermedad debilitante80. Un potencial problema asociado al uso de luz ultravioleta es la fotosensibilidad. Los pacientes con VIH son más propensos a la fotosensibilidad, quizá por el propio VIH o por el tratamiento ARV81. Debe tenerse especial cuidado a la hora de seleccionar a los pacientes, ya que se ha observado una mayor incidencia de cáncer de piel no melanoma y melanoma en pacientes que recibieron más de 250 tratamientos de PUVA82,83, aunque, en líneas generales, se tiene la noción de que la luz ultravioleta B es segura79.
En pacientes con VIH, el tratamiento ARV también debería tenerse en cuenta como terapia de primera línea para el manejo de la psoriasis de carácter entre moderado y grave, y en algunos pacientes puede usarse como monoterapia80. En varios informes de casos clínicos se ha descrito una mejoría de la psoriasis asociada al VIH tras iniciar un curso de tratamiento ARV84–86.
Como tratamiento de segunda línea de la psoriasis de carácter de moderado a grave se recomienda el uso de agentes orales. Los retinoides orales son los de uso más habitual y son una alternativa eficaz y no inmunosupresora. Los retinoides tienen éxito como monoterapia o como parte de regímenes combinados, sobre todo con tratamiento con luz ultravioleta. Un efecto adicional es que pueden utilizarse dosis acumulativas más bajas de luz ultravioleta. Las dosis para pacientes con VIH son similares a las de pacientes sin VIH, aunque quizá sean necesarias dosis más altas para tener resultados óptimos87,88.
En pacientes refractarios, inmunosupresores como el metotrexato, la ciclosporina y la hidroxiurea son opciones a tener en cuenta; no obstante, en poblaciones infectadas por el VIH, las infecciones oportunistas son un problema. Aunque el metotrexato es un tratamiento clave en la psoriasis clásica y se ha utilizado en el manejo de psoriasis asociadas al VIH, es hepatotóxico y puede provocar leucopenia e infecciones oportunistas, de ahí que deba utilizarse con mucha precaución60.
La ciclosporina ejerce su efecto inmunomodulador inhibiendo la activación de células T CD4 mediante la inhibición de la calcineurina. En casos publicados de tratamiento de psoriasis asociada al VIH con ciclosporina, los pacientes experimentaron un rápido aclaramiento de la psoriasis y no desarrollaron infecciones oportunistas ni empeoró la inmunosupresión89,90. Por otro lado, es preciso llevar a cabo una monitorización exhaustiva tanto de la nefrotoxicidad como de la hipertensión. La ciclosporina se recomienda durante cursos cortos e intermitentes de hasta 12 semanas de duración. También puede utilizarse cuando estemos buscando remisiones rápidas en variantes potencialmente letales de psoriasis, tales como la eritrodermia o la psoriasis pustular generalizada60.
La hidroxiurea es un fármaco inmunosupresor sistémico. Además de sus efectos antipsoriásicos, también se ha demostrado que tiene efectos antivirales. Este doble efecto hace que sea un fármaco a tener en cuenta para el tratamiento de la psoriasis asociada al VIH. Son muchos los informes que hablan, por separado, de los perfiles de seguridad y eficacia de la hidroxiurea, en el manejo de la psoriasis y el VIH. Una revisión de 2011 muestra que la hidroxiurea es, por lo general, segura y eficaz. El principal riesgo son los episodios adversos hematológicos (anemia, leucopenia, trombocitopenia y macrocitosis), que parecen depender de la dosis. A pesar de este hecho, la hidroxiurea puede ser una opción viable para pacientes con psoriasis generalizada que no responden adecuadamente a opciones más seguras, sean o no pacientes seropositivos91.
Apremilast es un inhibidor oral de moléculas pequeñas de PDE4 que trabaja intracelularmente bloqueando la degradación de cAMP y aumentando los niveles de cAMP intracelular en las células que expresan PDE4. Esta inhibición resulta en una menor expresión de los mediadores proinflamatorios, así como en una mayor expresión de los mediadores antiinflamatorios, proporcionando apremilast un modo de acción más antiinflamatorio que inmunosupresor92. Apremilast no se ha estudiado para el manejo de la psoriasis asociada al VIH, aunque su uso sí ha tenido éxito y ha sido seguro en pacientes con psoriasis seropositivos y con hepatitis C93. Debido a su mecanismo de acción y menor inmunosupresión, apremilast puede ser una buena opción para el manejo de la psoriasis asociada al VIH.
Durante la pasada década se han desarrollado y aprobado varios agentes biológicos para el tratamiento de la psoriasis y la artritis psoriásica. Los inhibidores de TNF-α incluyen el etanercept, el adalimumab y el infliximab, que están aprobados para el tratamiento tanto de la psoriasis como de la artritis psoriásica, y el golimumab aprobado para el tratamiento de la psoriasis artrítica. Ustekinumab es un inhibidor de p40-IL12/23 que está aprobado para ambas indicaciones, mientras que el secukinumab y el ixekizumab son inhibidores de la IL-17A aprobados para el tratamiento de la psoriasis y este último también para el de la artritis psoriásica. Los agentes biológicos se utilizan para tratamientos a largo plazo porque no hay evidencias de toxicidad acumulativa ni tampoco de interacciones fármaco-fármaco. Además, estos agentes tienen un buen perfil de seguridad y solo aumentan, tímidamente, el número de infecciones oportunistas. Estos agentes suelen utilizarse como tratamientos de segunda línea, en parte por su alto coste65.
La Academia Americana de Dermatología revisó 27 casos publicados de pacientes con VIH tratados con inhibidores de TNF-α. Aunque esta revisión se ve limitada por el hecho de no haberse llevado a cabo ningún ensayo controlado aleatorizado con esta población de pacientes, se propone que enfermos seropositivos fiables, que siguen sus regímenes de medicación y se someten habitualmente a revisiones, pero que no han tenido éxito con otras modalidades de tratamiento, podrían ponerse en tratamiento con inhibidores de TNF-α, igual que se han utilizado, eficientemente, agentes anti-TNF-α en pacientes con psoriasis asociada al VIH y artritis psoriásica asociada al VIH que no responden a un régimen combinado de metotrexato y ciclosporina94–96. El TNF-α es una citocina esencial en la patogénesis de la inflamación granulomatosa; simula la transcripción VIH in vitro97 y se cree que está implicada en la patogénesis de las úlceras aftosas, la caquexia, la demencia, la fatiga y la fiebre en el VIH. El uso de este tratamiento es preocupante porque predispone a contraer otras infecciones. Cuando se utilizan inhibidores de TNF-α hay que descartar otras comorbilidades que suelen darse en el VIH, tales como tuberculosis, hepatitis B e infecciones oportunistas. La infección por hepatitis C, no obstante, no supone una contraindicación para el uso de inhibidores de TNF-α porque ya se han utilizado de forma segura y eficaz en pacientes infectados de hepatitis C60,98. En lo que respecta al uso de ustekinumab, hay informes de su utilización en psoriasis refractaria asociada al VIH que hablan de su perfil de seguridad y eficacia, así como de la ausencia de efectos secundarios o de un descenso en el recuento de CD499,100, si bien el uso y perfil de seguridad de secukinumab e ixekizumab todavía ha de establecerse en esta población de pacientes. Recientemente, se ha informado del uso de inhibidores de TNF-α y ustekinumab en 10 pacientes italianos. La duración media del tratamiento fue de 34,8 meses y ninguno de los pacientes desarrolló episodios adversos, complicaciones infecciosas ni tuvo que interrumpir el tratamiento. Todos los pacientes alcanzaron niveles estables o ligeramente más bajos de CD4, que terminaron resolviéndose sin necesidad de cambiar el tratamiento ARV101.
ConclusionesLa disfunción inmunológica asociada al VIH crea un ambiente favorable para el desarrollo de psoriasis. Los principales mecanismos que se postulan son el desequilibrio de células T y el VIH como fuente de los superantígenos, así como un factor coestimulador de presentación antigénica.
El tratamiento de la psoriasis asociada al VIH puede ser todo un reto, por lo que debe basarse en la gravedad de la enfermedad, y los riesgos y los beneficios asociados a cada tratamiento deben tenerse muy en cuenta. Para este grupo de pacientes todavía no se han llevado a cabo ensayos clínicos ni hay directrices específicas al respecto. Los tratamientos de primera línea consisten en tratamientos tópicos, fototerapia, tratamiento ARV y, como terapias de segunda línea, retinoides orales. Para el manejo de la variante refractaria de esta enfermedad, se recomienda un tratamiento con inmunosupresores sistémicos. En estos casos, los agentes biológicos pueden también ser una buena opción a tener en cuenta. Con independencia del tratamiento que se instaure, debe hacerse un meticuloso seguimiento para descartar posibles episodios adversos, con monitorizaciones frecuentes de los recuentos de CD4 y de las cargas virales de VIH.
Conflicto de interesesN. Queirós no tiene conflicto de intereses. T. Torres ha participado en ensayos clínicos promovidos por AbbVie, Amgen y Novartis y ha recibido honorarios como consultor y/o ponente en actividades formativas promovidas por AbbVie, Boehringer Ingelheim, Celgene, Janssen, Leo-Pharma, Lilly-Eli, MSD, Novartis, y Pfizer.