Metotrexato (MTX) es el fármaco sistémico convencional más empleado en el tratamiento de la psoriasis. A pesar de que la experiencia en su uso se remonta a más de 50años, todavía existen aspectos en el manejo clínico poco estandarizados o conocidos. Bajo esta premisa, un grupo de 15 expertos participó en una conferencia de consenso en la que, a partir de una revisión sistemática y 2 rondas de validación previas, se validaron recomendaciones categorizadas por nivel de evidencia y grado de recomendación sobre el uso de MTX en la psoriasis.
La elección de MTX en el tratamiento de la psoriasis moderada grave requiere la evaluación previa de la idoneidad del fármaco, incluyendo estado de vacunación, cribado de tuberculosis y gestación. La dosis recomendada de inicio es de 10-20mg/semana si el paciente no presenta factores de riesgo, con una dosis terapéutica de 15mg/semana para la mayoría de pacientes y máxima de 20mg/semana. La mayor parte de pacientes que respondan al tratamiento mostrarán mejoría antes de las 8 semanas. Es preferible la administración parenteral de MTX cuando exista riesgo de error en la pauta de administración, incumplimiento, intolerancia gastrointestinal o respuesta insuficiente a dosis plenas por vía oral. Los métodos no invasivos son preferibles para la monitorización de la hepatotoxicidad. El tratamiento con MTX representa una buena opción en pacientes con antecedentes oncológicos, mientras que no se recomienda en pacientes portadores crónicos de virus de la hepatitisB o seropositivos para el virus de la inmunodeficiencia humana (VIH+).
Methotrexate (MTX) is the most frequently used conventional systemic drug in the treatment of psoriasis. Despite over 50years of experience in this setting, certain aspects of the use of this drug in clinical practice are still little standardized and poorly understood. For this reason, a group of 15 experts took part in a consensus development conference to achieve consensus on a series of recommendations on the use of MTX in psoriasis. The guidelines, which were developed on the basis of a systematic review of the literature, were validated by 2 rounds of voting and categorized by level of evidence and grade of recommendation. Before MTX can be used to treat moderate to severe psoriasis, the patient must be evaluated to assess the suitability of the treatment, including consideration of vaccination status and screening for tuberculosis and pregnancy. The recommended starting dose for a patient with no risk factors is 10 to 20mg/wk, the therapeutic dose for most patients is 15mg/wk, and the maximum dose is 20mg/wk. Most patients who respond to treatment will show improvement within 8weeks. Parenteral administration of MTX is desirable when there is a risk of erroroneous dosing, nonadherence, gastrointestinal intolerance, or inadequate response to the therapeutic dose taken orally. Noninvasive methods are preferred for monitoring hepatotoxicity. MTX is a good treatment option for patients with a history of cancer, but is not recommended in patients with chronic hepatitisB infection or individuals who are seropositive for human immunodeficiency virus.
Metotrexato (MTX) es el fármaco sistémico convencional más empleado en la psoriasis, enfermedad en la que sigue considerándose un tratamiento de primera línea en las formas moderadas y graves, tanto en monoterapia como en asociación con otros fármacos. La evidencia en cuanto a su empleo en psoriasis moderada-grave está basada en la experiencia sobre su uso durante más de 50años y en estudios retrospectivos más que en ensayos clínicos o estudios prospectivos y controlados1,2. Aunque algunos estudios prospectivos que comparan MTX con otros fármacos empleados en el tratamiento sistémico de la psoriasis como ciclosporina (CsA) o biológicos como adalimumab o infliximab proporcionan un buen nivel de evidencia3-6, la heterogeneidad en su empleo en cuanto a dosis y escalado dificulta la asunción de un consenso en el uso de este fármaco en la práctica clínica habitual. Existen precedentes rigurosos en la literatura reciente de revisiones sistemáticas y consenso de expertos que aportan recomendaciones sobre algunos aspectos del uso de MTX en psoriasis que, sin embargo, dejan todavía temas sin responder7,8.
El objetivo de este trabajo es el de establecer unas recomendaciones sobre diversos aspectos relacionados con el uso del MTX en el tratamiento de la psoriasis moderada-grave a partir de las evidencias científicas disponibles y la práctica clínica habitual.
Metodología de consensoSe estableció un grupo de trabajo formado por 15 dermatólogos expertos en psoriasis pertenecientes al Grupo de Psoriasis de la Academia Española de Dermatología y Venereología (AEDV) y autores de publicaciones previas sobre el tema y con experiencia en el manejo de MTX en esta enfermedad. Tres de ellos actuaron como coordinadores y los 12 restantes como panel de expertos discusores y validadores de las propuestas procedentes del grupo coordinador. Los coordinadores elaboraron y consensuaron un índice temático (tabla 1) con el objetivo de incluir las preguntas clínicas consideradas de interés en cuanto al manejo clínico de MTX en psoriasis. Para cada pregunta se aplicó la metodología PICO (Patients, Intervention, Comparison, Outcome). El panel de preguntas fue la base para la revisión de la literatura y la elaboración de recomendaciones.
Resumen de temas abordados en el índice temático estructurados por bloques
| Previo al inicio de MTX | Tratamiento con MTX | Seguimiento del tratamiento con MTX | Combinaciones terapéuticas con MTX | Uso de MTX en escenarios complejos |
|---|---|---|---|---|
| ✓ Vacunación ✓ Tuberculosis ✓ Concepción y embarazo ✓ Perfil de seguridad | ✓ Cribado previo al tratamiento con MTX ✓ Dosis de inicio y ajuste de dosis ✓ Vía de administración ✓ Tiempo de respuesta ✓ Uso en niños ✓ Uso en artropatía psoriásica ✓ Uso en otras indicaciones ✓ Suplementación con folatos | ✓ Pacientes sin factores de riesgo | ✓ Combinación con UVBBE ✓ Combinación con biológicos | ✓ Pacientes con hepatopatía ✓ Pacientes ancianos ✓ Pacientes oncológicos ✓ Pacientes portadores de hepatitis B ✓ Pacientes con VIH |
MTX: metotrexato; UVBBE: ultravioleta B de banda estrecha.
Se realizó una búsqueda bibliográfica en Medline y la Biblioteca Cochrane, con una perspectiva temporal genérica de 5años (artículos publicados a partir de mayo de 2009), ampliando los límites si no se obtenían resultados con los filtros previos. Se filtró por guías de práctica clínica o consensos, revisiones sistemáticas, metaanálisis y ensayos clínicos, realizados en humanos y en inglés o castellano. Las palabras clave generales fueron «psoriasis» y «metotrexato», y para cada apartado sometido a consenso se aplicaron otras más específicas, como «methotrexate/contraindications», «tuberculosis/diagnosis», «pregnancy», «test dose», «subcutaneous administration», «folic acid» o «hepatopathy». Finalmente, se completó la búsqueda con artículos proporcionados directamente por los coordinadores, así como la ficha técnica de MTX9.
Elaboración de recomendacionesPara cada pregunta se realizó una extracción de contenidos y se evaluó la calidad de cada artículo mediante las plantillas del Scottish Intercollegiate Guidelines Network (SIGN)10. En base a la evidencia científica disponible para cada pregunta se redactaron las recomendaciones de uso.
Proceso de consensoA partir de la revisión bibliográfica y del documento elaborado, los miembros coordinadores diseñaron un cuestionario con las recomendaciones que fue enviado a los discusores para su evaluación individual. Se definieron los porcentajes de acuerdo como sigue: consenso, cuando al menos el 85% del panel estaba de acuerdo con una recomendación; mayoría, cuando el acuerdo estaba entre el 66 y el 84%; y discrepancia, para porcentajes inferiores al 66%. Cada experto indicó si estaba o no de acuerdo con cada recomendación y pudo realizar comentarios.
Tras la agrupación de los resultados, se envió una segunda ronda con las recomendaciones que no habían alcanzado el nivel de consenso o que, tras evaluar los comentarios, requerían una segunda valoración. Tras esta segunda ronda se celebró una reunión presencial, donde se discutieron las discrepancias y se volvieron a votar las recomendaciones con un sistema de votación electrónica anónima.
Posteriormente se elaboró un documento con las recomendaciones acordadas y se categorizó el nivel de evidencia (NE) y el grado de recomendación (GR) de cada una de ellas, utilizando el sistema SIGN modificado, tal como sugiere el Manual metodológico de elaboración de guías del Sistema Nacional de Salud11 (tablas s1 y s2, material suplementario).
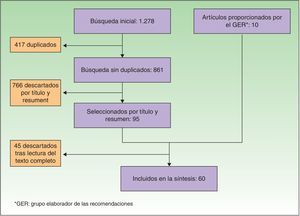
Recomendaciones consensuadasBúsqueda bibliográfica y elaboración de recomendacionesLa búsqueda bibliográfica en las bases de datos médicas proporcionó 861 referencias. Tras la lectura del título y resumen, se seleccionaron 95 artículos, y se añadieron manualmente 10 artículos más: algunos de ellos por haberse publicado posteriormente a la búsqueda bibliográfica y otros por ser relevantes según el panel de expertos y no haber aparecido en la primera búsqueda. Tras la lectura del texto completo de todos ellos, finalmente se extrajeron contenidos de 60 referencias (fig. 1).
Tras la evaluación de las recomendaciones en las 2 rondas de consenso y la reunión presencial se validaron un total de 27 recomendaciones (grado de acuerdo ≥85%), de las cuales 15 obtuvieron unanimidad (grado de acuerdo 100%) (tabla 2).
Resumen de recomendaciones consensuadas
| N.° | Recomendación | % A | NE / GRa |
|---|---|---|---|
| Previo al inicio de metotrexato | |||
| 1 | Antes de iniciar tratamiento con MTX, al igual que en otros fármacos sistémicos inmunosupresores, se recomienda evaluar el estado de vacunación de todos los pacientes con psoriasis de moderada a grave | 92% | IV/D |
| 2 | No se recomienda el uso de MTX en pacientes con vacunación con virus vivos atenuados en los últimos 3 meses | 85% | ✓ |
| 3 | Aunque el riesgo de reactivación de tuberculosis latente es bajo según la evidencia científica, se recomienda efectuar cribado de tuberculosis en todo paciente que va a iniciar tratamiento con MTX dentro de la estrategia común de cribado para terapia sistémica | 100% | IV/D |
| 4 | Ante el diagnóstico de infección tuberculosa latente en un paciente en tratamiento con MTX, en general se tratará la misma de igual forma que en el caso de otros fármacos sistémicos inmunosupresores | 86% | ✓ |
| 5 | En un varón en tratamiento con MTX se recomienda, como regla general, no engendrar durante el tratamiento y posponer el deseo de embarazo hasta 3 meses después de la suspensión del mismo Sin embargo, teniendo en cuenta la ausencia de evidencia científica firme en cuanto a la interacción con la espermatogénesis, el tratamiento puede mantenerse cuando MTX está a dosis bajas si el paciente manifiesta deseo de embarazo, tras informar al paciente y registrar su decisión en la historia clínica | 100% | 4/D 2+/D |
| 6 | Con respecto a la concepción en mujeres, se recomienda esperar de 3 a 6 mesesb tras la suspensión de MTX | 92% | 4/D |
| 7 | MTX puede administrarse en la mayor parte de las situaciones conocidas como «contraindicaciones relativas»19,25, aunque requiere una monitorización personalizada y debe asumirse un posible mayor riesgo | 100% | ✓ |
| 8 | La existencia de factores de riesgo cardiovascular no contraindica el uso de MTX | 93% | ✓ |
| Inicio de metotrexato | |||
| 9 | La dosis recomendada de inicio de MTX en psoriasis es 10-20mg/semana si el paciente no presenta factores de riesgo de aparición de efectos adversos (deterioro de la función renal, riesgo de hepatotoxicidad, interacciones farmacológicas). Si el paciente presenta estos factores de riesgo, el tratamiento puede iniciarse a dosis inferiores (5-7,5mg/semana), con reevaluación clínica y analítica al mes. Sin embargo, debe tenerse en cuenta que la dosis mínima eficaz para la mayoría de pacientes es de 7,5mg/semana, salvo cuando existan alteraciones en el aclaramiento renal del fármaco | 100% | ✓ |
| 10 | La dosis de 15mg/semana se considera terapéutica para la mayoría de pacientes, con una dosis máxima de 20-25mg/semana. Si la tolerancia clínica y analítica es adecuada a las 3-4semanas del inicio, la dosis se ajustará a la considerada óptima terapéutica para el paciente | 100% | ✓ |
| 11 | La dosis máxima capaz de proporcionar respuesta se considera de 20mg/semana en la mayoría de los pacientes. Sin embargo, puede valorarse su incremento hasta los 25mg/semana en algunos casos | 86% | 1++/B |
| 12 | En pacientes con psoriasis y en tratamiento con MTX que hayan alcanzado una respuesta satisfactoria se puede realizar una disminución progresiva de la dosis, reduciéndola de 2,5 a 5mg cada 2-4meses hasta conseguir la dosis óptima para ese paciente | 100% | ✓ |
| 13 | Es preferible la administración parenteral de MTX en aquellos pacientes en los que haya riesgo de error en la pauta de administración, incumplimiento o exista intolerancia gastrointestinal. Esta sería también una opción adecuada cuando la respuesta clínica sea insuficiente a dosis plenas por vía oral (≥15mg/semana) | 100% | 4/D |
| 14 | A partir de la evidencia disponible, parece razonable esperar 12-16semanas en pacientes en tratamiento con dosis óptima, antes de considerar fallo terapéutico a MTX. Sin embargo, debe recordarse que la mayor parte de pacientes que responden al tratamiento mostrarán mejoría antes de las 8semanas | 100% | ✓ |
| 15 | El MTX (0,3mg/kg/semana) es una opción terapéutica para la psoriasis en edad pediátrica, aunque la evidencia es escasa | 92% | ✓ |
| 16 | Se recomienda efectuar suplementación con folatos en los pacientes en tratamiento con MTX, justificada por una potencial disminución de efectos adversos y un escaso impacto en la respuesta terapéutica | 85% | 4/D |
| 17 | No existen evidencias de que deba priorizarse el ácido fólico o el ácido folínico, y la elección dependerá de las preferencias del especialista. El ácido fólico puede tener una ventaja adicional desde el punto de vista de la eficiencia al tener un menor coste y ventajas farmacocinéticas en determinadas subpoblaciones de pacientes | 100% | 1++/A |
| 18 | Se recomienda efectuar una suplementación de 5-15mg/semana de ácido fólico o de 15mg/semana de ácido folínico, 24-48h tras la administración de MTX | 86% | 4/D |
| Seguimiento del tratamiento con metotrexato | |||
| 19 | En pacientes sin factores de riesgo debería llevarse a cabo una analítica en las primeras semanas de tratamiento. Si se produce una elevación de las enzimas hepáticas <3 veces del límite normal, se recomienda monitorizar cuidadosamente, repetir el análisis en 2-4semanas y disminuir la dosis si fuera necesario. Para elevaciones persistentes por encima de estas cifras debería reconsiderarse la conveniencia de MTX para estos pacientes | 100% | IV/D |
| 20 | A pesar de sus limitaciones, los métodos no invasivos (determinación de PIIINP y elastografía de transición) son útiles para la monitorización de la hepatotoxicidad de MTX en los pacientes | 86% | IV/D |
| Combinaciones terapéuticas con metotrexato | |||
| 21 | Cuando el perfil del paciente lo aconseje, puede administrarse MTX en asociación con infliximab o adalimumab para evitar el desarrollo de anticuerpos antifármacos y/o para mejorar su farmacocinética | 100% | 2++/B |
| Uso de metotrexato en escenarios clínicos complejos | |||
| 22 | En los pacientes con factores de riesgo hepático o enfermedades hepáticas en los que se decida administrar MTX, deberán tomarse precauciones que incluirán el inicio con dosis inferiores a las propuestas como estándar para la mayoría de pacientes y con incremento gradual, la búsqueda de la dosis mínima eficaz, el control de los factores que pudiesen condicionar la toxicidad del fármaco —terapia concomitante, ingesta enólica—, la rigurosidad en la monitorización analítica y la realización de pruebas complementarias | 100% | ✓ |
| 23 | Los pacientes ancianos presentan un menor aclaramiento de MTX y presentan una mayor tendencia a los efectos secundarios graves asociados con MTX, por lo que tanto las dosis de inicio como las de mantenimiento deben ser menores. Las dosis iniciales propuestas serían de 5 a 7,5mg/semana, ajustándose en función de la evolución y respuesta en cada caso | 100% | ✓ |
| 24 | Aunque en pacientes ancianos el objetivo terapéutico será idéntico al planteado en otros grupos de edad, deberá priorizarse la seguridad, ya que son más frecuentes algunos factores (insuficiencia renal, interacciones farmacológicas) que condicionan efectos secundarios graves | 86% | ✓ |
| 25 | El tratamiento con MTX representa una buena opción en pacientes con antecedentes oncológicos, al igual que el tratamiento tópico, la fototerapia o acitretina. El dermatólogo deberá valorar de forma individualizada los riesgos y beneficios y contar con el consentimiento informado del paciente | 100% | 4/D |
| 26 | No se recomienda el uso de MTX en pacientes portadores crónicos de VHB por el riesgo de reactivación de la infección y por su efecto hepatotóxico | 100% | 4/D |
| 27 | No existen suficientes evidencias para el empleo seguro de MTX en pacientes VIH+, por lo que la decisión de utilizar MTX en el tratamiento de psoriasis en estos pacientes debe ser individualizada valorando la relación riesgo-beneficio | 85% | 3/D |
A: grado de acuerdo; GR: grado de recomendación; NE: nivel de evidencia.
✓: buena práctica clínica recomendada en base a la experiencia clínica del grupo que ha desarrollado el consenso.
1. Antes de iniciar tratamiento con MTX, al igual que en otros fármacos sistémicos inmunosupresores, se recomienda evaluar el estado de vacunación de todos los pacientes con psoriasis de moderada a grave (IV/D).
Se ha demostrado que la respuesta a la vacunación durante el tratamiento con MTX es subóptima, circunstancia que obliga a conocer el estado de inmunización de cualquier paciente que vaya a recibir este fármaco12. Por otro lado, aunque el aumento en el riesgo de sufrir infecciones en pacientes con MTX no está del todo claro en la psoriasis, es posible que estos pacientes vayan a requerir medicación adicional o un aumento de dosis eventual. Por ello, las recomendaciones de Wine-Lee et al.12 establecen que a todos los pacientes con psoriasis moderada-grave se les debe realizar un estudio inicial sobre su estado de vacunación, incluyendo: inmunización o historia de enfermedad por Haemophilus influenzae, tétanos, tosferina, virus varicela zoster, hepatitisA y B, virus del papiloma humano, gripe, Neisseria meningitidis y Streptococcus pneumoniae. En este estudio se deberán incluir pruebas serológicas para la hepatitis.
2. No se recomienda el uso de MTX en pacientes con vacunación con virus vivos atenuados en los últimos 3 meses (✓).
El tratamiento con MTX está contraindicado en caso de haberse realizado una vacunación reciente con virus vivos atenuados12,13. Sin embargo, el intervalo de tiempo para ello no está bien establecido. De este modo, la recomendación de la National Psoriasis Foundation13 no detalla el tiempo que debe haber pasado desde la vacunación hasta el inicio del tratamiento. Wine-Lee et al.12 recomiendan un periodo de lavado adecuado, teniendo en cuenta que son necesarios de 1 a 3meses para que la inmunidad vuelva a la normalidad14. Por ello, el grupo de expertos acuerda un periodo de 3meses, similar al establecido para otros fármacos inmunomoduladores.
Tuberculosis3. Aunque el riesgo de reactivación de tuberculosis latente es bajo según la evidencia científica, se recomienda efectuar cribado de tuberculosis en todo paciente que va a iniciar tratamiento con MTX dentro de la estrategia común de cribado para terapia sistémica (IV/D).
El tratamiento de la psoriasis con fármacos inmunosupresores puede estar asociado a un riesgo elevado de reactivación de tuberculosis (TBC). Aunque la evidencia de la reactivación de TBC latente durante el tratamiento con MTX es muy escasa15-17, resulta conveniente llevar a cabo una valoración unificada de un paciente con psoriasis y con indicación de tratamiento sistémico. Esto se debe a que, con frecuencia y debido a la cronicidad de la enfermedad y la variabilidad de la respuesta, resulta adecuado que el estudio basal incluya procedimientos estandarizados que posteriormente sean aplicables a los distintos fármacos con efecto inmunosupresor indicados en la psoriasis en cuanto al cribado de TBC, tal como ha sido sugerido por algunos autores18,19, o como referencia basal en el caso de que apareciera una complicación pulmonar. Este cribado se puede efectuar mediante Mantoux (y booster si procede)19 o mediante técnicas in vitro basadas en la detección de IFN-gamma (IGRA), teniendo en cuenta que la evidencia no permite, en el momento actual, establecer una preferencia entre ambos procedimientos en pacientes tratados con MTX. En el caso de positividad de alguna de estas pruebas se requerirá la práctica de un examen radiológico de tórax a fin de descartar una infección activa.
4. Ante el diagnóstico de infección tuberculosa latente en un paciente en tratamiento con MTX, en general se tratará la misma de igual forma que en el caso de otros fármacos sistémicos inmunosupresores (✓).
Según Bogas et al.20, el tratamiento con MTX probablemente no se asocia con un aumento significativo en la incidencia de TBC21, por lo que el manejo de esta en pacientes con MTX será similar al de la población general. Otros autores especifican que debería llevarse a cabo un cribado y quimioprofilaxis con isoniazida en pacientes de riesgo y monitorización estrecha durante el tratamiento con MTX22, prestando especial atención al riesgo de hepatotoxicidad por isoniazida, que se incrementa por la concomitancia con MTX.
Concepción y embarazo5. En un varón en tratamiento con MTX se recomienda, como regla general, no engendrar durante el tratamiento, y posponer el deseo de embarazo hasta 3 meses después de la suspensión del mismo (4/D).
Sin embargo, teniendo en cuenta la ausencia de evidencia científica firme en cuanto a la interacción con la espermatogénesis, el tratamiento puede mantenerse cuando MTX está a dosis bajas si el paciente manifiesta deseo de embarazo, tras informar al paciente y registrar su decisión en la historia clínica (2+/D).
Existen recomendaciones heterogéneas sobre la actitud recomendada en el uso de MTX en varones con perspectivas de engendrar un hijo. De este modo, mientras que algunos autores defienden la necesidad de un periodo de lavado de 3meses tras el MTX —a pesar de una escasa evidencia—, otros sugieren mantener la pauta terapéutica sin modificar. Tanto algunas revisiones de la literatura como las recomendaciones de las guías americana y española recomiendan a los varones evitar engendrar durante la terapia de MTX y, al menos, 3 meses después18, teniendo en cuenta que un ciclo de espermatogénesis dura 74días. En sentido contrario, Weber et al.23 subrayan la no evidencia de que exista un mayor riesgo de episodios adversos durante el embarazo después de que el padre haya tomado dosis bajas de MTX (≤30mg/semana), por lo que no sería necesario someter al padre a un periodo de 3meses libre de MTX previo al intento de embarazo, opinión también defendida en otros trabajos18,24.
6. Con respecto a la concepción en mujeres, se recomienda esperar de 3 a 6 meses tras la suspensión de MTX (4/D).
Se ha sugerido que el tiempo que debe esperarse para la concepción tras la retirada del MTX debe ser entre un ciclo ovulatorio y 3meses19,25, aunque la ficha técnica de MTX indica un periodo de 6meses9. Carretero et al.19 proponen que, aunque no se ha establecido cuál es el intervalo libre de riesgo entre la finalización del tratamiento y la gestación, según las características del MTX la mujer debería evitar el embarazo al menos pasado un ciclo ovulatorio después del tratamiento. En las guías europeas25 se indica que el MTX está absolutamente contraindicado en el embarazo y en la lactancia materna, con un periodo de lavado de 3meses para ambos sexos.
Perfil de seguridad7. MTX puede administrarse en la mayor parte de las situaciones conocidas como «contraindicaciones relativas»19,25, aunque requiere una monitorización personalizada y debe asumirse un posible mayor riesgo (✓).
Existen varias contraindicaciones relativas al tratamiento con MTX19,25 (tabla 3). Sin embargo, teniendo en cuenta la baja evidencia científica al respecto, en la mayoría de los casos se podrá administrar el MTX, conociendo la existencia de un posible aumento en el riesgo de efectos adversos y realizando un seguimiento y una monitorización de estos pacientes de forma personalizada.
Contraindicaciones relativas al tratamiento con metotrexato
| Vacunación reciente con virus vivos |
| Trastornos renales o hepáticos |
| Historia de hepatitis |
| Colitis ulcerosa |
| Gastritis |
| Insuficiencia cardíaca congestiva |
| Paciente anciano |
| Falta de cumplimiento |
| Interacciones medicamentosas |
| Deseo activo de tener un hijo en hombres y mujeres en edad de procrear |
| Diabetes mellitus |
| Obesidad |
| Hiperlipidemia |
| Hipoalbuminemia |
| Déficit de folatos |
| Antecedentes de neoplasia |
8. La existencia de factores de riesgo cardiovascular no contraindica el uso de MTX (✓).
En los últimos años se ha evidenciado una relación entre la psoriasis y diferentes factores de riesgo cardiovascular (síndrome metabólico, obesidad, hipertensión arterial, dislipidemia, diabetes mellitus tipo2) y, en consecuencia, su asociación con enfermedad cardiovascular26. En el trabajo de Prodanovich et al.27 se recoge que el tratamiento con MTX tanto en pacientes con psoriasis como con artritis reumatoide reduce significativamente el riesgo de enfermedad vascular en comparación con los no tratados con MTX. Esta reducción fue más evidente en los pacientes que recibieron una dosis acumulativa baja de MTX y se redujo aún más con el uso concomitante de ácido fólico27. También existe alguna evidencia de que MTX puede reducir el riesgo de infarto de miocardio28, y que el uso de inhibidores de TNF-α para la psoriasis en placa grave se acompaña de una mejora de los biomarcadores de riesgo cardiovascular29. Aunque las evidencias no permiten soportar de forma fehaciente el impacto positivo en los factores de riesgo cardiovascular, sí puede concluirse que no está contraindicado en estos pacientes.
Inicio de metotrexatoCribado a realizar previo al tratamiento con metotrexatoLa evaluación previa al tratamiento con MTX se inicia con la historia clínica y la exploración física y unas pruebas de laboratorio. Basándose en Kalb et al.18, el panel acordó que las pruebas de laboratorio se deberían centrar en un hemograma, pruebas de función renal, perfil hepático, serología de la hepatitisB y C, descartar la presencia de TBC latente o activa y, en mujeres en edad fértil, realizar una prueba de embarazo.
Dosis de inicio y ajuste de dosis9. La dosis recomendada de inicio de MTX en psoriasis es 10-20mg/semana si el paciente no presenta factores de riesgo de aparición de efectos adversos (deterioro de la función renal, riesgo de hepatotoxicidad, interacciones farmacológicas). Si el paciente presenta estos factores de riesgo, el tratamiento puede iniciarse a dosis inferiores (5-7,5mg/semana), con reevaluación clínica y analítica al mes. Sin embargo, debe tenerse en cuenta que la dosis mínima eficaz para la mayoría de pacientes es de 7,5mg/semana, salvo cuando existan alteraciones en el aclaramiento renal del fármaco (✓).
En los estudios evaluados se ha observado un rango de dosis de 5-15mg/semana como dosis inicial de MTX, en la mayor parte de ellos iniciado a dosis bajas para minimizar los efectos secundarios. No obstante, el inicio a dosis bajas solo tiene un fundamento histórico30. Así, las guías europeas sugieren una dosis de inicio baja (5-10mg/semana)25; las americanas establecen que no hay dosis máximas o mínimas establecidas, pudiendo estas variar entre 7,5 y 25mg13; la española acepta 7,5mg/semana de inicio, aunque muestra que a dosis superiores se obtienen mejores resultados19, y una revisión sistemática recomienda comenzar con 5-10mg/semana durante la primera semana8. Aun así, el panel de expertos acuerda que si no existen factores de riesgo parece razonable empezar con dosis iguales o superiores a 10mg/semana, ya que se obtienen mejores resultados con dosis más altas sin que se incrementen los efectos adversos.
10. La dosis de 15mg/semana se considera terapéutica para la mayoría de pacientes, con una dosis máxima de 20-25mg/semana. Si la tolerancia clínica y analítica es adecuada a las 3-4 semanas del inicio, la dosis se ajustará a la considerada óptima terapéutica para el paciente (✓).
Según Paul et al.8, la dosis terapéutica se encuentra entre 15 y 25mg/semana, aunque los expertos consideran que con 15mg/semana suele ser suficiente en la mayoría de los pacientes. En los estudios evaluados se ha observado un rango de dosis de 20-25 (o hasta 30)mg/semana como dosis máxima. En una revisión sistemática la dosis máxima recomendada fue de 25mg/semana8, y en las guías europeas se concluye que no deberían superarse los 30mg/semana25, basándose más en la evidencia clínica acumulada que en estudios controlados al respecto. El panel de expertos considera que generalmente se requiere un periodo aproximado de un mes para ajustar la dosis a la óptima para cada paciente.
11. La dosis máxima capaz de proporcionar respuesta se considera de 20mg/semana en la mayoría de los pacientes. Sin embargo, puede valorarse su incremento hasta los 25mg/semana en algunos casos (1++/B).
Según el subanálisis del estudio CHAMPION, si no se ha conseguido una respuesta adecuada a las 12semanas con una dosis de 20mg/semana, las probabilidades de mejorarla incrementando a 25mg/semana serán muy bajas5. Teniendo en cuenta este estudio, no parece lógico incrementar la dosis por encima de 20mg/semana, aunque quizá haya algunos pacientes que puedan beneficiarse de dosis superiores (25mg/semana) (por ejemplo, pacientes con peso elevado).
12. En pacientes con psoriasis y en tratamiento con MTX que hayan alcanzado una respuesta satisfactoria se puede realizar una disminución progresiva de la dosis, reduciéndola de 2,5 a 5mg cada 2-4 meses hasta conseguir la dosis óptima para ese paciente (✓).
Hay escasas referencias en la literatura a la reducción de dosis de MTX. Paul et al.8 concluyen que no hay ninguna evidencia firme para proponer una pauta concreta de escalado o desescalado. Por ello, la propuesta de reducción de dosis se basa en la experiencia del panel de expertos.
Vía de administración13. Es preferible la administración parenteral de MTX en aquellos pacientes en los que haya riesgo de error en la pauta de administración, incumplimiento o exista intolerancia gastrointestinal. Esta sería también una opción adecuada cuando la respuesta clínica sea insuficiente a dosis plenas por vía oral (≥15mg/ semana) (4/D).
No existen estudios comparativos de la vía oral frente a la parenteral en psoriasis7, aunque sí en artritis reumatoide, que demuestren que la administración parenteral mejora la eficacia de fármaco31,32. En una revisión sistemática8 se recomienda la vía oral de inicio, a menos que la respuesta sea inadecuada, exista intolerancia gastrointestinal o riesgo de mal cumplimiento. En estos casos se considerará la administración parenteral a la misma dosis. Por otro lado, la biodisponibilidad a dosis ≥15mg/semana es mejor para la vía subcutánea33, por lo que a partir de esta dosis podría haber un beneficio de esta vía frente a la oral. El panel de expertos consideró que la administración de MTX por vía oral o parenteral podrá escogerse por igual, priorizando una u otra opción según las circunstancias, dosis y preferencias del paciente.
Tiempo de respuesta al tratamiento14. A partir de la evidencia disponible, parece razonable esperar 12-16semanas en pacientes en tratamiento con dosis óptima, antes de considerar fallo terapéutico a MTX. Sin embargo, debe recordarse que la mayor parte de pacientes que responden al tratamiento mostrarán mejoría antes de las 8semanas (✓).
Debido a la gran variabilidad en el uso del fármaco, la mayor parte de recomendaciones se fundamentan en la práctica clínica de los expertos. Esta circunstancia se refleja en los trabajos evaluados, en los que se observa cierta imprecisión e intervalos de tiempo en las afirmaciones. Sin embargo, tras el análisis de las evidencias se puede concluir que la mayor parte de respondedores mostrarán signos de buena respuesta a las 8semanas y lo habrán hecho a las 12. No es de esperar que se consiga una mayor tasa de respuesta a partir de 12semanas, pues según datos del estudio CHAMPION, incluso con una pauta conservadora solo el 5% de los pacientes que no habían respondido en las primeras semanas lo hicieron después5. Aun así, según la guía NICE, parece razonable esperar a las 12semanas si las dosis alcanzadas son de, al menos, 15mg/semana, y un máximo de 16-24semanas si las dosis han sido inferiores34. Por ello, el panel de expertos consideró que el margen de 8semanas podría ser insuficiente para algunos pacientes, ampliándolo hasta 12semanas, o incluso 16 en algunos casos.
Uso de metotrexato en niños15. MTX (0,3mg/kg/semana) es una opción terapéutica para la psoriasis en edad pediátrica, aunque la evidencia es escasa (✓).
En su conjunto, la experiencia en psoriasis infantil es discreta y se basa en series de casos y opiniones de expertos. En una revisión sistemática se concluye que MTX es una alternativa efectiva en el tratamiento de la psoriasis infantil moderada y grave, con buena tolerancia a corto plazo35. De igual forma, en un consenso europeo basado en un cuestionario Delphi36 se concluye que MTX es una terapia apropiada en casos graves de psoriasis guttata infantil, con preferencia de dosis de 0,3mg/kg/semana, independientemente de la edad, pero sin superar la dosis máxima estándar de 22,5mg/semana.
Uso de metotrexato en artropatía psoriásicaEn el momento actual, los FAME son considerados como el tratamiento de segunda línea después de los antiinflamatorios no esteroideos para la mayor parte de pacientes con artropatía psoriásica periférica de grado moderado, siendo MTX el FAME de elección37.
Metotrexato en otras indicacionesEn otras indicaciones dentro del ámbito de la psoriasis la evidencia sobre el uso de MTX es escasa, como en la onicopatía38,39, las formas pustulosas y eritrodérmicas o la pustulosis palmoplantar.
Suplementación con folatos16. Se recomienda efectuar suplementación con folatos en los pacientes en tratamiento con MTX, justificada por una potencial disminución de efectos adversos y un escaso impacto en la respuesta terapéutica (4/D).
El uso de ácido folínico a altas dosis para revertir los episodios graves de toxicidad aguda de MTX llevó a evaluar la suplementación de folatos concomitante a la administración de dosis bajas de MTX40. El ácido fólico disminuye la hepatotoxicidad y puede normalizar la elevación de transaminasas hepáticas40-46, por lo que su uso concomitante con MTX permite una mayor tolerabilidad de MTX a dosis >15mg/semana42,43. Además, la suplementación con ácido fólico es barata, casi no tiene efectos adversos y, acorde a la mayoría de los estudios, no disminuye la eficacia del MTX47. Por ello, parece una terapia adyuvante razonable para los pacientes con psoriasis moderada-grave.
17. No existen evidencias de que deba priorizarse el ácido fólico o el ácido folínico, y la elección dependerá de las preferencias del especialista. El ácido fólico puede tener una ventaja adicional desde el punto de vista de la eficiencia al tener un menor coste y ventajas farmacocinéticas en determinadas subpoblaciones de pacientes (1++/A).
No existe evidencia clara de si es preferible emplear ácido fólico o folínico como coadyuvante del tratamiento con MTX, si bien algunos dermatólogos prefieren el ácido fólico8. En una revisión sistemática, tras evaluar de forma conjunta los resultados de la adición de ácido fólico y folínico se obtuvieron resultados similares para ambos fármacos. Sin embargo, el bajo coste favorece la eficiencia del ácido fólico frente al folínico48. Además, únicamente el ácido fólico (no el folínico) inhibe la aldehído oxidasa y podría contribuir a incrementar los niveles de MTX en los pacientes metabolizadores rápidos, mejorando su eficacia49.
18. Se recomienda efectuar una suplementación de 5-15mg/semana de ácido fólico o de 15mg/semana de ácido folínico, 24-48h tras la administración de MTX (4/D).
La Guía Española19 establece como posibilidades una toma diaria de 5mg de ácido fólico (exceptuando el día de administración de MTX), o una pauta de 15mg/semana de ácido folínico, 24-48h tras la toma de MTX, o incluso, una toma de 5mg 1-2días, separada 24-48h de la administración de MTX, si el paciente no tiene mayores requerimientos de ácido fólico. En una revisión sistemática se recomienda un suplemento de 5mg/día de ácido fólico durante 1-3días 48h después de MTX, por vía oral preferentemente7. Otro trabajo recomienda la misma pauta, especificando los días en los que se administran MTX y ácido fólico para evitar confusiones8.
Seguimiento del tratamiento con metotrexatoPacientes sin factores de riesgo19. En pacientes sin factores de riesgo debería llevarse a cabo una analítica en las primeras semanas de tratamiento. Si se produce una elevación de las enzimas hepáticas <3 veces del límite normal, se recomienda monitorizar cuidadosamente, repetir el análisis en 2-4semanas y disminuir la dosis si fuera necesario. Para elevaciones persistentes por encima de estas cifras debería reconsiderarse la conveniencia de MTX para estos pacientes (IV/D).
Siguiendo las recomendaciones de la guía de la AAD13 y el consenso de MTX y psoriasis de Kalb et al.18, se deberá monitorizar la hepatotoxicidad según la elevación de las enzimas hepáticas en pacientes sin factores de riesgo. Estos trabajos recomiendan la realización de una biopsia hepática si se producen elevaciones persistentes de niveles de AST durante un periodo de 12meses o ante un descenso de albúmina sérica por debajo del rango normal (con estado nutricional normal), y con enfermedad bien controlada. No obstante, el panel de expertos considera que en el momento actual sería prioritario, en el caso de alteraciones analíticas persistentes, valorar la sustitución de MTX por otra alternativa antes de indicar una biopsia.
20. A pesar de sus limitaciones, los métodos no invasivos (determinación de PIIINP y elastografía de transición) son útiles para la monitorización de la hepatotoxicidad de MTX en los pacientes (IV/D).
Aunque en algunas guías se ha propuesto realizar una biopsia dentro de los 2-6 primeros meses tras iniciar el MTX y repetir después cada 1-1,5g de dosis acumulada si existe uno o más factores de riesgo de hepatotoxicidad13,18, otros trabajos abogan por el uso de técnicas menos invasivas, como la medición de los niveles de PIIINP o la elastografía de transición con vibración controlada18,25,50. La realidad de la consulta médica impone una agenda realista y accesible, siendo poco razonable realizar estudios analíticos frecuentes o llevar a cabo biopsias hepáticas, un procedimiento no exento de riesgo y de coste considerable, en la monitorización rutinaria de los pacientes. De hecho, las biopsias no forman parte de la rutina en el seguimiento dermatológico y solo deberían considerarse excepcionalmente, pues mayoritariamente condicionarán un cambio de estrategia terapéutica. Por ello, es fundamental la elección del paciente tributario de MTX. Si el paciente tiene factores de riesgo relativos para MTX —obesidad, diabetes mellitus, elevación de transaminasas—, las recomendaciones serán similares a las de uno sin factores de riesgo, con precaución en la dosificación y la monitorización, considerando MTX como una opción transitoria de tratamiento.
Combinaciones terapéuticas con metotrexatoCombinación de metotrexato con ultravioleta B de banda estrechaLa combinación de MTX con ultravioletaB de banda estrecha (UVBBE) es más efectiva que la monoterapia con UVBBE, ya que permite reducir la dosis y la exposición a la fototerapia25,50-52. Aun existiendo un mayor riesgo teórico de cáncer cutáneo no melanoma, este es menor que en MTX con PUVA52. Sin embargo, son necesarios estudios a largo plazo.
Combinación de metotrexato con biológicos21. Cuando el perfil del paciente lo aconseje, puede administrarse MTX en asociación con infliximab o adalimumab para evitar el desarrollo de anticuerpos antifármaco y/o para mejorar su farmacocinética (2++/B).
La inmunogenicidad reduce la respuesta terapéutica a los anti-TNF, fundamentalmente a infliximab y adalimumab. Una revisión sistemática reciente concluye que el uso de tratamiento inmunosupresor concomitante atenúa el impacto de los anticuerpos antifármaco sobre el efecto de los anti-TNF, particularmente con MTX53. La utilización de dosis bajas de MTX es especialmente útil asociado a infliximab, mejorando su eficacia19,54. De igual forma, la combinación de adalimumab con MTX podría mejorar los resultados clínicos tanto en la psoriasis cutánea como en la articular19,55. La combinación de etanercept con MTX ha demostrado una eficacia superior y una seguridad aceptable comparada con etanercept en monoterapia en pacientes con psoriasis moderada-grave56.
Uso de metotrexato en escenarios clínicos complejosPacientes con hepatopatía22. En los pacientes con factores de riesgo hepático o enfermedades hepáticas en los que se decida administrar MTX, deberán tomarse precauciones que incluirán el inicio con dosis inferiores a las propuestas como estándar para la mayoría de pacientes y con incremento gradual, la búsqueda de la dosis mínima eficaz, el control de los factores que pudiesen condicionar la toxicidad del fármaco —terapia concomitante, ingesta enólica—, la rigurosidad en la monitorización analítica y la realización de pruebas complementarias (✓).
Se recomienda evitar el uso de MTX si hay factores de riesgo de hepatotoxicidad. El uso prolongado de MTX puede inducir fibrosis y cirrosis, y en la población con psoriasis esta circunstancia puede no estar precedida por síntomas o cifras anormales de laboratorio. Los pacientes con esteatohepatitis no alcohólica también tienen mayor riesgo de hepatotoxicidad por MTX57.
Pacientes ancianos23. Los pacientes ancianos presentan un menor aclaramiento de MTX y presentan una mayor tendencia a los efectos secundarios graves asociados con MTX, por lo que tanto las dosis de inicio como las de mantenimiento deben ser menores. Las dosis iniciales propuestas serían de 5 a 7,5mg/semana, ajustándose en función de la evolución y respuesta en cada caso (✓).
La dosis de MTX necesaria para controlar la psoriasis grave en pacientes mayores de 50años es menor debido a un cambio en el metabolismo y el menor aclaramiento renal en esta población58. El uso de dosis reducidas de MTX es efectivo en el control de la psoriasis en ancianos59; incluso se ha observado un control adecuado de la enfermedad en pacientes de 80 o más años con solo 2,5mg de MTX semanal60.
24. Aunque en pacientes ancianos el objetivo terapéutico será idéntico al planteado en otros grupos de edad, deberá priorizarse la seguridad, ya que son más frecuentes algunos factores (insuficiencia renal, interacciones farmacológicas) que condicionan efectos secundarios graves (✓).
Aunque su toxicidad general no es mayor que en población joven, los efectos adversos gastrointestinales, hepáticos y hematológicos son más frecuentes en mayores de 65años50, por lo que se deberá prestar especial atención a esta población.
Pacientes oncológicos25. El tratamiento con MTX representa una buena opción en pacientes con antecedentes oncológicos, al igual que el tratamiento tópico, la fototerapia o acitretina. El dermatólogo deberá valorar de forma individualizada los riesgos y beneficios y contar con el consentimiento informado del paciente (4/D).
El uso de MTX en pacientes con neoplasias linforreticulares y con tumores sólidos, incluido el melanoma maligno, se establece según el tiempo desde el diagnóstico del tumor, priorizándose antes o después de acitretina, fototerapia o corticoides tópicos según cada caso concreto57. Por ello, el tratamiento de la psoriasis en pacientes oncológicos debe ser individualizado, y se debe informar a los pacientes de la falta de certeza completa con respecto al de recurrencia al utilizar las terapias disponibles.
Pacientes portadores de hepatitis B26. No se recomienda el uso de MTX en pacientes portadores crónicos de VHB por el riesgo de reactivación de la infección y por su efecto hepatotóxico (4/D).
Existen otras alternativas mejores para los pacientes portadores crónicos del VHB57, pues el riesgo de hepatotoxicidad es especialmente elevado en los pacientes con formas crónicas e incluso latentes de hepatitis víricas, portadores de virus de la hepatitisB61,62. Además, se han descrito múltiples casos de reactivación de hepatitisB causados por MTX en pacientes con antígeno de superficie positivo y en algunos con antígeno de superficie negativo pero antiHBc positivo63-68.
Pacientes con virus de la inmunodeficiencia humana27. No existen suficientes evidencias para el empleo seguro de MTX en pacientes VIH+, por lo que la decisión de utilizar MTX en el tratamiento de psoriasis en estos pacientes debe ser individualizada, valorando la relación riesgo-beneficio (3/D).
Aunque la recomendación de no usar MTX en pacientes VIH+ se remonta a los primeros casos en los que se administró en individuos con esta infección, otros estudios posteriores no confirmaron un riesgo incrementado69,70. Sin embargo, no existen ensayos clínicos que evalúen la eficacia y la seguridad de MTX en esta población, por lo que el uso a dosis bajas de MTX debería llevarse a cabo de forma individualizada y realizando un control estricto de la enfermedad71.
DiscusiónMTX es un fármaco que acumula una amplia experiencia de uso y está plenamente integrado en el armamentario terapéutico de la psoriasis moderada y grave. Aun así, destaca la limitada evidencia científica en buena parte de los aspectos relacionados con su empleo. El presente trabajo ofrece una visión conjunta de la evidencia disponible complementada por la opinión de dermatólogos con experiencia en el uso de MTX con el objetivo de ofrecer una respuesta a la mayor parte de retos que encontrará en el manejo de este fármaco en pacientes con psoriasis. El elevado nivel de acuerdo alcanzado para todas las recomendaciones, superior al 85%, de las cuales más de la mitad obtuvieron unanimidad, permite afirmar que las recomendaciones representan la opinión de los expertos consultados.
Existen algunas revisiones previas referidas al uso de MTX en psoriasis, aunque de forma infrecuente se ha implicado la opinión de expertos a través de procedimientos metodológicos participativos3,4,15. Mountadié et al. llevaron a cabo una revisión sistemática de la literatura referida a las dosis de empleo, la vía de administración y los efectos adversos, en particular el riesgo de fibrosis7. Paul et al., en un trabajo similar al actual, complementaron una revisión de la literatura con la opinión de expertos, a través de un método Delphi en el que participaron 66 dermatólogos, centrados en aspectos similares a los del artículo previo9,10.
En ambos trabajos los autores propusieron conclusiones similares, concretadas en dosis de inicio de entre 5-10mg/semana, con rápido incremento hasta alcanzar las dosis terapéuticas. En el presente trabajo el comité no encontró justificación para mantener una dosis baja de inicio cuando no existiesen factores de riesgo que condicionasen la seguridad, teniendo en cuenta que, como se describe en la literatura, existe una clara relación entre la dosis y la eficacia del fármaco.
Existe coincidencia, en referencia a los 2 trabajos de revisión antes citados, con respecto a la conveniencia de emplear técnicas no invasivas en la monitorización del daño hepático —aun con las limitaciones técnicas que estas aún hoy presentan—, con el objetivo último de abandonar la biopsia hepática, de muy escasa implantación en la clínica diaria, como un requisito en los pacientes tratados de forma prolongada.
El presente trabajo aporta, por otro lado, una perspectiva práctica en aspectos escasamente revisados, tales como las precauciones en vacunación y profilaxis antituberculosa, similares a las observadas en otros tratamientos sistémicos y las consideraciones en diversos grupos de edad, que representan un reto en el manejo de las formas graves de psoriasis58. También plantea una reflexión con respecto a la vía de administración. Si bien en general en la literatura tiende a considerarse el tratamiento oral como la forma estándar de prescripción, la vía subcutánea podría aportar ventajas en la tolerancia y en la eficacia —por el momento solo demostradas en otras enfermedades inflamatorias—, además de una mayor seguridad cuando existe riesgo de errores de posología, ventajas que, sin embargo, deberán contrastarse con un coste mayor.
El presente trabajo adolece de algunas limitaciones. Entre ellas puede señalarse, en primer lugar, que la metodología aplicada para realizar la revisión no es exhaustiva, reduciendo el volumen de trabajos obtenidos en la búsqueda bibliográfica. Esto genera potenciales sesgos en el análisis de los resultados. Sin embargo, los métodos de búsqueda realizados permitieron contar con los trabajos de mayor calidad. Otra limitación inherente a todos los consensos sobre el empleo de MTX en psoriasis es la existencia de pocos estudios de calidad que permitan realizar recomendaciones de uso basadas exclusivamente en sus resultados. Por ese motivo, gran parte de las propuestas tienen grados de evidencia bajos o de experto. Sin embargo, en este contexto, con el que también tuvieron que enfrentarse otros trabajos similares, precisamente la recomendación consensuada de los expertos adquiere especial relevancia para el clínico interesado en el manejo del fármaco.
Finalmente, ante cada una de las recomendaciones, los dermatólogos consultores solo tuvieron la opción de votar afirmativa o negativamente, a diferencia de lo que ocurre en un método Delphi. Sin embargo, el alto grado de acuerdo permite afirmar que el texto refleja de forma adecuada la opinión del comité.
En conclusión, el presente consenso propone diversas recomendaciones referidas al uso de MTX fundamentadas tanto en la evidencia como en la experiencia clínica con el objetivo de aportar un instrumento útil al clínico implicado en el manejo de los pacientes con psoriasis moderada y grave.
FinanciaciónEste trabajo se ha podido realizar gracias al apoyo económico ofrecido por Gebro Pharma, S.A. Sin embargo, ningún empleado de Gebro Pharma ha participado en la discusión científica ni ha desarrollado ninguna función en la elaboración ni revisión del manuscrito, funciones desarrolladas de forma independiente por el comité científico.
Conflicto de interesesGebro Pharma ha facilitado la reunión y el soporte técnico y metodologico pero ninguno de sus miembros ha participado en el desarrollo y elaboración del material científico, las discusiones o el texto escrito. José Manuel Carrascosa ha participado como ponente para Gebro Pharma.
Los autores agradecen el soporte técnico y metodológico de Verónica Albert, de GOC Networking, por su apoyo en la conducción de la metodología utilizada para la elaboración del estudio.