La enfermedad injerto contra huésped (EICH) es una enfermedad multisistémica que aparece como complicación de un trasplante de progenitores hematopoyéticos alogénico. Se basa en el reconocimiento de tejidos del receptor por parte de la inmunidad heredada del donante. La piel y las mucosas son los órganos más frecuentemente afectados. Se clasifica en aguda y crónica, en función de su fisiopatología y presentación clínica. La forma aguda se manifiesta típicamente con la tríada de exantema, diarrea e hiperbilirrubinemia, y el tratamiento se basa en el uso de corticoides e inmunosupresores sistémicos. Las manifestaciones cutáneas de la forma crónica se dividen en esclerodermiformes y no esclerodermiformes. Puede afectar también a mucosas y faneras. El diagnóstico es fundamentalmente clínico, aunque en casos dudosos la biopsia cutánea puede ayudar a confirmarlo. El tratamiento puede ser tópico, sistémico o físico, en función de la extensión, localización, profundidad de las lesiones y afectación de otros órganos.
Graft-vs-host disease (GVHD) is a multisystem disease that arises as a complication of allogeneic hematopoietic stem cell transplant. It is due to recognition of the recipient's tissues by immune cells from the donor. The skin and mucous membranes are the organs most commonly affected. GVHD is classified as acute or chronic depending on the pathophysiology and clinical presentation. Acute GVHD typically presents with the triad of rash, diarrhea, and hyperbilirubinemia, and treatment is based on systemic corticosteroid and immunosuppressant therapy. The cutaneous manifestations of chronic GVHD are divided into sclerodermiform and nonsclerodermiform, and the mucous membranes and skin appendages may also be affected. The diagnosis is mainly clinical, but skin biopsy can help in doubtful cases. Treatment can be topical, systemic, or physical, depending on the size, site, and depth of the lesions and the involvement of other organs.
La enfermedad injerto contra huésped (EICH) es una enfermedad multisistémica que aparece como complicación de un trasplante de progenitores hematopoyéticos (TPH) alogénico. Este procedimiento es el único tratamiento curativo para ciertas enfermedades hematológicas, y se basa en una sustitución de una hematopoyesis ineficaz del paciente por otra procedente de un donante sano, que puede proceder de médula ósea (MO), sangre periférica (SP) o sangre de cordón umbilical (SCU)1. A pesar de las medidas profilácticas que se toman su incidencia sigue siendo elevada1. Puede afectar a cualquier órgano, aunque la piel y las mucosas son los órganos más frecuentemente afectados (20-70%), los más rápidamente visibles y los más accesibles para la realización de una biopsia.
La EICH es una complicación que contribuye en gran manera a la morbimortalidad asociada al TPH alogénico, siendo la causa de muerte más frecuente tras la recidiva de la neoplasia hematológica que motivó el TPH1. Por ello hoy en día sigue siendo la principal barrera para un uso más amplio, a pesar de ser el único tratamiento curativo para una gran variedad de enfermedades hematológicas y no hematológicas1.
Fisiopatología y clasificaciónLa EICH se basa en el reconocimiento de tejidos del receptor por parte de la inmunidad heredada del donante. Es el resultado de la interacción entre las células presentadoras de antígenos (CPA) del receptor y las células T maduras del donante1, con la consiguiente desregulación inmune, que da lugar a un proceso de inflamación y destrucción de las células del receptor. Se trata de un trastorno aloinmune y autoinmune que conlleva inmunodeficiencia, afectación de la calidad de vida y disminución de la supervivencia2,3. Este fenómeno tiene consecuencias negativas para el paciente, pero a su vez tiene un efecto beneficioso en aquellos pacientes con neoplasias hematológicas, ya que actúa también contra el tumor primario impidiendo su recidiva (concepto de vigilancia tumoral)4. Es por ello que en el tratamiento de la EICH se intenta llegar a un equilibrio entre una mínima EICH, controlada pero no abolida completamente para poder tener ese efecto de vigilancia tumoral.
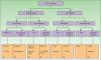
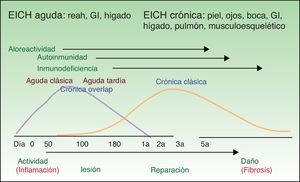
La EICH se clasifica en 2 tipos, aguda (EICHa) y crónica (EICHc). Clásicamente se distinguían por presentarse antes o después de los 100 días post-TPH, pero actualmente se distinguen en función de sus distintos mecanismos fisiopatológicos y de su presentación clínica5 (tabla 1). En fases iniciales predominan cambios inflamatorios debido fundamentalmente a fenómenos de alorreactividad. En etapas más avanzadas se desarrollan fenómenos de autoinmunidad e inmunodeficiencia que, con el paso del tiempo, van produciendo lesión tisular por reparación y fibrosis (fig. 1). A pesar de que se trata de un proceso dinámico y superponible, no necesariamente los pacientes presentan ambas formas ni se explican por mecanismos fisiopatológicos comunes, por lo que se estudian por separado.
Clasificación de la EICH
| Tipo | Tiempo desde TPH | Signos o síntomas EICH agudaa | Signos o síntomas EICH crónicab |
|---|---|---|---|
| EICH aguda | |||
| Clásica | ≤100 días | Sí | No |
| Persistente, recurrente o de inicio tardío | >100 días | Sí | No |
| EICH crónica | |||
| Clásica | Sin límite de tiempo | No | Sí |
| Liquenoide | Más inicial | ||
| Esclerodermiforme | Más tardía | ||
| Síndrome de solapamiento | Sí | Sí | |
Adaptada de Filopovich et al.5
EICH: enfermedad injerto contra huésped; TPH: trasplante de progenitores hematopoyéticos.
Esquema evolutivo de la EICH aguda y crónica.
GI: gastrointestinal.
Adaptada de: http://ccr.cancer.gov/resources/gvhd/about.asp
La forma aguda se explica mediante un modelo de 3 fases: 1) en una primera fase el régimen de acondicionamiento produce daño del queratinocito en un ambiente proinflamatorio; 2) este ambiente induce a la presentación de antígenos (Ag) por las células dendríticas (CD) del huésped a los linfocitos T del donante con su posterior activación; y 3) lo anterior promueve una respuesta Th1 que da lugar a la necrosis de queratinocitos6.
La fisiopatogenia de la EICHc se basa tanto en fenómenos de alorreactividad como de autoinmunidad. Tras un daño en el timo debido al régimen de acondicionamiento y/o a la EICHa se produce una pérdida de tolerancia a los propios tejidos. Se desencadena una respuesta compleja donde participan linfocitos T CD4+, CD8+, LT reguladores y linfocitos B (LB) con la producción de autoanticuerpos. Mediante respuestas Th1, Th2 y Th17 se producen citocinas inflamatorias que dan lugar a fibrosis y disfunción de órganos7–9. Se ha observado que los pacientes con EICHc presentan una alta incidencia de autoanticuerpos (ANA, DNAds, anti-músculo liso) y, aunque estos no se relacionan con manifestaciones órgano-específicas, su presencia se ha asociado, en algunos estudios, con mayor riesgo de desarrollar una EICHc extensa y esclerótica10–12.
Enfermedad injerto contra huésped agudaEs necesario conocer la situación y el entorno del paciente durante esta primera etapa tras el TPH para orientar el diagnóstico y tratamiento de la enfermedad. Durante los primeros 100 días tras el TPH el paciente sufre una intensa inmunosupresión inducida, que se va recuperando de manera paulatina y ordenada por las distintas series hematopoyéticas tras el prendimiento del injerto. Además, el paciente se encuentra expuesto a múltiples fármacos mieloablativos, inmunosupresores y antiinfecciosos profilácticos. Son por tanto frecuentes las complicaciones infecciosas y los efectos secundarios a fármacos.
Los factores de riesgo más importantes para el desarrollo de EICH aguda son: una mayor disparidad del HLA, mayor edad del donante y receptor, aloinmunización del donante (transfusiones previas, mujeres con embarazos), uso de SP como fuente de progenitores hematopoyéticos y cantidad de linfocitos T del inóculo6.
Clínica, estadificación clínica y clasificaciónA pesar de ser una enfermedad multisistémica la piel y las mucosas son los órganos más frecuentemente afectados, y habitualmente los primeros en presentarse, por lo que en muchos casos serán clave para el diagnóstico. El hígado y el intestino son los siguientes en frecuencia, por lo que la tríada característica es el exantema, la hiperbilirrubinemia y la diarrea13.
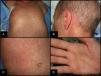
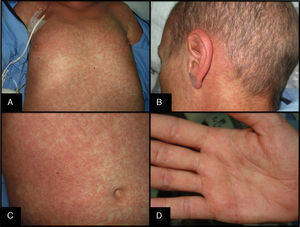
La clínica cutánea puede iniciarse en forma de disestesias, prurito, eritema o edema que progresivamente da lugar a un exantema morbiliforme o foliculotropo generalizado de predominio troncular, progresivo y confluente, que evoluciona de manera centrífuga. Es típica la afectación palmo-plantar y retroauricular (fig. 2). Si es muy intenso puede dar lugar a la formación de ampollas por despegamiento dermo-epidérmico. Es frecuente la afectación de mucosas (oral, genital, nasal y ocular), que se manifiesta como una mucositis.
La estadificación clínica de la EICH aguda varía de 0 a 4 en función de la clínica y del porcentaje de superficie corporal afecta13. De la misma manera existe una clasificación de 0-4 para la afectación hepática en función del nivel de bilirrubina en sangre e intestinal, según la cuantificación de la diarrea.
La EICH aguda se clasifica en: clásica si aparece en los primeros 100 días post-TPH, persistente si dura más allá de los 100 días, recurrente si desaparece pero vuelve a aparecer más allá del día 100 y de inicio tardío si se manifiesta a partir del día 100 (tabla 1 y fig. 1)5.
Diagnóstico y diagnóstico diferencialEl diagnóstico de la EICH aguda es clínico por la presencia de la tríada característica de exantema, diarrea e hiperbilirrubinemia, aunque no necesariamente debe afectar a todos los órganos.
En esta fase inicial tras el TPH debemos tener en cuenta otras posibilidades diagnósticas que también son muy frecuentes, y que se pueden manifestar de manera similar, en forma de rash. Las toxicodermias y los exantemas infecciosos (frecuentemente virales) son las entidades con las que deberemos realizar el diagnóstico diferencial14. La eritrodisestesia palmo-plantar, la siringometaplasia y la necrólisis epidérmica tóxica son toxicodermias relativamente frecuentes en estos pacientes que se deben distinguir de la EICH. Los virus que más frecuentemente muestran manifestaciones debido a su reactivación tras un TPH son el CMV, el VEB, el VHS tipo 1 y 2, el VVZ y el HHV tipo 6, 7 y 8.
Se debe tener en cuenta el contexto clínico del paciente, la cronología de las lesiones y de los fármacos administrados y el resto de manifestaciones sistémicas para llegar al diagnóstico, aunque en muchos casos resulta tremendamente difícil diferenciar estos procesos.
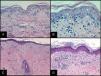
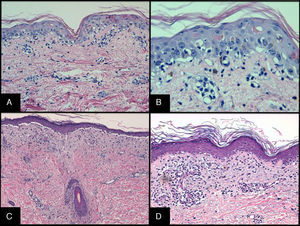
Histopatología y estadificación patológicaEl estudio histopatológico de una biopsia cutánea puede apoyar el diagnóstico de EICH aguda, pero esta no es específica15. La toma de una biopsia cutánea que incluya folículos pilosos puede ser de ayuda para el diagnóstico histopatológico. Característicamente se observa una dermatitis de interfase vacuolar con apoptosis de queratinocitos y presencia de linfocitos satélite alrededor de estos (fig. 3). En estadios avanzados puede observarse una separación dermo-epidérmica con formación de ampollas subepidérmicas.
De la misma manera que ocurre con la clínica, con la histología también existe una gradación de 0 a 4 en función del grado de afectación dermo-epidérmica16.
El diagnóstico diferencial histológico sigue planteando los mismos problemas que la clínica; básicamente debe realizarse con toxicodermias y exantemas infecciosos. Algunas características histopatológicas pueden ayudarnos a diferenciar la EICHa de las toxicodermias. Existen controversias sobre la utilidad en el recuento de eosinófilos para el diagnóstico diferencial15,17. La afectación anexial iría a favor de que se tratara de EICH mientras que la presencia de espongiosis, infiltrado inflamatorio denso y extravasación hemática hablaría a favor de toxicidad medicamentosa. En estudios investigacionales se ha observado que la expresión inmunohistoquímica de la elafina ocupando todo el espesor de la epidermis sería de utilidad para el diagnóstico diferencial con reacciones a fármacos, donde solo se teñiría la capa granulosa18.
Enfermedad injerto contra huésped crónicaGeneralmente se presenta tras los primeros 100 días post-TPH, con una media entre los 4 y 6 meses19. Durante este periodo el grado de inmunosupresión es menor, pero sigue existiendo, debido tanto a la toma de inmunosupresores (IS) como al propio TPH. Los pacientes están asimismo expuestos a múltiples fármacos, cuyos efectos secundarios pueden aparecer de manera inmediata o a largo plazo.
Son factores de riesgo para el desarrollo de EICHc los siguientes: presencia de EICHa previa, pacientes o donantes de edad avanzada, mujer donante en receptor masculino, donante no emparentado o con incompatibilidad HLA, SP como fuente de progenitores hematopoyéticos (mayor que MO y esta a su vez mayor que SCU), diagnóstico de leucemia mieloide crónica (LMC) e infusión de linfocitos del donante6.
Son factores de mal pronóstico: el inicio progresivo, la afectación cutánea mayor del 50% al diagnóstico, trombocitopenia menor de 100.000 y la presencia de afectación pulmonar (bronquiolitis) o de múltiples órganos20.
Hay que recalcar que las estrategias que han mejorado las tasas de EICH aguda no han disminuido la incidencia de EICHc21.
Clínica, estadificación clínica y clasificaciónLa EICHc puede aparecer como extensión de la EICH aguda (progresiva), tras un intervalo libre de enfermedad (quiescente) o sin precedente agudo (de novo)2,3.
Se distingue la forma clásica (sin límite de tiempo pero con signos o síntomas característicos) del síndrome de solapamiento, donde coexisten síntomas o signos característicos de la forma aguda y crónica5.
Es una enfermedad multisistémica que puede repercutir en cualquier órgano, ya sea uno o varios. Los órganos más frecuentemente afectados son la piel y la mucosa oral22. Los siguientes órganos afectos en orden decreciente son: el hígado, los ojos (síndrome seco), el intestino y el pulmón.
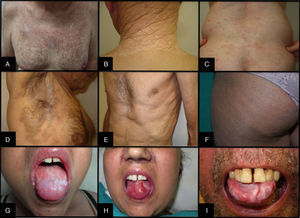
La clínica cutánea es muy variada y puede afectar tanto a la piel y las mucosas como a las faneras. Las manifestaciones cutáneas se distinguen en 2 grupos, escleróticas y no escleróticas23,24. Dentro del primer grupo, y de superficial a profundo, se encuentran el liquen escleroso y atrófico (LEA), la morfea y la fascitis. Formando parte del segundo grupo se encuentran el liquen plano, la poiquilodermia y la queratosis pilar. Otras formas de presentación menos frecuentes son la paniculitis, las alteraciones en la pigmentación y en la sudoración, el eritema, el rash, el prurito, la ulceración, el vitíligo y la alopecia areata, entre otras25 (fig. 4). Las lesiones liquenoides suelen aparecer de manera más temprana y pueden evolucionar más tardíamente a formas esclerodermiformes, aunque no todas las lesiones esclerodermiformes provienen de lesiones liquenoides ni todas las liquenoides tienen por qué evolucionar a esclerodermiformes14. No es infrecuente la aparición de lesiones en aquellas localizaciones donde existió un daño previo por quemaduras, radioterapia, herpes… (fenómeno isotópico) o en zonas de traumatismo repetido (fenómeno isomórfico)23.
A pesar de tener poca trascendencia, la afectación de las uñas aparece hasta en el 50% de los pacientes, pudiéndose manifestar en forma de distrofia, engrosamiento, adelgazamiento, onicolisis, estrías verticales o pterigium. De la misma manera es frecuente la afectación del cuero cabelludo en forma de alopecia cicatricial o no cicatricial, aunque frecuentemente la causa es multifactorial (quimioterapia, radioterapia, hormonal, carencial, EICH…)23.
La afectación de la mucosa oral puede aparecer en forma de liquen plano oral, hiperqueratosis, esclerosis, xerostomía, mucoceles, atrofia mucosa, pseudomembranas y úlceras, entre otras23 (fig. 4).
La afectación de la mucosa genital es menos frecuente y el paciente no suele preguntar al respecto. Es por ello que debemos interrogar de manera activa y realizar una exploración física completa para poder descartar este proceso, ya que frecuentemente entorpece la vida sexual del paciente. Puede aparecer en forma de liquen plano, estenosis vaginal, erosiones, fisuras y úlceras23.
En la tabla 2 se muestran los signos y síntomas de la EICHc cutánea y mucosa.
Signos o síntomas de la EICH crónica
| Diagnósticos | Característicos | Otros | Comunes a EICH aguda | |
|---|---|---|---|---|
| Cutánea | Poiquilodermia | Despigmentación | Alteraciones de sudoración | Eritema |
| Liquen plano | Rash maculopapular | |||
| Cambios escleróticos | Prurito | |||
| Morfea | ||||
| Liquen escleroso | ||||
| Oral | Liquen plano | Xerostomía | Gingivitis | |
| Hiperqueratosis | Mucocele | Mucositis | ||
| Esclerosis | Atrofia mucosa | Eritema | ||
| Pseudomembranas | Dolor | |||
| Úlceras | ||||
| Genital | Liquen plano | Erosiones | ||
| Estenosis vaginal | Fisuras | |||
| Úlceras | ||||
| Ungueal | Distrofia | |||
| Uñas quebradizas, estrías | ||||
| Onicolisis | ||||
| Pterigium | ||||
| Pérdida ungueal | ||||
| Cuero cabelludo | Alopecia | Pelo fino, desigual, opaco | ||
| Lesiones papuloescamosas | Canas precoces | |||
La gradación de la EICHc tiene por objetivo determinar la gravedad del cuadro y poder valorar la respuesta al tratamiento. Existen sistemas de gradación por órganos y otros para valoración de EICH global, según el tipo de órgano afecto, el número de órganos y su gravedad. El sistema de gradación más utilizado en la práctica clínica por su sencillez y rapidez es el de National Institutes of Health (NIH)26–28. Este describe la gravedad de 0 a 3 para cada órgano, teniendo en cuenta su repercusión funcional. En la tabla 3 se muestra la gradación NIH para la piel, la mucosa oral y la mucosa genital. Existen también otras escalas más complejas usadas en ensayos clínicos, aunque en estudios comparativos no han demostrado superioridad a la de la NIH en cuanto a determinación de la actividad, percepción del médico y paciente ni relación con la supervivencia29,30.
Gradación de la EICH crónica de la NIH
| Score | Piel | Oral | Genital |
|---|---|---|---|
| 0 | No manifestaciones/síntomas | ||
| 1 | Signos cutáneos en ≤18%sc sin esclerosis | Síntomas leves sin limitación de la ingesta | Síntomas leves sin repercusión en la función sexual |
| 2 | Signos cutáneos entre 19-50% de sc con esclerosis superficial | Síntomas moderados con limitación parcial de la ingesta | Síntomas moderados con dispareunia o molestia al examen |
| 3 | Signos cutáneos en ≥50% de sc Esclerosis profunda Movilidad afectada, ulceración o prurito grave | Síntomas graves con limitación mayor de la ingesta | Síntomas avanzados (estenosis, aglutinación labial, úlceras graves) y dolor grave durante el coito |
Sc: superficie corporal.
Los signos y síntomas de la EICHc se clasifican en31:
- -
Diagnósticos: establecen el diagnóstico de EICHc sin necesidad de otras pruebas.
- -
Característicos: no son suficientes para establecer el diagnóstico de EICHc sin la ayuda de otras pruebas o demostración de lesión en otros órganos.
- -
Otros: infrecuentes o controvertidos, que no permiten establecer el diagnóstico por sí solos.
- -
Comunes con EICHa.
En la tabla 2 se muestran los signos y síntomas de las manifestaciones cutaneomucosas según esta clasificación.
El diagnóstico de la EICHc requiere31:
- -
La presencia de al menos un signo o síntoma diagnóstico o presencia de al menos un signo o síntoma característico con confirmación histológica.
- -
La exclusión de otros posibles diagnósticos.
- -
El diagnóstico diferencial con la EICHa.
No debemos olvidar que no todas las lesiones cutáneas en pacientes con TPH son EICH. En estos pacientes también pueden aparecer reacciones a fármacos, lesiones inflamatorias, infecciones, tumores benignos o malignos, etc. Por ello, ante toda lesión cutánea es necesaria una buena correlación clínica, cronológica y patológica.
Histopatología y estadificación patológicaLa biopsia cutánea es recomendable para confirmar el diagnóstico, aunque no es obligatoria si el paciente tiene un signo o síntoma definido como diagnóstico. Como ocurre con la variante aguda, las biopsias son sugestivas pero no específicas, aunque una biopsia informada como «compatible con» o «diagnóstica de» se considera suficiente para establecer el diagnóstico en caso de que la manifestación sea característica31. Los criterios histológicos mínimos para su diagnóstico son la presencia de apoptosis de la capa basal de la epidermis o vaina radicular externa del folículo o acrosiringio, que pueden llevar acompañado un infiltrado liquenoide, cambios vacuolares o satelitosis de linfocitos alrededor de queratinocitos necróticos. Existen otros criterios específicos según el tipo de EICHc32 (fig. 3).
TratamientoProfilaxis y tratamiento de soporteTodos los pacientes tras un TPH deben evitar la exposición solar y usar fotoprotectores y gafas de sol, mantener una buena hidratación cutánea y realizar ejercicio físico moderado23.
Es muy frecuente el síndrome seco oral y genital como manifestación de EICH. Existen tratamientos tópicos y orales dirigidos a paliar sus molestias33:
- -
Síndrome seco oral: saliva artificial y pilocarpina oral (5mg cada 6-8h)34.
- -
Síndrome seco genital: humectantes y tratamiento hormonal.
Debemos tener presente que se trata de una enfermedad multisistémica que aparece en pacientes inmunodeprimidos y habitualmente durante el ingreso tras el TPH. Es por ello que el manejo de estos pacientes recaerá fundamentalmente en el hematólogo. El tratamiento de primera línea es la metilprednisolona, y en caso de falta de respuesta se añade un segundo fármaco (globulina antitimocítica, micofenolato de mofetilo, anti-TNF, sirolimus…) de manera individualizada y en función de los protocolos de cada servicio35. A pesar de estos tratamientos, la principal medida preventiva de la EICHa se basa en el uso profiláctico de corticoides, ciclosporina y/o metotrexato tras el TPH36.
Para las manifestaciones cutáneas, de manera específica, los tratamientos tópicos son insuficientes. En casos resistentes al tratamiento habitual podría ser de utilidad la fototerapia37–42.
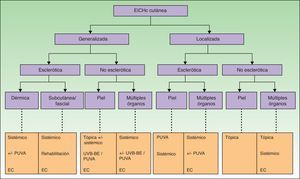
Enfermedad injerto contra huésped cutánea crónicaEn el manejo y tratamiento de la forma crónica es donde los dermatólogos desempeñan un papel más importante. Antes de abordar el tratamiento debemos tener en cuenta una serie de consideraciones. No debemos olvidar que estamos ante una enfermedad multisistémica, por lo que siempre hay que interrogar por la afectación de otros órganos. Es importante diferenciar el tipo (esclerodermiforme o no esclerodermiforme), la profundidad de la afectación cutánea (epidérmica, dérmica o subcutánea), su extensión (localizada vs. generalizada) y la localización de las lesiones. La afectación cutánea de más del 50% de la superficie corporal es un factor predictivo adverso43.
Tratamiento tópicoSe puede utilizar en caso de afectación cutánea localizada, epidérmica o dérmica. Son útiles los corticoides33 y el tacrolimus44,45, este último especialmente para la afectación facial y de pliegues y como ahorrador de corticoides. También se pueden usar en la mucosa oral y genital46,47. El empleo de los distintos tipos de corticoides se realiza en función de su potencia según la localización y profundidad de las lesiones.
En caso de afectación de la mucosa oral son útiles las fórmulas de acetónido de triamcinolona 0,1% en colutorio o en gel adhesivo oral, el clobetasol 0,05% en gel adhesivo oral, el tacrolimus 0,1% en pomada o la ciclosporina en colutorio en caso de uso crónico de corticoides48.
Tratamiento sistémicoEl tratamiento sistémico debería considerarse en caso de fallo de los tratamientos tópicos o dirigidos a la piel (por falta de mejoría, empeoramiento o falta de control de los síntomas), en caso de afectación de múltiples órganos, afectación de un porcentaje considerable de superficie corporal o ante manifestaciones de esclerosis cutánea o fascial23,31. En todos los casos hay que considerar las posibles comorbilidades del paciente, su estado general, el estado de la enfermedad de base y el riesgo infeccioso.
El tratamiento de primera línea es la prednisona oral a dosis de 1mg/kg. En caso de fracaso no existe un tratamiento de rescate estándar. La elección se realiza de forma individualizada, dependiendo de las manifestaciones clínicas de la EICH y de otros factores del paciente. Se puede usar sirolimus, micofenolato mofetilo, rituximab, imatinib, azatioprina, talidomida, metotrexato… De todos ellos el mesilato de imatinib a dosis de 100-200mg/día es más específico para las formas cutáneas esclerodermiformes49–51. De cualquier manera el tratamiento sistémico deberá consensuarse con el hematólogo y el resto de especialistas implicados.
Tratamiento físico- 1.
Fototerapia. Se han empleado PUVA, UVA-1, UVB y UVB-BE52. Puede ser una alternativa para pacientes con lesiones generalizadas, resistentes a otros tratamientos o como medida ahorradora de corticoides53. La elección del tipo de fototerapia se realiza en función de la profundidad de las lesiones y de las comorbilidades del paciente fundamentalmente. Así, las lesiones esclerodermiformes responden mejor a PUVA y las superficiales a UVB-BE. La presencia de EICH ocular sería una contraindicación relativa para utilizar PUVA. Hay que tener en cuenta la toma de posibles fármacos fotosensibilizantes (con especial atención al voriconazol), así como aquellos pacientes con ANA+54.
- 2.
Fotoféresis extracorpórea. Esta técnica está especialmente indicada para las formas cutaneomucosas, pacientes corticodependientes y las formas hepáticas y pulmonares55,56. Se necesita la colocación de una vía central desde la cual se realiza la leucoaféresis. Posteriormente se realiza el tratamiento de la bolsa con psoraleno+UVA, y luego se reinfunde el concentrado al paciente. Este mismo procedimiento se realiza 2 días a la semana durante varios meses. Es una técnica cara que consume mucho tiempo. Aunque los efectos adversos durante el tratamiento generalmente son escasos, existe riesgo de infección y sepsis.
En la figura 5 se muestra un esquema del tratamiento de la EICHc cutánea.
Medida de la respuestaNo existen criterios validados y estandarizados para medir la respuesta cutánea en la EICHc. Esto supone un obstáculo para el manejo de estos pacientes y para el diseño de ensayos clínicos.
Para valorar la respuesta a un tratamiento debe medirse la actividad en 2 puntos del tiempo y compararlos. En el caso de la piel es importante hacer constar la profundidad de las lesiones (epidermis, dermis o tejido subcutáneo) y el porcentaje de superficie corporal que afecta cada nivel anatómico.
Se proponen definiciones de respuesta completa (RC) cuando desaparecen las lesiones completamente, respuesta parcial (RP) cuando existe solo una mejoría y progresión cuando hay empeoramiento31. Estas definiciones son subjetivas y poco reproducibles. Además, la heterogeneidad de las manifestaciones clínicas y el hecho de que algunas de ellas sean irreversibles hacen aún más difícil la estandarización de los criterios de respuesta (sequedad oral, lesiones escleróticas cutáneas…).
Perspectivas futurasEnfermedad injerto contra huésped agudaLa EICHa continúa siendo la principal limitación del TPH alogénico. Necesitamos marcadores que nos ayuden en el diagnóstico y predicción precoz del riesgo de desarrollar EICH57. El tratamiento de la EICHa es subóptimo, por lo que se requieren nuevas estrategias en profilaxis y tratamiento, pero que conserven el efecto injerto contra tumor.
Enfermedad injerto contra huésped crónicaAún no se conoce en profundidad la patogenia de la EICHc. El papel de las citocinas en las manifestaciones y gravedad de la EICH suscita cada vez mayor interés por su posible uso como dianas terapéuticas58.
Uno de los mayores problemas a los que nos enfrentamos en el tratamiento de la EICHc cutánea es la valoración de la respuesta. Los sistemas de gradación existentes no son capaces de evaluar la extensión y gravedad de la enfermedad, ni de medir el efecto del tratamiento. No existen parámetros clínicos o analíticos para diferenciar la EICHc activa de la fibrosis residual.
Tampoco existen a día de hoy test de laboratorio que puedan predecir el riesgo de desarrollar EICHc, respuesta al tratamiento o supervivencia. La importancia de los biomarcadores es crucial por su capacidad de identificar de manera temprana a pacientes de riesgo y poder realizar una vigilancia estrecha y un tratamiento precoz. Los biomarcadores podrían servir de ayuda para medir la actividad de la enfermedad y evaluar el balance entre EICHc y efecto injerto-contra-leucemia. Estos biomarcadores se encuentran en fase de investigación y validación, por lo que no se utilizan en la práctica habitual59,60.
ConclusionesLa EICH es una enfermedad multisistémica que puede afectar a cualquier órgano. Es por ello que su manejo debe de ser multidisciplinar.
Una mejor comprensión de la EICH y la validación de biomarcadores puede ayudar a maximizar el potencial terapéutico del TPH alogénico y minimizar el riesgo de EICH.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Pau Alonso, a Conrad Pujol y a los Servicios de Hematología y de Anatomía Patológica del Hospital La Fe de Valencia.