Los pacientes con psoriasis moderada-grave que van a iniciar tratamiento con agentes biológicos deben ser monitorizados para la detección de infección tuberculosa latente antes, durante y después del tratamiento. En el último informe publicado de BIOBADADERM la prevalencia de infección latente por M.tuberculosis (ILMT) alcanzaba el 20,5% de los pacientes psoriásicos tratados con agentes biológicos en nuestro país. En la actualidad no existe un método diagnóstico gold standard que permita una aplicación sistemática y consensuada, con variaciones en los diferentes países según el grado de endemicidad y vacunación con BCG. La prueba de tuberculina (PT) continúa siendo el método de elección para el diagnóstico de infección, pero presenta importantes limitaciones en su sensibilidad (principalmente en pacientes inmunodeprimidos). Esta situación, junto a su falta de especificidad conocida, errores en su administración, la subjetividad en la interpretación de los resultados, la necesidad de una segunda visita para la lectura y la ausencia de privacidad hacen de ella una prueba limitada, cuyas principales ventajas resultarían su bajo coste y fácil realización. Por eso la mayoría de los estudios de coste beneficio se inclinan por el método IGRA para el diagnóstico de la ILMT, ya que minimiza los falsos positivos (especialmente en población vacunada), eliminando costes extra y efectos secundarios de la quimioprofilaxis antituberculosa. Valoramos la aplicabilidad en pacientes psoriásicos candidatos a terapia biológica y discutimos la necesidad de su realización previamente a terapia sistémica convencional, puesto que la mayoría de las guías actuales no consideran imprescindible su realización.
Screening to detect latent tuberculosis infection (LTBI) is essential before patients with moderate to severe psoriasis start treatment with biologics and vigilance will continue to be needed during and after such treatment. The most recently analyzed statistics from the BIOBADADERM registry show a 20.5% prevalence of LTBI in psoriasis patients treated with biologics in Spain. Various screening protocols are in effect in different countries according to their levels of endemic TB and bacillus Calmette-Guérin (BCG) vaccination, and there is no consensus on a gold-standard approach to the diagnosis of LTBI. Tuberculin skin testing (TST) continues to be the diagnostic method of choice in spite of its limited sensitivity, mainly in immunocompromised patients. Additional problems include the TST's well-established lack of specificity, errors in application, subjectivity in the interpretation of results (which must be read during a second visit), and lack of privacy; the main advantages of this test are its low cost and ease of application. Most cost-benefit studies are therefore inclined to favor using interferon-γ release assays to detect LTBI because they minimize false positives (especially in BCG-vaccinated individuals), thereby eliminating the extra costs and side effects of unnecessary chemoprophylaxis. We review the methods used for LTBI screening in psoriasis patients who are candidates for biologic therapy. Additionally, given the fact that most guidelines do not currently consider it necessary to screen patients about to start conventional systemic therapy, we discuss the reasons underlying the need for such screening.
La infección tuberculosa (TB) se produce tras el contacto por vía aerógena a partir de pacientes bacilíferos con lesiones pulmonares «abiertas», es decir, conectadas con el exterior por un bronquio de drenaje. Las otras posibles vías de contagio han dejado de tener importancia epidemiológica. Por tanto, el único reservorio relevante de M. tuberculosis causante del mantenimiento de la pandemia es el ser humano infectado. Esta primoinfección genera una respuesta inmunológica, la cual, en la mayoría de las ocasiones, detiene la multiplicación del bacilo, permitiendo el control de la infección y la subsiguiente curación. Sin embargo, cuando no todos los microorganismos se destruyen y algunos de ellos permanecen en estado de latencia intracelular, el huésped, que normalmente no ha desarrollado clínica ni presenta hallazgos objetivos en la exploración, se encuentra en el estado de infección latente por M. tuberculosis (ILMT).
En el último informe epidemiológico publicado recientemente por la Organización Mundial de la Salud (OMS)1, y con datos actualizados a 2014, se notificaron 6,1 millones de casos de TB. De ellos, 5,7 millones correspondían a casos recién diagnosticados, y los otros 0,4 millones a casos que ya estaban en tratamiento. En España la prevalencia publicada es de 16 casos/100.000hab. (incluyendo los casos de coinfección con VIH), con una incidencia de 13 nuevos casos/100.000hab. en 2013. Estos datos se refieren a pacientes diagnosticados de TB activa y nos dan una idea de la magnitud del problema. Por el contrario, es difícil precisar la prevalencia de ILMT, ya que no existen registros uniformes para la recogida de la información. Las cifras varían de países con alta endemia, por ejemplo Sudáfrica (4,2%), a países con baja endemia, como Estados Unidos (0,03%)2, sin haber muchas modificaciones en las cifras aportadas en los últimos 10 años.
En la actualidad el riesgo de que una persona con ILMT desarrolle una TB activa es variable y oscila entre un 0,1% (individuos sanos con ausencia de factores de riesgo) hasta un 10% aproximadamente (en pacientes con infección por el VIH). Es por ello que un adecuado cribado de la TL conducirá a una disminución de la incidencia de TB activa. Las personas que padecen una TB activa y no han recibido tratamiento correcto son la principal fuente de infección, como hemos comentado3. Las principales características que favorecen su transmisión son la gravedad del paciente con enfermedad activa, periodos largos de exposición del contacto con el paciente enfermo, escasas medidas de ventilación y escasa exposición a la radiación ultravioleta en el medio ambiente donde reside el paciente enfermo4. Sin entrar en la descripción de los factores intrínsecos al huésped y a M. tuberculosis, en el campo de la dermatología el interés de la prevención y tratamiento de la TL reside en que los pacientes con psoriasis moderada-grave en tratamiento con terapia biológica (especialmente fármacos anti-TNF) son uno de los principales grupos de riesgo para contraer la infección, tal y como señalamos en la tabla 1.
Grupos de alto riesgo para desarrollar TB activa
| Síndrome de inmunodeficiencia adquirida |
| Infección por el virus de la inmunodeficiencia humana |
| Pacientes trasplantados bajo tratamiento inmunosupresor |
| Silicosis |
| Enfermedad renal crónica en tratamiento con hemodiálisis |
| Cáncer de cabeza y cuello |
| Infección tuberculosa reciente en los 2 últimos años |
| Radiografía de tórax alterada con cambios apicales fibronodulares típicos de TBC (no granulomas) |
| Trabajadores sanitarios en contacto con pacientes con TBC activa |
| Contactos casuales con pacientes con TBC activa de alto índice de contagiosidad |
| Pacientes en tratamiento con anti-TNF |
Por ello, en la siguiente revisión nos proponemos describir las principales técnicas disponibles en el momento actual para el diagnóstico de la ILMT, actualizar el algoritmo de despistaje de la ILMT y la situación actual de dicho despistaje en pacientes psoriásicos en países con alta y baja endemia, y explorar la posibilidad de extender dicho despistaje a pacientes psoriásicos que reciben o son candidatos a terapia sistémica no biológica.
Diagnóstico de la infección latente por M. tuberculosisEs preciso identificar a los individuos con ILMT con riesgo de desarrollar una TB activa para aplicar tratamiento (preventivo o profilaxis) frente a esta infección latente. No es una prueba que deba realizarse de manera indiscriminada, sino solo a aquellos pacientes cuya realización redunde en un claro beneficio, ya que un resultado positivo implica tratar obligatoriamente.
Tradicionalmente, en estos pacientes se ha detectado la positividad por la prueba de la tuberculina. Recientemente se han incorporado métodos de detección de la infección basados en test inmunológicos in vitro en sangre, los conocidos como Interferon–Gamma Release Assay (IGRA). Es preciso hacer hincapié en que no existe un criterio de referencia (gold standard) para la detección de la ILMT. Las pruebas existentes son de base inmunológica (implica la participación y respuesta de células T memoria evidenciando esta respuesta frente a antígenos más o menos específicos). El principal inconveniente de ambas pruebas, que pasaremos a describir a continuación, es que son incapaces de diferenciar entre ILMT y TB activa.
Prueba de la tuberculinaPara su realización se utiliza un extracto obtenido del filtrado del cultivo de bacilos tuberculosos, esterilizado y concentrado. El tipo de antígeno utilizado es el purified protein derivate (PPD). En España se utiliza la variante RT-23 con tween 80 como antiadsorbente5,6.
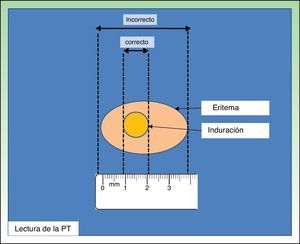
La técnica más ampliamente utilizada para realizar la PT es la técnica de Mantoux, la cual implica la inyección intradérmica de 0,1ml de PPD a dosis de 2UT en la cara ventral del antebrazo. Después de su administración deberá aparecer un habón que se desvanece en poco tiempo. La lectura se realiza a las 48-72h, midiéndose el diámetro transversal de la induración respecto al eje longitudinal del antebrazo (fig. 1). Otra técnica utilizada es el test de los pinchazos múltiples, que se realiza en el antebrazo con púas impregnadas en tuberculina. Dado que no se conoce la cantidad de tuberculina que penetra en la piel se considera una técnica inadecuada7,8.
El principal inconveniente de la PPD radica en que las proteínas utilizadas no son específicas de M. tuberculosis, sino que son compartidas con el bacilo de la vacuna BCG y otras micobacterias ambientales, lo que resta especificidad a la prueba de la tuberculina.
En nuestro país se considera positiva la PT cuando la induración es mayor o igual a 5mm en las personas que no han sido vacunadas con BCG. En aquellas personas vacunadas la interpretación es dificultosa, ya que es necesario discernir entre el efecto de la vacuna y la infección tuberculosa. En esta situación vamos a considerar que la PT es positiva >5mm, si además de vacunados son convivientes o mantienen contactos frecuentes con pacientes bacilíferos o son portadores de radiología de tórax con lesiones sugestivas de tuberculosis antiguas y nunca tratadas. En los pacientes vacunados con BCG no contemplados en las situaciones anteriores, aunque se estima que a mayor diámetro de la induración mayor es la posibilidad de que la respuesta esté relacionada con la presencia de infección tuberculosa, no es posible establecer con certeza el efecto de la vacuna y habrá que tratar9,10.
En personas con inmunodepresión importante (infectados por el VIH, trasplantados, tratamientos biológicos y con corticoides) se acepta como positiva cualquier induración de la PT.
Es conocido el efecto booster que presenta la PT y que puede conducir al error de interpretar como conversión de la tuberculina lo que en realidad corresponde a la inducción o restablecimiento de la capacidad de respuesta, en personas que se infectaron anteriormente y en las que el paso del tiempo ha debilitado, pero ha hecho desaparecer la capacidad de respuesta y aparece tras la aplicación de la PT. Este efecto se observa en personas mayores de 55 años y en vacunados con BCG, aconsejándose que cuando la PT sea negativa se repita a los 7-10 días tomando como definitivo el resultado de la segunda PT5,6.
El hecho de que el PPD esté constituido por antígenos no exclusivos de M. tuberculosis, sino compartidos con otras micobacterias no tuberculosas (MNT), y el estar vacunado previamente con BCG son los principales factores conocidos de falsos positivos ante un individuo con PT positiva. Las MNT no son clínicamente una causa importante de resultados falsos positivos, excepto en países con una alta prevalencia frente a MNT y baja prevalencia de infección por M. tuberculosis10. El impacto de la vacuna BCG depende del tiempo desde la administración y del número de dosis utilizadas.
Otras situaciones, como la realización inadecuada de la técnica con formación de hematoma, o infección local pueden, a su vez, alterar la interpretación de la prueba. Otras circunstancias responsables de falsos negativos en la realización y lectura de la PT incluirían: infección viral concurrente, vacunas con virus vivos, situaciones de inmunodepresión o tratamiento con fármacos que disminuyan la respuesta inmunitaria, así como la respuesta inmune en edades extremas de la vida.
En general, aunque la PT continúa siendo el método de elección para el diagnóstico de infección, presenta importantes limitaciones en su sensibilidad (principalmente en pacientes inmunodeprimidos). Esta situación, junto a su falta de especificidad conocida, errores en su administración, la subjetividad en la interpretación de los resultados, la necesidad de una segunda visita para la lectura y la ausencia de privacidad hacen de ella una prueba limitada, cuyas principales ventajas resultarían su bajo coste y su fácil realización.
Pruebas de determinación de la producción de interferón gammaEstas técnicas se basan en la detección de interferón gamma en sangre, una citocina fundamental en el control de la infección tuberculosa, que se libera como respuesta a la estimulación in vitro de las células T sensibilizadas con antígenos específicos de M. tuberculosis.
Los antígenos utilizados en esta prueba son el early secretory antigen target -6 (ESAT-6) y el culture filtrate protein 10 (CFP-10), que están codificados por genes de la RD1 (región de diferenciación) del genoma de M. tuberculosis11,12. Son más específicos que el PPD, ya que no están codificados por ninguna cepa utilizada para la vacuna de la BCG ni por la mayoría de las MNT, a excepción de M .marinun, M .kansasii, M. szulgai y M. flavencens13.
Existen 2 test comercializados para su realización: Quantiferon TB Gold in tube (Q-TB) (Cellesti/Qiagen, Carnegie, Australia), que utiliza una técnica de ELISA, y T-SPOT-TB (Oxford Immunotec. Abingdon, Reino Unido) basado en la técnica ELISPOT. Ambos test han sido recientemente aprobados para su venta en Europa y finalmente aprobados para su uso en el diagnóstico de ILMT por la Food and Drug Administration americana. El Q-TB incorpora además de los antígenos comentados un tercero, el TB 7.7.
Ambas técnicas presentan ventajas operacionales respecto a la tuberculina, y son significativamente más específicas en población vacunada14,15. Incorporan controles para detectar anergia y excluir así los falsos negativos. Por otro lado, pueden repetirse inmediatamente sin el riesgo de estimulación de la inmunidad, con lo que se evita el efecto booster. Se elimina la visita de lectura y se evita la pérdida en aquellos individuos que no acuden. Son más fáciles de estandarizar y aplicar en el laboratorio, respetándose la intimidad del paciente. El principal inconveniente de los test IGRA es su coste respecto a la PT.
La prueba se realiza incubando 1ml de sangre periférica con heparina en 3 tubos: a) un tubo control negativo con sangre del paciente; b) un tubo control positivo con fitohemaglutinina para medir la capacidad de linfoproliferación de los linfocitos de cada paciente; y c) un tercer tubo que contiene los antígenos específicos ESAT-6, CFP-10 y TB 7.7. Estos 3 tubos se incubarán durante 16-18h a una temperatura de 37° y determinándose la concentración de interferón gamma mediante la técnica de ELISA en unidades internacionales (UI) por mililitro. Los resultados son calculados de acuerdo a una recta patrón con la ayuda del software proporcionado por el fabricante.
En relación con la prueba T-SPOT-TB, y a diferencia del Q-TB, se precisa de la separación previa de células mononucleares para su estimulación. La presencia de interferón gamma se determina por ELISPOT en lugar de ELISA, mediante el recuento de células productoras de mancha (spot forming cells). Cada mancha representa la huella de un linfocito T individual T secretor de interferón gamma. Técnicamente el T-SPOT-TB requiere mayor volumen de sangre, mayor tiempo de preparación y es más dificultoso de realizar, pero sin embargo parece más sensible.
Desafortunadamente hay resultados indeterminados de IGRA que pueden ocurrir debido a una baja producción de interferón gamma en el control positivo (mitógeno) o a una alta respuesta de fondo en el control negativo.
La especificidad de los IGRA es mayor del 95% en lugares con una baja incidencia de TB activa, la cual no se ve afectada por la vacunación con BCG. Se ha descrito una mayor sensibilidad para el T-SPOT-TB en relación con el Q-TB y con la PT (90%, 80% y 80% respectivamente) en diferentes trabajos publicados16,17.
Terapia biológica y despistaje de infección latente por M. tuberculosisUna vez caracterizadas ambas pruebas los objetivos que nos proponemos en este apartado son determinar el punto de partida en el que nos hallamos en el despistaje de la ILMT en pacientes con psoriasis moderada-grave que sean candidatos a terapia biológica, su incidencia en España, el posicionamiento actual de la OMS y un breve análisis de los estudios de concordancia entre ambas pruebas para concluir con un algoritmo de fácil aplicación.
Desde el año 2005, en el que se comenzaron a utilizar los fármacos biológicos de forma rutinaria en el arsenal terapéutico de la psoriasis moderada-grave, uno de los puntos clave fue del despistaje de la ILMT. Este hecho, aprendido de la experiencia previa en pacientes reumatológicos, llevó a considerar 3 situaciones diferentes, recogidas en el primer documento de consenso para el manejo de la psoriasis moderada-grave, auspiciado por el grupo de psoriasis de la AEDV18 (tabla 2).
Algoritmo de despistaje de la ILMT20
| Mantoux negativo Booster negativo Radiografía de tórax normal | Inicio de terapia biológica |
| Mantoux y/o booster positivo Radiografía de tórax normal | Diagnóstico de ILMT Inicio de quimioprofilaxis Demora de terapia biológica un mes |
| Mantoux y/o booster positivo (y BCG>10 años si vacunación previa) Radiografía de tórax anormal | Diagnóstico de TB activa Inicio de terapia anti-TB Demora de terapia biológica 6 meses |
En pacientes con PT negativa esta era repetida de forma secuencial con periodicidad anual.
Si tras realizar una correcta anamnesis con la pertinente búsqueda de antecedentes y factores de riesgo:
Adaptado del documento de consenso del manejo de la psoriasis moderada-grave por la AEDV 2009.
En España disponemos de una aproximación bastante reciente sobre la situación actual de la ILMT en nuestro país, ya que Sánchez Moya et al. recogen los últimos datos publicados por el registro BIOBADADERM19 en 2013. En él se incluyen datos de 1.425 pacientes con psoriasis moderada-grave (56% pacientes en tratamiento biológico y 44% en tratamiento sistémico convencional) marcando una prevalencia de ILMT del 20,5%.
El despistaje se habría realizado al 83% de los pacientes y la adherencia exacta a las recomendaciones de los protocolos sobre despistaje de ILMT en situación basal previa al tratamiento habría sido tan solo del 51%.
Los autores explican estos hallazgos por la introducción del método IGRA en muchos de los hospitales participantes en el estudio, y habiendo solo contabilizado el despistaje utilizando la PT. Todo ello deriva en la afirmación de modificar las guías o directrices de manejo de pacientes con psoriasis moderada-grave y enfatizar en la adherencia a los protocolos establecidos.
Recientemente, la OMS ha publicado sus directrices sobre la atención de la ILMT21. En ellas se nos recuerdan 3 puntos de sumo interés:
- •
Antes de someter a un paciente a un despistaje de ILMT es necesario realizar una correcta historia clínica, y la presencia de sintomatología o radiografía de tórax anormal debe incurrir en un estudio minucioso de TB activa (recomendación firme, bajo nivel de evidencia).
- •
La PT o los IGRA se pueden usar de manera indistinta en países con altos recursos económicos para el despistaje de TL, o en países de ingresos moderados con incidencia de TBC inferior a 100 casos/106 hab. (recomendación firme, bajo nivel de evidencia).
- •
Los IGRA no deben sustituir a la PT en países de ingresos bajos ni países con ingresos moderados con incidencia de TB superior a 100 casos/106 hab. (recomendación firme, bajo nivel de evidencia).
Con estas premisas y la introducción de los nuevos métodos de cribado de ILMT previamente descritos (IGRA) aparece un nuevo panorama que nos ofrece la posibilidad de actualizarnos en este punto. La concordancia entre la PT y los IGRA varía claramente entre los países con alta y baja incidencia debido a los efectos de la vacunación con el BCG y las tasas de reinfección22,23.
- •
En países de alta endemia y alta tasa de vacunación la PT sobreestima el diagnóstico de ILMT, incurriendo en un exceso de profilaxis y efectos secundarios asociados24,25, mientras que el resultado del test IGRA no ofrece diferencias significativas con los grupos control, acercando la tasa de ILMT a la de la población real.
- •
En países de endemicidad media y baja tasa de vacunación la PT también sobreestima la tasa de ILMT en comparación con los IGRA26.
- •
Finalmente, en países de baja endemicidad y con baja tasa de vacunación parece que el grado de concordancia entre ambas pruebas mejora, si bien la PT también sobreestima la tasa de TL en comparación con los IGRA27,28.
De todos los estudios recientemente publicados, especialmente interesante resulta el comunicado por Gisondi et al.29, en el que se valora la prevalencia de ILMT en pacientes con psoriasis candidatos a terapia biológica, estableciendo la comparación con enfermos de Crohn, artritis reumatoide y trabajadores sanitarios. Estos datos complementan la evidencia obtenida a partir del registro italiano de psoriasis30 (Psocare), donde ya se establecía una prevalencia del 8,2%. El despistaje de TL se realizó en todos los casos mediante IGRA (Quantiferon B Gold in tube) y en 88 de los pacientes estudiados se realizó simultáneamente la PT, siendo la prevalencia del 8,2%,7%, 9% y 8,8% respectivamente. Cabe destacar que ninguno de los pacientes con diagnóstico de ILMT desarrolló TB activa tras realizar la oportuna quimioprofilaxis. La determinación de los IGRA se reevaluó a los 31±1,7 meses (sin que se aduzcan motivos por los que se realiza en ese periodo exactamente), con un 25% de reversiones en los pacientes diagnosticados y tratados de TL y un 0,8% de conversiones. El índice de concordancia Kappa (κ) en este estudio fue bajo (0,15), revelando baja concordancia entre ambos métodos, si bien los autores se decantan claramente por la utilización de la técnica de IGRA, la cual puede ser repetida el número de veces que el dermatólogo estime oportuno, sin riesgo de producir fenómeno booster o sensibilización, aunque se requieren nuevos estudios que den respuesta a una correcta valoración de las fluctuaciones en su determinación seriada.
La causa de la discrepancia en los distintos estudios entre ambas técnicas no está bien establecida, pero entre las razones se señalan la gravedad de la psoriasis, el estatus vacunal con BCG y la presencia o ausencia de tratamiento inmunosupresor concomitante. De hecho, los pacientes con psoriasis moderada-grave presentan menor respuesta inmunológica específica frente a M .tuberculosis, mientras que la sensibilidad a la PT suele ser mayor. Además, el tratamiento inmunosupresor sí puede condicionar los resultados de la PT, no así los IGRA31.
Todo ello hace que la mayoría de los estudios de coste beneficio se inclinen por el método IGRA para el diagnóstico de la ILMT, ya que minimiza los falsos positivos (especialmente en población vacunada), eliminando costes extra y efectos secundarios de la quimioprofilaxis antituberculosa23.
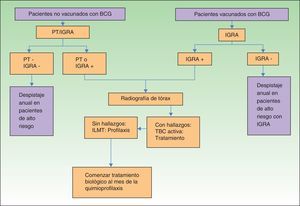
En virtud de todo lo expuesto previamente, y dado que la penetrancia del método IGRA no es global en todos los hospitales de nuestro entorno, el algoritmo de despistaje de ILMT en nuestros pacientes con psoriasis moderada-grave podría quedar establecido tal y como se recoge en la figura 2.
Terapia sistémica y despistaje de infección latente por M. tuberculosis. Otras consideracionesEl despistaje de ILMT en pacientes candidatos a terapia biológica está plenamente asentado, pero existen dudas razonables del mismo cuando el paciente comienza con la transición entre terapia tópica y sistémica. No todos los fármacos sistémicos ni la fototerapia presentan el mismo mecanismo de acción, y solo metotrexato y ciclosporina, debido a su efecto inmunosupresor, presentarían un notable incremento del riesgo de desarrollo de infecciones bacterianas, víricas y fúngicas, resultando especialmente relevante la ILMT.
De este modo, en las guías española18 y americana32 de manejo diagnóstico y terapéutico de psoriasis se recomienda el despistaje de la ILMT previo al inicio de tratamiento con ciclosporina o metotrexato, pero no así con acitretino o fototerapia, al no haberse demostrado un incremento del riesgo de reactivación con los mismos. Esta recomendación también queda reflejada en el reciente estudio de Gisondi27 sobre la prevalencia de ILMT previamente comentado.
En el estudio publicado por Sánchez-Moya et al.19 ya referido, que recoge los datos del último informe de BIOBADADERM, no se detectó ningún caso de tuberculosis activa entre los pacientes tratados con agentes sistémicos convencionales, lo cual podría presumir un menor riesgo de ILMT. Quizá en función de estudios como este y de experiencias previas algunas guías, como las europeas S333, no consideran necesario el despistaje de ILMT antes de iniciar ninguno de los 4 tratamientos clásicos utilizados en el manejo de la psoriasis moderada-grave.
Aunque no es objetivo del presente trabajo si nos ha parecido importante reseñar como curiosidad un hecho remarcado por diferentes autores: la inclusión de los corticoides orales dentro de las terapéuticas que precisarían despistaje de ILMT previo a su inicio, especialmente cuando se va a superar la dosis de 20mg/día durante más de 2 semanas en áreas de alta prevalencia de TB34–36. En una revisión realizada por Keith et al.36 sobre la evidencia del despistaje de enfermedades infecciosas antes del inicio de inmunosupresores sistémicos en pacientes con enfermedades ampollosas autoinmunes, se recomienda una estratificación del riesgo individual del paciente para elegir el método apropiado. Asimismo, se enfatiza el hecho de que son pacientes que pueden requerir múltiples terapias inmunosupresoras a lo largo de la historia natural de su enfermedad.
Esta situación es algo similar a lo que ocurre en los pacientes con psoriasis moderada-grave, por lo cual sería razonable realizar el despistaje de la ILMT en todos los pacientes antes del inicio de la terapia sistémica, a pesar de no existir una postura común, como acabamos de comentar.
ConclusionesEn conclusión, hemos realizado una actualización de los métodos de despistaje de ILMT y su aplicación en nuestra práctica clínica diaria. En el momento actual el test IGRA se ha convertido en un método de gran utilidad en el diagnóstico de la TL, debido a la ausencia de reacción cruzada con el BCG y otras micobacterias no tuberculosas. Es una prueba menos influenciada por la inmunosupresión que la PT, afirmación no compartida por todos los autores37, y cuya posibilidad de repetición a lo largo del tiempo, sin el riesgo de provocar un efecto booster, la convierten en la prueba idónea para la monitorización de la ILMT en pacientes con psoriasis moderada-grave candidatos a terapia biológica. Su coste, no obstante, sigue siendo su principal desventaja. Si bien no hay consenso en la realización de la misma, previa prescripción de terapia sistémica convencional, el hecho de que sean pacientes que en su historia natural precisarán diferentes tratamientos, entre ellos la posibilidad de terapia biológica, hace altamente recomendable su despistaje. Además, debemos considerar su extensión a otras enfermedades sistémicas o autoinmunes que precisan terapias como corticoides sistémicos, también relacionados con mayores tasas de reactivación de ILMT.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.