Staphylococcus aureus resistente a meticilina de adquisición comunitaria (SARM-CO) constituye un patógeno emergente como agente productor de infecciones de piel y partes blandas.
ObjetivoDescribir las características clínicas de las infecciones cutáneas causadas por SARM-CO, así como su correlación con los datos demográficos y microbiológicos disponibles.
Material y métodosSe realizó un estudio descriptivo de los pacientes con diagnóstico de infección microbiológicamente confirmada por SARM-CO en el Servicio de Dermatología desde junio de 2009 a diciembre de 2011. Se recogieron los datos demográficos de los pacientes, las características clínicas de las lesiones y los tratamientos realizados.
ResultadosSe reclutaron 11 pacientes, 5 hombres y 6 mujeres. El 91% tenía menos de 40 años y no presentaba antecedentes médicos de interés. El absceso cutáneo (asociado o no a celulitis) fue la forma más frecuente de presentación. Tras su drenaje se observó una cantidad escasa o nula de exudado purulento junto a un componente de necrosis tisular marcado en todas estas lesiones. El 50% de los abscesos había recibido tratamiento previo con antibióticos betalactámicos y el drenaje quirúrgico, asociado en el 63% a quinolonas o cotrimoxazol, aseguró la resolución de los mismos.
ConclusionesActualmente las infecciones cutáneas causadas por SARM-CO se presentan en individuos jóvenes, sanos, deportistas, sin contacto con el ámbito sanitario. Los abscesos cutáneos, su forma más frecuente de presentación, se caracterizan por una marcada necrosis tisular, con escaso o nulo exudado purulento. Ante estos hallazgos en pacientes susceptibles debe sospecharse la implicación de SARM-CO como agente causal. El drenaje de los abscesos se realizará siempre que sea posible, y cuando resulte necesario añadir tratamiento antibiótico deberá evitarse el uso de betalactámicos de forma empírica.
Community-acquired methicillin-resistant Staphylococcus aureus (CA-MRSA) is an emerging pathogen that causes skin and soft-tissue infections.
ObjectiveTo describe the clinical characteristics of skin infections caused by CA-MRSA and correlations with the available demographic and microbiological data.
Material and methodsThis was a descriptive study of patients with a microbiologically confirmed diagnosis of CA-MRSA infection treated in a dermatology department between June 2009 and December 2011. We recorded demographic details, the clinical characteristics of lesions, and the treatments used.
ResultsWe studied 11 patients (5 men and 6 women); 91% were under 40 years of age and had no relevant past medical history. The most common presentation was a skin abscess (with or without cellulitis). In all such cases, marked tissue necrosis and little or no purulent exudate was observed when the abscess was drained. Fifty percent of these abscesses had been treated previously with β-lactam antibiotics, and in all cases the lesions resolved after surgical drainage, which was combined in 63% of cases with quinolones or cotrimoxazole.
ConclusionsToday, skin infections due to CA-MRSA affect healthy young athletes who have no contact with healthcare settings. The most common presentation is a skin abscess characterized by marked tissue necrosis and little or no purulent exudate. In cases with these characteristics in susceptible patients, the involvement of CA-MRSA as the causative agent should be suspected. The abscesses should be drained whenever possible and, if necessary, antibiotic treatment should be prescribed; empirical use of β-lactam antibiotics should be avoided.
El aumento de las infecciones causadas por microorganismos resistentes a los antimicrobianos convencionales supone una de las principales limitaciones terapéuticas en el ámbito hospitalario.
Tras la introducción de la penicilina en el año 1941 no tardaron en aislarse las primeras cepas de Staphylococcus aureus resistentes a este fármaco. Dos décadas después aparecerían cepas hospitalarias del mismo germen resistentes a la meticilina (en nuestro medio equivalente a la oxacilina), constituyéndose posteriormente como una de las principales bacterias productoras de infecciones nosocomiales. Sin embargo, a partir de la década de los ochenta se documentó su presencia en infecciones no hospitalarias1. Desde ese momento su incidencia en países como Estados Unidos ha ido aumentando exponencialmente, hasta convertirse en la primera causa de infección de piel y partes blandas adquirida en la comunidad en varios de sus estados2.
Staphylococcus aureus resistente a meticilina comunitario (SARM-CO) difiere de su homólogo nosocomial en sus características clínicas, epidemiológicas y microbiológicas (tabla 1)3–7, confiriéndole un manejo terapéutico radicalmente distinto en la mayor parte de los casos.
Características diferenciales entre las cepas de SARM nosocomial y comunitario
| SARM-comunitario | SARM-nosocomial | |
| Grupos de riesgo | Niños, deportistas, instituciones de reclutamiento, promiscuidad sexual, ADVP, VIH4, tatuajes5,6, procedencia áreas endémicas (Islas Pacífico, América Central/Sur, aborígenes australianos) | Hospitalización prolongada, catéteres intravasculares, diabetes mellitus, inmunosupresión, estancia en unidades de vigilancia intensiva, hemodializados, diálisis peritoneal |
| Mecanismos de resistencia (genes SCCmec) | IV | I, II, III |
| Producción leucocidina de Panton-Valentine | Frecuente | Infrecuente |
| Patrón de resistencia a antimicrobianos | Resistente a antibióticos beta-lactámicosa | Multirresistencia |
| Clínica | Infecciones de piel y partes blandas, neumonía necrotizante | Bacteriemia asociada a dispositivos endovasculares, infección urinaria, neumonía nosocomial, endocarditis, infección de herida quirúrgica |
| Colonización | Genital, perineal (en infecciones recurrentes) | Nasal |
ADVP: adictos a drogas por vía parenteral; SARM: Staphylococcus aureus resistente a meticilina; SCCmec: cassette cromosómico estafilocócico;, VIH: virus de la inmunodeficiencia humana.
Fuente: Kowalski et al.3.
En España es frecuente que los aislados de SARM-CO sean resistentes a la tetraciclina y a la doxiciclina, resistencia mediada por el gen tet(M)177.
Dado que el SAMR-CO produce predominantemente infecciones de piel y partes blandas, hemos revisado 11 casos diagnosticados en nuestro centro, con el objetivo de describir sus principales características clínicas, así como su correlación con los datos demográficos y microbiológicos disponibles. De este modo, proponemos definir unos criterios clínicos que contribuyan a mejorar el tratamiento empírico inicial de las infecciones de piel y partes blandas de los pacientes no hospitalizados.
Material y métodosSe trata de un estudio retrospectivo, descriptivo y observacional de pacientes adultos con diagnóstico microbiológico de infección de piel y partes blandas causada por SAMR-CO. Los casos fueron recogidos a través de la base de datos de infecciones cutáneas del Servicio de Dermatología del Hospital General Universitario Gregorio Marañón de Madrid, entre los meses de junio del año 2009 y diciembre del año 2011.
Todos los casos fueron confirmados microbiológicamente mediante la realización de cultivo, antibiograma y estudio molecular.
Las variables clínicas estudiadas fueron la edad, el sexo, la forma de presentación clínica (tipo de lesiones, presencia de pus, necrosis y localización), la evolución de las lesiones, los tratamientos realizados y su respuesta a los mismos. Desde el punto de vista epidemiológico se analizó la procedencia de los pacientes, la existencia de infecciones cutáneas de repetición en ellos o en el ámbito familiar, las prácticas de riesgo (actividades o deportes de contacto, uso compartido de objetos de higiene personal, pertenencia a colectivos o instituciones de reclutamiento), el contacto con el ámbito sanitario (laboral, ingreso hospitalario previo) y el contacto con animales domésticos o de granja.
ResultadosLos datos correspondientes a los pacientes estudiados se resumen en la tabla 2.
Datos demográficos, clínicos y microbiológicos de los pacientes incluidos en el estudio
| Paciente/edad/sexo | Procedencia | Tipo de lesión | Localización de la/s lesión/es | Exudado purulento | Necrosis tisular | Factores de riesgo | Tratamientos previos | Resistencia a ANB | Producción LPV | Tratamiento |
| 1/38/V | España | Absceso+celulitis | Pierna | No | Sí | Deporte (fútbol sala) | Cloxacilina, amoxi-clavu | Eritromicina | Sí | Qx+ciprofloxacino vo |
| 2/40/V | Ecuador | Absceso | Brazo | No | Sí | Eritromicina | Sí | Qx | ||
| 3/27/V | España | Absceso | Pierna | No | Sí | Acampada rural en Tailandia | No | Sí | Qx+ciprofloxacino vo | |
| 4/26/M | Cuba | Absceso | Fosa ilíaca | Escaso | Sí | Danza, tatuaje | Cloxacilina, amoxi-clavu, cefuroxima | Eritromicina, levofloxacino | Sí | Qx+clindamicina vo (suspensión por intolerancia digestiva)/cotrimoxazol |
| 5/43/V | Colombia | Absceso | Abdomen | Escaso | Sí | Amoxi-clavu | Eritromicina | Sí | Qx+vancomicina iv | |
| 6/37/M | España | Ántrax | Labio superior | Escaso | No | Amoxi-clavu | No | Sí | Qx+ciprofloxacino vo | |
| 7/35/V | Polonia | Paroniquia | Primer dedo pie | Escaso | No | Uña encarnada | Amoxi-clavu, cefuroxima | No | Sí | Cotrimoxazol vo+Qx diferida uña encarnada |
| 8/37/M | Polonia | Absceso+celulitis | Muslo | No | Sí | Deporte (natación-buceo) | No | Sí | Qx+cotrimoxazol vo | |
| 9/18/M | Ecuador | Absceso+celulitis | Abdomen | No | Sí | Procedimientos estéticos no invasivos | Eritromicina | Sí | Qx+ciprofloxacino vo | |
| 10/18/M | Colombia | Foliculitis | Espalda | Sí | No | Infecciones cutáneas recurrentes | Eritromicina | Sí | Cotrimoxazol | |
| 11/24/M | España | Absceso+celulitis | Pierna | Escaso | Sí | Danza | Amoxi-clavu, eritromicina | Eritromicina, clindamicina | ? | Qx+vancomicina |
Amoxi-clavu: amoxicilina-ácido clavulánico; ANB: antibióticos no betalactámicos; LPV: leucocidina de Panton-Valentine; M: mujer; Qx: drenaje quirúrgico; V: varón.
El 91% (10/11) de los sujetos era menor de 40 años, con una proporción hombre:mujer de 1:1,2. Se trataba de pacientes sanos, inmunocompetentes, sin ingresos hospitalarios previos ni contacto laboral o familiar con el ámbito sanitario.
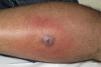
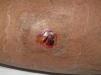
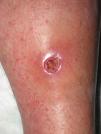
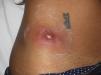
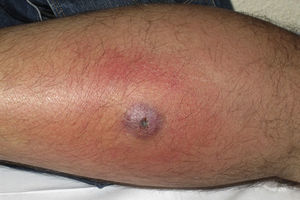
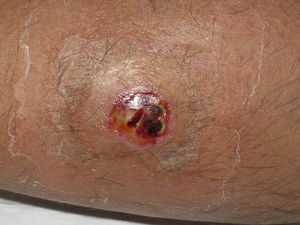
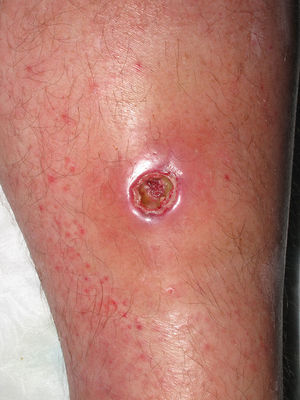
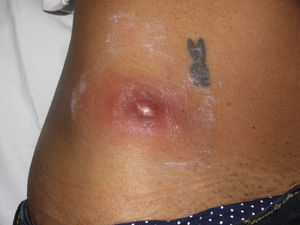
Clínicamente el 73% (8/11) de los pacientes consultó por abscesos (figs. 1–4) asociados a celulitis perilesional en la mitad de los casos (4/8). El 63% (5/8) de estas lesiones se encontraban localizadas en áreas expuestas de las extremidades. Tras su drenaje quirúrgico no se obtuvo material purulento en el 63% de los abscesos (5/8), siendo escaso en el resto (3/8: 37%). De forma característica en todas estas lesiones dominaba el componente de necrosis tisular, alcanzando la cavidad formada el tejido celular subcutáneo.
Existían, asimismo, 2 casos con afectación folicular primaria (foliculitis y ántrax estafilocócico) y un paciente con paroniquia recurrente. En estos 3 últimos pacientes, por la naturaleza de sus lesiones, no pudo establecerse con claridad la cuantía del exudado purulento.
Desde el punto de vista epidemiológico el 36% (4/11) eran españoles, mientras que el 45% (5/11) procedía de países latinoamericanos y el 18% (2/11) de Polonia. Como posibles factores de riesgo implicados en el desarrollo de la infección se identificó la práctica deportiva en 2 pacientes (18%), la danza en 2 (18%) y la realización de procedimientos estéticos no invasivos en uno (9%).
En 2 pacientes se documentaron antecedentes de infecciones cutáneas recurrentes no complicadas.
Todos los casos fueron confirmados mediante cultivo, antibiograma y estudio molecular. El 64% (7/11) de las cepas bacterianas presentó resistencia a la eritromicina. Adicionalmente, en un caso (1/7) existía resistencia a levofloxacino y en otro (1/7) resistencia inducible a clindamicina, confirmada mediante D-test. Todos los estafilococos aislados (salvo un caso en el que no se realizó su determinación al proceder de otro centro) expresaron genes codificadores para la leucocidina de Panton-Valentine.
El 55% (6/11) recibió tratamiento previo con amoxicilina-ácido clavulánico sin respuesta clínica. De ellos el 67% (4/6) fracasó tras un segundo ciclo de antibiótico betalactámico (cefuroxima/cloxacilina) o eritromicina.
En todos los abscesos se realizó drenaje quirúrgico (8/8) y en el 88% de los mismos se asoció tratamiento antibiótico. Ciprofloxacino y cotrimoxazol fueron los antimicrobianos de elección en el 73% de los pacientes (8/11). En un caso se suspendió el tratamiento con clindamicina oral por intolerancia digestiva (diarrea). Dos pacientes con abscesos no complicados recibieron vancomicina intravenosa como alternativa a los antibióticos betalactámicos. Ningún sujeto presentó complicaciones sistémicas o compromiso del plano miofascial.
DiscusiónEl SARM-CO constituye un patógeno emergente como agente productor de infecciones de piel y partes blandas. En nuestro medio su incidencia continúa siendo baja, a diferencia de lo que ocurre en otros países industrializados, en los que representa uno de los principales patógenos bacterianos de adquisición comunitaria8,9.
Desde el punto de vista epidemiológico los datos obtenidos resultan similares a los descritos en la literatura científica: pacientes jóvenes, sanos, que practican deportes/actividades de contacto o que provienen de áreas endémicas como América Central o del Sur9.
Con frecuencia, los pacientes presentan abscesos cutáneos, generalmente únicos, localizados en áreas de piel expuestas o en contacto durante las distintas actividades realizadas10. De forma característica, en estos abscesos domina la necrosis del tejido y la producción de pus resulta muy escasa. Busch et al.11 realizaron un estudio en el que obtuvieron una sensibilidad del 92% y un valor predictivo positivo del 94% al evaluar la presencia de escara y celulitis perilesional como datos diagnósticos en los abscesos causados por SARM-CO. Esto podría ser explicado por el efecto citotóxico que teóricamente ejerece la leucocidina de Panton-Valentine (LPV) sobre los neutrófilos e hipotéticamente sobre las células epidérmicas, así como la liberación de factores proinflamatorios secundaria a la lisis de los granulocitos12. Sin embargo, se necesitan más estudios que confirmen el papel que desempeña esta toxina en la patogénesis de las infecciones causadas por SARM-CO.
El diagnóstico diferencial de estas lesiones debe incluir el pioderma gangrenoso, las mordeduras de araña13, el loxoscelismo14 o la leishmaniasis cutánea.
Se han descrito otras formas clínicas cutáneas frecuentes, como la foliculitis, los forúnculos (infecciones recurrentes) o el impétigo (especialmente en niños)15.
Las cepas de SARM-CO presentan características microbiológicas que las diferencian de las nosocomiales, ya que son resistentes, normalmente, solo a los antibióticos betalactámicos y son portadoras de los genes lukF-PV y lukS-PV que codifican la LPV. Sin embargo, dependiendo del origen de las cepas de SARM-CO puede existir resistencia a otros antimicrobianos, como ocurre con el clon predominante en Estados Unidos, USA300 (ST8-MRSA-IV), que presenta una elevada tasa de resistencia a los macrólidos7. Por tanto, en todos los casos en los que resulte posible se tomarán muestras para estudio microbiológico de las lesiones.
En esta serie el 91% los pacientes recibió tratamiento antimicrobiano, unido al drenaje quirúrgico de los abscesos. Sin embargo, algunos autores afirman que en los abscesos menores de 5cm en pacientes no diabéticos, inmunocompetentes, de localización extrafacial y que no presenten compromiso del plano miofascial bastaría con realizar drenaje de las lesiones fluctuantes y curas locales diarias16–18. En la tabla 3 se resumen las distintas modalidades terapéuticas válidas en el tratamiento de las infecciones causadas por SARM-CO.
Modalidades terapéuticas en las infecciones causadas por SARM-CO
| Tratamiento | Indicaciones | Posologíaa/vía administración | Efectos adversos y precauciones | Comentario |
| Drenaje quirúrgico | Debe realizarse en todos los abscesos | |||
| Cotrimoxazol | 1. Abscesos>cmo <cm en: lactantes, mayores de 65 años, localización facial, diabéticos, inmunosupresión, celulitis perilesional2. Impétigo, ectima, celulitis, foliculitis, paroniquia… | Oral:Adultos y ≥12 años: 800/160mg/ 12hNiños:-6-12 años: 400/80mg/12h-6 meses-5 años: 200/40mg/12h-6 semanas-5 meses: 100/20mg/12hIV/IM:Adultos y >12 años: 800/160mg/12-24hNiños de 6-12 años: 400/80mg/12-24hDosis media: 80/16mg/5kg/12 hNiños > 2 meses: 6-12mg/kg/día trimetoprim | Toxicodermia, leucopenia, trombocitopenia, anemia hemolítica, anemia megaloblástica, fotosensibilidad.No debe utilizarse en: embarazo, lactancia, < 2 meses, déficit de glucosa-6-fosfato deshidrogenasa, porfirias, tratamiento con metotrexato, azatioprina o metformina | Alta tasa de resistencia en las infecciones causadas por Streptococcus pyogenes: precaución en el tratamiento empírico de los abscesos con celulitis perilesional |
| Clindamicina | 1. Abscesos> 5cm< 5cm en: lactantes, > 65 años, localización facial, diabéticos, inmunosupresión, celulitis perilesional2. Impétigo, ectima, celulitis, foliculitis, paroniquia… | Oral:Adultos: 150-450mg/6hNiños>1 mes: 8-25mg/kg/día, en 3-4 dosisIV/IM:Adultos: 1,2-1,8g/día, en 3-4 dosisNiños>1 mes: 20-40mg/kg/día, en 3-4 dosis | Diarrea, riesgo de colitis pseudomembranosa, sabor metálico desagradableNo debe utilizarse en: embarazo, lactancia, asociado a eritromicina o aminoglucósidos | Puede presentarresistencia inducible no detectable con antibiogramas habituales (confirmar realización de D-test si resistencia a eritromicina en antibiograma convencional) |
| Quinolonas (ciprofloxacino, levofloxacino) | 1. Abscesos> 5cmo < 5cm en: lactantes, mayores de 65 años, localización facial, diabéticos, inmunosupresión, celulitis perilesional2. Impétigo, ectima, celulitis, foliculitis, paroniquia… | Ciprofloxacinoa:Oral: adultos 500mg/12hIV: adultos 200-400mg/12hLevofloxacinoa:Adultos. Oral: 250-500mg/díaIV: 500mg/día | Riesgo tendinopatía, artropatía (mayor en niños, ancianos, corticoterapia prolongada)Ajustar dosis en insuficiencia renalEvitar en: embarazo, lactancia, ingesta junto a lácteos o calcio | Por el momento, las tasas de resistencia a estos fármacos son bajas19 |
| Tetraciclinas(doxiciclina, minociclina) | 1. Abscesos> 5cmo < 5cm en: lactantes, > 65 años, localización facial, diabéticos, inmunosupresión, celulitis perilesional2. Impétigo, ectima, celulitis, foliculitis, paroniquia… | Doxiciclinaa:Oral: adultos y niños mayores de 8 años (peso≥45kg): 100-200mg/24h, repartido en una o 2 tomasMinociclinaa:Oral: adultos y niños mayores de 8 años (peso≥45kg): 100mg/12h | Fosensibilidad, hepatotoxicidad, hipertensión intracraneal benigna (mayor riesgo si se administra en niños o junto a retinoides), toxicidad vestibular (minociclina) esofagitis.Evitar en: embarazo, lactancia, niños < 8 años (riesgo de alteraciones dentarias y del metabolismo óseo) | No eficaz en monoterapia.Las cepas ST80-MRSA-IV (presentes en el norte y este de Europa, así como en algunos países de la cuenca mediterránea) son resistentes a la tetraciclina |
| Rifampicina | 1. Abscesos> 5cmo < 5cm en: lactantes, > 65 años, localización facial, diabéticos, inmunosupresión, celulitis perilesional2. Impétigo, ectima, celulitis, foliculitis, paroniquia… | Oral:Adultos 450-600mg/díaNiños>5 años: 10-20mg/kg/día en 1-2 tomas (máx. 600mg/día) | Hepatotoxicidad, cambios coloración secreciones corporales/orina, múltiples interacciones medicamentosas (inductor citocromo p450) | Efecto sinérgico con otros antimicrobianos. No utilizar en monoterapia (aparición frecuente de cepas resistentes) |
| Daptomicinab | Infecciones complicadas de piel y partes blandas | IV: Adultos 4–6mg/kg/díaAdultos 4-6mg/kg/díaSeguridad y eficacia no establecidas en < 18 años | MiotoxicidadAjuste de dosis en nefropatíaAlteración de parámetros hemostásicos (INR/tiempo de protrombina) | No utilizar si existe riesgo de infección necrotizante pulmonar (acción inhibida por el surfactante pulmonar) |
| Vancomicinab | Infecciones complicadas de piel y partes blandas | IV: Adultos inicial 30–50mg/kg/día; habitual 1g/12h o 500mg/6hAdultos inicial 30-50mg/kg/día; habitual 1g/12h o 500mg/6hNiños > 1 mes 10mg/kg/6h | Nefrotoxicidad. Síndrome del hombre rojo: evitar administración iv rápida (mínimo en 1h) | Monitorizar sus niveles séricos en pacientes con insuficiencia renal o si co-administración con fármacos nefrotóxicos |
| Linezolidb | Infecciones complicadas de piel y partes blandas | Oral e IV:Adultos 600mg/12hNo recomendado en menores de 18 años | Mielosupresión, reacción tiramínica, neuropatía nervio óptico, HTA, hipertransaminasemia | Su elevado coste y efectos secundarios obligan a justificar de forma estricta su uso |
| Quinupristina-dalfopristinab | Infecciones complicadas de piel y partes blandas | Administrar a través de catéter venoso central en glucosa al 5% durante 60min: 7,5mg/kg/8h (no diluir en solución salina) | Alarga intervalo Q-T, hepatotoxicidad, aumento de niveles plasmáticos de fármacos metabolizados por via CYP 3A4 | Solo debería emplearse en caso de fracaso terapéutico con el resto de alternativas disponibles |
IM: intramuscular; IV: intravenosa; HTA: hipertensión arterial.
Dado que esta bacteria produce fundamentalmente infecciones cutáneas no complicadas, el tratamiento de los pacientes no suele requerir ingreso hospitalario. Sin embargo, se han descrito casos de artritis séptica, piomiositis, fascitis20 o neumonía necrotizante21. Esta última debe considerarse en aquellos pacientes que presenten infecciones cutáneas no complicadas y un cuadro previo o simultáneo de infección respiratoria22. En estos casos se asociará siempre tratamiento antimicrobiano y se realizará observación clínica estrecha.
La determinación del estado de portador en el exudado nasal no se recomienda de forma rutinaria16. La colonización nasal suele ser baja en pacientes que presentan lesiones no asociadas a brotes comunitarios (la mayor parte en nuestro medio) y puede encontrarse en otras localizaciones como el área inguinoperineal, los pliegues axilares, el recto o la faringe23. No existe consenso sobre las medidas a realizar para lograr la descolonización por este germen24. Se ha propuesto la práctica de duchas con soluciones jabonosas antisépticas (clorhexidina o povidona iodada, aunque el uso de esta última está limitado por teñir la superficie cutánea y por el riesgo de sensibilización o irritación local25), el uso de antibióticos tópicos intranasales (mupirocina) y sistémicos (cotrimoxazol)26,27, con resultados variables.
ConclusionesLas infecciones no complicadas de piel y partes blandas suponen uno de los principales motivos de consulta en los servicios de urgencias hospitalarias y en la práctica dermatológica diaria. Durante los últimos años estamos asistiendo a un cambio en la epidemiología de las mismas, con la aparición de gérmenes hasta ahora considerados exclusivos del ámbito nosocomial. El SARM-CO representa un paradigma en la práctica dermatológica, puesto que su diana patogénica principal son la piel y los anejos cutáneos. La toma de muestras para cultivo y el estudio por antibiograma continúan siendo el patrón de oro en su diagnóstico. Sin embargo, mientras se obtienen los resultados del estudio microbiológico, creemos que resulta fundamental individualizar el tratamiento antibiótico empírico inicial, con la inclusión de este germen dentro del espectro bacteriano a cubrir.
Aunque el reducido número de casos incluido y el carácter retrospectivo de nuestro estudio no permite generalizar los resultados obtenidos, en los pacientes jóvenes, sanos, que presenten abscesos cutáneos con importante componente necrótico y escaso exudado purulento, asociados o no celulitis, deberá evitarse el uso de antibióticos betalactámicos como medida terapéutica inicial. Igualmente, ante los casos de infecciones cutáneas de repetición, los brotes familiares de abscesos, foliculitis y forúnculos, o el fracaso terapéutico tras uno o varios ciclos de antibióticos betalactámicos, debemos considerar al SARM-CO como posible agente etiológico.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.