Los pacientes con melanoma cutáneo portadores de polimorfismos en MC1R presentan unas características clínicas distintivas. El objetivo de este estudio ha sido caracterizar desde el punto de vista clínico las diferencias en el grado de afectación funcional del receptor debidas al número y tipo (R y r) de los polimorfismos del gen MC1R de los pacientes.
Material y métodosSe seleccionaron 1.044 pacientes con melanoma diagnosticados en nuestro centro de forma consecutiva desde enero del año 2000 a partir de la base de datos de melanoma. Se clasificaron en 3 grupos según una puntuación asociada a los polimorfismos no sinónimos del gen MC1R y se compararon las frecuencias observadas de cada una de las variables epidemiológicas, fenotípicas, histológicas y los antecedentes personales y familiares de cáncer.
ResultadosSe observó que el desarrollo de melanoma antes de los 50 años (OR=1,47), la localización en la cabeza y el cuello (OR=3,04), poseer antecedentes de carcinoma basocelular y de carcinoma epidermoide cutáneo (OR=1,70) y la presencia de nevus atípicos (OR=1,74) y nevus asociados al melanoma (OR=1,87) es predominantemente característico de pacientes con puntuación igual o mayor que 3.
ConclusionesEl sistema de puntuación aplicado a los polimorfismos en MC1R nos ha permitido detectar relaciones en las que algunas características clínicas del paciente y de la presentación del melanoma presentan un efecto proporcional al grado de afectación funcional de la vía de la melanogénesis.
Patients with cutaneous melanoma who are carriers of polymorphisms in the melanocortin 1 receptor gene (MC1R) have distinctive clinical characteristics. The objective of this study was to determine the clinical characteristics associated with differing degrees of functional impairment of the melanocortin 1 receptor, as determined by the number and type (R and r) of MC1R polymorphisms.
Material and methodsIn total, 1044 consecutive patients with melanoma diagnosed in our hospital after January 2000 were selected from the melanoma database. These patients were divided into 3 groups according to a score based on nonsynonymous MC1R polymorphisms. The frequencies of epidemiologic, phenotypic, and histologic variables and personal and family history of cancer were compared.
ResultsPatients with a score of 3 or more were more likely to develop melanoma before the age of 50 years (odds ratio [OR]=1.47), have a tumor on the head or neck (OR=3.04), have a history of basal cell carcinoma or cutaneous squamous cell carcinoma (OR=1.70), have atypical nevi (OR=1.74), and have nevi associated with the melanoma (OR=1.87).
ConclusionsThe use of a scoring system for MC1R polymorphisms allowed us to identify associations between the degree of functional impairment of the melanogenesis pathway and the clinical characteristics of the patients and melanoma presentation.
El melanoma cutáneo (CM) es un tumor maligno de los melanocitos, con una etiología heterogénea y compleja, que causa la mayoría de las muertes relacionadas con el cáncer de piel1. El factor de riesgo medioambiental más importante para el cáncer cutáneo, tanto melanocítico como no melanocítico, es la exposición a la radiación ultravioleta (RUV). La pigmentación cutánea, que ejerce una función protectora frente al daño producido por la exposición solar y frente a la fotocarcinogénesis, depende de las características de la melanina producida en los melanocitos. La producción de la melanina está asociada a una genética compleja con más de 120 genes implicados en su regulación, entre los que destaca el gen del receptor 1 de la melanocortina (MC1R; MIM N.o 155555; GenBank genomic reference sequence NC_000016.8) cuyas variantes están estrechamente ligadas al riesgo de desarrollar la enfermedad2,3.
El gen MC1R está localizado en una terminación telomérica del cromosoma 16q24.3 y codifica para el receptor 1 de la melanocortina (MC1R) acoplado a la proteína G (GPCR), que está formado por 7 dominios transmembrana. En respuesta a la RUV se secretan la hormona estimulante de los melanocitos α (α-MSH) y la hormona adrenocorticotropa (ACTH), péptidos derivados de la proopiomelanocortina (POMC), que estimulan la expresión del receptor por los melanocitos de la piel, lo que activa la adenilato ciclasa. El aumento de los niveles de AMP cíclico (AMPc) activan la proteína cinasa A y aumenta la transcripción de microphthalmia transcription factor (MITF), que incrementa la transcripción de diversos genes, incluidos TYR y TYRP1, que participan en la regulación de la síntesis de eumelanina y feomelanina, determinante de la pigmentación de la piel, el fototipo y el riesgo de padecer cáncer de piel2,4. En el gen MC1R humano, altamente polimórfico, se han identificado más de 100 variaciones, en gran parte no sinónimas5. En combinación con una elevada exposición solar, las variantes MC1R asociadas a características pigmentarias del fenotipo RHC (del inglés red hair color, es decir, pelo pelirrojo y que también asocia pigmentación cutánea clara, elevada tendencia a quemarse tras la exposición solar, baja capacidad de bronceado y presencia de numerosos nevus melanocíticos o displásicos) y, en menor medida, las variantes no asociadas al fenotipo RHC, que se caracterizan por una proporción de eumelanina/feomelanina baja, se consideran factores genéticos de riesgo para el desarrollo de melanoma, un hecho que también ha sido demostrado en nuestro medio2,4,6,7.
Funcionalmente el MC1R en los queratinocitos participa en la reducción del estrés oxidativo inducido por RUV; en los melanocitos α-MSH se une al receptor modulando las respuestas inflamatorias cutáneas y algunos estudios sugieren que mediante la inhibición de la expresión de syndecan-2, un proteoglucano heparán sulfato de la superficie celular, el receptor regula la migración celular en el desarrollo de melanoma8,9. Sin embargo, las consecuencias de las mutaciones en la función fisiológica de MC1R no han sido completamente identificadas. Algunos análisis revelan una estimulación ineficiente de la ruta del AMPc. Los distintos polimorfismos provocan un impacto diferente en la señalización a través de MITF y la baja actividad TYR que resulta en una síntesis de feomelanina, responsable del fenotipo RHC7. MITF es considerado un potencial marcador biológico para el melanoma y, tras el tratamiento, permite determinar la posibilidad de recaída y la supervivencia en general10–12. Recientemente se ha postulado que las células implicadas en el melanoma portadoras de variaciones en MC1R podrían tener una menor resistencia a la apoptosis y a la proliferación sostenida. Una peor reparación del ADN en los pacientes puede implicar un mejor pronóstico y, por lo tanto, una mayor supervivencia13.
Hasta la fecha, las características pigmentarias de la piel, el pelo y los ojos sirven como marcador fenotípico de la capacidad fotoprotectora de la melanina frente a la RUV, y para la determinación del riesgo individual de padecer cáncer de piel. No obstante, los avances en sustituir la información subjetiva del fenotipo pigmentario por información genotípica de la síntesis de melanina permiten una evaluación más directa y precisa de dicho riesgo4.
El objetivo de este estudio es identificar las características epidemiológicas, fenotípicas e histológicas que tienen los pacientes con melanoma clasificados según el número de polimorfismos en MC1R, empleando un método ya aplicado en otras publicaciones de cálculo de puntuación genética14. Este abordaje permite discriminar con una mayor fiabilidad entre grupos de pacientes según el grado de afectación funcional del receptor relacionado con el número y tipo (R y r) de los polimorfismos presentes en el gen MC1R.
Pacientes y métodosSe diseñó un estudio observacional retrospectivo a partir de los datos incluidos en la base de datos de melanoma cutáneo del Servicio de Dermatología del Instituto Valenciano de Oncología.
Los datos y muestras se introdujeron de forma sucesiva en la base de datos para los pacientes que visitaron el centro entre el 1 de enero de 2000 y el 22 de mayo de 2012. Los datos se introdujeron tanto para pacientes recientemente diagnosticados de melanoma, casos incidentes, como para los pacientes que acudían para las visitas de seguimiento. Esta base de datos incluye los datos clínicos, epidemiológicos e histopatológicos de los pacientes con melanoma que se recogen de forma prospectiva durante la primera visita en la consulta de dermatología, realizada por dermatólogos expertos en el seguimiento de pacientes con melanoma15.
Para el estudio se seleccionaron únicamente aquellos pacientes diagnosticados de melanoma cutáneo a partir del 1 de enero de 2000, dado que es el momento en que se inició la base de datos, y por ello solo se seleccionaron pacientes incidentes, en los que los datos se han introducido desde entonces de manera prospectiva. Se excluyeron aquellos pacientes con melanoma mucoso o melanoma metastásico de tumor primario desconocido, y aquellos pacientes en los que no se ha analizado la presencia o ausencia de polimorfismos en MC1R.
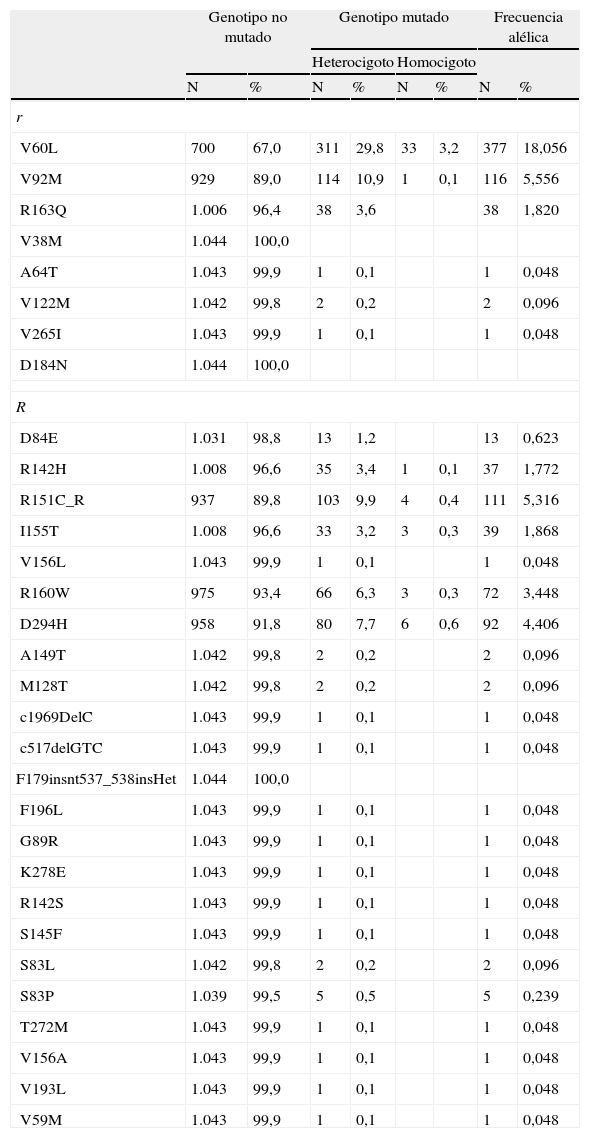
Se definió como variable independiente el genotipo MC1R. Puesto que las variantes de MC1R son numerosas, el enfoque analítico se abordó cuidadosamente mediante el sistema de clasificación previamente publicado y ampliamente adoptado que emplea la nomenclatura «r» y «R» descrita por primera vez por Duffy14. Los alelos «R» hacen referencia a variantes alélicas de MC1R fuertemente asociadas con el fenotipo RHC y los alelos «r» a variantes alélicas de MC1R débilmente asociadas con el fenotipo RHC. La tabla 1 muestra la clasificación «R» y «r» de los polimorfismos MC1R que se detectaron en los pacientes de la base de datos en función de la información previamente publicada13,16. El análisis de las mutaciones en MC1R incluyó aquellas variaciones no sinónimas (causan cambios aminoacídicos) que se han visto previamente asociadas con el melanoma, mientras que las variaciones sinónimas (se encuentran en las regiones codificantes, pero no causan cambios aminoacídicos) se consideraron alelos MC1R con la secuencia consenso.
Clasificación de los polimorfismos en MC1R y distribución de sus frecuencias en la población estudiada
| Genotipo no mutado | Genotipo mutado | Frecuencia alélica | ||||||
| Heterocigoto | Homocigoto | |||||||
| N | % | N | % | N | % | N | % | |
| r | ||||||||
| V60L | 700 | 67,0 | 311 | 29,8 | 33 | 3,2 | 377 | 18,056 |
| V92M | 929 | 89,0 | 114 | 10,9 | 1 | 0,1 | 116 | 5,556 |
| R163Q | 1.006 | 96,4 | 38 | 3,6 | 38 | 1,820 | ||
| V38M | 1.044 | 100,0 | ||||||
| A64T | 1.043 | 99,9 | 1 | 0,1 | 1 | 0,048 | ||
| V122M | 1.042 | 99,8 | 2 | 0,2 | 2 | 0,096 | ||
| V265I | 1.043 | 99,9 | 1 | 0,1 | 1 | 0,048 | ||
| D184N | 1.044 | 100,0 | ||||||
| R | ||||||||
| D84E | 1.031 | 98,8 | 13 | 1,2 | 13 | 0,623 | ||
| R142H | 1.008 | 96,6 | 35 | 3,4 | 1 | 0,1 | 37 | 1,772 |
| R151C_R | 937 | 89,8 | 103 | 9,9 | 4 | 0,4 | 111 | 5,316 |
| I155T | 1.008 | 96,6 | 33 | 3,2 | 3 | 0,3 | 39 | 1,868 |
| V156L | 1.043 | 99,9 | 1 | 0,1 | 1 | 0,048 | ||
| R160W | 975 | 93,4 | 66 | 6,3 | 3 | 0,3 | 72 | 3,448 |
| D294H | 958 | 91,8 | 80 | 7,7 | 6 | 0,6 | 92 | 4,406 |
| A149T | 1.042 | 99,8 | 2 | 0,2 | 2 | 0,096 | ||
| M128T | 1.042 | 99,8 | 2 | 0,2 | 2 | 0,096 | ||
| c1969DelC | 1.043 | 99,9 | 1 | 0,1 | 1 | 0,048 | ||
| c517delGTC | 1.043 | 99,9 | 1 | 0,1 | 1 | 0,048 | ||
| F179insnt537_538insHet | 1.044 | 100,0 | ||||||
| F196L | 1.043 | 99,9 | 1 | 0,1 | 1 | 0,048 | ||
| G89R | 1.043 | 99,9 | 1 | 0,1 | 1 | 0,048 | ||
| K278E | 1.043 | 99,9 | 1 | 0,1 | 1 | 0,048 | ||
| R142S | 1.043 | 99,9 | 1 | 0,1 | 1 | 0,048 | ||
| S145F | 1.043 | 99,9 | 1 | 0,1 | 1 | 0,048 | ||
| S83L | 1.042 | 99,8 | 2 | 0,2 | 2 | 0,096 | ||
| S83P | 1.039 | 99,5 | 5 | 0,5 | 5 | 0,239 | ||
| T272M | 1.043 | 99,9 | 1 | 0,1 | 1 | 0,048 | ||
| V156A | 1.043 | 99,9 | 1 | 0,1 | 1 | 0,048 | ||
| V193L | 1.043 | 99,9 | 1 | 0,1 | 1 | 0,048 | ||
| V59M | 1.043 | 99,9 | 1 | 0,1 | 1 | 0,048 | ||
Siguiendo el procedimiento descrito por John Davies la clasificación se traduce en una puntuación numérica con un rango de 0 a 4 mediante la suma de los 2 alelos, dando un valor de 1 a los polimorfismos «r» y de 2 a los polimorfismos «R». La puntuación de aquellos pacientes con 2 copias de la secuencia consenso será 0, mientras que la de los pacientes con 2 polimorfismos «R» será 413. En el presente trabajo en aquellos pacientes portadores de más de 2 polimorfismos en MC1R y con puntuaciones superiores a 4, la puntuación se consideró 4. Así, los pacientes se distribuyeron en 3 grupos en función de la puntuación obtenida a partir del genotipo MC1R: «puntuación 0»’ (-/-, r/-), «puntuación 1-2» (r/r, R/-) y «puntuación 3-4» (R/r, R/R y los casos con más de 2 polimorfismos).
Para el análisis comparativo de las características de cada paciente según la puntuación del análisis del genotipo MC1R se consideraron las siguientes variables:
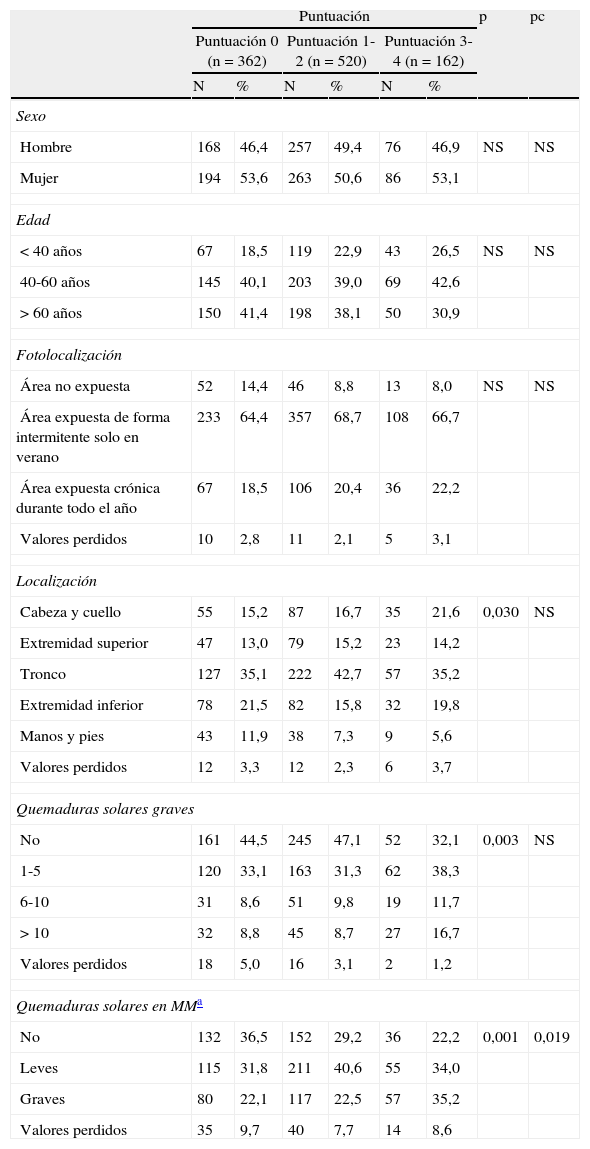
Epidemiológicas: sexo, edad al diagnóstico (<40 años, 40-60 años, >60 años), fotolocalización (área no expuesta, área expuesta de forma intermitente solo en verano, área expuesta crónica durante todo el año) y localización del tumor primario (cabeza/cuello, extremidad superior, tronco, extremidad inferior, mano/pie), número de quemaduras graves a lo largo de toda la vida (definidas como aquellas que producen ampollas o dolor cutáneo de al menos 48h y categorizadas en 0, 1-5, 6-10 y >10), antecedentes de quemaduras en la localización del melanoma (no, leves, intensas).
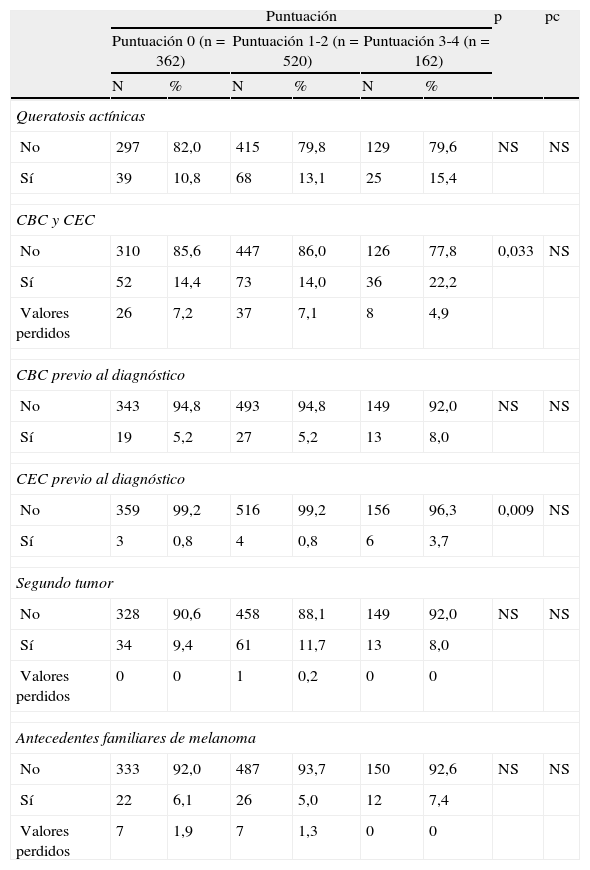
Antecedentes personales y familiares de cáncer: presencia de queratosis actínicas, historia personal de cáncer cutáneo de estirpe epitelial (carcinoma basocelular o epidermoide) y de otras neoplasias no cutáneas, antecedentes familiares en primer grado de melanoma.
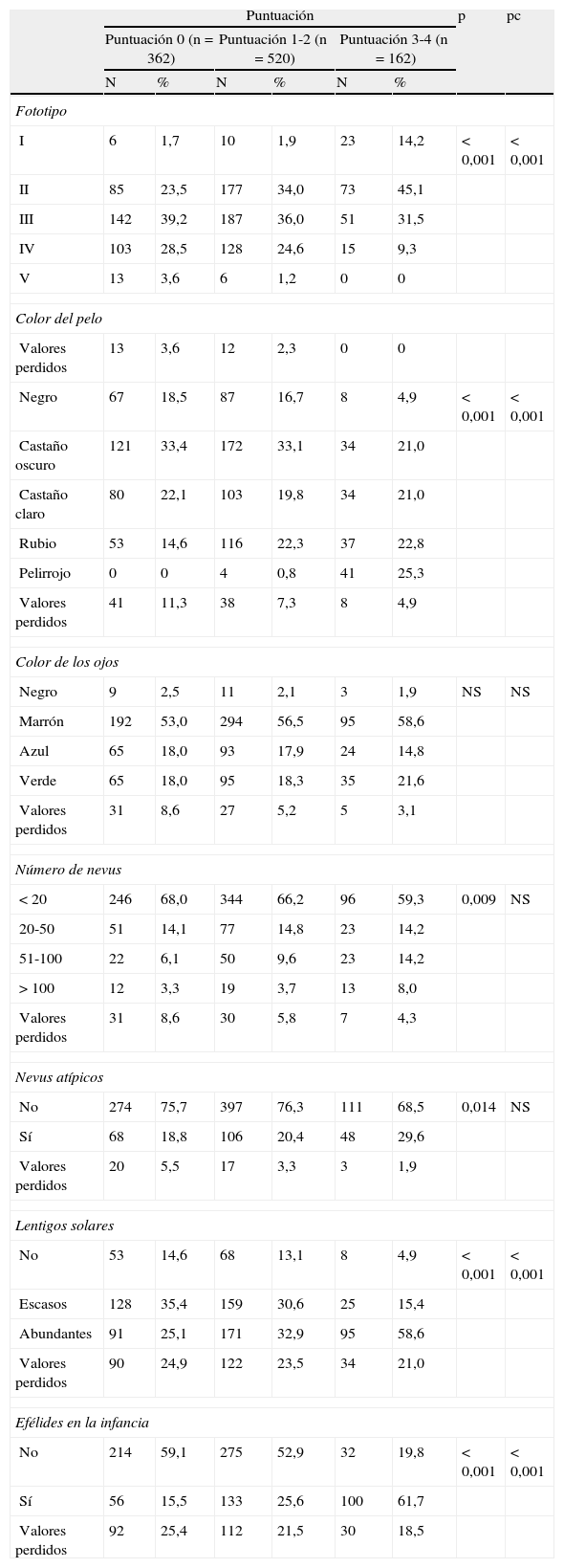
Fenotipo: fototipo cutáneo según la clasificación establecida por Fitzpatrick (I, II, III, IV, V), color del pelo (negro, castaño oscuro, castaño claro, rubio, pelirrojo), color de los ojos (negro, marrón, azul, verde), número de nevus (<20, 20-50, 51-100 y >100), presencia de algún nevus clínicamente atípico17, presencia de lentigos solares (no, escasos, abundantes) y presencia de efélides en la infancia.
Datos histológicos: tipo histológico (lentigo maligno melanoma, melanoma de extensión superficial, melanoma nodular, melanoma lentiginoso acral, u otros/sin especificar), el espesor tumoral de Breslow (<1mm, 1,01-2,00mm, 2,01-4,00mm, >4mm), evidencia histológica de ulceración, presencia de restos de nevus melanocítico preexistente en la pieza tumoral, presencia de elastosis solar, detección de metástasis en el ganglio centinela y presencia de satelitosis microscópica.
La secuenciación genómica del ADN del MC1R se obtuvo mediante reacción en cadena de la polimerasa, a partir de 2 pares de cebadores para la región codificante del MC1R (16q24.3), tomados de linfocitos de muestras de sangre periférica obtenidas del paciente durante la primera visita tras el diagnóstico. El análisis secuencial fue realizado mediante el sistema ABI Prism (Applied Biosystems, Foster city, CA) utilizando el kit Big Dye Terminator Cycle y el secuenciador automatizado ABI 3700, según las instrucciones del fabricante.
Las diferencias de las distribuciones de cada variable en cada una de las categorías fueron evaluadas mediante la prueba de Chi cuadrado de Pearson, que determina si existe asociación entre variables cualitativas. El nivel de significación estadística se estableció en p<0,05 y se aplicó la corrección de Bonferroni como método de ajuste para comparaciones múltiples.
En las variables cualitativas ordinales —edad, fototipo, número de nevus y efélides— se analizó el grado de correlación mediante la prueba de Spearman. Con el fin de evaluar las asociaciones entre los genotipos, las características de los pacientes y el riesgo de melanoma se llevó a cabo una regresión de extremos, un análisis en el que se estudió el grupo de pacientes con ausencia total de polimorfismos MC1R «puntuación 0» frente al grupo de pacientes con 3 o más polimorfismos MC1R «puntuación 3-4». Mediante regresión logística binaria se obtuvieron las odds ratio (OR) relacionadas con el genotipo, sus correspondientes intervalos de confianza (IC) del 95% y los valores de p asociados de aquellas variables que resultaron significativas antes de la prueba de Bonferroni y de aquellas que, aunque no fueron significativas en la prueba de Chi cuadrado, permitieron intuir cierta conexión con el genotipo. Finalmente, la prueba de la U de Mann-Whitney se empleó para estudiar la relación entre la puntuación genética del gen MC1R y el número de melanomas desarrollados por paciente. El estudio estadístico se realizó con el paquete estadístico incluido en el programa SPSS, versión 15.0. (SPSS Inc. Chicago, IL, EE. UU.).
ResultadosDe los 1.337 pacientes de la base de datos incluidos durante el periodo de selección se excluyeron 293 (21,9%) pacientes cuyos polimorfismos MC1R no habían sido analizados. La muestra final sobre la que se realizó el estudio estuvo constituida por un grupo de 1.044 pacientes con melanoma cutáneo (78,1% del total de pacientes elegibles). El grupo de pacientes incluía 543 mujeres (52,1%) y 501 hombres (47,9%), con una edad mediana al diagnóstico de 55 años (intervalo intercuartílico de 42-67 años). La localización predominante fue el tronco (406 pacientes, 38,8%), seguida de las extremidades inferiores (192 pacientes, 18,4%), la cabeza y el cuello (177 pacientes, 16,9%), las extremidades superiores (149 pacientes, 14,3%) y las regiones acrales (90 pacientes, 8,6%). De los 1.044 pacientes incluidos en el estudio se excluyeron 29 (2,77%) pacientes con melanomas con localizaciones distintas a las citadas anteriormente. El melanoma se había desarrollado sobre un área de piel expuesta al sol durante todo el año en 209 casos (20%), se encontraba en un área expuesta de forma intermitente solo en verano en 698 casos (66,8%), y estaba en un área no expuesta a la radiación solar en 111 casos (10,6%). La mayoría de los pacientes tenían una puntuación 1-2 (520 pacientes; 49,8%), seguido por la puntuación 0, que hace referencia a la ausencia de polimorfismos MC1R (362 pacientes; 34,7%) y por los 162 pacientes (15,5%) que constituyen el grupo con puntuación 3-4.
Los resultados del análisis de Chi cuadrado y la corrección de Bonferroni, que hacen referencia a las diferencias encontradas entre los 3 grupos definidos por la puntuación, se encuentran detallados en las tablas 2–5.
Características epidemiológicas
| Puntuación | p | pc | ||||||
| Puntuación 0 (n=362) | Puntuación 1-2 (n=520) | Puntuación 3-4 (n=162) | ||||||
| N | % | N | % | N | % | |||
| Sexo | ||||||||
| Hombre | 168 | 46,4 | 257 | 49,4 | 76 | 46,9 | NS | NS |
| Mujer | 194 | 53,6 | 263 | 50,6 | 86 | 53,1 | ||
| Edad | ||||||||
| <40 años | 67 | 18,5 | 119 | 22,9 | 43 | 26,5 | NS | NS |
| 40-60 años | 145 | 40,1 | 203 | 39,0 | 69 | 42,6 | ||
| >60 años | 150 | 41,4 | 198 | 38,1 | 50 | 30,9 | ||
| Fotolocalización | ||||||||
| Área no expuesta | 52 | 14,4 | 46 | 8,8 | 13 | 8,0 | NS | NS |
| Área expuesta de forma intermitente solo en verano | 233 | 64,4 | 357 | 68,7 | 108 | 66,7 | ||
| Área expuesta crónica durante todo el año | 67 | 18,5 | 106 | 20,4 | 36 | 22,2 | ||
| Valores perdidos | 10 | 2,8 | 11 | 2,1 | 5 | 3,1 | ||
| Localización | ||||||||
| Cabeza y cuello | 55 | 15,2 | 87 | 16,7 | 35 | 21,6 | 0,030 | NS |
| Extremidad superior | 47 | 13,0 | 79 | 15,2 | 23 | 14,2 | ||
| Tronco | 127 | 35,1 | 222 | 42,7 | 57 | 35,2 | ||
| Extremidad inferior | 78 | 21,5 | 82 | 15,8 | 32 | 19,8 | ||
| Manos y pies | 43 | 11,9 | 38 | 7,3 | 9 | 5,6 | ||
| Valores perdidos | 12 | 3,3 | 12 | 2,3 | 6 | 3,7 | ||
| Quemaduras solares graves | ||||||||
| No | 161 | 44,5 | 245 | 47,1 | 52 | 32,1 | 0,003 | NS |
| 1-5 | 120 | 33,1 | 163 | 31,3 | 62 | 38,3 | ||
| 6-10 | 31 | 8,6 | 51 | 9,8 | 19 | 11,7 | ||
| >10 | 32 | 8,8 | 45 | 8,7 | 27 | 16,7 | ||
| Valores perdidos | 18 | 5,0 | 16 | 3,1 | 2 | 1,2 | ||
| Quemaduras solares en MMa | ||||||||
| No | 132 | 36,5 | 152 | 29,2 | 36 | 22,2 | 0,001 | 0,019 |
| Leves | 115 | 31,8 | 211 | 40,6 | 55 | 34,0 | ||
| Graves | 80 | 22,1 | 117 | 22,5 | 57 | 35,2 | ||
| Valores perdidos | 35 | 9,7 | 40 | 7,7 | 14 | 8,6 | ||
NS: no significativo; pc: valor de la p tras la corrección de Bonferroni para comparaciones múltiples.
Antecedentes personales o familiares de otros cánceres cutáneos o no cutáneos
| Puntuación | p | pc | ||||||
| Puntuación 0 (n=362) | Puntuación 1-2 (n=520) | Puntuación 3-4 (n=162) | ||||||
| N | % | N | % | N | % | |||
| Queratosis actínicas | ||||||||
| No | 297 | 82,0 | 415 | 79,8 | 129 | 79,6 | NS | NS |
| Sí | 39 | 10,8 | 68 | 13,1 | 25 | 15,4 | ||
| CBC y CEC | ||||||||
| No | 310 | 85,6 | 447 | 86,0 | 126 | 77,8 | 0,033 | NS |
| Sí | 52 | 14,4 | 73 | 14,0 | 36 | 22,2 | ||
| Valores perdidos | 26 | 7,2 | 37 | 7,1 | 8 | 4,9 | ||
| CBC previo al diagnóstico | ||||||||
| No | 343 | 94,8 | 493 | 94,8 | 149 | 92,0 | NS | NS |
| Sí | 19 | 5,2 | 27 | 5,2 | 13 | 8,0 | ||
| CEC previo al diagnóstico | ||||||||
| No | 359 | 99,2 | 516 | 99,2 | 156 | 96,3 | 0,009 | NS |
| Sí | 3 | 0,8 | 4 | 0,8 | 6 | 3,7 | ||
| Segundo tumor | ||||||||
| No | 328 | 90,6 | 458 | 88,1 | 149 | 92,0 | NS | NS |
| Sí | 34 | 9,4 | 61 | 11,7 | 13 | 8,0 | ||
| Valores perdidos | 0 | 0 | 1 | 0,2 | 0 | 0 | ||
| Antecedentes familiares de melanoma | ||||||||
| No | 333 | 92,0 | 487 | 93,7 | 150 | 92,6 | NS | NS |
| Sí | 22 | 6,1 | 26 | 5,0 | 12 | 7,4 | ||
| Valores perdidos | 7 | 1,9 | 7 | 1,3 | 0 | 0 | ||
CBC: carcinoma basocelular; CEC: carcinoma epidermoide cutáneo; NS: no significativo; pc: valor de la p tras la corrección de Bonferroni para comparaciones múltiples.
Características fenotípicas
| Puntuación | p | pc | ||||||
| Puntuación 0 (n=362) | Puntuación 1-2 (n=520) | Puntuación 3-4 (n=162) | ||||||
| N | % | N | % | N | % | |||
| Fototipo | ||||||||
| I | 6 | 1,7 | 10 | 1,9 | 23 | 14,2 | <0,001 | <0,001 |
| II | 85 | 23,5 | 177 | 34,0 | 73 | 45,1 | ||
| III | 142 | 39,2 | 187 | 36,0 | 51 | 31,5 | ||
| IV | 103 | 28,5 | 128 | 24,6 | 15 | 9,3 | ||
| V | 13 | 3,6 | 6 | 1,2 | 0 | 0 | ||
| Color del pelo | ||||||||
| Valores perdidos | 13 | 3,6 | 12 | 2,3 | 0 | 0 | ||
| Negro | 67 | 18,5 | 87 | 16,7 | 8 | 4,9 | <0,001 | <0,001 |
| Castaño oscuro | 121 | 33,4 | 172 | 33,1 | 34 | 21,0 | ||
| Castaño claro | 80 | 22,1 | 103 | 19,8 | 34 | 21,0 | ||
| Rubio | 53 | 14,6 | 116 | 22,3 | 37 | 22,8 | ||
| Pelirrojo | 0 | 0 | 4 | 0,8 | 41 | 25,3 | ||
| Valores perdidos | 41 | 11,3 | 38 | 7,3 | 8 | 4,9 | ||
| Color de los ojos | ||||||||
| Negro | 9 | 2,5 | 11 | 2,1 | 3 | 1,9 | NS | NS |
| Marrón | 192 | 53,0 | 294 | 56,5 | 95 | 58,6 | ||
| Azul | 65 | 18,0 | 93 | 17,9 | 24 | 14,8 | ||
| Verde | 65 | 18,0 | 95 | 18,3 | 35 | 21,6 | ||
| Valores perdidos | 31 | 8,6 | 27 | 5,2 | 5 | 3,1 | ||
| Número de nevus | ||||||||
| <20 | 246 | 68,0 | 344 | 66,2 | 96 | 59,3 | 0,009 | NS |
| 20-50 | 51 | 14,1 | 77 | 14,8 | 23 | 14,2 | ||
| 51-100 | 22 | 6,1 | 50 | 9,6 | 23 | 14,2 | ||
| >100 | 12 | 3,3 | 19 | 3,7 | 13 | 8,0 | ||
| Valores perdidos | 31 | 8,6 | 30 | 5,8 | 7 | 4,3 | ||
| Nevus atípicos | ||||||||
| No | 274 | 75,7 | 397 | 76,3 | 111 | 68,5 | 0,014 | NS |
| Sí | 68 | 18,8 | 106 | 20,4 | 48 | 29,6 | ||
| Valores perdidos | 20 | 5,5 | 17 | 3,3 | 3 | 1,9 | ||
| Lentigos solares | ||||||||
| No | 53 | 14,6 | 68 | 13,1 | 8 | 4,9 | <0,001 | <0,001 |
| Escasos | 128 | 35,4 | 159 | 30,6 | 25 | 15,4 | ||
| Abundantes | 91 | 25,1 | 171 | 32,9 | 95 | 58,6 | ||
| Valores perdidos | 90 | 24,9 | 122 | 23,5 | 34 | 21,0 | ||
| Efélides en la infancia | ||||||||
| No | 214 | 59,1 | 275 | 52,9 | 32 | 19,8 | <0,001 | <0,001 |
| Sí | 56 | 15,5 | 133 | 25,6 | 100 | 61,7 | ||
| Valores perdidos | 92 | 25,4 | 112 | 21,5 | 30 | 18,5 | ||
NS: no significativo; pc: valor de la p tras la corrección de Bonferroni para comparaciones múltiples.
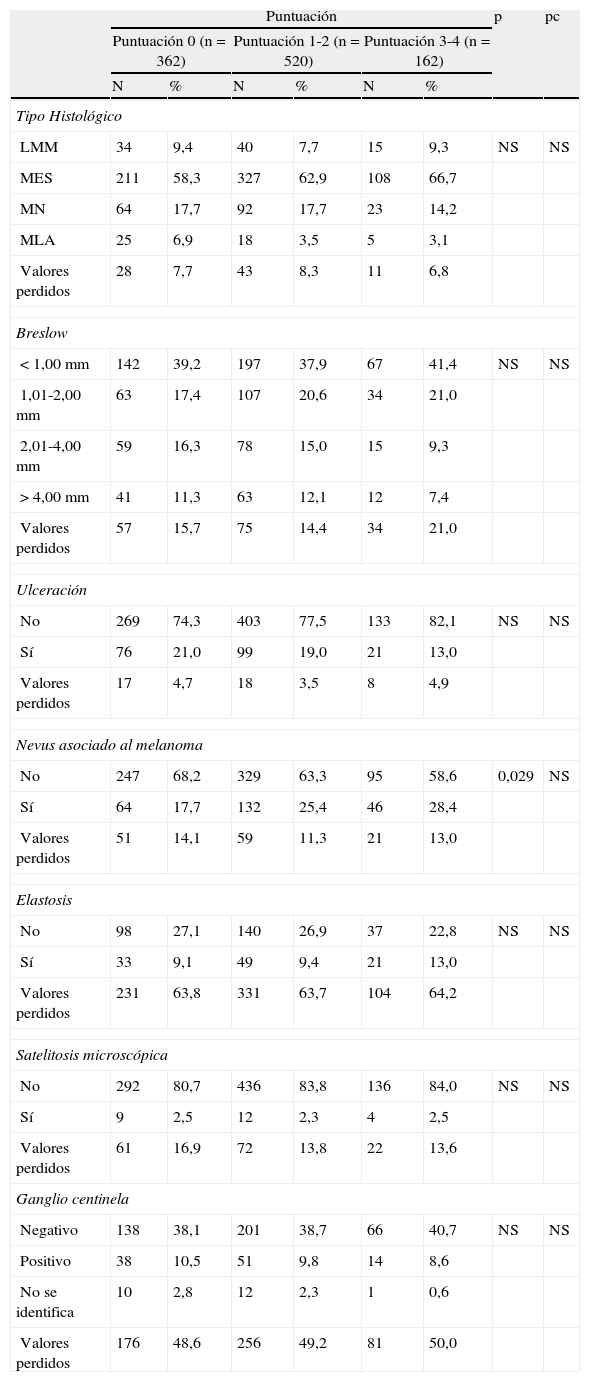
Características histológicas
| Puntuación | p | pc | ||||||
| Puntuación 0 (n=362) | Puntuación 1-2 (n=520) | Puntuación 3-4 (n=162) | ||||||
| N | % | N | % | N | % | |||
| Tipo Histológico | ||||||||
| LMM | 34 | 9,4 | 40 | 7,7 | 15 | 9,3 | NS | NS |
| MES | 211 | 58,3 | 327 | 62,9 | 108 | 66,7 | ||
| MN | 64 | 17,7 | 92 | 17,7 | 23 | 14,2 | ||
| MLA | 25 | 6,9 | 18 | 3,5 | 5 | 3,1 | ||
| Valores perdidos | 28 | 7,7 | 43 | 8,3 | 11 | 6,8 | ||
| Breslow | ||||||||
| <1,00mm | 142 | 39,2 | 197 | 37,9 | 67 | 41,4 | NS | NS |
| 1,01-2,00mm | 63 | 17,4 | 107 | 20,6 | 34 | 21,0 | ||
| 2,01-4,00mm | 59 | 16,3 | 78 | 15,0 | 15 | 9,3 | ||
| >4,00mm | 41 | 11,3 | 63 | 12,1 | 12 | 7,4 | ||
| Valores perdidos | 57 | 15,7 | 75 | 14,4 | 34 | 21,0 | ||
| Ulceración | ||||||||
| No | 269 | 74,3 | 403 | 77,5 | 133 | 82,1 | NS | NS |
| Sí | 76 | 21,0 | 99 | 19,0 | 21 | 13,0 | ||
| Valores perdidos | 17 | 4,7 | 18 | 3,5 | 8 | 4,9 | ||
| Nevus asociado al melanoma | ||||||||
| No | 247 | 68,2 | 329 | 63,3 | 95 | 58,6 | 0,029 | NS |
| Sí | 64 | 17,7 | 132 | 25,4 | 46 | 28,4 | ||
| Valores perdidos | 51 | 14,1 | 59 | 11,3 | 21 | 13,0 | ||
| Elastosis | ||||||||
| No | 98 | 27,1 | 140 | 26,9 | 37 | 22,8 | NS | NS |
| Sí | 33 | 9,1 | 49 | 9,4 | 21 | 13,0 | ||
| Valores perdidos | 231 | 63,8 | 331 | 63,7 | 104 | 64,2 | ||
| Satelitosis microscópica | ||||||||
| No | 292 | 80,7 | 436 | 83,8 | 136 | 84,0 | NS | NS |
| Sí | 9 | 2,5 | 12 | 2,3 | 4 | 2,5 | ||
| Valores perdidos | 61 | 16,9 | 72 | 13,8 | 22 | 13,6 | ||
| Ganglio centinela | ||||||||
| Negativo | 138 | 38,1 | 201 | 38,7 | 66 | 40,7 | NS | NS |
| Positivo | 38 | 10,5 | 51 | 9,8 | 14 | 8,6 | ||
| No se identifica | 10 | 2,8 | 12 | 2,3 | 1 | 0,6 | ||
| Valores perdidos | 176 | 48,6 | 256 | 49,2 | 81 | 50,0 | ||
LMM: melanoma sobre lentigo maligno; MES: melanoma de extensión superficial; MLA: melanoma lentiginoso acral; MN: melanoma nodular; NS: no significativo; pc: valor de la p tras la corrección de Bonferroni para comparaciones múltiples.
En relación con las características epidemiológicas se encontraron diferencias respecto al antecedente de quemaduras solares que hubieran afectado a la zona donde se desarrolló el melanoma. El grupo de puntuación 0 se caracterizó mayoritariamente por la ausencia de las mismas, mientras que los grupos de puntuación 1-2 y puntuación 3-4 por un predominio de quemaduras solares leves y graves, respectivamente (tabla 2). La localización y el número de quemaduras solares graves que ha padecido el paciente presentaron diferencias significativas, aunque este resultado no se mantuvo al aplicar la corrección para comparaciones múltiples. El grupo de puntuación 0 se caracterizó por una mayor frecuencia de pacientes que no habían padecido quemaduras solares graves en general (44,5%) y una localización predominante en el tronco (35,1%) y las extremidades inferiores (21,5%). El grupo de puntuación 1-2, que al igual que el anterior grupo se caracterizó por una mayor frecuencia de pacientes que no habían padecido quemaduras solares graves en general (47,1%), se diferenció de este en una localización predominante en el tronco (42,7%) y la cabeza y el cuello (16,7%). El grupo de puntuación 3-4, que compartió la localización predominante en el tronco y la cabeza y el cuello con el grupo anterior (35,2 y 16,7% respectivamente), se caracterizó por una mayor frecuencia de pacientes que han padecido entre una y 5 quemaduras solares graves en general (38,3%). No hubo diferencia en cuanto al sexo, la fotolocalización, ni la edad en el momento del diagnóstico, aunque se observó una destacable mayor frecuencia de individuos entre 40 y 60 años en el grupo de puntuación 3-4 (42,6%) frente a los individuos menores de 40 años (26,5%) y los mayores de 60 años (30,9%).
Tras la corrección para comparaciones múltiples no se encontraron diferencias estadísticamente significativas entre las frecuencias de queratosis actínicas y de pacientes con antecedentes personales o familiares de otros cánceres cutáneos o no cutáneos (tabla 3).
Respecto a las características fenotípicas que hacen referencia al fototipo, color de pelo y presencia de lentigos y efélides, se observó una tendencia a variar de forma proporcional a la combinación polimórfica definida en los diferentes grupos (tabla 4). Las diferencias en el número de nevus melanocíticos total, al igual que en la presencia de nevus clínicamente atípicos, resultaron estadísticamente significativas tras la prueba de Chi cuadrado de Pearson, pero no superaron la prueba de Bonferroni. No se encontraron diferencias en cuanto al color de los ojos.
Finalmente, entre las características histológicas (tabla 5) tan solo presentó diferencias la presencia de nevus melanocíticos preexistentes asociados al melanoma, pese a que no se mantuvo tras la corrección para comparaciones múltiples.
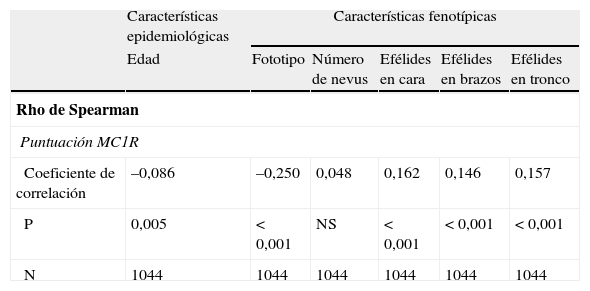
Como refleja la tabla 6, mediante el test de correlación de Spearman se obtuvo una correlación bilateral significativa pero débil entre la puntuación numérica de MC1R con la edad en la que se diagnosticó el melanoma, con el fototipo y con la presencia de efélides en la cara, los brazos y el tronco.
Test de correlación de Spearman
| Características epidemiológicas | Características fenotípicas | |||||
| Edad | Fototipo | Número de nevus | Efélides en cara | Efélides en brazos | Efélides en tronco | |
| Rho de Spearman | ||||||
| Puntuación MC1R | ||||||
| Coeficiente de correlación | –0,086 | –0,250 | 0,048 | 0,162 | 0,146 | 0,157 |
| P | 0,005 | <0,001 | NS | <0,001 | <0,001 | <0,001 |
| N | 1044 | 1044 | 1044 | 1044 | 1044 | 1044 |
NS: no significativo.
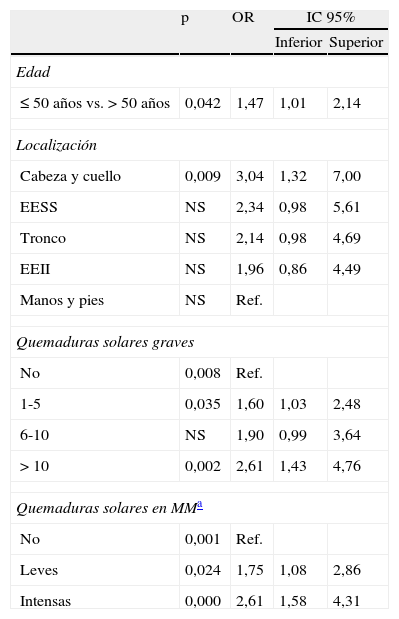
De manera significativa, la regresión logística binaria de extremos determinó que frente a la ausencia de polimorfismos en MC1R (puntuación 0) en los pacientes de melanoma la presencia de una puntuación numérica igual o mayor de 3 en MC1R en los pacientes se puede asociar con el desarrollo de melanoma antes de los 50 años (OR=1,47), a una localización predominante en la cabeza y el cuello frente a las zonas acrales (OR=3,04), a haber desarrollado entre 1 y 5, y más de 10 quemaduras solares graves en el cuerpo en general (OR=1,60 y OR=2,61 respectivamente) y a haber sufrido quemaduras solares leves e intensas en la zona de desarrollo del melanoma (OR=1,75 y OR=2,61 respectivamente) (tabla 7).
Regresión logística binaria aplicada a las características epidemiológicas (variable dependiente: puntuación≥3)
| p | OR | IC 95% | ||
| Inferior | Superior | |||
| Edad | ||||
| ≤50 años vs. >50 años | 0,042 | 1,47 | 1,01 | 2,14 |
| Localización | ||||
| Cabeza y cuello | 0,009 | 3,04 | 1,32 | 7,00 |
| EESS | NS | 2,34 | 0,98 | 5,61 |
| Tronco | NS | 2,14 | 0,98 | 4,69 |
| EEII | NS | 1,96 | 0,86 | 4,49 |
| Manos y pies | NS | Ref. | ||
| Quemaduras solares graves | ||||
| No | 0,008 | Ref. | ||
| 1-5 | 0,035 | 1,60 | 1,03 | 2,48 |
| 6-10 | NS | 1,90 | 0,99 | 3,64 |
| >10 | 0,002 | 2,61 | 1,43 | 4,76 |
| Quemaduras solares en MMa | ||||
| No | 0,001 | Ref. | ||
| Leves | 0,024 | 1,75 | 1,08 | 2,86 |
| Intensas | 0,000 | 2,61 | 1,58 | 4,31 |
NS: no significativo; Ref.: categoría de referencia.
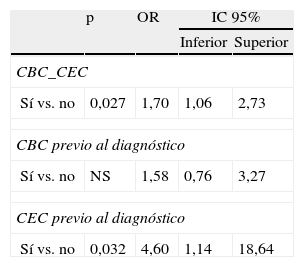
Así mismo, poseer antecedentes de otros cánceres como el carcinoma basocelular (CBC) y el carcinoma epidermoide cutáneo (CEC) puede vincularse a la presencia de 3 o más de los citados polimorfismos en el genotipo del paciente (OR=1,70) (tabla 8).
Regresión logística binaria aplicada a los antecedentes personales o familiares de otros cánceres cutáneos o no cutáneos (variable dependiente: puntuación≥3)
| p | OR | IC 95% | ||
| Inferior | Superior | |||
| CBC_CEC | ||||
| Sí vs. no | 0,027 | 1,70 | 1,06 | 2,73 |
| CBC previo al diagnóstico | ||||
| Sí vs. no | NS | 1,58 | 0,76 | 3,27 |
| CEC previo al diagnóstico | ||||
| Sí vs. no | 0,032 | 4,60 | 1,14 | 18,64 |
CBC: carcinoma basocelular; CEC: carcinoma epidermoide cutáneo; NS: no significativo.
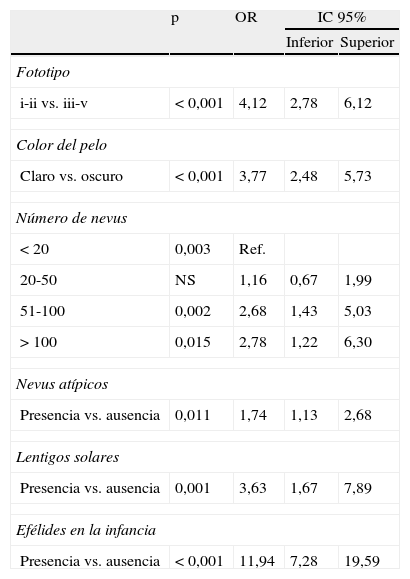
En relación con las características fenotípicas e histológicas (tablas 9 y 10) que pueden asociarse a una puntuación mayor o igual a 3 se incluyen los fototipos i-ii frente a un fototipo iii-v (OR=4,12), así como color del pelo claro frente al oscuro (OR=3,77). También la presencia en el paciente de más de 50 nevus frente a menos de 20 nevus (OR=2,68 de presentar entre 50-100 nevus y OR=2,78 de presentar más de 100 nevus) y la presencia de nevus atípicos (OR=1,74), lentigos solares (OR=3,63), efélides (OR=11,94) y nevus asociados al melanoma (OR=1,87).
Regresión logística binaria aplicada a las características fenotípicas (variable dependiente: puntuación ≥3)
| p | OR | IC 95% | ||
| Inferior | Superior | |||
| Fototipo | ||||
| i-ii vs. iii-v | <0,001 | 4,12 | 2,78 | 6,12 |
| Color del pelo | ||||
| Claro vs. oscuro | <0,001 | 3,77 | 2,48 | 5,73 |
| Número de nevus | ||||
| <20 | 0,003 | Ref. | ||
| 20-50 | NS | 1,16 | 0,67 | 1,99 |
| 51-100 | 0,002 | 2,68 | 1,43 | 5,03 |
| >100 | 0,015 | 2,78 | 1,22 | 6,30 |
| Nevus atípicos | ||||
| Presencia vs. ausencia | 0,011 | 1,74 | 1,13 | 2,68 |
| Lentigos solares | ||||
| Presencia vs. ausencia | 0,001 | 3,63 | 1,67 | 7,89 |
| Efélides en la infancia | ||||
| Presencia vs. ausencia | <0,001 | 11,94 | 7,28 | 19,59 |
NS: no significativo; Ref.: categoría de referencia.
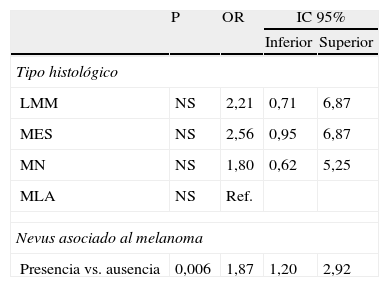
Regresión logística binaria aplicada a las características histológicas (variable dependiente: puntuación≥3)
| P | OR | IC 95% | ||
| Inferior | Superior | |||
| Tipo histológico | ||||
| LMM | NS | 2,21 | 0,71 | 6,87 |
| MES | NS | 2,56 | 0,95 | 6,87 |
| MN | NS | 1,80 | 0,62 | 5,25 |
| MLA | NS | Ref. | ||
| Nevus asociado al melanoma | ||||
| Presencia vs. ausencia | 0,006 | 1,87 | 1,20 | 2,92 |
LMM: melanoma sobre lentigo maligno; MES: melanoma de extensión superficial; MLA: melanoma lentiginoso acral; MN: melanoma nodular; NS: no significativo; Ref.: categoría de referencia.
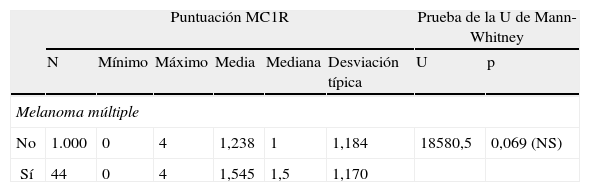
Los pacientes portadores de melanoma múltiple se caracterizaron por una puntuación genética media superior a la de los pacientes no portadores (1,6 frente a 1,2). Sin embargo, la prueba de la U de Mann-Whitney no mostró una relación estadísticamente significativa entre la puntuación MC1R y el número de de melanomas desarrollados por paciente (tabla 11).
Prueba de la U de Mann-Whitney aplicada a la relación de la puntuación de MC1R y el desarrollo de melanomas múltiples
| Puntuación MC1R | Prueba de la U de Mann-Whitney | |||||||
| N | Mínimo | Máximo | Media | Mediana | Desviación típica | U | p | |
| Melanoma múltiple | ||||||||
| No | 1.000 | 0 | 4 | 1,238 | 1 | 1,184 | 18580,5 | 0,069 (NS) |
| Sí | 44 | 0 | 4 | 1,545 | 1,5 | 1,170 | ||
NS: no significativo.
En este estudio se recogen los resultados —sobre la serie española más amplia de pacientes de melanoma cutáneo publicada hasta la fecha— de evaluar mediante el método de puntuación numérica aplicado al genotipo cómo las diferentes combinaciones de los polimorfismos del receptor MC1R, en función de su asociación fuerte o débil al fenotipo RHC, están estrechamente vinculadas a determinadas características epidemiológicas, fenotípicas e histológicas del melanoma.
En primer lugar es importante destacar que la gran cantidad de información almacenada en la base de datos empleada ha permitido analizar un elevado número de variables (26) y de pacientes (1.044). Los resultados se han obtenido a partir de un gran volumen de datos recogidos de forma prospectiva sin tener en mente el objetivo del estudio, no han sido manipulados para la realización de este trabajo y proceden de una única institución, lo cual garantiza su uniformidad. El empleo del sistema de clasificación numérico para el análisis del genotipo nos ha permitido evaluar la asociación entre las variantes MC1R y las características estudiadas, teniendo presente el grado de afectación funcional de los polimorfismos y no únicamente la presencia o ausencia de los mismos. Así hemos detectado relaciones en las que el efecto es proporcional al grado de afectación funcional de la vía.
Debido a su carácter retrospectivo hay que asumir algunas limitaciones; en concreto, la ausencia de datos que no han sido recogidos (valores perdidos) y los sesgos de memoria que puedan tener los pacientes para recordar los eventos pasados como los antecedentes de quemaduras, tanto de forma global como sobre las que se habían producido en el área del melanoma.
En este estudio se ha podido observar que las características de los pacientes difieren según el genotipo pigmentario definido por las variantes en MC1R. Este hecho remarca, desde el punto de vista clínico, que no existe un único patrón genético de MC1R asociado al desarrollo de melanoma. Numerosos estudios previos demuestran que el desarrollo de melanoma está asociado tanto al fenotipo pigmentario de la piel, de los ojos y el pelo, como a los antecedentes personales o familiares de cáncer cutáneo o no cutáneo y al genotipo del huésped18–20. De acuerdo con trabajos anteriores determinamos que la expresión de determinadas variantes en el gen MC1R puede influir en el tipo de piel del paciente, en los antecedentes de quemadura, en la exposición solar y en una mayor frecuencia de melanomas de extensión superficial y melanomas asociados a nevus melanocíticos15,21. Análisis funcionales han determinado que las diferentes variantes alélicas R y r afectan de manera distinta a la función de MC1R. La función del receptor se ha visto afectada por variaciones en la expresión superficial celular, por una respuesta funcional alterada o por diferencias en la unión y activación del AMPc22,23. El sistema de puntuación numérica aplicado nos ha permitido estudiar cómo la combinación de diferentes variantes alélicas en el gen MC1R, que conllevan a un receptor no funcional, altera la pigmentación cutánea constitutiva humana, así como la respuesta a la radiación UV debido probablemente a la falta relativa de eumelanina2.
Por otra parte, en los resultados obtenidos observamos un cambio proporcional en las características clínicas a medida que aumenta la puntuación genética, y por tanto el grado de afectación del receptor. Así, la presencia de diferentes variantes alélicas MC1R que acumulan una puntuación igual o mayor de 3 en los pacientes se asocian a melanomas de presentación a edades más tempranas (antes de los 50 años), en áreas expuestas al sol de forma continuada como la cara y el cuello o las regiones acrales, asociados a nevos y en pacientes con antecedentes de quemaduras solares graves, tanto en el área del melanoma como en el cuerpo en general y de CBC o CEC.
La prueba de la U de Mann-Whitney no concluyó una relación estadísticamente significativa entre la puntuación MC1R y el desarrollo de melanomas múltiples; sin embargo, el valor p (0,069) cercano a la significación estadística podría sugerir cierta vinculación.
No obstante, la distribución de la frecuencia alélica, la influencia de las distintas variaciones en MC1R y el perfil clínico de los pacientes con melanoma puede variar en las distintas poblaciones, por lo que nuestros resultados pueden no aplicarse de idéntica manera en otras poblaciones differentes6,24–30.
En conclusión, en el presente trabajo se constata cómo las características de presentación del melanoma cutáneo en la población española difieren según el grado de afectación funcional de la síntesis de melanina determinada por los polimorfismos en MC1R. A mayor afectación funcional predominan los fototipos y el color de pelo claros, así como la abundancia de efélides, lentigos solares y nevus melanocíticos y atípicos. Del mismo modo, se asocia al desarrollo de melanoma asociado a nevos en edades más tempranas, en áreas expuestas al sol de forma continuada y en pacientes con antecedentes de quemaduras solares graves, tanto en el área del melanoma como en el cuerpo en general, y de CBC o CEC. Estos hallazgos podrían ser útiles para definir estrategias de prevención específicas en portadores de dichas alteraciones.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.
Nuestro agradecimiento al Biobanco del Instituto Valenciano de Oncología de donde se han obtenido las muestras para el estudio genético.