El diagnóstico de las enfermedades del cabello y del cuero cabelludo se basa, en la mayoría de las ocasiones, en el reconocimiento de signos clínicos; sin embargo, dichos signos no siempre son característicos y, en ocasiones, tenemos que recurrir a técnicas más invasivas como la realización de una biopsia. En este artículo se revisan de forma detallada las principales formas de alopecia desde un punto de vista histopatológico, y para ello se utiliza la clasificación tradicional de las alopecias que las divide en 2 grandes grupos: las alopecias cicatriciales y las no cicatriciales. Las alopecias cicatriciales son aquellas en las cuales el folículo piloso es sustituido por tejido fibroso cicatricial, causando una pérdida permanente del cabello. En las alopecias no cicatriciales el folículo permanece intacto y puede retomar su actividad cuando cesa el estímulo desencadenante. La segunda parte de este artículo revisa las principales formas de alopecia cicatricial desde un punto de vista histopatológico. Dado que una buena correlación clinicopatológica es fundamental para realizar el correcto diagnóstico histopatológico de las alopecias, en este artículo se incluye también una breve descripción de las características clínicas de las principales formas de alopecia.
The diagnosis of disorders of the hair and scalp can generally be made on clinical grounds, but clinical signs are not always diagnostic and in some cases more invasive techniques, such as a biopsy, may be necessary. This 2-part article is a detailed review of the histologic features of the main types of alopecia based on the traditional classification of these disorders into 2 major groups: scarring and nonscarring alopecias. Scarring alopecias are disorders in which the hair follicle is replaced by fibrous scar tissue, a process that leads to permanent hair loss. In nonscarring alopecias, the follicles are preserved and hair growth can resume when the cause of the problem is eliminated. In the second part of this review, we describe the histologic features of the main forms of scarring alopecia. Since a close clinical-pathological correlation is essential for making a correct histopathologic diagnosis of alopecia, we also include a brief description of the clinical features of the principal forms of this disorder.
En la práctica clínica diaria los dermatólogos nos encontramos con bastante frecuencia ante pacientes que consultan por alopecia. En muchos casos el diagnóstico correcto de esta patología se puede establecer directamente por la presentación y evolución del proceso. Sin embargo, en ocasiones, es necesaria la realización de una biopsia para poder establecer un diagnóstico definitivo. En este artículo se revisan de forma detallada las principales formas de alopecia cicatricial (AC) desde un punto de vista histopatológico.
Alopecias cicatricialesLas AC constituyen un grupo de trastornos en los que los folículos pilosos son sustituidos por columnas de fibrosis o colágeno hialinizado, dando lugar a una pérdida permanente del cabello. Esto se traduce clínicamente en la desaparición de los ostia foliculares y una atrofia cutánea. Existen muchas causas de AC secundaria, como son los procesos infiltrativos (metástasis cutáneas, sarcoidosis), los traumatismos (quemaduras, radiación) o las infecciones. Sin embargo, el término AC se utiliza para denominar preferentemente las AC primarias (ACP), un grupo de enfermedades en las que el folículo piloso es la principal diana del proceso inflamatorio, mientras que la dermis interfolicular permanece respetada1. La clasificación de las AC es confusa y controvertida, debido a que su etiología, en muchos casos, es desconocida y las características clínico-patológicas se superponen, son variables en el tiempo y dependen de factores raciales y genéticos. En este artículo nosotros utilizamos la clasificación establecida en 2001 por la North American Hair Research Society (NAHRS) que clasifica las ACP atendiendo a la composición del infiltrado inflamatorio en: linfocíticas, neutrofílicas y mixtas2 (tabla 1).
Clasificación de las alopecias cicatriciales primarias (ACP) según la North American Hair Research Society (NAHRS)
| Composición mayoritaria del infiltrado inflamatorio | Entidades |
|---|---|
| Linfocíticas | Lupus eritematoso cutáneo crónico (LECC) |
| Liquen plano folicular (LPF) | |
| Pseudopelada de Brocq | |
| Alopecia cicatricial centrífuga central (ACCC) | |
| Alopecia mucinosa | |
| Queratosis folicular espinulosa decalvante (QFED) | |
| Neutrofílicas | Foliculitis decalvante (FD) |
| Celulitis/foliculitis disecante | |
| Mixtas | Acné queloideo de la nuca (AQN) |
| Acné necrótica varioliforme | |
| Dermatosis pustulosa erosiva | |
| No específicas |
Las ACP presentan una fase inicial activa, con características clínicas más o menos específicas. Progresivamente van apareciendo zonas cicatriciales, generalmente en la zona central de las lesiones, lo que determina que en fases más avanzadas de AC el diagnóstico diferencial clínico sea mucho más difícil, y en ocasiones imposible. La toma de una biopsia será útil para establecer o confirmar el diagnóstico, pero para que la muestra sea demostrativa la biopsia deberá obtenerse de aquellas zonas en las que aún se observen ostia foliculares. Es especialmente útil tomar la biopsia de la periferia de las lesiones, de zonas con pilotracción positiva, o de zonas con actividad clínica visible. Además, se puede mejorar la rentabilidad tomando la biopsia de forma paralela al folículo, para no atravesarlo. Si se toma una única biopsia es mejor remitirla para cortes transversales, ya que nos permitirá observar múltiples folículos a distintos niveles3,4. Sin embargo, con esta técnica perdemos la posibilidad de observar en conjunto la epidermis, la dermis y las unidades pilosebáceas, de gran utilidad en este tipo de alopecias3. Por tanto, ante la sospecha de AC lo mejor es tomar 2 muestras, una para cortes horizontales y otra para verticales. Además, en el estudio histopatológico de las AC también resulta útil el uso de tinciones para fibras elásticas y la inmunofluorescencia directa (IFD). Las principales claves histopatológicas que son útiles en el diagnóstico de las ACP se encuentran resumidas en la tabla 2.
Claves histopatológicas de las alopecias cicatriciales primarias (ACP)
| Tipo de alopecia | Claves histopatológicas |
|---|---|
| Lupus eritematoso cutáneo crónico (LECC) | Dermatitis de la interfase de tipo vacuolar |
| Infiltrado inflamatorio linfocitario foliculocéntrico | |
| Infundíbulos dilatados con queratina laminar en el interior | |
| Destrucción de fibras elásticas perifoliculares | |
| Depósitos de IgG y C3 en la interfase entre la dermis y el epitelio folicular | |
| Liquen plano folicular (LPF) | Dermatitis de la interfase de tipo liquenoide |
| Infiltrado inflamatorio linfocitario foliculocéntrico | |
| Fibrosis lamelar concéntrica | |
| Cicatriz en forma de cuña con destrucción de fibras elásticas | |
| Pseudopelada de Brocq (PB) | Diagnóstico por exclusión en ausencia de hallazgos característicos de otra AC |
| Alopecia cicatricial centrífuga central (ACCC) | Fibroplasia lamelar alrededor de infundíbulos foliculares |
| Tractos fibrosos sustituyendo unidad foliculosebácea | |
| Fibras elásticas engrosadas en la dermis | |
| Alopecia mucinosa | Depósitos de mucina en la vaina radicular externa |
| Lagos de mucina intrafoliculares | |
| Queratosis folicular espinulosa decalvante (QFED) | Hiperqueratosis compacta en el infundíbulo |
| Infiltrado inflamatorio mixto neutrofílico/linfocitario | |
| Alopecias cicatriciales primarias neutrofílicas | Infiltrado inflamatorio neutrofílico intra y peri-folicular |
| Fibrosis perifolicular e intersticial | |
| Varios tallos pilosos emergiendo de un infundíbulo folicular (foliculitis «en penacho») | |
| Reacción granulomatosa de tipo cuerpo extraño a tallos pilosos rotos |
Los pacientes con lupus eritematoso (LE), en sus distintas variantes, pueden presentar afectación del cuero cabelludo, siendo los que padecen lupus eritematoso cutáneo crónico (LECC), especialmente aquellos con lupus discoide crónico (LDC), los únicos que evolucionarán hacia una AC. Al igual que Sperling, preferimos el término de LECC al de LDC ya que es más inclusivo5, y por eso esta será la denominación que utilizaremos en nuestras descripciones. Los pacientes con lupus eritematoso sistémico (LES) pueden presentar lesiones de LECC, sin embargo la mayoría de pacientes con LECC no presentan enfermedad sistémica. Entre los pacientes que solo presentan afectación cutánea un 50% aproximadamente presentará afectación del cuero cabelludo, y muy pocos desarrollarán afectación sistémica. Clínicamente, estos pacientes presentan placas alopécicas eritemato-descamativas en el cuero cabelludo, con atrofia epidérmica y presencia de infundíbulos foliculares dilatados con tapones córneos. Estas placas presentan un crecimiento centrífugo, y varias placas pueden confluir formando áreas de AC de bordes irregulares. La presencia de una zona central hipopigmentada con hiperpigmentación periférica es característica de las lesiones de LECC evolucionadas en pacientes con fototipo medio-alto.
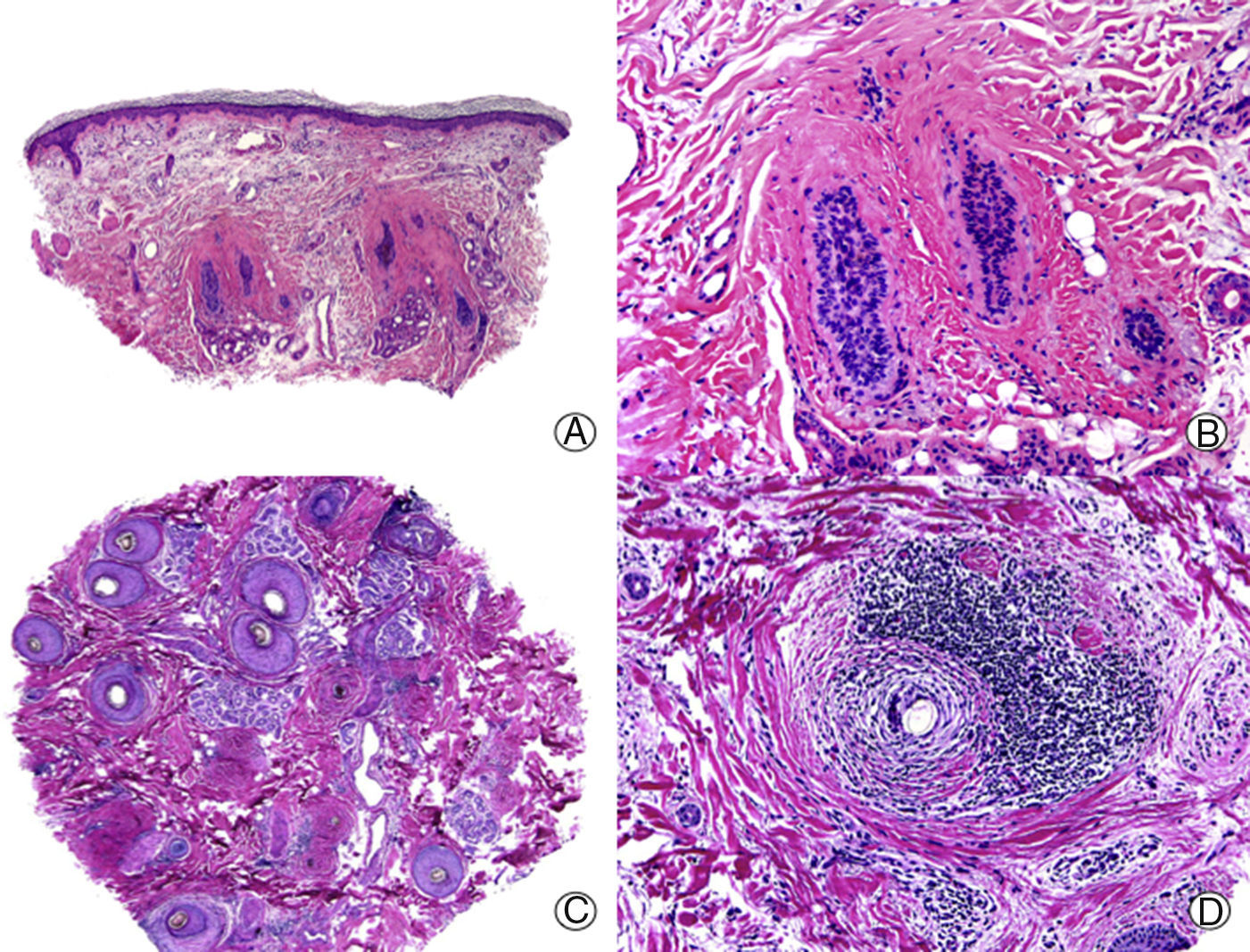
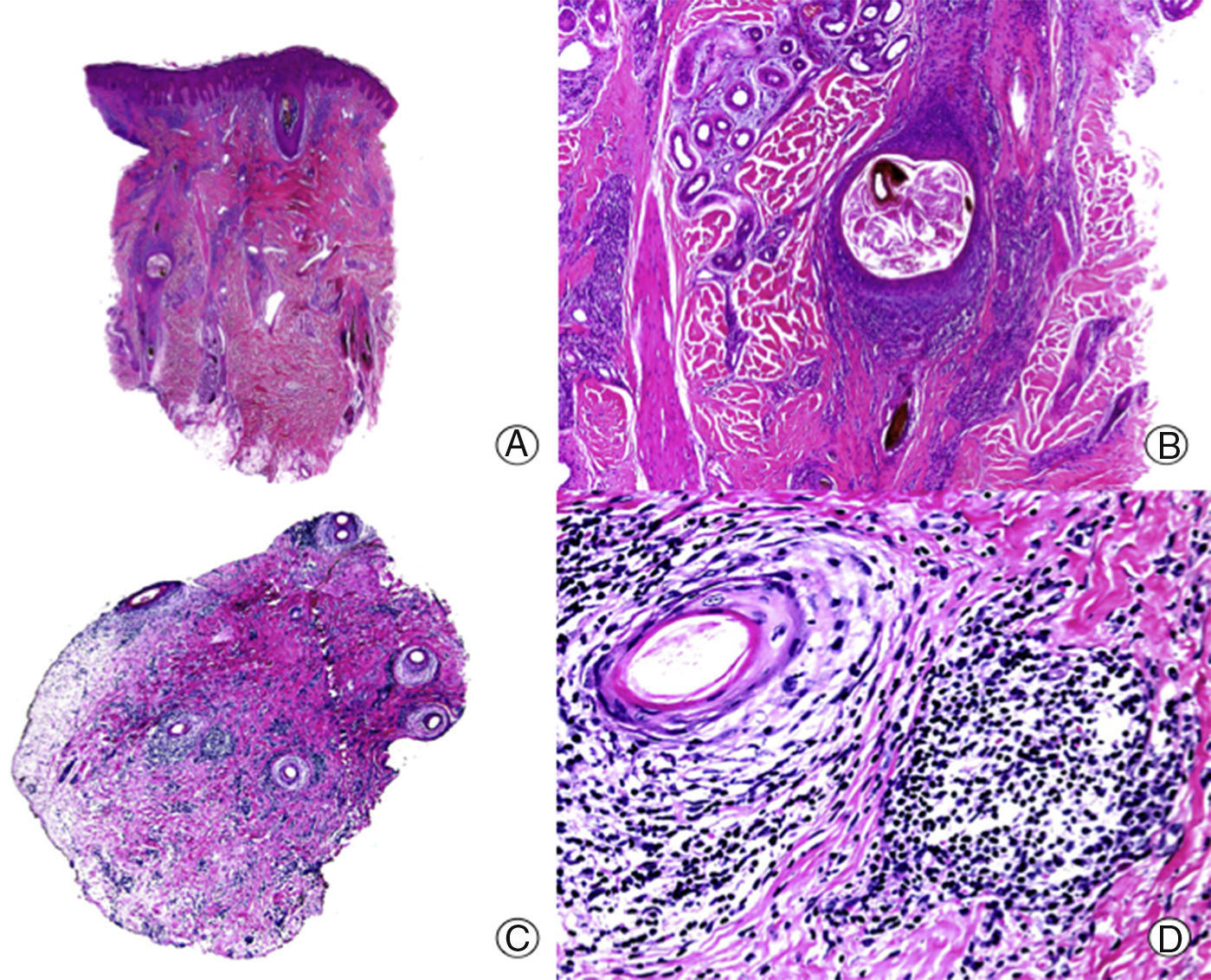
Histopatológicamente, en las lesiones activas de LECC en el cuero cabelludo se observa una dermatitis de la interfase de tipo vacuolar y un infiltrado inflamatorio linfocitario foliculocéntrico. Esta dermatitis tiende a afectar la epidermis interfolicular, pero en ocasiones puede encontrarse respetada, dificultando el diagnóstico4. Un hallazgo frecuente en el LECC, aunque también se observa en el liquen plano folicular (LPF), consiste en la presencia de cuerpos coloides, cuerpos hialinos o cuerpos de Civatte, así como la presencia de disqueratosis en el epitelio folicular y el de la epidermis. Es frecuente observar infundíbulos dilatados con presencia de queratina laminar en su interior, hallazgo frecuente en las ACP en general, y que se traduce clínicamente por la presencia de «tapones córneos» en la exploración. El infiltrado inflamatorio foliculotropo característicamente se dispone preferentemente alrededor del infundíbulo y el istmo6, aunque también puede afectar al folículo en su totalidad. Este infiltrado inflamatorio, predominantemente linfocitario, aunque con frecuencia incluye células plasmáticas, presenta además un patrón perivascular superficial y profundo, con una llamativa distribución periecrina4,6–9. Además, es frecuente observar la atrofia o destrucción de las glándulas sebáceas desde estadios precoces7,9. En estadios finales las lesiones de LECC presentan una fibrosis lamelar llamativa rodeando la porción superior del folículo, aunque también puede ser panfolicular, y con la evolución del cuadro acaba por destruir el folículo en su totalidad (fig. 1). Al igual que en otras ACP se pueden observar granulomas a cuerpo extraño rodeando tallos pilosos libres en la dermis sin revestimiento epitelial7. Además, es frecuente la presencia de mucina intersticial en la dermis reticular, y en ocasiones se puede observar la formación de folículos linfoides con centros germinales en la hipodermis10.
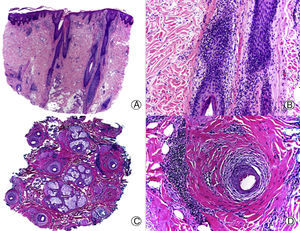
Alopecia cicatricial en una placa de lupus eritematoso cutáneo crónico. A. En cortes longitudinales se observan escasas unidades foliculares (HE x10). B. Fibrosis rodeando restos foliculares (HE x200). C. El mismo caso en cortes transversales (HE x20). D. Fibrosis concéntrica alrededor de restos foliculares (HE x200).
Las tinciones para fibras elásticas nos pueden ayudar en el diagnóstico diferencial del LECC con otras ACP. En las lesiones de LECC avanzadas observamos destrucción de las fibras elásticas perifoliculares11, mientras que en las lesiones tardías de LPF se observa la presencia de una cicatriz en forma de cuña de base superior en la dermis superficial, con destrucción de fibras elásticas solo en esta zona11. En la pseudopelada de Brocq (PB) las fibras elásticas no solo no están destruidas, sino que se observan llamativamente engrosadas11.
El uso de IFD es también de utilidad en el diagnóstico diferencial del LECC con otras ACP. Para que la muestra sea óptima la lesión de la que se toma la biopsia debe haber estado al menos 3 semanas sin tratamiento y tener una antigüedad mínima de 2-3 meses12. Al realizar IFD en lesiones de LECC se observan depósitos de IgG y C3 o IgM en un patrón granular o en banda homogénea en la unión dermo-epidérmica y la interfase entre dermis y epitelio folicular5,8,13. La presencia de IgA es menos frecuente5,13. En un estudio las lesiones de LECC en el cuero cabelludo presentaban el mayor porcentaje de positividad en la IFD al compararlas con biopsias tomadas de otras regiones anatómicas12. Por tanto, se recomienda tomar una muestra en fresco para IFD siempre que se sospeche LECC entre los diagnósticos diferenciales de una ACP.
Finalmente, el diagnóstico diferencial entre LPF y LECC puede suponer un reto en algunas ocasiones, especialmente cuando el LECC no presenta afectación epidérmica concomitante. En estos casos la presencia de un infiltrado inflamatorio con células plasmáticas y afectación perivascular profunda y periecrina, así como la presencia de mucina dérmica y cuerpos coloides en la unión dermo-epidérmica apoyarían el diagnóstico de LECC14. Además, la presencia de una membrana basal engrosada PAS positiva es un hallazgo clásico y muy frecuente en las lesiones crónicas de LECC6,13 que está presente incluso en lesiones muy avanzadas6, y puede ser de gran ayuda en el diagnóstico diferencial entre estas 2 entidades3.
Liquen plano folicularLPF es el nombre utilizado para definir el liquen plano que afecta a los folículos pilosos. Se divide en 3 tipos según la presentación clínica: LPF clásico, alopecia frontal fibrosante (AFF) y síndrome de Graham Little. Desde el punto de vista histopatológico estas 3 entidades son prácticamente indistinguibles, incluso en su fase activa, por lo que se describirán todas ellas en conjunto. La presentación clínica del LPF clásico en el cuero cabelludo es muy similar al LECC, en forma de grandes placas con pápulas foliculares queratósicas e hiperqueratosis folicular espinulosa, que en contraste con el LECC presentan mayor actividad en la zona periférica8,15, dejando de forma característica folículos no afectos en el interior de la placa alopécica. Las clásicas lesiones poligonales del liquen plano no se observan en el cuero cabelludo, pero sí en otras zonas corporales, y si están presentes pueden ayudar al diagnóstico. Lo mismo sucede cuando encontramos lesiones mucosas o ungueales típicas de liquen plano. En este sentido se han descrito casos de coexistencia de LPF y liquen plano vulvar16. La AFF se considera una variante de LPF con patrón específico, que clínicamente da lugar al retroceso de la línea frontal de implantación capilar del cuero cabelludo y pérdida de las cejas17–21. Finalmente, se denomina síndrome de Graham Little a la tríada de alopecia cicatricial del cuero cabelludo, pápulas queratósicas foliculares en el tronco y las extremidades y pérdida reversible de vello pubiano y/o axilar.
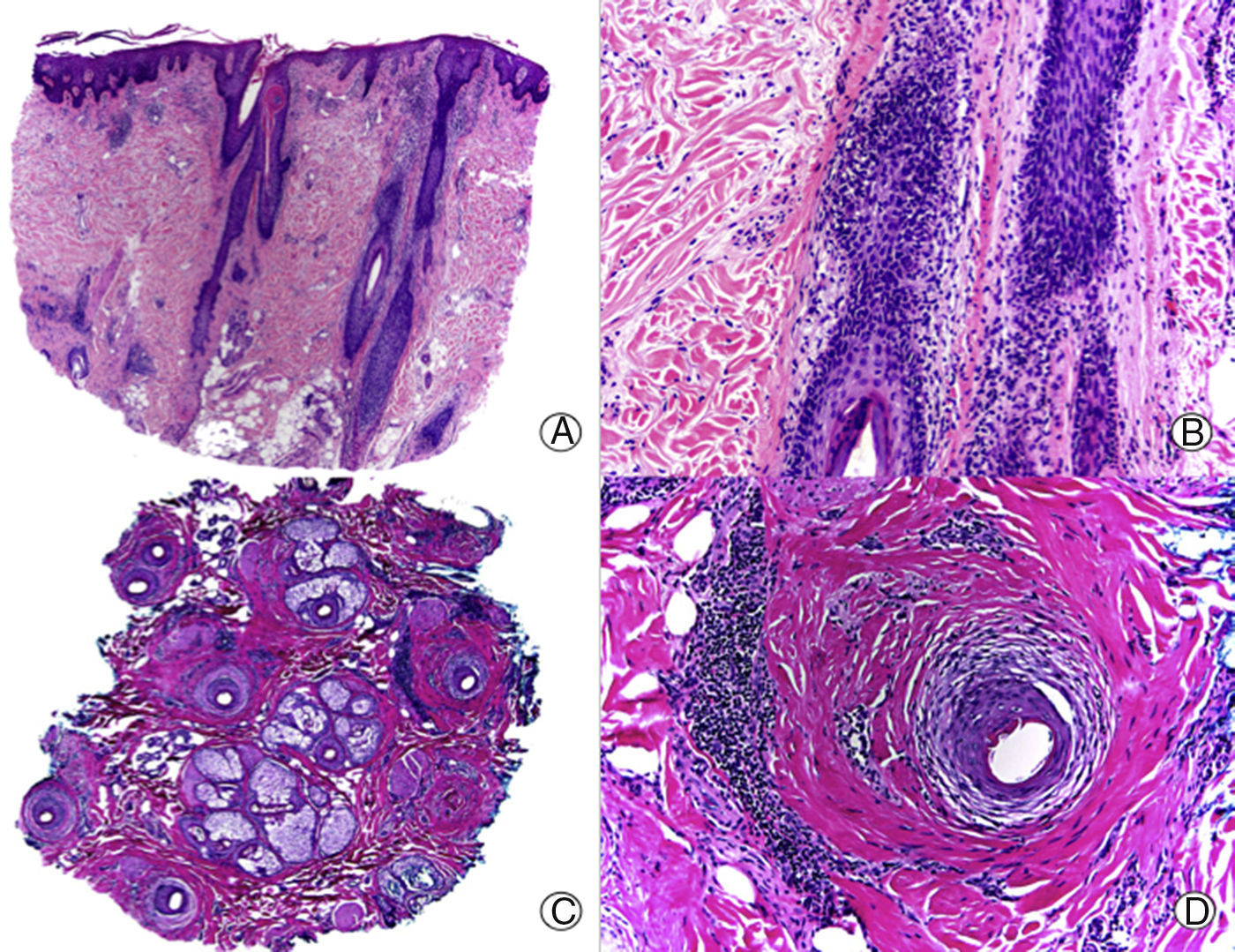
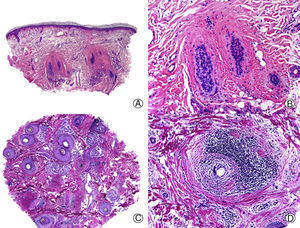
Histopatológicamente, en una lesión activa de LPF se observa una dermatitis de la interfase linfocitaria, generalmente de tipo liquenoide, que respeta la epidermis y la dermis interfolicular y se dispone preferentemente de manera perifolicular (fig. 2). Al igual que en la clínica, no todos los folículos pilosos se encuentran afectados en la biopsia6,7,21. El infiltrado liquenoide afecta de forma predominante a la porción fija del folículo (infundíbulo e istmo), llegando a ocultar la unión entre dermis adventicial y epitelio folicular6,7,13,22–24, produciendo una imagen en la que parece que el infiltrado y la fibroplasia periinfundibular están «estrangulando» al infundíbulo8. Por encima del infiltrado el infundíbulo se encuentra dilatado, adquiriendo un aspecto de «taza o embudo»8, con hipergranulosis y presencia de queratina hojaldrada, basófila y ortoqueratósica en su interior22,23, que se traduce en los hallazgos clínicos de hiperqueratosis espinulosa. La presencia de numerosos cuerpos coloides, compuestos por queratinocitos disqueratósicos, que son positivos con tinciones de citoqueratinas, suele ser llamativa a lo largo de la unión dermoepidérmica22–24. Al igual que sucedía en el LECC, las glándulas sebáceas están atróficas o completamente destruidas desde fases iniciales7,8,23. El plexo vascular profundo, así como otras estructuras anexiales no están afectadas, y el depósito de mucina en la dermis no es un hallazgo típico de LPF. En ocasiones se pueden observar alteraciones epidérmicas típicas de liquen plano en la biopsia22,23 que pueden ser de gran ayuda para el diagnóstico histopatológico.
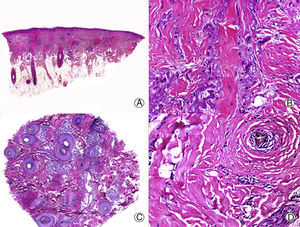
Liquen plano folicular. A. En cortes longitudinales se observa infiltrado perifolicular (HE x10). B. A mayor aumento se observan linfocitos salpicando el epitelio folicular (HE x200). C. El mismo caso estudiado en cortes transversales (HE x20). D. A mayor aumento se observa una fibrosis concéntrica perifolicular e infiltrado linfocitario en la periferia (HE x200).
Con la evolución del cuadro se observa fibrosis lamelar concéntrica23, destrucción de los folículos pilosos que serán sustituidos por gruesos tractos fibrosos longitudinales, y aparición de granulomas a cuerpo extraño24. La presencia de fibrosis en el tejido adyacente es escasa, predominando en la dermis papilar y asociada a atrofia epidérmica23. La tinción para fibras elásticas mostrará una cicatriz en forma de cuña centrada en el folículo. Los cambios histopatológicos en AFF y síndrome de Graham Little son indiferenciables del LPF clásico17,18, aunque se ha descrito la denominada «tríada folicular», que consiste en la afectación simultánea de folículos de diferentes tipos (terminales, intermedios y vellosos) en distintos estadios del ciclo folicular (anagen, catagen y telogen) como una clave histopatológica diagnóstica de las fases iniciales de la AFF25.
El diagnóstico diferencial histopatológico de LPF más complicado es con el LECC, siendo fundamental la correlación clinicopatológica. En aquellos casos especialmente difíciles puede ser de ayuda el estudio de IFD. En el LPF los abundantes cuerpos de Civatte muestran positividad con IgM, y menos frecuentemente con IgA, IgG y C3, y predominan en el epitelio folicular del infundíbulo y el istmo22,26,27. Este hallazgo, pese a ser una característica altamente sugestiva de LPF, no es patognomónico, ya que se puede observar también en el LECC27. Sin embargo, parece que ambas entidades podrían diferenciarse en función de la composición de estos cuerpos de Civatte, que estarían formados por queratinocitos necróticos (expresan citoqueratinas) en el LPF, y por agregados de membrana basal (positivos con colágeno iv) en el LECC.
Pseudopelada de BrocqExiste gran debate acerca de si la PB es una entidad nosológica o realmente equivale al estadio final, no inflamatorio, de otras ACP. Es un término muy arraigado en la literatura dermatológica desde su descripción por Brocq en 188528. Diversos estudios han tratado de esclarecer la individualidad o no de la PB. Así, algunos autores diagnostican clínicamente de PB a todos aquellos pacientes que no cumplen criterios de LPF ni LECC, y encuentran que entre un 33%29 y un 69% (este último en lesiones tempranas y activas)30 pueden ser diagnosticadas histopatológicamente de LECC o LPF. En la última clasificación de la NAHRS de 2001, la PB se describe como una entidad específica2, y Sellheyer y Bergfeld31, también consideran la PB como una entidad individual alegando que presenta una ausencia clara clínica e histológica de tapones córneos, y que conserva el entramado dérmico de fibras elásticas, hallazgos que no se observan en el LPF ni en el LECC.
Clínicamente suele presentarse como pequeños parches de alopecia del color de la piel normal, sin hiperqueratosis ni signos de inflamación29. Las placas pueden mostrar cierta atrofia, de ahí la descripción clásica de «pisadas en la nieve»32, y afecta con mayor frecuencia el vertex y las regiones parietales29.
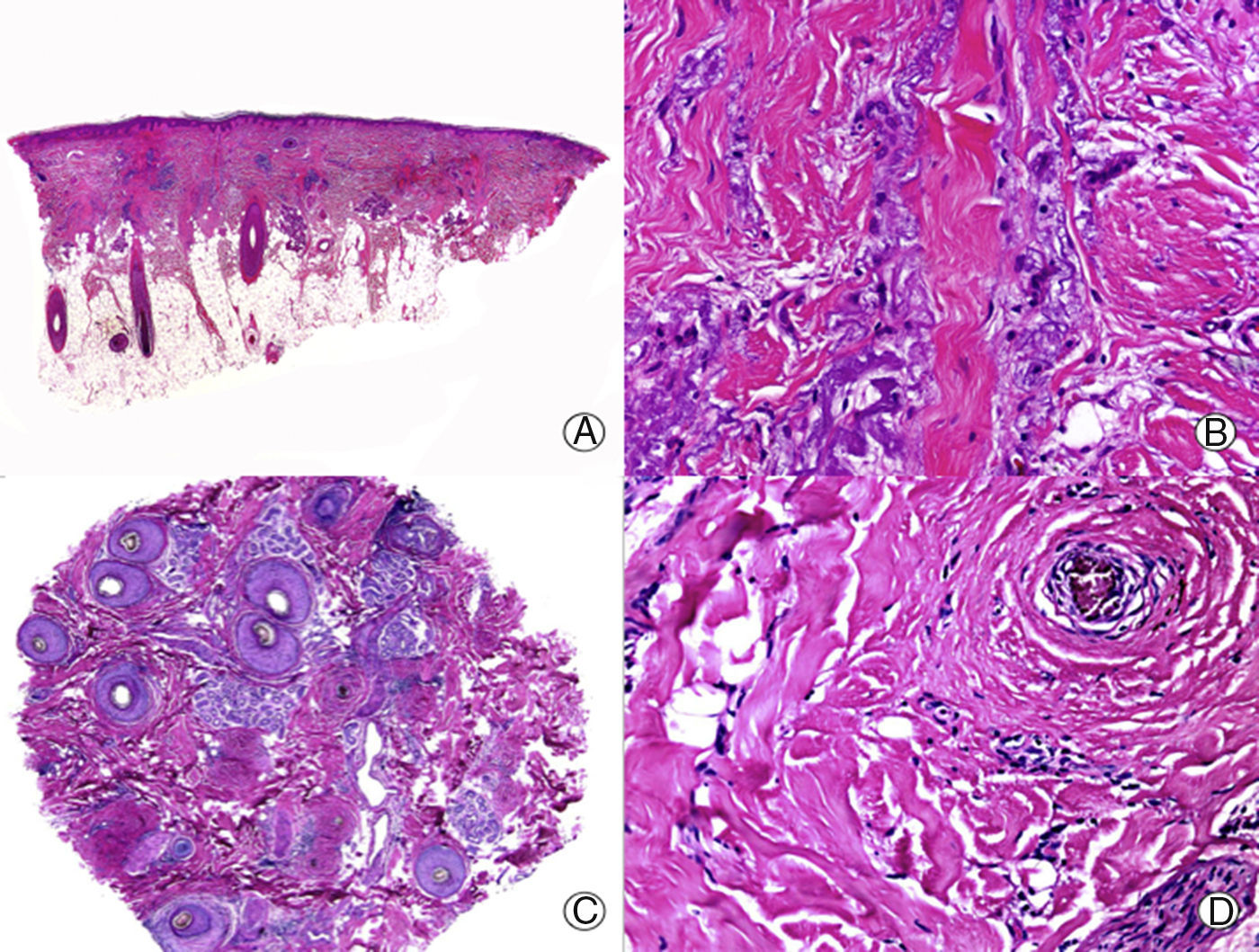
Desde el punto de vista histopatológico la PB se caracteriza por no presentar una dermatitis de la interfase, en contraste con el LPF o el LECC, pero no se han descrito características histopatológicas distintivas de PB33. Las lesiones tempranas presentan un infiltrado linfocitario perifolicular escaso o moderado, que predomina en la zona periinfundibular29. Las glándulas sebáceas resultan destruidas de forma temprana34. Con la evolución del cuadro aparece fibroplasia lamelar alrededor de los infundíbulos foliculares, que termina produciendo la destrucción completa de la unidad foliculosebácea, con aparición de tractos fibrosos en su lugar (fig. 3). El músculo erector del pelo se mantiene íntegro, y se pueden observar granulomas a cuerpo extraño, rodeando los tallos pilosos29. Con tinción para fibras elásticas la PB presenta fibras elásticas llamativamente engrosadas tanto en la dermis adventicial como reticular11, lo que ayuda al diagnóstico diferencial con otras ACP en fases avanzadas.
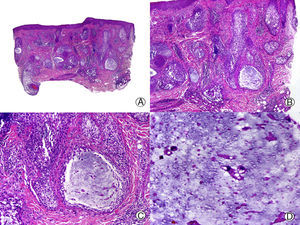
Pseudopelada de Brocq de larga evolución. A. Visión panorámica donde se observan columnas de fibrosis reemplazando a los folículos (HE x10). B. Detalle de la anterior mostrando fibrosis vertical entremezclada con elastosis actínica (HE x200). C. Corte transversal del mismo caso en el que se observan varias unidades foliculares (HE x20). D. A mayor aumento se aprecia fibroplasia concéntrica alrededor de restos foliculares (HE x200).
La alopecia cicatricial centrífuga central (ACCC) es un término acuñado por el grupo de consenso de la NAHRS, y definido como «pérdida de cabello de inicio en la zona del vertex y que progresa de forma centrífuga»2. Es un término descriptivo que se usa para agrupar entidades como el síndrome de degeneración folicular, la pseudopelada en afroamericanos y la pseudopelada elíptica central en caucásicos2. Presenta un importante solapamiento desde el punto de vista histopatológico con la PB, pero la presentación clínica es diferente, por lo que resulta fundamental la correlación clinicopatológica en el diagnóstico de ambas entidades.
La patogenia es desconocida. Sperling postuló que este proceso es el resultado de una degeneración precoz de la vaina radicular interna que permite que el tallo piloso lesione la vaina radicular externa iniciando una cadena de alteraciones histopatológicas que culminarán con el proceso de cicatrización35,36. Sperling et al. consideraron que el hallazgo de esta degeneración prematura de la vaina radicular interna, en ausencia de signos de inflamación, sería muy sugestivo de un síndrome de degeneración folicular36. Sin embargo, Gibbons y Ackerman37, Headington7 y Sulllivan y Kossard10 no consideran que la ACCC sea una entidad nosológica independiente, y defienden que los cambios histopatológicos que presenta son inespecíficos y similares a los de otras ACP. De hecho, Ackerman et al. consideran que la ACCC realmente constituye el estadio final de una alopecia por tracción38.
Las características histopatológicas de la ACCC han sido poco descritas en la literatura4,8,35. En general, los hallazgos descritos son similares a los de la PB. Se observa un infiltrado linfocitario perifolicular alrededor de la porción superior del folículo, y en ocasiones perivascular. Algunos autores han descrito un adelgazamiento asimétrico de la pared folicular, que se observa mejor en los cortes transversales y que desplaza de manera significativa el tallo piloso a una situación excéntrica39. Con la evolución de las lesiones se observa fibroplasia lamelar, así como la destrucción de las unidades pilosebáceas, dando lugar al desarrollo de tejido cicatricial en el lugar de los folículos preexistentes. La tinción para fibras elásticas presenta un patrón similar al de la PB11.
Alopecia mucinosaLa alopecia mucinosa (AM) es un proceso inflamatorio de la unidad foliculosebácea que se puede relacionar tanto con alopecia permanente como con no permanente. El nombre del cuadro describe su principal característica histopatológica, la presencia de mucina intrafolicular. Este hallazgo se considera un patrón histopatológico reactivo inespecífico40,41, y la denominación de mucinosis folicular parece ser adecuada40–42. Tradicionalmente se describen 2 tipos de AM: uno primario idiopático y otro secundario en relación con linfomas. Debido a que existe gran solapamiento entre estas 2 entidades, y a que se han descrito casos de AM primaria que progresan a linfoma42–44, se considera que esta distinción puede no ser real. Es posible que en realidad las AM primarias y secundarias representen diferentes espectros de un único proceso. La AM primaria debería considerarse como una condición premaligna45 o como una forma indolente de micosis fungoide (MF) de muy buen pronóstico46. Clínicamente ambas formas se caracterizan por presentarse como pápulas foliculares agrupadas, parches eritematosos y/o placas fluctuantes que afectan con mayor frecuencia al área de cabeza y cuello, pero también al tronco y a las extremidades46.
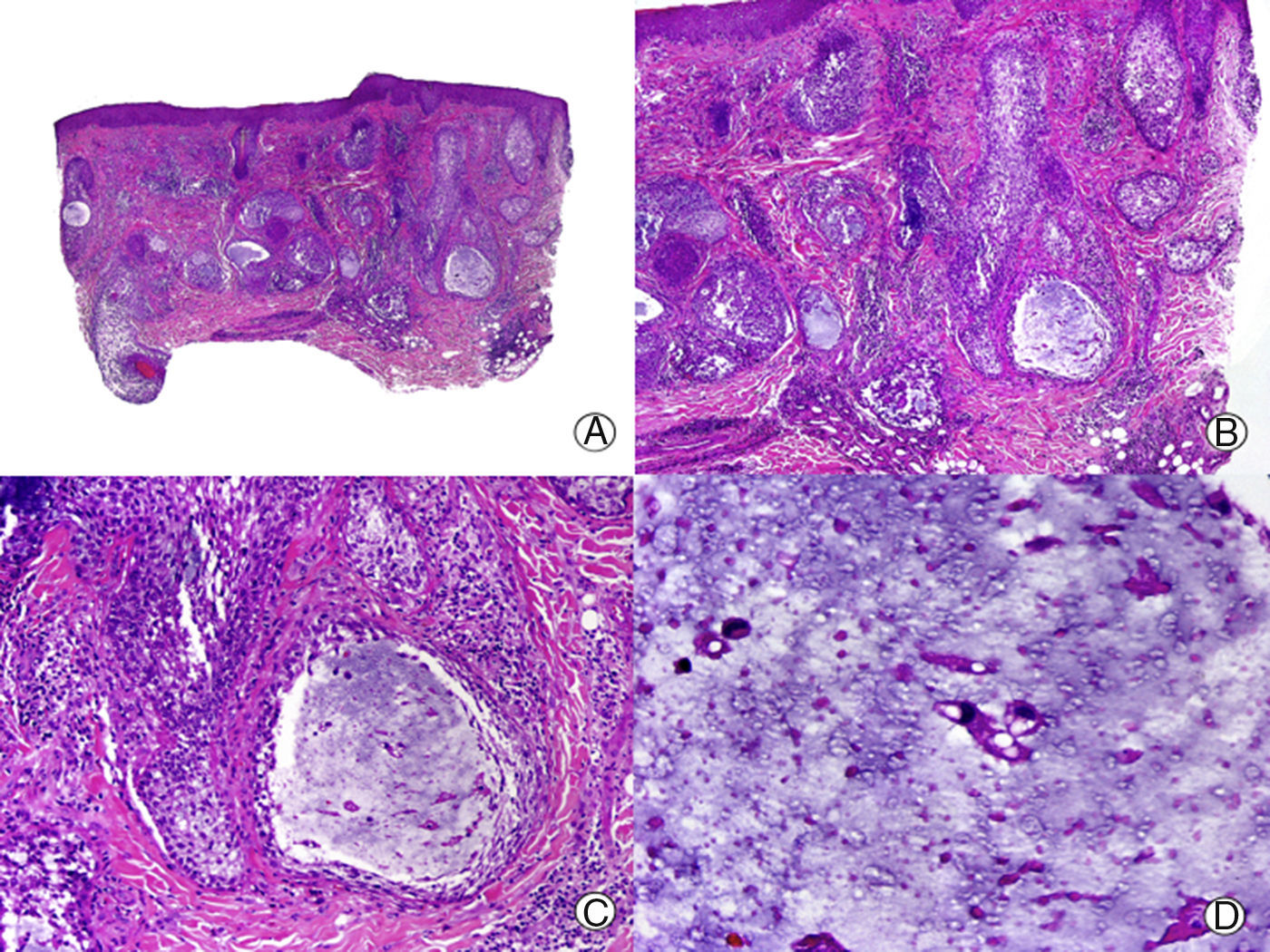
Desde el punto de vista histopatológico la alteración que se observa más precozmente es el depósito de mucina entre los queratinocitos de la vaina radicular externa (fig. 4). En casos intensos este depósito da lugar a la formación de lagos de mucina que afectan al folículo en su totalidad, así como a la glándula sebácea8,46. Se observa un infiltrado linfocitario peri e intrafolicular, de linfocitos de aspecto tanto normal como atípicos. Puede observarse exocitosis linfocitaria en el epitelio folicular en la forma primaria46. En la dermis la afectación es variable, pudiendo observarse un infiltrado linfocitario con patrón perivascular superficial, perivascular superficial y profundo, así como difuso8. Al igual que sucede en la presentación clínica no existen características histopatológicas fiables y reproducibles que nos permitan realizar la diferenciación entre AM primaria y secundaria asociada a linfoma. Además, la atipia celular y el reordenamiento monoclonal de receptores de genes de células T se pueden encontrar en ambas formas, por lo que tampoco son útiles en el diagnóstico diferencial46. En estadios finales se produce la destrucción de la unidad foliculosebácea, y se observa la persistencia de tractos residuales de mucina con un manguito periférico de células inflamatorias47. A diferencia de la mayoría de ACP en la AM no se observa fibrosis lamelar concéntrica8. De manera rutinaria no son necesarias las tinciones para mucina. Sin embargo, cuando observamos una espongiosis prominente en el epitelio folicular es importante hacer el diagnóstico diferencial con la dermatitis atópica, para lo que sí puede ser útil el uso de tinciones31. La foliculitis eosinofílica también puede presentar mucinosis folicular, pero presenta otras características histopatológicas adicionales que permiten su diagnóstico diferencial31.
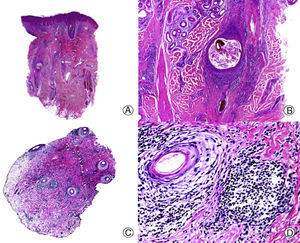
Alopecia mucinosa. A. Visión panorámica (HE x10). B. A mayor aumento se observan lagos de mucina en el interior de los folículos pilosos (HE x20). C. Mayor aumento mostrando mucina entre los queratinocitos del epitelio folicular y un gran lago de mucina (HE x200). D. Detalle del material basófilo granular en el interior del epitelio folicular (HE x400).
La queratosis folicular espinulosa decalvante (QFED), también denominada queratosis pilar decalvante o ictiosis folicular, es una de las 3 entidades que se incluyen bajo el término de queratosis pilar atrófica48,49. Las otras 2 entidades afectan preferentemente a la cara, y son la queratosis pilar atrófica facial y la atrofoderma vermiculata. La QFED se considera una genodermatosis de herencia ligada al cromosoma X50.
Clínicamente se presenta con áreas alopécicas que muestran pápulas foliculares hiperqueratósicas y pústulas. El inicio es con frecuencia en la adolescencia48,49, y la afectación predomina en el cuero cabelludo, aunque puede presentarse también en las cejas y las pestañas. En el cuero cabelludo las zonas ya alopécicas pueden presentar tapones córneos residuales, rodeados por eritema perifolicular, así como atrofia puntiforme, más llamativa en la cara49. Asociado a las placas de alopecia se aprecia con frecuencia queratosis pilar en el tronco y las extremidades, distrofia corneal y fotofobia.
La QFED está clasificada por la NAHRS entre las alopecias linfocíticas. Sin embargo, pese a que esto es cierto en cuadros evolucionados o en estadios finales48, en las lesiones iniciales se puede observar un infiltrado neutrofílico49. El defecto inicial parece ser una queratinización anormal que da lugar a hipergranulosis e hiperqueratosis compacta en la porción superior del infundíbulo49, lo que se correlaciona clínicamente con las espinas foliculares. En la siguiente fase de inflamación aguda aparece espongiosis y un infiltrado neutrofílico en el infundíbulo y la epidermis adyacente. La evolución cursa con la aparición de un infiltrado linfocitario asociado a fibrosis perifolicular, predominantemente en la porción superior del folículo. En el estadio final se observa fibrosis con presencia de granulomas de tipo cuerpo extraño frente a los tallos pilosos, así como la destrucción del folículo piloso31.
Alopecias cicatriciales primarias neutrofílicasSe consideran dentro de esta categoría las foliculitis en las que el infiltrado neutrofílico inicial tiene importancia en la patogénesis. En ellas la sobreinfección bacteriana del folículo y la consiguiente respuesta inflamatoria neutrofílica serán la base de los hallazgos clínicos e histopatológicos. Con la posterior evolución del cuadro y la aparición de fibrosis el infiltrado pasará a ser mixto.
Aunque clásicamente se han descrito importantes diferencias clínicas entre los procesos incluidos dentro de este grupo de alopecias, los hallazgos histopatológicos son bastante parecidos en todas ellas, lo que plantea la duda de si en realidad se trata de distintos procesos o todos ellos no son más que variantes evolutivas dentro de un mismo espectro lesional. Con esta posibilidad en mente nosotros las revisaremos como entidades separadas para mantener la nomenclatura clásica.
Foliculitis decalvanteLa foliculitis decalvante (FD) es un proceso patológico de curso crónico y progresivo caracterizado por una foliculitis supurativa destructiva. Clínicamente se presenta como placas de alopecia con pústulas foliculares en el margen, donde la lesión está activa8,13,51. Las placas predominan en el cuero cabelludo, pero pueden aparecer también en otras regiones corporales con folículos terminales, y se resuelven dejando una cicatriz central.
Histopatológicamente, al realizar una biopsia del borde activo, es posible observar una dilatación acneiforme del infundíbulo folicular, asociada a un infiltrado neutrofílico intra y perifolicular13,51. Con la evolución del cuadro el infiltrado afectará al folículo en su totalidad y está constituido mayoritariamente por linfocitos e histiocitos, con presencia de células plasmáticas y células gigantes multinucleadas. Además, se observa fibrosis perifolicular e intersticial, afectando a la dermis que no es directamente perifolicular. Sullivan y Kossard10 consideran que la presencia de células plasmáticas puede suponer una clave para el diagnóstico de FD en estadios avanzados (fig. 5). Los estadios finales se caracterizan por la presencia de tractos fibrosos que sustituyen a los folículos pilosos. Además, se pueden observar granulomas de tipo cuerpo extraño alrededor de los tallos pilosos en contacto directo con la dermis.
Foliculitis decalvante. A.Visión panorámica mostrando varios folículos pilosos rotos con fibrosis perifolicular (HE x10). B. Detalle de la anterior donde se observa un quiste infundibular rodeado de infiltrado inflamatorio y debajo un tallo piloso pigmentado rodeado de células gigantes multinucleadas (HE x200). C. Cortes transversales mostrando fibrosis perifolicular y manguitos de infiltrado alrededor de los folículos pilosos (HE x20). D. A mayor aumento se observa que el infiltrado está constituido por linfocitos y células plasmáticas (HE x200).
En ocasiones pueden ser necesarias tinciones especiales para descartar una etiología microbiana. El principal diagnóstico diferencial histopatológico de esta entidad es con la celulitis/foliculitis disecante (CD), que presenta ausencia de tractos fistulosos, y la afectación intersticial por el infiltrado solo se observa en estadios avanzados. Para diferenciar la FD del acné queloideo buscaremos la presencia de fibrosis con características de cicatrización hipertrófica que solo se observan en el segundo proceso.
La foliculitis en penacho (FP) es una foliculitis supurativa en la que se observan múltiples tallos pilosos emergiendo de un único infundíbulo folicular51,52. Habitualmente se obtienen cultivos positivos para S. aureus y puede coexistir con la FD. Algunos autores consideran que la FP es patognomónica de la FD51, sin embargo la opinión mayoritaria es que se trata de una forma inespecífica de alopecia cicatricial52,53, ya que puede encontrarse en múltiples enfermedades cicatrizantes, tanto primarias como secundarias. Histopatológicamente se observa un infundíbulo dilatado con varios tallos pilosos en su interior que salen a la superficie por un orificio folicular común.
Celulitis/foliculitis disecanteLa CD, conocida incialmente como perifoliculitis capitis abscedens et suffodiens, es una foliculitis supurativa, por lo que el nombre de celulitis sería equívoco. Es una entidad considerada dentro de la tétrada de oclusión folicular, junto con el acné conglobata, la hidradenitis supurativa y los quistes pilonidales. Estas entidades se caracterizan por una queratinización folicular anormal que da lugar a la obstrucción del folículo piloso, con infección bacteriana secundaria y la consiguiente destrucción del folículo piloso54. Clínicamente la CD presenta nódulos inflamatorios profundos que ya desde el inicio pueden ocasionar alopecia suprayacente. Con la evolución del cuadro aparecen placas fluctuantes conectadas entre sí por trayectos fistulosos, que pueden drenar material purulento por varios orificios simultáneamente. Esta afectación profunda provoca un aspecto cerebriforme del cuero cabelludo.
En las lesiones iniciales se observa dilatación de los infundíbulos, que aparecen obstruidos por tapones córneos. En su interior se observan numerosos neutrófilos, que acaba provocando la perforación del epitelio folicular, con la consecuente formación de abscesos dérmicos y subcutáneos, que aparecen conectados entre sí por trayectos fistulosos recubiertos de epitelio escamoso estratificado. Este epitelio proviene de la vaina radicular externa folicular proliferante, y constituye la principal característica histopatológica de esta entidad7,13,51. En etapas más avanzadas el infiltrado es de tipo mixto, con presencia de linfocitos, células plasmáticas y células gigantes de tipo cuerpo extraño. En este estadio se aprecia también una extensa fibrosis que rodea abscesos y trayectos fistulosos, con la destrucción de los folículos pilosos y la consecuente alopecia cicatricial.
La presencia de trayectos fistulosos permite establecer el diagnóstico diferencial de esta entidad con el resto de foliculitis supurativas del cuero cabelludo. Sin embargo, el diagnóstico diferencial con la hidradenitis supurativa no es posible desde el punto de vista histopatológico. La diferente localización de las lesiones entre ambas entidades nos ayudará al diagnóstico definitivo.
Alopecias cicatriciales primarias mixtasAcné queloideo de la nucaEl término acné queloideo de la nuca (AQN) es equívoco, ya que designa una entidad que no está relacionada con el acné vulgar y que tampoco se caracteriza por la formación de verdaderos queloides, sino más bien cicatrices hipertróficas55. Clínicamente se caracteriza por la presencia de pápulas foliculares milimétricas, firmes al tacto, que pueden ser costrosas, umbilicadas o pustulosas con pelo en su interior51,56. Las pápulo-pústulas dan lugar a placas de aspecto queloideo y nódulos que pueden presentar secreción purulenta. Afecta preferentemente a la raza negra.
Desde el punto de vista histopatológico se observa una foliculitis inflamatoria en la que el infiltrado inflamatorio está situado en la porción inferior del istmo. Este infiltrado es granulomatoso, y se asocia a un infiltrado neutrofílico y linfocitario, con ocasionales células plasmáticas en la porción superior y media56,57. Las glándulas sebáceas resultan destruidas en etapas precoces de este proceso, observándose un importante infiltrado inflamatorio circundante cuando biopsiamos lesiones incipientes56,57. Se ha postulado que la afectación inflamatoria del infundíbulo, que lesiona su epitelio, provoca un intento de reparación en forma de fibroplasia lamelar. Sin embargo, esto no suele ser efectivo, y el folículo lesionado acaba liberando el tallo piloso a la dermis circundante ocasionando una reacción granulomatosa aguda y crónica, que se traduciría clínicamente en pápulas de consistencia firme. Debido a la afectación de la porción superior del folículo, los tallos pilosos dañados no pueden ser eliminados, lo que aumenta la reacción inflamatoria y granulomatosa, que provoca estímulos de reparación continuos, produciendo finalmente una cicatrización hipertrófica56,57. La observación de haces de colágeno de tipo queloideo es poco frecuente55–57.
Acné necrótica varioliformeEl acné necrótica es una dermatosis rara, que se presenta como una alteración necrosante del folículo piloso que da lugar a la aparición de cicatrices varioliformes. Clínicamente se caracteriza por brotes recidivantes de pápulo-pústulas foliculares con necrosis central que dejan una cicatriz deprimida58, y que afecta a pacientes adultos. Se observa principalmente en la linea frontal de implantación capilar, pero también en otras zonas seborréicas de la cara58,59.
Histopatológicamente las lesiones iniciales presentan espongiosis y exocitosis linfocitaria en el epitelio folicular asociado a disqueratosis, con un abundante infiltrado linfocitario perifolicular y perivascular58. Al evolucionar las lesiones los queratinocitos necróticos confluyen produciendo una necrosis conjunta del epitelio folicular, de la epidermis y de la dermis adventicial adyacentes. En esta zona de necrosis suelen observarse fragmentos residuales de tallos pilosos.
Dermatosis pustulosa erosivaLa dermatosis pustulosa erosiva del cuero cabelludo es una pustulosis idiopática, amicrobiana, que presenta un curso crónico con múltiples recaídas. Se caracteriza por la presencia de lesiones pustulosas en el cuero cabelludo, junto a lesiones erosivas y costrosas que con la evolución del cuadro provocan alopecia cicatricial60. Los hallazgos histopatológicos son inespecíficos60, pudiéndose observar alteraciones epidérmicas como erosiones, atrofia, acantosis, paraqueratosis y pústulas subcórneas. En la dermis suele existir un infiltrado no foliculocéntrico de carácter mixto asociado a células gigantes de tipo cuerpo extraño. En lesiones de largo tiempo de evolución el número de folículos pilosos suele estar disminuido.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.