El objetivo de la presente revisión es hacer una puesta al día sobre los trabajos más relevantes en relación con la artritis psoriásica y etanercept. El etanercept ha demostrado ser capaz de reducir los signos y síntomas de la artritis psoriásica utilizando diferentes escalas de evaluación como el DAS28, PsACR o ACR, e inhibir la progresión radiológica en estudios con seguimiento de hasta 2 años. Existen datos de eficacia en entesitis, dactilitis y afectación axial, al igual que en uñas y piel. El perfil de seguridad en los ensayos clínicos fue similar a placebo y se mantuvo en el tiempo. En modelos de coste-efectividad etanercept resulta el anti-TNF más coste-efectivo para el grupo de pacientes con artritis psoriásica y psoriasis leve o moderada. El perfil de riesgo-beneficio a corto plazo resulta favorable para etanercept. El uso de metotrexato no modifica la supervivencia del fármaco.
The aim of the present review is to provide an update on the most important recent studies on the use of etanercept in psoriatic arthritis (PsA). Using various assessment tools, such as the Disease Activity Score 28-joint count (DAS28), the PsA Response Criteria (PsARC), and the American College of Rheumatology (ACR) score, several authors have shown that etanercept can reduce the signs and symptoms of psoriatic arthritis and inhibit radiographic progression in studies with follow-up periods of up to 2 years. There is evidence that etanercept is effective in the treatment of psoriatic enthesitis, dactylitis, and axial joint disease as well as in disease affecting the skin and nails. In clinical trials, etanercept had a safety profile similar to that of placebo and this profile did not change over time. Cost-effectiveness models have found etanercept to be the most cost-effective tumor necrosis factor inhibitor in patients with psoriatic arthritis and mild to moderate psoriasis. Etanercept has a favorable risk-benefit profile in the short term. The concomitant use of methotrexate does not alter etanercept survival.
En esta revisión del tratamiento de la artritis psoriásica con etanercept describimos las características generales de los ensayos clínicos y medidas de evaluación empleadas en los mismos, el mecanismo de acción del fármaco, su eficacia clínica y efectividad, dosis óptima, asociación con fármacos antirreumáticos modificadores de la enfermedad, seguridad, inmunogenicidad y papel en el tratamiento de la enfermedad en función de los metaanálisis, estudios de equivalencia clínica y farmacoeconómicos publicados.
Se efectuó una búsqueda en PubMed para identificar publicaciones acerca de la eficacia y/o seguridad de los agentes biológicos etanercept, infliximab, adalimumab, golimumab, certolizumab, ustekinumab, secukinumab, ixekizumab y/o brodalumab en el tratamiento de la artritis psoriásica empleando la estrategia de búsqueda psoriatic, arthritis AND (etanercept OR infliximab OR adalimumab OR golimumab OR certolizumab OR ustekinumab OR secukinumab OR brodalumab OR ixekizumab) AND (randomized controlled trial OR meta-analysis). Seleccionamos ensayos clínicos aleatorizados de fase iii y otros estudios con tratamientos biológicos en pacientes con artritis psoriásica que tuvieran un mínimo de 2 articulaciones afectas.
Artritis psoriásica y directrices de tratamientoLa artritis psoriásica es una enfermedad inflamatoria mediada inmunológicamente que comparte muchos elementos fisiopatogénicos y de susceptibilidad genética con la psoriasis; se clasifica dentro del grupo de las espondiloartropatías y se puede manifestar en forma de sinovitis, entesitis, dactilitis y espondilitis, pudiendo presentarse con diferentes fenotipos (oligo y poliarticular, axial, periférica y mixta), que pueden variar con el tiempo de evolución y requieren un diagnóstico y tratamiento precoz para evitar el desarrollo de alteraciones osteoarticulares irreversibles1.
En un reciente documento de consenso Delphi2 se han propuesto unas directrices para el manejo conjunto de la artritis psoriásica por parte del reumatólogo y el dermatólogo, en las que se recogen las recomendaciones terapéuticas basadas en el Documento de Consenso de la Sociedad Española de Reumatología (SER)3 y las recomendaciones de la European League Against Rheumatism (EULAR)1 sobre el uso de terapias biológicas en la artritis psoriásica. En la actualidad existen 6 tratamientos biológicos aprobados para el tratamiento de la artritis psoriásica: adalimumab (Humira®), etanercept (Enbrel®), infliximab (Remicade®), golimumab (Simponi®), certolizumab pegol (Cimzia®) y ustekinumab (Stelara®), de los que los 3 primeros y el último están también aprobados para el tratamiento de la psoriasis. Por lo general se administran combinados con metotrexato para el tratamiento de la artritis psoriásica, aunque pueden administrarse en monoterapia cuando el tratamiento combinado con metotrexato no sea adecuado. Adalimumab y etanercept están aprobados en monoterapia tanto para psoriasis como para la artritis psoriásica, mientras que infliximab, golimumab y ustekinumab pueden emplearse indistintamente en monoterapia o asociados con metotrexato en esta última indicación.
No hay datos de comparaciones directas que avalen la superioridad de un fármaco biológico sobre otro en el tratamiento de la artritis psoriásica, por lo que la elección de uno u otro dependerá de las circunstancias particulares de cada paciente, teniendo en cuenta las comorbilidades, respuesta previa a otros biológicos, inmunogenicidad, vía de administración y mecanismo de acción del fármaco.
A falta de comparaciones directas se han efectuado revisiones sistemáticas y metaanálisis4–8, en los que se han basado estudios de equivalencia9 y evaluaciones económicas9,10 del tratamiento de la artritis psoriásica con los fármacos biológicos inicialmente disponibles (adalimumab, etanercept, golimumab e infliximab).
Medidas de evaluación de la respuesta terapéuticaCon los primeros ensayos clínicos de etanercept en la artritis psoriásica11 se hizo necesario el desarrollo de escalas de medida, individuales y compuestas, para evaluar la respuesta al tratamiento en los diversos dominios clave de la enfermedad, que incluyen las articulaciones, la piel, la entesitis, la dactilitis, la columna vertebral, el daño articular evaluado radiológicamente, la calidad de vida y la capacidad funcional12,13. Algunas de estas medidas se han tomado prestadas de la artritis reumatoide (American College of Rheumatology [ACR], Disease Activity Score [DAS]) y la espondilitis anquilosante (Bath Ankylosing Spondylitis Disease Activity Index [BASDAI], Maastricht Ankylosing Spondylitis Enthesis Score [MASES]) y otras (como el Psoriatic Arthritis Response Criteria o PsARC) se han desarrollado específicamente para la artritis psoriásica.
En un ensayo clínico histórico de sulfasalazina en la artritis psoriásica14 se desarrolló un índice de respuesta específico que fue posteriormente denominado PsARC y empleado como medida primaria de respuesta en el primer ensayo clínico de etanercept11. Una respuesta PsARC se define como una mejora de al menos 2 de las 4 medidas siguientes, una de las cuales debe ser la sensibilidad de las articulaciones o la puntuación de inflamación, sin empeoramiento en ninguna de las 4: autoevaluación global del paciente (en una escala Likert de 0 a 5); evaluación global del médico (en una escala Likert de 0 a 5); mejoría de al menos un 30% en el recuento de articulaciones hinchadas y mejoría de al menos un 30% en el recuento de articulaciones dolorosas.
Como medida de respuesta secundaria se utilizó una versión modificada del recuento de articulaciones ACR20 del ACR, diseñado para la artritis reumatoide en la época previa al tratamiento biológico15, que define un resultado dicotómico (ausencia o presencia de respuesta) basado en:
- •
Mejoría igual o superior al 20% en el recuento de articulaciones dolorosas y en el recuento de articulaciones hinchadas.
- •
Mejoría igual o superior al 20% en al menos 3 de los siguientes parámetros: velocidad de sedimentación globular (VSG) o proteína C reactiva (PCR), valoración global de la actividad de la enfermedad por el médico, valoración global de la actividad de la enfermedad por el paciente, valoración del paciente del grado de dolor y discapacidad física.
Estos criterios vienen denominándose ACR20, reflejando la necesidad de mejoría del 20% en cada uno de los parámetros, valor considerado como punto de corte clínicamente relevante. Cuando se emplea 50% o 70% como criterio de respuesta se utiliza la denominación ACR50 y ACR70, respectivamente.
En el ensayo de etanercept14 se añadieron al habitual recuento de articulaciones ACR de 68 dolorosas (2 temporomandibulares, 2 esternoclaviculares, 2 acromioclaviculares, 2 hombros, 2 codos, 2 muñecas, 10 metacarpofalángicas, 10 interfalángicas proximales, 8 interfalángicas distales, 2 caderas, 2 rodillas, 2 tobillos, 2 tarsales, 10 metatarsofalángicas, 10 interfalángicas proximales) y 66 hinchadas (las mismas exceptuando las de las caderas) las 8 articulaciones interfalángicas distales de los pies y las 2 carpometacarpianas para dar un recuento de 78 y 76 articulaciones, respectivamente.
Posteriormente se ha venido empleando sistemáticamente en los ensayos clínicos de tratamientos de la artritis psoriásica (infliximab, adalimumab, golimumab, etc.) el recuento ACR 68/66, por la dificultad en distinguir clínicamente la afectación de las 10 últimas articulaciones, y se ha considerado que esta medida de evaluación es más estricta que PsARC, puesto que proporciona un menor porcentaje de respuesta en los grupos placebo.
Otra medida de respuesta que se emplea en los ensayos de artritis psoriásica es el DAS28, que utiliza el recuento de 28 articulaciones (tumefactas o dolorosas), la VSG o la PCR y una escala analógica visual de actividad de la enfermedad para calcular una puntuación basada en una fórmula; en la mayoría de ensayos clínicos se define como objetivo terapéutico alcanzar una DAS28<3,2, que indica baja actividad de la enfermedad, o DAS28<2,6, que indica remisión.
Etanercept: resultados de los ensayos clínicos en artritis psoriásicaLa eficacia de etanercept se demostró inicialmente en un ensayo clínico aleatorizado controlado con placebo de 12 semanas de duración en el que 60 pacientes con artritis psoriásica activa (3 o más articulaciones hinchadas y 3 o más articulaciones dolorosas) sin respuesta a antiinflamatorios no esteroideos fueron asignados a recibir etanercept 25mg 2 veces por semana, por vía subcutánea, o placebo11. En cada uno de los grupos, un 47% de los pacientes, en tratamiento con metotrexato a una dosis estable inferior a 25mg/semana, continuaron tomándolo. En este estudio de 12 semanas de duración, sin extensión abierta, 26 (87%) de los pacientes tratados con etanercept alcanzaron una respuesta PsARC, en comparación con 7 (23%) de los controlados con placebo. La respuesta ACR20 fue alcanzada por 22 (73%) y 4 (13%) pacientes, respectivamente, sin que hubiera diferencias significativas en relación con el tratamiento con metotrexato. Por extrapolación visual de la figura 2del artículo, las respuestas ACR50 y ACR70 del grupo de tratamiento activo fueron 50% y 15%, aproximadamente. En los 19 pacientes de cada grupo de tratamiento en quienes se pudo evaluar la psoriasis (área de superficie corporal afectada o BSA≥3), 5 (26%) de los pacientes tratados con etanercept alcanzaron una mejoría del 75% o superior con respecto al Psoriasis Area and Severity Index (PASI) basal (respuesta PASI75), en comparación con ninguno de los del grupo placebo.
En un ensayo clínico ulterior16, con una fase inicial controlada con placebo de 24 semanas de duración y una extensión abierta hasta la semana 48, se incluyeron 205 pacientes (104 en el grupo placebo y 101 en el grupo de tratamiento con etanercept, a la misma dosis que en el anterior estudio). A las 12 semanas el 59% de los pacientes tratados con etanercept alcanzaron la respuesta ACR20, en comparación con 15% de los del grupo placebo (p<0,0001). Las respuestas ACR50 y ACR70 a las 12 semanas, por extrapolación de la figura 2 del artículo16, fueron de aproximadamente 40% y 15% en el grupo tratado con etanercept. En todos los casos la tasa de respuesta en los pacientes tratados con etanercept se mantuvo hasta la semana 24 de la fase abierta de extensión del estudio. Las tasas de respuesta PsARC fueron 72% y 70% a las 12 y 24 semanas para los pacientes tratados con etanercept y 31% y 23% para los pacientes asignados al grupo placebo, respectivamente. En este estudio16 se evaluó la progresión radiológica de la enfermedad (141 de los 169 pacientes que entraron en la fase de extensión abierta tenían datos radiográficos disponibles para el análisis a los 2 años) mediante una modificación de la puntuación Sharp total, observándose una inhibición en el grupo tratado con etanercept a los 12 meses: la tasa anualizada de cambio fue –0,03 unidades, en comparación con +1,00 unidad para el grupo placebo (p=0,0001). En el seguimiento a 2 años se observó que se mantenía la inhibición (–0,38 entre la evaluación basal y a los 2 años, –0,22 entre el primer año y el segundo en los pacientes que pasaron de placebo a etanercept)17.
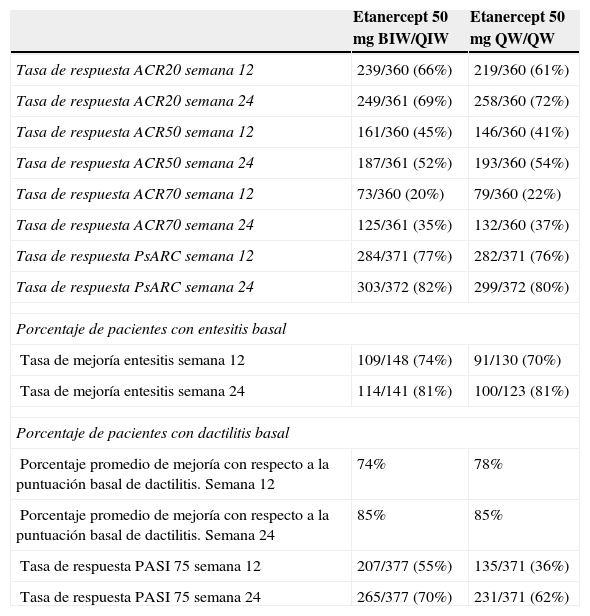
El estudio PRESTA18 incluyó 752 pacientes con psoriasis moderada-grave, que afectaba por lo menos al 10% de la superficie corporal, y artritis psoriásica comprobada por un reumatólogo, con al menos 2 articulaciones hinchadas y 2 dolorosas, pero no incluyó un grupo de control. Los pacientes fueron asignados aleatoriamente a tratamiento con etanercept 50mg 2 veces por semana (n=379) o 50mg una vez por semana (n=373) durante 12 semanas, y posteriormente etanercept 50mg una vez por semana durante 12 semanas más. El objetivo primario de eficacia fue la consecución de «blanqueamiento» o «casi blanqueamiento» en la evaluación global por el médico (PGA-m) a la semana 12. Se incluyó también una evaluación ACR 20/50/70 y PsARC, así como la respuesta PASI 75, entesitis y dactilitis, cuyos resultados se detallan en la tabla 1. Ambas pautas de tratamiento con etanercept se asociaron con una mejoría mantenida y significativa de la calidad de vida de los pacientes, ya evidenciada a partir de la tercera semana de tratamiento19.
Resultados de la evaluación de la artritis psoriásica en el estudio PRESTA
| Etanercept 50mg BIW/QIW | Etanercept 50mg QW/QW | |
|---|---|---|
| Tasa de respuesta ACR20 semana 12 | 239/360 (66%) | 219/360 (61%) |
| Tasa de respuesta ACR20 semana 24 | 249/361 (69%) | 258/360 (72%) |
| Tasa de respuesta ACR50 semana 12 | 161/360 (45%) | 146/360 (41%) |
| Tasa de respuesta ACR50 semana 24 | 187/361 (52%) | 193/360 (54%) |
| Tasa de respuesta ACR70 semana 12 | 73/360 (20%) | 79/360 (22%) |
| Tasa de respuesta ACR70 semana 24 | 125/361 (35%) | 132/360 (37%) |
| Tasa de respuesta PsARC semana 12 | 284/371 (77%) | 282/371 (76%) |
| Tasa de respuesta PsARC semana 24 | 303/372 (82%) | 299/372 (80%) |
| Porcentaje de pacientes con entesitis basal | ||
| Tasa de mejoría entesitis semana 12 | 109/148 (74%) | 91/130 (70%) |
| Tasa de mejoría entesitis semana 24 | 114/141 (81%) | 100/123 (81%) |
| Porcentaje de pacientes con dactilitis basal | ||
| Porcentaje promedio de mejoría con respecto a la puntuación basal de dactilitis. Semana 12 | 74% | 78% |
| Porcentaje promedio de mejoría con respecto a la puntuación basal de dactilitis. Semana 24 | 85% | 85% |
| Tasa de respuesta PASI 75 semana 12 | 207/377 (55%) | 135/371 (36%) |
| Tasa de respuesta PASI 75 semana 24 | 265/377 (70%) | 231/371 (62%) |
Fuente: modificada de Sterry et al.18
BIW: 2 veces por semana; QW: una vez por semana.
La eficacia de etanercept en las manifestaciones clínicas axiales se ha evaluado en un estudio multicéntrico observacional de 32 pacientes, mostrando una mejoría en diversas variables empleadas en la evaluación de la respuesta en espondilitis20,21: se consiguió alcanzar el criterio de respuesta de la Assessment of SpondyloArthritis international Society basado en el BASDAI en el 72% de los pacientes. En este estudio se alcanzó una respuesta ACR20 y ACR50 en el 78% y 56% de pacientes con afectación periférica, respectivamente.
En el estudio observacional EDUCATE22, abierto, de 24 semanas de duración, que incluyó un total de 1.122 pacientes con psoriasis en placa y afectación articular (2 o más articulaciones dolorosas e inflamadas durante al menos 3 meses, o una o más articulaciones afectas con sacroileítis o espondilitis), el tratamiento con etanercept a la dosis de 50mg semanal se asoció con una reducción promedio de 2,7 (intervalo de confianza del 95% [IC 95%] 2,53-2,84) y 1,5 (IC 95% 1,39-1,55) en las puntuaciones de la evaluación global por el paciente de dolor y afectación articular, respectivamente.
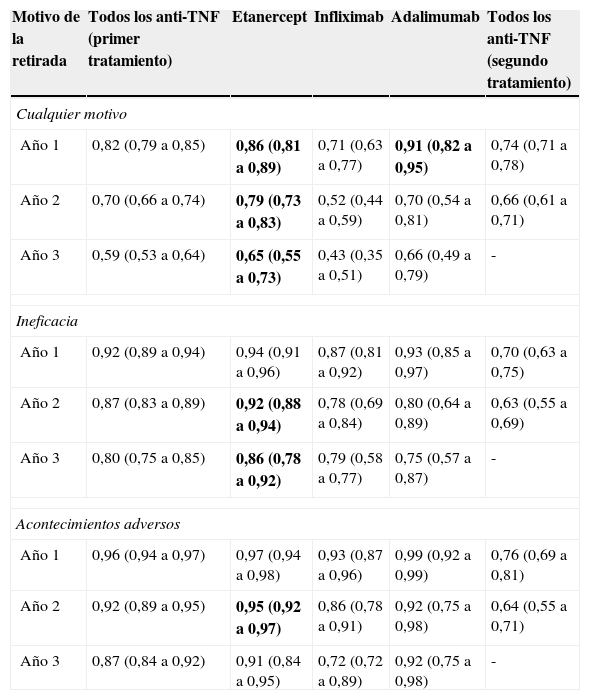
La tasa de retención del tratamiento con etanercept ha sido evaluada en varios estudios observacionales y registros. En un estudio observacional, retrospectivo, de seguimiento a 3 años en 650 pacientes con psoriasis, de los cuales el 58,6% presentaban PsA como comorbilidad asociada, etanercept mostró una adherencia superior con significación estadística a la observada con infliximab y adalimumab. En otro estudio observacional, retrospectivo, de seguimiento de 3 años en 287 pacientes con edad igual o superior a 65 años que presentaban psoriasis y artritis psoriásica asociada, etanercept y adalimumab mostraron una favorable eficacia y seguridad, si bien la adherencia fue superior para etanercept (75,4% y 60,7%, respectivamente). Los datos del British Society of Rheumatology Biologics Register, incluyendo 566 pacientes sin exposición previa a biológicos, de los que 316 (55,8%) habían recibido tratamiento con etanercept, indican que la probabilidad de retención con etanercept es en general superior a la de infliximab (tabla 2)23. En el análisis multivariante el cociente de tasas de probabilidad (hazard ratio) de retirada del tratamiento (por cualquier causa) con infliximab con respecto a etanercept fue de 2,80 IC 95% 2,12 a 3,70) (p<0,05), no observándose diferencias significativas con respecto a adalimumab. En este estudio no se observó que el tratamiento concomitante con metotrexato modificara significativamente la probabilidad de supervivencia del tratamiento biológico, lo que concuerda con los resultados de un estudio prospectivo de 82 pacientes con artritis psoriásica tratados con etanercept24. En cualquier caso el efecto del tratamiento combinado con metotrexato como promotor de la supervivencia del fármaco parece ser más marcado en el caso de infliximab25.
Función de supervivencia de la retirada del primer tratamiento biológico por año de seguimiento
| Motivo de la retirada | Todos los anti-TNF (primer tratamiento) | Etanercept | Infliximab | Adalimumab | Todos los anti-TNF (segundo tratamiento) |
|---|---|---|---|---|---|
| Cualquier motivo | |||||
| Año 1 | 0,82 (0,79 a 0,85) | 0,86 (0,81 a 0,89) | 0,71 (0,63 a 0,77) | 0,91 (0,82 a 0,95) | 0,74 (0,71 a 0,78) |
| Año 2 | 0,70 (0,66 a 0,74) | 0,79 (0,73 a 0,83) | 0,52 (0,44 a 0,59) | 0,70 (0,54 a 0,81) | 0,66 (0,61 a 0,71) |
| Año 3 | 0,59 (0,53 a 0,64) | 0,65 (0,55 a 0,73) | 0,43 (0,35 a 0,51) | 0,66 (0,49 a 0,79) | - |
| Ineficacia | |||||
| Año 1 | 0,92 (0,89 a 0,94) | 0,94 (0,91 a 0,96) | 0,87 (0,81 a 0,92) | 0,93 (0,85 a 0,97) | 0,70 (0,63 a 0,75) |
| Año 2 | 0,87 (0,83 a 0,89) | 0,92 (0,88 a 0,94) | 0,78 (0,69 a 0,84) | 0,80 (0,64 a 0,89) | 0,63 (0,55 a 0,69) |
| Año 3 | 0,80 (0,75 a 0,85) | 0,86 (0,78 a 0,92) | 0,79 (0,58 a 0,77) | 0,75 (0,57 a 0,87) | - |
| Acontecimientos adversos | |||||
| Año 1 | 0,96 (0,94 a 0,97) | 0,97 (0,94 a 0,98) | 0,93 (0,87 a 0,96) | 0,99 (0,92 a 0,99) | 0,76 (0,69 a 0,81) |
| Año 2 | 0,92 (0,89 a 0,95) | 0,95 (0,92 a 0,97) | 0,86 (0,78 a 0,91) | 0,92 (0,75 a 0,98) | 0,64 (0,55 a 0,71) |
| Año 3 | 0,87 (0,84 a 0,92) | 0,91 (0,84 a 0,95) | 0,72 (0,72 a 0,89) | 0,92 (0,75 a 0,98) | - |
Fuente: Saad et al.23
Se indican en negrita las tasas de supervivencia para cada fármaco cuyos intervalos de confianza del 95% no se solapan con los de infliximab. Datos presentados en forma de media (intervalos de confianza del 95%).
No existen estudios comparativos de asignación aleatoria a doble ciego que permitan establecer posibles diferencias de eficacia entre los diferentes agentes (biológicos o no) disponibles para el tratamiento de la artritis psoriásica. Tan solo en un estudio abierto que incluyó a 100 pacientes con artritis psoriásica sin respuesta a fármacos antiinflamatorios modificadores de la enfermedad se efectuó una asignación aleatoria a infliximab 5mg/kg cada 6-8 semanas (n=30), etanercept 50mg semanales (n=36) o adalimumab 40mg cada 2 semanas (n=34), manteniendo el tratamiento previo26, aunque con un claro predominio de pacientes recibiendo tratamiento combinado con metotrexato en el grupo tratado con infliximab. Al cabo de 12 meses las tasas de respuesta ACR20 fueron del 75%, 72% y 70% respectivamente; los pacientes tratados con infliximab y adalimumab presentaron una mejor respuesta en cuanto a PASI, mientras que los tratados con etanercept mostraron la máxima respuesta en cuanto a recuento total de articulaciones y afectación funcional medida por el Health Assessment Questionnaire.
Metaanálisis y estudios de equivalencia clínicaEl primer metaanálisis4 en el que se evaluaron los diferentes fármacos anti-TNF para el tratamiento de la artritis psoriásica incluyó 6 ensayos, con un total de 982 pacientes. La respuesta ACR20 para todos los anti-TNF fue significativamente mejor que la de placebo, con un riesgo relativo (RR) agrupado de 4,35 (IC 95% 3,24 a 5,84). Los RR para cada tratamiento individual fueron los siguientes: adalimumab 3,42, IC 95% 2,08 a 5,63; etanercept 5,50, IC 95% 2,15 a 14,04; infliximab 5,71, IC 95% 3,53 a 9,25, sin que las comparaciones indirectas mostraran diferencias entre ellos. Al evaluar la respuesta PsARC a las 12 y 24 semanas se observó el mismo patrón. No se observaron diferencias en cuanto a las tasas de retirada del estudio por cualquier causa (RR 0,48, IC 95% 0,20 a 1,18), o acontecimientos adversos (RR 2,14, IC 95% 0,73 a 6,27), ni en la tasa de acontecimientos adversos graves (RR 0,98, IC 95% 0,55 a 1,77), o infecciones respiratorias de vías altas (RR 0,91, IC 95% 0,65 a 1,28).
En otro metaanálisis5, también publicado en 2008, se incluyeron un total de 5 ensayos con fármacos anti-TNF (etanercept 2, infliximab 2, adalimumab uno) y diversos tratamientos modificadores de la enfermedad empleando el riesgo de retirada del estudio por falta de eficacia como criterio de respuesta; en el caso de los anti-TNF el RR con respecto a placebo fue 0,25 (IC 95% 0,13 a 0,48; p=0,0001), con el mejor beneficio/riesgo (cociente number needed to treat/number needed to heal=0,25) de todos los agentes estudiados, pero no se evaluaron por separado los diferentes agentes biológicos.
En una revisión sistemática del Health Technology Assessment6 publicada en 2011 se evaluó la eficacia y seguridad de etanercept, infliximab y adalimumab a partir de los datos de 6 ensayos aleatorizados a doble ciego y controlados con placebo. Empleando la respuesta PsARC como parámetro de eficacia los riesgos relativos en comparación con placebo fueron: etanercept 2,60 (IC 95% 1,96 a 3,45), infliximab 3,44 (IC 95% 2,53 a 4,69) y adalimumab 2,24 (IC 95% 1,74 a 2,88). Estos resultados fueron concordantes con los obtenidos empleando los datos agrupados de respuesta ACR20.
Ash et al.7 efectuaron un metaanálisis en el que se basaron las recomendaciones terapéuticas de la EULAR para el tratamiento de la artritis psoriásica. En este estudio no se agruparon los ensayos por fármaco sino por clase, aunque los intervalos de confianza en los gráficos de «bosque» se superponían para todos los anti-TNF. Los riesgos relativos de respuesta ACR20 en comparación con placebo en el análisis agrupado fueron 2,73 (IC 95% 2,36 a 3,15) para la respuesta PsARC a las 12-14 semanas, 4,39 (IC 95% 3,53 a 5,46) para respuesta ACR20 a las 12-16 semanas, 14,61 (IC 95% 5,96 a 35,76) para ACR70 a las 12-16 semanas y 6,89 (IC 95% 4,64 a 10,23) para la respuesta PASI50 a las 12 a 16 semanas.
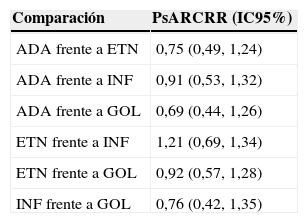
En 2012 se publicó un metaanálisis dirigido a la estimación directa y la comparación indirecta de las tasas de respuesta PsARC8 que no identificó diferencias significativas entre los diferentes agentes anti-TNF: los riesgos relativos en comparación con placebo fueron: adalimumab 2,39 (IC 95%: 1,84 a 3,12), etanercept 3,19 (IC 95%: 2,31 a 4,42), infliximab 2,64 (IC 95%: 1,66 a 4,21) y golimumab 2,45 (IC 95%: 2,39 a 4,99). El análisis de sensibilidad con resultados a las 24 semanas dio resultados similares. Las estimaciones indirectas del riesgo relativo en las combinaciones binarias se resumen en la tabla 3.
Comparaciones binarias de los fármacos anti-TNF por estimación indirecta
| Comparación | PsARCRR (IC95%) |
|---|---|
| ADA frente a ETN | 0,75 (0,49, 1,24) |
| ADA frente a INF | 0,91 (0,53, 1,32) |
| ADA frente a GOL | 0,69 (0,44, 1,26) |
| ETN frente a INF | 1,21 (0,69, 1,34) |
| ETN frente a GOL | 0,92 (0,57, 1,28) |
| INF frente a GOL | 0,76 (0,42, 1,35) |
Fuente: Thorlund et al.8
ADA: adalimumab; ETN: etanercept; GOL: golimumab; IC 95%: intervalos de confianza del 95%; INF: infliximab; PsARC: Psoriatic Arthritis Response Criteria; RR: riesgo relativo.
Empleando la respuesta ACR50 a las 24 semanas como variable primaria de eficacia para la comparación indirecta Fénix-Caballero et al.9 efectuaron comparaciones indirectas con el método de Bucher, empleando infliximab como referente y una δ del 16% (mitad de la reducción absoluta del riesgo con respecto a placebo obtenida en el metaanálisis) como criterio de equivalencia clínica. Las diferencias estimadas (reducción absoluta de riesgo) en cuanto a la variable de respuesta ACR50 con respecto a infliximab fueron 4% (IC 95% –9,5 a 17,5) para adalimumab, 4% (IC 95% –10,5 a 18,5) para etanercept y 9% (IC 95% –5,4 a 23,4) para golimumab. En el análisis de eficacia secundario, empleando ACR20, no se observaron diferencias significativas entre los fármacos, pero empleando ACR70 etanercept resultó menos efectivo que infliximab (reducción absoluta del riesgo 17%, IC 95%: 6,2 a 27,8), adalimumab (14%, IC 95% 4,9 a 23,0) y golimumab (10%, IC 95% 1,2 a 18,8).
Los resultados correspondientes a la probabilidad de obtener una respuesta PsARC obtenidos en un meta-nálisis bayesiano en red patrocinado por Pfizer y recientemente publicado10 son los siguientes: placebo 0,26 (IC 95%: 0,22 a 0,29), adalimumab 40mg cada 2 semanas 0,59 (IC 95%: 0,48 a 0,70), infliximab 5mg/kg cada 8 semanas 0,77 (IC 95%: 0,66 a 0,86), golimumab 50mg cada 4 semanas 0,78 (IC 95%: 0,66 a 0,87) y etanercept 25mg 2 veces por semana 0,73 (IC 95%: 0,60 a 0,83). El análisis de sensibilidad obtuvo resultados similares cuando se evaluó la respuesta a las 24 semanas.
Se ha publicado un metaanálisis de la progresión radiológica27 en el que se incluyeron 5 artículos con resultados de 110 pacientes. A las 24 semanas de tratamiento con anti-TNF, no había progresión radiológica en 494 de 584 pacientes (84,5%), en comparación con 362 de 526 (68,8%) de los grupos placebo, con una odds ratio de 2,68 (IC 95% 1,99 a 3,60; p<0,001). Solo 3 de los ensayos proporcionaban datos sobre la posible eficacia del tratamiento combinado con metotrexato: en 2 de ellos no se encontró una diferencia significativa, mientras que uno sugería un efecto beneficioso de la combinación.
Evaluaciones económicasUn análisis de coste-efectividad patrocinado por los National Institutes of Health Research del Reino Unido28 empleó un modelo basado en la probabilidad de respuesta PsARC y PASI75 a 12-16 semanas, según el cual en pacientes con artritis psoriásica y psoriasis leve a moderada la ratio coste-eficacia incremental de etanercept con respecto al cuidado paliativo es de alrededor de 18.000£ por Quality-Adjusted Life Year (QALY), y el de infliximab con respecto a etanercept de unas 44.000£ por QALY, siendo adalimumab menos coste-efectivo. Para un umbral de 20.000£ por QALY la probabilidad calculada de que etanercept sea coste-efectivo es del 43,6%.
La evaluación completa6 del Health Technology Assessment Program de los National Institutes of Health Research del Reino Unido, basada en los modelos publicados y los análisis de coste-efectividad aportados por los fabricantes, establece que etanercept sería la estrategia más coste-efectiva para los pacientes con artritis psoriásica y psoriasis mínima a moderada, con un umbral de 20.000-30.000£ por QALY, y los 3 biológicos evaluados (etanercept, adalimumab e infliximab) tendrían la misma probabilidad de ser coste-efectivos en pacientes con artritis psoriásica y psoriasis moderada a grave para un umbral de 20.000£ por QALY.
Un estudio recientemente publicado10 que incluye golimumab y emplea un modelo de Markov que tiene en cuenta la respuesta PsARC mantenida y la respuesta PASI50, PASI75 y PASI90, con ciclos de 3 meses, llega a una conclusión similar: empleando simulaciones Monte Carlo a 40 años etanercept resulta el tratamiento más coste-efectivo para un umbral de gasto (willingness to pay) comprendido entre 20.000 y 70.000£ por QALY, con una probabilidad del 62% para 20.000£ por QALY y del 70% para 30.000£ por QALY.
SeguridadEl perfil de seguridad delos fármacos anti-TNF ha sido estudiado extensamente en la artritis reumatoide y las espondiloartropatías. En una revisión sistemática de los ensayos clínicos con estos fármacos en pacientes con psoriasis y artritis psoriásica (incluyendo 7 estudios con un total de 1.472 pacientes tratados con etanercept)29, el perfil de riesgo/beneficio a corto plazo (12-24 semanas, 17,8 de promedio) es favorable. Las odds ratio globales de infección y neoplasia fueron 1,18 (IC 95% 1,05 a 1,33) y 1,48 (IC 95% 0,71 a 3,09), respectivamente, sin que hubiera diferencias significativas entre fármacos; en el caso de etanercept fueron 1,14 (IC 95% 0,92 a 1,40) y 1,61 (IC 95% 0,49 a 5,35), respectivamente.
Estos resultados difieren de los obtenidos en un metaanálisis que incluyó ensayos de tratamiento con infliximab o adalimumab en pacientes con artritis reumatoide, en el que se observó un incremento dosis dependiente en el riesgo de infecciones graves y neoplasias en general30, lo que sugiere que existen diferencias de susceptibilidad relacionadas con la propia enfermedad o el tratamiento inmunosupresor (metotrexato y/o corticoides), mucho más frecuente en pacientes con artritis reumatoide30.
Otras revisiones abundan en la seguridad del tratamiento biológico con fármacos anti-TNF31,32 y etanercept33 en pacientes con artritis psoriásica, aunque faltan datos a largo plazo de registros específicos para esta enfermedad y que tengan en cuenta los diferentes tratamientos.
ConclusiónEl etanercept en la artritis psoriásica ha demostrado ser capaz de reducir los signos y síntomas de la artritis, utilizando diferentes escalas de evaluación como el DAS28, PsARC o ACR. Existen datos de eficacia en entesitis y dactilitis y con los índices disponibles para espondilitis ha mostrado ser eficaz en la afectación axial de la enfermedad. A nivel cutáneo también reduce la afectación psoriásica de uñas y piel. Desde el punto de vista radiológico es capaz de frenar la progresión de la enfermedad en estudios frente a placebo, a 24 semanas, manteniendo dicho efecto en estudios de seguimiento hasta 2 años. El perfil de seguridad de etanercept fue similar al del placebo en la fase ciega del estudio y se mantuvo con la misma tasa de efectos adversos a lo largo de 48 semanas de seguimiento.
La comparación de resultados de eficacia y seguridad entre los diferentes fármacos biológicos disponibles para el tratamiento de la artritis psoriásica depende de datos extraídos a partir de diferentes metaanálisis. En función de dichos datos etanercept se muestra igual de eficaz que el resto de los anti-TNF, excepto en modelos de coste-efectividad, donde etanercept se ha mostrado como el fármaco anti-TNF más coste-efectivo para el grupo de pacientes con artritis psoriásica y psoriasis leve o moderada. En lo que se refiere a seguridad, el perfil de riesgo/beneficio a corto plazo fue favorable para etanercept.
El uso de metotrexato no modifica significativamente la supervivencia del fármaco, pero se desconoce la implicación exacta del mecanismo de acción de etanercept y/o el papel de la inmunogenicidad en estos resultados.
Conflicto de interesesLluís Puig ha recibido apoyo financiero de Pfizer España SLU en relación con el desarrollo de este manuscrito.
El resto de autores declara que no tiene ningún conflicto de intereses.