El herpes zóster presenta una incidencia de 42 casos por cada 100.000 personas/año, siendo la afectación de niños muy rara. La vacuna de la varicela ofrece una protección del 90% frente a la varicela y cerca del 100% frente a los casos graves1. Inicialmente se esperaba una menor incidencia de herpes zóster tras la inmunización. Sin embargo, el virus vacunal puede causar una infección latente, manifestándose después en forma de herpes zóster. Recientemente, algunos estudios también han demostrado un riesgo significativamente mayor de herpes zóster en niños con infección natural por varicela que en niños vacunados sin historia de varicela2,3.
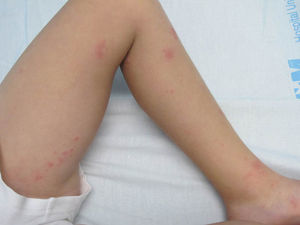
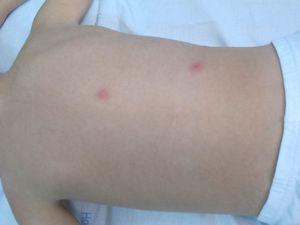
Caso clínicoUn niño de 6 años de edad acudió a nuestro hospital por la aparición de unas lesiones pruriginosas y dolor predominantes en el miembro inferior izquierdo. Había recibido una sola dosis de la vacuna del virus varicela zóster (VVZ) a los 15 meses. Durante la exploración se evidenciaron vesículas agrupadas sobre una base eritematosa, siguiendo una distribución metamérica en la cara interna del muslo izquierdo (fig. 1), así como otras lesiones dispersas en el miembro inferior contralateral y en la zona lumbar (fig. 2). Se realizaron hemograma y bioquímica sanguíneos, cuyos resultados fueron normales salvo una ligera linfopenia (1,91×103/μl [valores normales: 2,70-12,60]). La serología del VVZ objetivó positividad de IgG anti-VVZ y la PCR de un frotis obtenido de una de las vesículas fue positiva. Tras tratamiento con aciclovir 250mg/m2 cada 8h por vía oral y revisión a los 4 días se evidenció una franca mejoría de las lesiones y del dolor, habiendo desaparecido la alteración en la marcha.
DiscusiónDesde 1998 se han descrito varios casos de herpes zóster en niños tras la vacunación, utilizándose técnicas de biología molecular para diferenciar la cepa salvaje del virus frente a la cepa vacunal (Oka).
La incidencia estimada de herpes zóster en niños vacunados varía ampliamente entre los diversos estudios realizados, situándola entre 262,1/100.000 personas/año tras la infección natural, y 93,3/100.000 personas(año tras la vacunación2,4. Esta incidencia podría estar subestimada debido a un infradiagnóstico de esta entidad, asociado a su desconocimiento, a la baja incidencia de herpes zóster en los niños y a la atipia de los casos posvacunales. Se encuentran diferencias clínicas en los casos producidos por la cepa vacunal respecto a los producidos por la cepa salvaje, lo que podría llevar a una menor frecuencia de consultas entre los primeros; entre estas destacan que los herpes zóster posvacunales suelen presentarse con lesiones menos dolorosas, más pequeñas, con menor frecuencia de vesículas y predominio de dermatomas lumbosacros5. Nuestro caso, sin embargo se distancia de esta forma de presentación e ilustra la atipia de los mismos al tratarse de un niño con lesiones diseminadas y con dolor intenso en la metámera afectada.
Para evaluar la incidencia de esta complicación se han realizado estudios en niños con leucemia, dada su mayor susceptibilidad al desarrollo de herpes zóster, aunque es importante reseñar que no se recomienda la vacunación rutinaria de individuos inmunocomprometidos, al tratarse de una vacuna de virus vivos atenuados. En estos niños, la incidencia de herpes zóster fue 3 veces superior en aquellos que tuvieron infección natural por el virus frente a los vacunados6.
En cuanto a los factores que pueden influir en la aparición del herpes zóster posvacunal, la edad de administración de la vacuna podría ser relevante, debido a una menor inmunogenicidad a una menor edad. La reactivación del virus Oka resulta más frecuente en niños vacunados con bajos títulos de anticuerpos anti-VVZ7. Estos datos concuerdan con la evidencia obtenida de que contraer la infección por varicela en el primer año de vida incrementa considerablemente el riesgo de herpes zóster en la infancia. Esto podría explicarse por el bajo nivel de inmunidad cuando la varicela se contrae a una menor edad8. El tiempo en el que tarda en presentarse el herpes zóster después del contacto con el virus también tiene relación con la edad en la que se produce ese contacto. El tiempo medio estimado en los niños que padecieron la varicela hasta que desarrollaron el herpes zóster fue de 4,12 años, siendo significativamente menor en aquellos diagnosticados de varicela a una edad menor a los 2 años2.
Un factor que parece aumentar el riesgo de herpes zóster tras la vacunación de varicela es la aparición de un exantema tras su administración. De esta forma se ha hallado que el riesgo relativo de que los vacunados desarrollen herpes zóster es 5,75 veces mayor en niños que habían desarrollado un exantema asociado a la vacuna. Existe la hipótesis de que las lesiones en la piel permiten al virus entrar en los nervios cutáneos y establecer una infección latente. La menor incidencia de herpes zóster posvacunal podría deberse a que se trata de una vacuna atenuada, pudiendo tener un menor acceso a los nervios sensoriales9.
Como conclusión, presentamos un caso de un niño con vacunación incompleta frente al VVZ con herpes zóster diseminado. A pesar de que esta complicación está descrita en la literatura, no se ha observado un aumento de su incidencia tras la vacunación. La vacunación incompleta condicionó probablemente un bajo nivel de inmunidad que favoreció el desarrollo de este cuadro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.