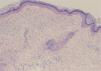
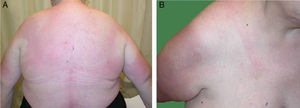
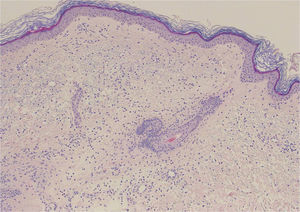
Una mujer de 68 años, con antecedentes de sordera neurosensorial y anemia de trastornos crónicos, consultó por episodios recurrentes de más de 20 años de evolución de fiebre, artralgias, mialgias y lesiones cutáneas en brazos y tronco. Estos se producían cada 2-6 meses, duraban unos 15 días y permanecía asintomática entre brotes. Presentaba grandes placas eritematoedematosas en tronco y raíz de extremidades superiores, acompañadas de fiebre de 38°C (fig. 1). La analítica sanguínea fue normal. La biopsia cutánea mostró edema y un infiltrado inflamatorio en dermis superficial, con linfocitos y neutrófilos, sin necrosis fibrinoide (fig. 2).
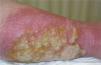
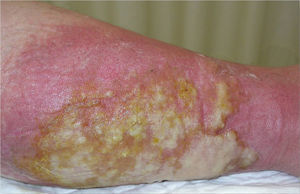
Posteriormente, presentó fiebre asociada a eritema y aumento de temperatura en una pierna, con ampollas y exudado abundante (fig. 3). En un cultivo se aisló un microorganismo gramnegativo, que se interpretó como una celulitis infecciosa. A los 4 meses presentó un cuadro clínico similar en la pierna contralateral.
Se realizó un estudio genético de los genes MEFV, TNFRSF1A, MVK, NLRP3, NOD2 y PSTPIP1. La paciente era portadora heterocigota de la variante c.1772T>C del gen MEFV.
Dado que además cumplía los criterios diagnósticos de Tel-Hashomer, de la fiebre mediterránea familiar (FMF), se diagnosticó de esta entidad (tabla 1). Se pautó tratamiento con colchicina, con lo que se observó una gran mejoría clínica.
Criterios diagnósticos de Tel-Hashomer
| Criterios Mayores | Criterios menores | Datos que apoyan el diagnóstico |
|---|---|---|
| Brotes típicos: recurrentes, <72 horas, febriles 1. Peritonitis generalizada 2. Pleuritis unilateral o pericarditis 3. Monoartritis de extremidades inferiores (EI) 4. Fiebre como manifestación aislada | Brotes atípicos: sin fiebre, duración más prolongada, otras manifestaciones diferentes de 1-3 de los Criterios Mayores 4. Dolor en EI con el esfuerzo 5. Respuesta favorable a colchicina | 1. Historia familiar de FMF 2. Origen étnico típico 3. Inicio < 20 años Características de los brotes: 4. Afectación severa del estado general que requiera reposo 5. Remisión espontánea 6. Sin síntomas entre brotes 7. Elevación de al menos 1 RFA: fibrinógeno, leucocitos, VSG 8. Episodio de proteinuria/ hematuria 9. Abdomen agudo con laparotomía blanca 10. Consanguinidad |
Es necesario cumplir:
- 1 criterio mayor
- 2 criterios menores.
- 1 criterio menor + 5 hallazgos que apoyen el diagnóstico.
- 4 de los 5 primeros datos que apoyan el diagnóstico.
En negrita los criterios de nuestra paciente, quien cumplía 2 criterios menores y 4 que apoyan el diagnóstico.
RFA: reactante de fase aguda.
La FMF es la enfermedad autoinflamatoria que más frecuentemente se manifiesta en la edad adulta1. Su herencia es monogénica autosómica recesiva (AR), producida por una mutación en el gen MEFV (16p13.3), aunque un 20% de los pacientes son heterocigotos2. Esto podría deberse a que se trate de una enfermedad autosómica dominante con penetrancia variable; que no fuera posible detectar la 2.a mutación por limitaciones en la técnica, o que se tratara de una enfermedad poligénica. Algunos autores afirman que estos pacientes tendrían un inicio más tardío de la enfermedad, con menor duración del brote, síntomas más leves y más tiempo entre los mismos3.
El gen MEFV codifica una proteína llamada pirina o marenostrina y actúa en la regulación de la respuesta inmune innata. Al estar esta proteína alterada, se produciría una ausencia en el control de la vía, aumentando la IL1β, la responsable de la respuesta inflamatoria en esta enfermedad4.
Soriano y Manna5 describen 4 fenotipos clínicos de la enfermedad:
- –
Tipo 1: pacientes con episodios recurrentes de corta duración (12-72h) con fiebre, dolor abdominal agudo, afectación articular, dolor torácico agudo por pleuritis/pericarditis y diferentes manifestaciones cutáneas. Entre brotes suelen permanecer asintomáticos, aunque con evidencia bioquímica de enfermedad.
- –
Tipo 2: personas que desarrollan amiloidosis secundaria (tipo AA) con proteinuria o fallo renal antes de manifestar otros signos de FMF o como manifestación aislada en familiares de afectados con FMF.
- –
Tipo 3: portadores de la mutación del gen MEFV sin manifestaciones clínicas de la enfermedad ni amiloidosis. Se da en poblaciones endémicas (como los judíos en Irak y Ashkenazi), donde hay una prevalencia de 1/25-300 personas. Aunque la mayoría nunca tienen clínica, algunos con el tiempo desarrollarán amiloidosis (fenotipo 2).
- –
«FMF-like»: pacientes heterocigotos con manifestaciones clínicas leves de la enfermedad. Este fenotipo correspondería a nuestra paciente.
Las manifestaciones cutáneas de la enfermedad6 se dan en un 10-40% de los pacientes afectados. Las lesiones tipo erisipela o celulitis son las únicas consideradas como específicas (5-30% de los pacientes con FMF) y se localizan en cara anterior de piernas y dorso de pies. La histología revelaría un infiltrado dérmico perivascular sin vasculitis, compuesto fundamentalmente por mononucleares y neutrófilos7. Probablemente los episodios que tuvo nuestra paciente en las piernas correspondían a este cuadro clínico. La paniculitis puede manifestarse como un eritema nudoso o una paniculitis neutrofílica. Las manifestaciones urticariformes son más típicas de otros síndromes autoinflamatorios como el TRAPS y el CAPS8.
Debe realizarse el diagnóstico diferencial con otras enfermedades autoinflamatorias8. En nuestro caso, se pensó en el síndrome de Muckle-Wells, por los brotes de lesiones urticariformes y la sordera neurosensorial, aunque finalmente las pruebas genéticas confirmaron el diagnóstico de FMF. Algunos autores defienden que los pacientes con FMF podrían tener una prevalencia mayor de pérdida auditiva que la población no afecta, pero esto no ha podido comprobarse en ningún estudio controlado9.
Los criterios diagnósticos de la FMF se establecieron en 1997 (tabla 1)10. El diagnóstico es clínico y el examen genético solo lo apoyaría. En nuestra opinión, en algunos casos la genética puede ser fundamental para llegar al diagnóstico. Sin embargo, la detección de una mutación por sí sola no puede confirmarnos el diagnóstico, sobre todo en poblaciones endémicas donde la prevalencia de la mutación es muy alta.
Los objetivos principales del tratamiento son la prevención de los brotes y de la amiloidosis secundaria a largo plazo. El fármaco de primera elección es la colchicina 1-3mg/día4.
Finalmente, ante un paciente con episodios recurrentes de fiebre con manifestaciones cutáneas, debemos pensar en los síndromes autoinflamatorios, entre los que se encuentra la FMF. El diagnóstico es fundamentalmente clínico, aunque el estudio genético puede sernos muy útil. Clásicamente se considera una enfermedad AR, aunque un porcentaje importante de pacientes son heterocigotos y tienen síntomas, por lo que todavía quedan aspectos genéticos por dilucidar en esta enfermedad.