Las reacciones en el punto de inyección son las complicaciones más frecuentes de la mayoría de los tratamientos que se administran por vía subcutánea.
Presentamos una mujer de 31 años, sin alergias medicamentosas conocidas, con antecedentes de asma e hidradenitis supurativa, ambos sin tratamiento actual, y esclerosis múltiple (EM) en su forma remitente-recurrente (EM-RR). Desde hace 4 años y medio la paciente realizaba tratamiento con inyecciones subcutáneas diarias de 20mg de acetato de glatirámero (AG, Copolymero-1, Copaxone®, Sanofi-Aventis Barcelona, España).
Consultó en Urgencias por un dolor agudo en el momento de la inyección del acetato de glatirámero (AG) en el glúteo izquierdo que no presentaba en las inyecciones habituales, junto con la aparición en la zona del pinchazo de una placa blanquecina que fue cambiando a eritematosa y necrótica en los 5 días siguientes.
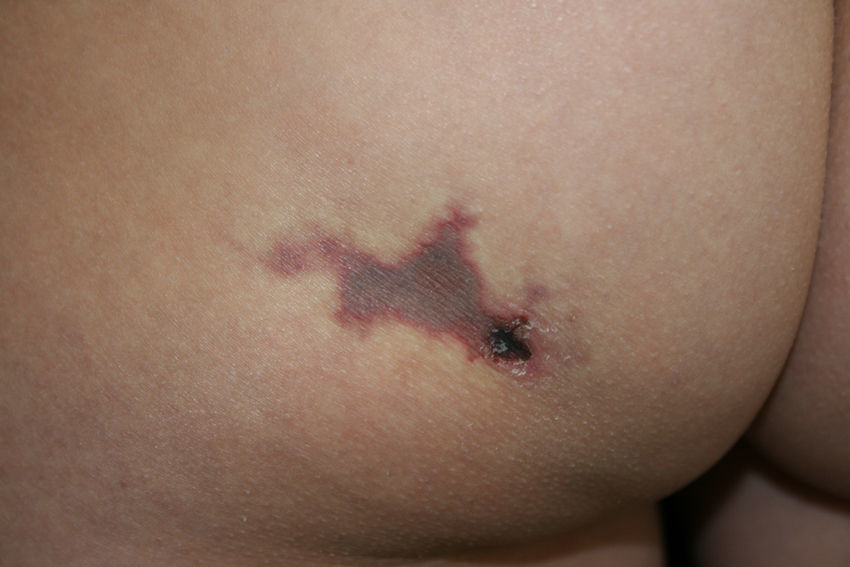
A la exploración (fig. 1) se observaba en el glúteo izquierdo una placa eritemato-grisácea de unos 3cm, de configuración geográfica, con un centro necrótico, borde eritemato-violáceo más marcado y morfología livedoide. En la zona más caudal de la lesión se apreciaba una costra redondeada, profunda y adherida de unos 8mm.
Interrogando a la paciente esta realizaba de forma adecuada el protocolo de inyección: no repetía el mismo lugar de aplicación en menos de una semana, dejaba el fármaco a temperatura ambiente 20 minutos antes de su uso y colocaba la aguja en la posición adecuada. Además, había seguido inyectándose el tratamiento en los días siguientes en los muslos y el abdomen sin apreciar ninguna lesión en esos nuevos puntos de inyección. Refería un cuadro de características similares al actual en el mismo glúteo un año antes que se había resuelto sin tratamiento y que había dejado una zona de hipopigmentación residual.
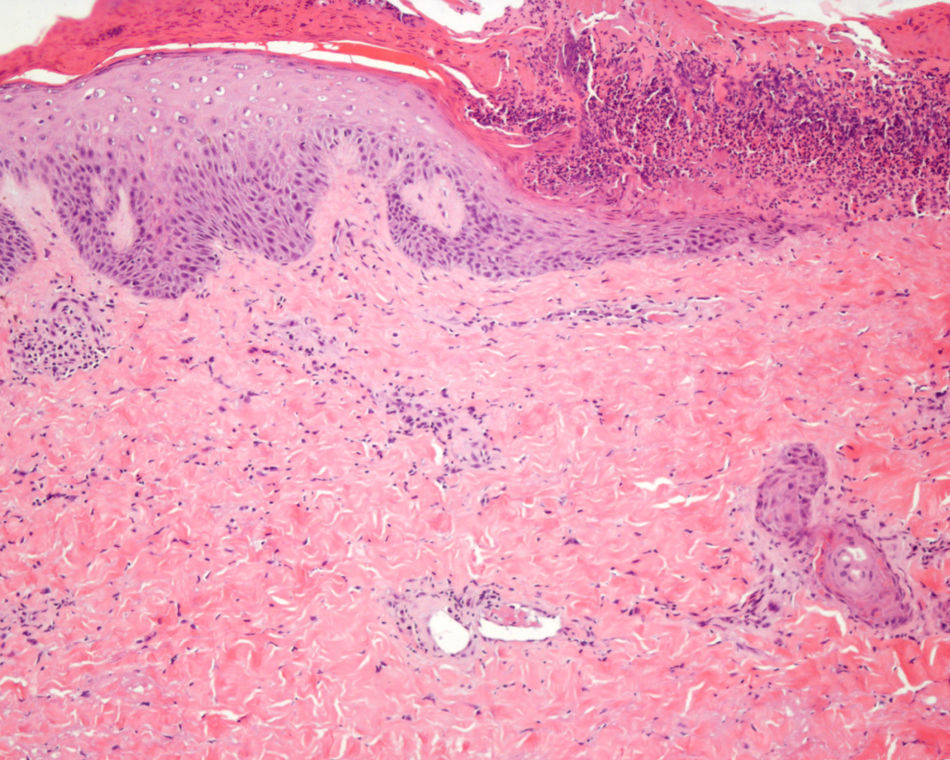
Se realizó una biopsia de la zona periférica de la lesión cutánea del glúteo, en la que se observó una epidermis parcialmente necrosada con necrosis coagulativa del colágeno dérmico, necrosis grasa y presencia de algunos trombos de fibrina en vasos de pequeño calibre (fig. 2). Una analítica con sistemático de sangre, bioquímica con perfil hepático, renal, inmunoglobulinas, complemento, anticuerpos antinucleares, anticardiolipina, anticuerpos contra antígenos nucleares extraíbles y estudio de coagulación no mostró alteraciones relevantes.
Con todos estos datos se diagnosticó a la paciente de síndrome de Nicolau. Se instauró tratamiento tópico con ácido fusídico y betametasona dos veces al día durante 10 días, con mejoría lenta de la lesión que se resolvió con una cicatriz levemente deprimida un mes después.
El AG es una mezcla de polipéptidos sintéticos utilizada en el tratamiento de la EM-RR que ha demostrado reducir el número de brotes de la enfermedad y la discapacidad de los pacientes1. El evento adverso más frecuente son las reacciones en el punto de inyección en forma de dolor, inflamación e induración, que ocurre en el 60% de los casos y desaparece en horas-días sin dejar lesión residual2. Esto las diferencia de un cuadro menos frecuente pero característico del AG, la paniculitis en el punto de inyección. Se trata de una paniculitis predominantemente lobulillar que clínicamente se presenta como lesiones nodulares subcutáneas eritematosas que se resuelven en dos o tres meses y en todos los casos dejan una lipoatrofia residual2.
El síndrome de Nicolau (SN), vasculopatía livedoide o embolia cutis medicamentosa fue inicialmente descrito en 1924 por Freudenthal y en 1925 por Nicolau3. En 1930 Gay-Prieto comunicó un caso similar4. La primera descripción de SN tras inyección subcutánea de AG la realizó Gaudez en el año 20035, y desde entonces se han publicado pocos casos similares6–8. El mecanismo patogénico no está claro, pero parece que una inyección accidental peri o intravascular del fármaco provocaría un vasoespasmo y una trombosis intravascular que daría lugar a una necrosis cutánea localizada mediada por la isquemia9.
Se trata de una reacción imprevisible e inevitable en la que desempeña un papel determinante la técnica de inyección, y pensamos que quizá tenga alguna relación con el fármaco administrado, ya sea por su peso molecular o por el pH del excipiente utilizado.
En cualquier caso, al tratarse de una reacción secundaria a la técnica de la inyección y no al fármaco en sí, su aparición no debe contraindicar la continuación del tratamiento.
Por ser una medicación de uso diario, cuando la paciente acudió a consulta ya se había puesto 4 inyecciones posteriores a la aparición de la lesión cutánea, y era lógico pensar que no se trataba de una reacción mediada por mecanismo inmunológico o alérgico, puesto que en ese caso la lesión se habría reproducido en los días posteriores.
Al tratarse de una paciente diestra, el glúteo izquierdo es la zona más incómoda e inaccesible para la inyección del fármaco, y quizás el ángulo de inyección o la profundidad de la administración del fármaco no fueran los adecuados.
Tras la resolución del cuadro, y la advertencia de no ponerse la inyección en los glúteos, ha continuado con la misma pauta de tratamiento sin aparición de nuevas lesiones en los puntos de inyección un año después de la consulta.