El objetivo de esta revisión es alertar al dermatólogo y a los clínicos en general de los signos y síntomas cutáneos que pueden contribuir al diagnóstico precoz de una neoplasia subyacente. Puesto que la piel es uno de los órganos más accesibles, nunca debe ser ignorada en las enfermedades sistémicas. Posee la ventaja de que su exploración no requiere técnicas agresivas y nos revela datos importantes de la situación del paciente.
Habitualmente se abordan los síndromes paraneoplásicos clásicos, pero hay una gran variedad de procesos cutáneos no estrictamente paraneoplásicos, que en un determinado contexto sugieren la presencia de una malignidad o que tienen más riesgo de desarrollarla a lo largo de la vida.
Se ha optado por enumerar las distintas dermatosis agrupándolas por su morfología clínica, siguiendo un orden aleatorio.
Varios de los procesos comparten signos y síntomas múltiples, por lo que se ha recurrido al más notorio para incluirlo en un determinado grupo.
The aim of this review is to familiarize dermatologists and clinicians in general with cutaneous signs and symptoms that can help lead to an early diagnosis of an underlying malignancy. Because the skin is one of the most accessible organs, it should never be overlooked in systemic disease. Examination of the skin has the advantage of revealing important information about the patient's condition without requiring the use of invasive techniques.
In the literature, most discussions of cutaneous manifestations of internal malignancy refer to classic paraneoplastic syndromes, but a wide variety of skin conditions, while not strictly paraneoplastic, can, in certain contexts, indicate the presence of malignancy or an increased risk of developing cancer later in life.
In this review, various skin conditions that can signal malignancy or increased cancer risk are presented in randomly ordered groups based on clinical morphology.
Conditions with multiple signs and symptoms have been classified on the basis of their most characteristic feature.
La piel nunca debe ser ignorada en las enfermedades sistémicas; es quizás el órgano más accesible y su exploración no requiere técnicas agresivas.
En las neoplasias internas la piel puede ofrecer el primer síntoma guía en el 1% de los pacientes. Esto, junto a una historia clínica detallada, supone una importante alerta de la presencia de un tumor maligno.
Las manifestaciones cutáneas de malignidades internas se pueden producir por invasión directa de la piel por el tumor y por diseminación metastásica, pero existen mecanismos indirectos que inducen la aparición de signos y síntomas cutáneos no relacionados con el tumor primitivo. Algunos de ellos cursan de forma aislada, pero otros forman parte de síndromes paraneoplásicos complejos; ambos son indicativos de la presencia de una neoplasia subyacente.
Curth, en 1976, propuso una serie de criterios requeridos para establecer una relación entre una dermatosis y un proceso maligno. Actualmente los síndromes paraneoplásicos se definen como aquellos procesos que preceden (el tumor puede estar presente pero no diagnosticado), acompañan o siguen a la aparición de un cuadro maligno sin evidenciarse la presencia de células tumorales del mismo y siguiendo un curso paralelo. Su naturaleza en sí misma no es cancerígena. La incidencia general se estima entre el 7-15% de pacientes con tumores malignos. Los síndromes paraneoplásicos cutáneos reflejan la interacción existente entre las células tumorales (tanto del tumor primitivo como de sus metástasis) y el huésped. La patogenia de estos procesos no está aclarada en su totalidad, pero se atribuye a la producción excesiva o a la depleción de sustancias biológicamente activas, factores de crecimiento, hormonas, otros mediadores no identificados producidos por el tumor o a interacciones antígeno-anticuerpo con una respuesta aberrante por parte del huésped a varios tipos de cáncer.
Con frecuencia es difícil definir una relación causal entre el tumor y el síndrome paraneoplásico porque la relación temporal es variable. La dermatosis puede preceder o no a la aparición del tumor, o puede comenzar mucho tiempo después, y esto se explica porque a veces se requiere cierta masa tumoral o una diferenciación específica de las células tumorales para la producción de los síntomas1–7.
En esta revisión se analizan los signos y síntomas cutáneos que pueden conducir al diagnóstico de una malignidad subyacente, formen parte o no de los síndromes paraneoplásicos. Se enumeran una gran variedad de procesos, algunos de ellos definidos genuinamente como «paraneoplásicos clásicos» (se señalan con un asterisco [*]), pero otros corresponden a un grupo amplio de dermatosis frecuentes observadas en el ámbito cotidiano, habitualmente no indicativas de malignidad, pero que en determinadas situaciones y con ciertas peculiaridades nos pueden alertar de la presencia de una neoplasia y requieren un alto grado de «sospecha clínica». Del clínico depende realizar pruebas complementarias para su estudio o mantener un seguimiento, sobre todo en aquellos en que la asociación a malignidad no tiene una frecuencia significativa o en algunas genodermatosis que en su evolución tienen mayor riesgo de desarrollar determinadas neoplasias. Se señalan con dos asteriscos (**) los procesos ocasionalmente asociados a una neoplasia interna y con tres (***) los excepcionalmente asociados a neoplasias internas (tabla 1).
Se ha optado por agrupar los signos y síntomas según su morfología clínica. Establecer un orden en esta relación resulta complicado, por lo que se enumeran los grupos morfológicos de una forma aleatoria (tabla 2). Algunas entidades complejas comparten varios signos y síntomas encuadrables en distintos grupos, por lo que se ha tenido en cuenta el aspecto más notorio para incluirlo en uno determinado.
Signos cutáneos indicadores de posibles neoplasias internas
| Eritema, edema facial y flushing |
| Hiperpigmentación |
| Lesiones anulares |
| Lesiones eritematoescamosas e hiperqueratósicas |
| Engrosamiento e induración cutánea |
| Lesiones vasculares |
| Lesiones erosivas y ampollares |
| Pápulas y nódulos inflamatorios |
| Xerosis, ictiosis, dermatitis exfoliativa (eritrodermia) |
| Prurito y prúrigo |
| Hirsutismo e hipertricosis |
| Hiperhidrosis y anhidrosis |
| Tumores cutáneos |
| Alteraciones bucales |
| Alteraciones ungueales |
El artículo se ha dividido en dos partes; en la primera se abordan los 6 primeros grupos de la tabla 2.
Eritema, edema facial y flushingEl eritema facial episódico o flushing es un síntoma relativamente frecuente que se manifiesta en múltiples dermatosis, algunas banales, pero que en ocasiones es la guía fundamental que delata un proceso maligno. A continuación se detallan los más frecuentes (tabla 3).
Procesos que cursan con eritema, edema facial y flushing y posible neoplasia interna
| Síndrome carcinoide** |
| Feocromocitoma** |
| Síndrome de la vena cava superior** |
| Mastocitosis** |
| Dermatomiositis** |
| Lupus eritematoso sistémico*** |
| Varios tumores*** |
| Síndrome de Bloom, síndrome de Rothomund-Thomson*** |
**Procesos ocasionalmente asociados a neoplasia interna; ***procesos excepcionalmente asociados a neoplasia interna
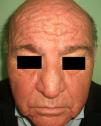
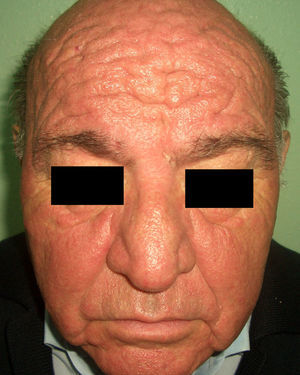
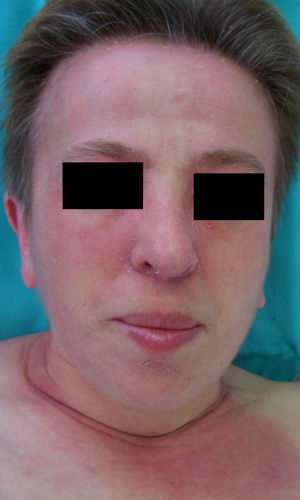
En el síndrome carcinoide (**) el paciente es portador de un tumor neuroendocrino que produce sustancias vasoactivas: serotonina, histamina, bradiquinina, prostaglandinas, etc. responsables del cuadro clínico que lo caracteriza. Implica casi siempre la presencia de metástasis hepáticas. Cursa con episodios de flushing repetidos que pueden evolucionar a una rosácea severa, y en ocasiones a facies leonina por el desarrollo de frontofima, rinofima y zigofima (fig. 1). En casos más avanzados se aprecia hiperpigmentación, lesiones pelagroides por consumo de triptófano (hiperqueratosis, xerosis, descamación, glositis), paquidermoperiostosis (engrosamiento cutáneo) con acropaquia, lesiones esclerodermiformes, placas parduzco-anaranjadas, prurito, eritema anular centrífugo, acrocianosis y pioderma gangrenoso. El cuadro se completa con un cortejo sistémico con episodios diarreicos, pérdida de peso, tos, disnea y broncoespasmo. El diagnóstico se confirma con la comprobación de la elevación de 5-hidroxi-indolacético en orina de 24 horas7–9.
El feocromocitoma (**) es un tumor neuroendocrino derivado de las células cromafines, productor de catecolaminas. En el 80% de los casos se origina en la médula suprarrenal, aunque algunos son ectópicos.
El eritema surge después de episodios de hipertensión, taquicardia, palpitaciones, dolor torácico, cefalea pulsátil, sudoración excesiva y palidez. La determinación de ácido vanilmandélico y catecolaminas en orina, habitualmente elevadas, aclara el diagnóstico. Su incidencia es mayor en pacientes con neurofibromatosis tipo i (no siempre son malignos). Rasgos cutáneos adicionales son la hiperpigmentación de tipo adissoniano, consecuencia de la producción ectópica por el tumor de ACTH y hormona estimulante de melanocitos (MSH), que remite con la intervención quirúrgica10.
Otro proceso, que para el dermatólogo comienza con edema facial, es el síndrome de la vena cava superior (SVCS) (**). Puede producirse por obstrucción extrínseca, por una tumoración que comprima la vena cava superior o por trombosis intrínseca.
Se caracteriza por la tríada: a) edema en esclavina (afecta a la cara, el cuello y el tercio superior de tórax); b) cianosis facial, por estasis venosa; y c) circulación colateral toracobraquial. Si el proceso progresa aparece ingurgitación yugular, disnea, ortopnea, tos, dolor torácico y signos consecutivos al edema cerebral (mareos, náuseas, visión borrosa).
En la etiología del SVCS destacan, como más frecuentes (85-90%) las causas malignas, encabezadas por el cáncer de pulmón, sobre todo el microcítico (oat cell) y si se localiza en la región derecha. Le siguen en frecuencia los linfomas no Hodgkin, tumores de células germinales, timomas y tumores metastásicos, el más frecuente el cáncer de mama11,12.
El flushing también puede ser manifestación de una mastocitosis (**). En el caso de mastocitosis sistémica o agresiva a veces evoluciona a una leucemia de células mastocitarias. En esta entidad el eritema súbito o flushing se atribuye a la degranulación de los mastocitos que contienen histamina, heparina, citoquinas, factor de necrosis tumoral, etc. El diagnóstico se sospecha con la historia clínica, y si se detectan lesiones cutáneas se confirma con la biopsia. Se determina la triptasa sérica y solo se realiza biopsia de médula ósea en pacientes con signos de trastorno hematológico o mastocitosis agresivas que habitualmente cursan con flushing7,13.
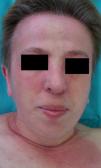
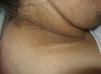
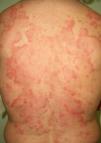
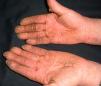
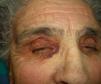
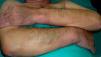
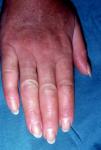
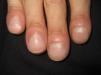
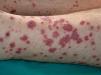
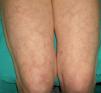
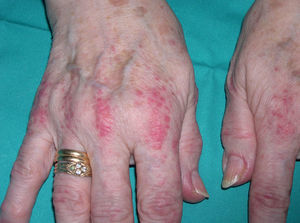
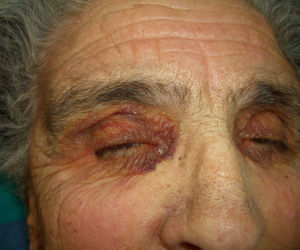
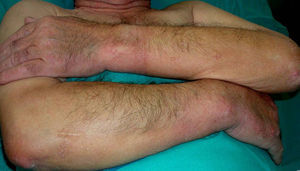
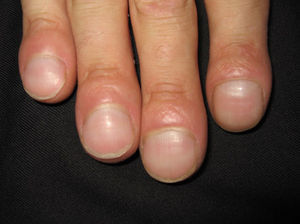
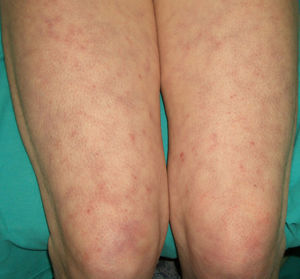
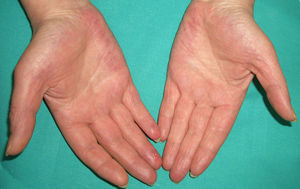
En ocasiones el eritema y el edema facial, no episódicos sino persistentes, son la manifestación inicial de una dermatomiositis (DM) (**) que cursa con edema y eritema heliotropo en anteojos, eritema malar, fotosensibilidad (fig. 2), además de otras lesiones características en las manos (fig. 3), poiquilodermia y telangiectasias ungueales. El desarrollo de lesiones vesiculoampollosas tiene una alta relación con la malignidad14, al igual que la necrosis cutánea asociada15,16. Puede cursar con o sin miositis que se traduce en debilidad muscular proximal.
Aproximadamente entre el 10-30% de pacientes adultos con DM tienen una malignidad asociada que puede surgir antes, durante o después del diagnóstico de DM. En la mujer es más frecuente el cáncer de ovario y el de mama17, y en el varón el de pulmón y el de próstata, pero los tumores gastrointestinales, ureterales18, carcinomas nasofaríngeos y otros también se pueden encontrar19. En la DM paraneoplásica no suele manifestarse el fenómeno de Raynaud, y la respuesta al tratamiento esteroideo es mala, requiriendo otros inmunosupresores. La DM infantil raramente se asocia a neoplasia subyacente20,21.
Se recomienda despistaje de malignidad al menos una vez al año durante tres años en los adultos diagnosticados de DM2,3,17.
Siguiendo en la línea de las conectivopatías, lesiones tipo lupus eritematoso sistémico (***), y por tanto eritema facial acompañado del cortejo sistémico y analítico propio del cuadro, se han observado en pacientes con linfoma intravascular y linfoma no Hodgkin y tipo Hodgkin22.
Con menor frecuencia el eritema y edema facial son síntoma guía (***) de tumores cerebrales, carcinoma medular de tiroides (puede secretar sustancias bioactivas, acompañarse de diarrea y metástasis óseas), carcinoma renal (produce sustancias hormonales responsables del flushing) o tumores pancreáticos (secretan sustancias variadas que también producen diarrea)7,13.
En los síndromes hereditarios con inmunodeficiencia, en los cuales un rasgo importante es el eritema, hay que destacar el síndrome de Bloom y el síndrome de Rothomund–Thomson (***), que cursan ambos con eritema y fotosensibilidad. En el primer caso son pacientes susceptibles de desarrollar leucemia, linfoma y adenocarcinoma gastrointestinal. En el síndrome de Rothmund-Thomson se añaden otros signos cutáneos como telangiectasias y atrofia de la piel facial (aspecto poiquilodérmico), de las extremidades y de las nalgas, además de alopecia y distrofia ungueal. Estos pacientes, aunque raramente, pueden desarrollar osteosarcoma, fibrosarcoma, carcinoma gástrico y carcinoma epidermoide cutáneo23.
HiperpigmentaciónEl aumento de coloración de la piel, difusa o localizada, es un signo cutáneo llamativo atribuible a múltiples causas, algunas de ellas malignas que se enumeran a continuación (tabla 4). Se elude el comentario de las manchas café con leche de la neurofibromatosis tipo i que se abordará con posterioridad.
Hiperpigmentación como marcador de posible neoplasia interna
| Síndrome ectópico de producción de ACTH** |
| Hemocromatosis*** |
| Síndrome POEMS* |
| Melanoma metastásico*** |
| Acantosis nigricans maligna* |
| Leucemias y linfomas de Hodgkin y no Hodgkin*** |
| Máculas melanóticas y pápulas de distribución perianal y genital** |
| Síndrome de Cronkhite-Canada** |
| Síndrome de Peutz-Jeghers** |
*Procesos genuinamente paraneoplásicos; **procesos ocasionalmente asociados a neoplasia interna; ***procesos excepcionalmente asociados a neoplasia interna
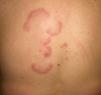
El síndrome ectópico de producción de hormona adrenocorticotrófica (ACTH) (**), originado por tumores hipofisarios o ectópicos productores de ACTH, cursa con síndrome de Cushing. La hiperpigmentación es generalizada, similar a la de la enfermedad de Adisson, más intensa en zonas expuestas (cara, cuello, dorso de manos), zonas de traumatismos o leve presión, así como en las mucosas. La causa de la hiperpigmentación es dudosa, pero se relaciona con la producción del péptido beta-lipotropina, capaz de inducir la producción de MSH que estimula los melanocitos cutáneos.
Los tumores responsables suelen ser el carcinoma de células pequeñas de pulmón, los tumores carcinoides, el feocromocitoma, el carcinoma medular de tiroides, los tumores de los órganos reproductivos y los tumores pancreáticos. La elevación de cortisol plasmático y de corticotropina son altamente sugestivos del diagnóstico7,23–25.
La hiperpigmentación difusa también es un rasgo de hemocromatosis (diabetes bronceada) (***), que cursa con hiperpigmentación en estados avanzados (actualmente poco observables), diabetes mellitus y cirrosis hepática, y predispone al desarrollo de cáncer hepático.
El síndrome POEMS (*), o mieloma esclerótico, atribuye su denominación al acrónimo de las iniciales de los procesos que lo caracterizan: polineuropatía, organomegalia, endocrinopatía, gammapatía monoclonal y cambios en la piel (skin). El síndrome incluye la hiperpigmentación habitualmente generalizada y homogénea, y con menor frecuencia de distribución acral o en el tronco. Otros hallazgos cutáneos son hemangiomas, hipertricosis, acropaquia, leuconiquia, vasculitis, engrosamiento cutáneo y cambios esclerodermiformes26.
El melanoma metastático (***) en un grado muy avanzado raramente ocasiona una melanosis difusa, con coloración gris azulada, que se atribuye a una lisis tumoral. No es infrecuente la depigmentación tipo vitíligo como resultado de una respuesta inmune contra los melanocitos.
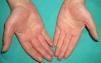
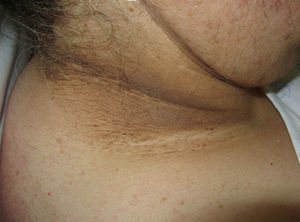
La hiperpigmentación en pliegues cutáneos suele ser el primer signo en un síndrome paraneoplásico clásico, como es la acantosis níigricans maligna (*) (ANM)27. Posteriormente, la piel desarrolla un aspecto aterciopelado con lesiones verrugosas localizadas en axilas, cuello y regiones inguinales (fig. 4). En su evolución surgen lesiones en la mucosa oral, los labios, las areolas mamarias y las zonas de roce. En casos más avanzados se desarrolla hiperqueratosis palmoplantar.
Las palmas con aspecto de tripa (recuerdan la superficie rugosa del intestino bovino) se presentan con un aspecto rugoso y aterciopelado de la mano, con exageración de los dermatoglifos normales. También se conoce con el término de «acantosis palmar» y «acantosis nigricans de las palmas». Representa una variación de ANM más que una entidad separada. Estas palmas tienen una coloración más oscura que las normales28.
La malignidad más frecuente asociada a ANM es el adenocarcinoma gástrico, al que puede preceder varios años antes de su diagnóstico y que posiblemente es productor de factores de crecimiento responsables de la ANM. Con menor frecuencia se observan adenocarcinoma uterino, hepático, intestinal, ovárico, renal, de mama, tiroides y pulmón27,29.
La ANM a veces acompaña a otros procesos considerados como paraneoplásicos (queratosis seborreicas eruptivas —signo de Leser-Trélat y a papilomatosis cutánea florida— desarrollo de lesiones verrugosas)30,31. Sirve como marcador cutáneo de la neoplasia por su evolución paralela a la misma.
No hay que olvidar que la AN también se observa en el contexto de otras entidades que no implican malignidad como obesidad, anomalías endocrinas, enfermedades congénitas o desencadenadas por medicamentos (ácido nicotínico y glucocorticoides). Esta variedad de AN benigna comienza en la infancia o pubertad, suele ser unilateral y tener un componente genético3,20,23,25,32.
En ocasiones la hiperpigmentación es una manifestación cutánea inespecífica de leucemias, linfomas de Hodgkin y no Hodgkin (***), y con menor frecuencia de micosis fungoide. Su patogenia se atribuye a las células mastocitarias, fibroblastos, queratinocitos, células endoteliales y células tumorales linfoides que producen factores estimulantes de la producción de melanina34.
El desarrollo de máculas melanóticas y pápulas de distribución perianal y genital se ha descrito asociado a adenocarcinoma de esófago y pulmón33,34.
El síndrome de Cronkhite-Canada (**) se describió en 1955 en dos pacientes con disfunción gastrointestinal, anomalías de la pigmentación tipo máculas lentiginosas hiperpigmentadas, que oscilaban de pocos milímetros a 10cm, localizadas en las palmas de las manos, en los brazos, en el cuello y en el cuero cabelludo; se acompañaban de alopecia y atrofia de las uñas de los pies y de las manos. Afecta más a los varones, cursa con diarrea, pérdida de peso y síntomas neurológicos. El 14% de los pacientes desarrollan un carcinoma gastrointestinal y, a pesar del paralelismo con el síndrome de Peutz-Jeghers, no existe un mecanismo genético subyacente23,24,35.
El síndrome de Peutz-Jeghers (**) es un proceso de herencia autosómica dominante en el que destaca la presencia de máculas pigmentadas periorificiales, muy evidentes alrededor de la boca, en los labios, la nariz, las mucosas y en las puntas de los dedos. Desarrollan pólipos y hamartomas gastrointestinales y el riesgo de carcinomas de páncreas, de mama, gastrointestinales, de cuello uterino, de ovario y de testículos es más elevado que en la población normal23.
Lesiones anularesLas lesiones anulares representan una morfología frecuente en gran variedad de procesos cutáneos. A continuación se exponen aquellos que pueden relacionarse con malignidades sistémicas. Entre ellos se citan algunos síndromes paraneoplásicos clásicos, como el eritema gyratum repens y el eritema necrolítico migratorio. Otros cuadros no siempre son indicativos de malignidad, pero en un contexto clínico adecuado obligan a descartarla. Se trata del eritema anular centrífugo, el granuloma anular, el lupus eritematoso subagudo, la mucinosis eritematosa reticulada (REM) y la pitiriasis rotunda (tabla 5).
Dermatosis con lesiones anulares y posible asociación a neoplasia interna
| Eritema gyratum repens* |
| Eritema necrolítico migratorio* |
| Otras lesiones anulares: |
| Eritema anular centrífugo*** |
| Granuloma anular generalizado*** |
| Lupus eritematoso cutáneo subagudo*** |
| Mucinosis eritematosa reticulada*** |
| Pitiriasis rotunda*** |
*Procesos genuinamente paraneoplásicos; ***procesos excepcionalmente asociados a neoplasia interna.
Es el eritema figurado más frecuentemente asociado a cáncer. Fue descrito por Gammel en 1952. La prevalencia de malignidad interna se estima en un 77-82%. Se atribuye a un mecanismo inmunológico. Es un proceso raro caracterizado por anillos eritematosos, pruriginosos, serpiginosos y concéntricos que emigran 1cm al día produciendo un aspecto en vetas de madera (fig. 5). Se localizan en el tronco y áreas proximales de las extremidades. Otras lesiones cutáneas que pueden acompañar son hiperqueratosis palmoplantar, distrofia ungueal e ictiosis36–39.
Se asocia a cáncer de pulmón (32-40%), de esófago (8%), de mama (6%), seguidos por otros del tracto gastrointestinal, de vejiga, de útero, de próstata, de ano, bucofaríngeos, mieloma múltiple y melanoma maligno, a los que suele preceder en el diagnóstico entre un mes y 6 años, aunque en una minoría de casos se presentan de forma simultánea o después del diagnóstico de la neoplasia.
Raramente el eritema gyratum repens (EGR) se ha observado en procesos no malignos como tuberculosis, calcinosis y síndrome CREST.
Los rasgos histológicos incluyen espongiosis moderada, paraqueratosis e infiltrado linfohistiocitario perivascular. La inmunofluorescencia directa puede detectar depósitos de IgG y/o C3 en la membrana basal similar al penfigoide.
Responde al tratamiento de la malignidad subyacente y, si no es posible, son útiles los corticoides sistémicos2,3,14,20,23,25,38,39.
Eritema necrolítico migratorio (*)Se asocia típicamente con carcinoma de células alfa de islotes pancreáticos secretor de glucagón que produce el síndrome del glucagonoma. Se caracteriza por placas eritematosas de morfología anular o arciforme, que tienden a coalescer adquiriendo una configuración policíclica. Las lesiones se distribuyen por la región perioral, las zonas distales de extremidades, el abdomen, el periné, los muslos, las nalgas y las ingles. En los bordes circinados activos se aprecia vesiculación, erosiones y costras. La piel tiene una apariencia seca y fisurada y puede recordar al síndrome de la piel escaldada estafilocócica y a la acrodermatitis enteropática por deficiencia de cinc. La afectación mucosa causa glositis y el exceso de glucagón produce pérdida de peso, intolerancia a la glucosa, anemia, diarrea, alopecia, trastornos tromboembólicos y psiquiátricos.
Histológicamente se observa una hiperplasia psoriasiforme o vacuolización y necrosis epidérmica, dependiendo del estadio en que se biopsie.
En su patogenia se valora el déficit de cinc, de aminoácidos y de ácidos grasos esenciales. Esto explicaría su presencia en síndromes de malabsorción, fallo hepático, enfermedad inflamatoria intestinal y enfermedad celiaca sin que exista síndrome del glucagonoma. También se ha descrito asociado a síndrome mielodisplásico sin glucagonoma, hepatocarcinoma, carcinoma bronquial y adenocarcinoma de yeyuno37–40. El tratamiento es el del proceso subyacente. No responde a suplementos de cinc. Últimamente se ha empleado el análogo de la somatostatina octreótido porque inhibe la producción de glucagón, pero no el crecimiento tumoral2,3,6,7,23–25,38.
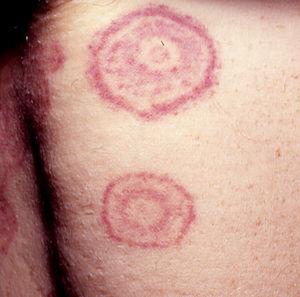
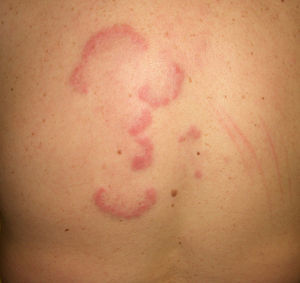
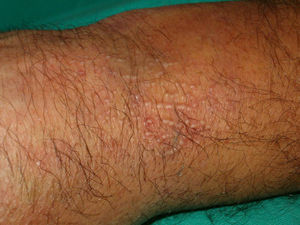
Otras lesiones anularesEritema anular centrífugo(***): se considera como un fenómeno de hipersensibilidad antigénica en respuesta a una gran variedad de procesos que incluyen infecciones, fármacos, trastornos endocrinos y muy raramente es secundario a procesos neoplásicos como linfomas, leucemias e histiocitosis maligna2,23,38, y de forma anecdótica se ha descrito asociado a cáncer de próstata41 (fig. 6).
Granuloma anular generalizado (GA) (***): es una dermatosis crónica de etiología desconocida. Su patogenia se relaciona con una reacción de hipersensibilidad retardada a un antígeno desconocido. Los factores que lo inducen o que se asocian son traumatismos, reacciones a picadura, test de la tuberculina, PUVA, infección viral y diabetes mellitus, pero existe una variedad paraneoplásica, muy poco frecuente, asociada a linfomas tipo Hodgkin y con menor frecuencia a otro tipo de tumores sólidos como adenocarcinoma de pulmón, colon, cuello uterino, próstata, estómago y ovario.
El GA asociado a tumores malignos tiene un patrón clínico atípico con lesiones dolorosas en localizaciones poco habituales, como palmas y plantas, y afecta a adultos mayores con un pico de edad de 54 años. El tiempo que transcurre entre el diagnóstico de GA y la malignidad oscila entre 18 meses antes y 7 años después. Por tanto, conviene investigar una neoplasia en los pacientes de edad media con GA generalizado y persistente, con mala respuesta al tratamiento42,43.
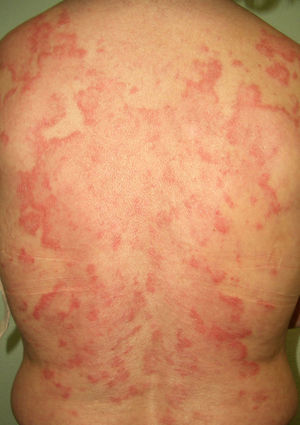
Lupus eritematoso cutáneo subagudo (LECS) (***): desde 1980 se reconoce la asociación entre LECS y malignidad sistémica, y hay unos 14 casos descritos acompañando a cáncer de pulmón, mama, estómago, útero, hígado, laringe y linfomas (fig. 7). La latencia entre la aparición de las lesiones cutáneas y el diagnóstico del tumor subyacente oscila entre un mes y 3 años. A pesar de estas publicaciones se cuestiona su carácter paraneoplásico, pero se puede tener en cuenta cuando el paralelismo entre ambos procesos es evidente y se podría investigar malignidad asociada en casos rebeldes al tratamiento44–46.
Mucinosis eritematosa reticulada(***): es una mucinosis cutánea primaria que se caracteriza por lesiones reticuladas eritematosas pruriginosas localizadas en la parte superior del tórax. Su asociación a neoplasias es escasa, pero se han descrito casos con cáncer de colon, de mama y pulmón47.
Pitiriasis rotunda(***): es una rara enfermedad caracterizada por lesiones circulares, descamativas, bien delimitadas. Son de coloración más clara o más oscura que la piel que las rodea. Afecta al tronco, se trata de lesiones múltiples que pueden llegar a confluir. No hay inflamación o prurito asociado. Para algunos autores representa una forma localizada de ictiosis adquirida. La pitiriasis rotunda es más frecuente en japoneses, pero también se ha descrito en otros grupos de población. Puede asociarse a tuberculosis, lepra, trastornos pulmonares y hepáticos.
Los procesos malignos que se han observado incluyen carcinoma hepatocelular, de estómago, de esófago, de paladar y de próstata, así como la leucemia linfoide crónica y el mieloma múltiple6,25.
Lesiones eritematoescamosas e hiperqueratósicasLas lesiones con aspecto de eczema crónico o psoriasis son motivo frecuente de consulta, y la mayoría de las veces no necesitan estudios complementarios, pero algunas lesiones con esta morfología obligan a descartar una neoplasia oculta, por lo que se requiere un alto grado de sospecha clínica (tabla 6).
Procesos que cursan con lesiones eritematoescamosas e hiperqueratósicas indicadoras de posible neoplasia interna
| Acroqueratosis paraneoplásica de Bazex* |
| Otras: parapsoriasis en pequeñas placas |
| Pitiriasis rubra pilaris*** |
| Poroqueratosis diseminada superficial*** |
| Queratodermia palmoplantar** |
*Procesos genuinamente paraneoplásicos; **procesos ocasionalmente asociados a neoplasia interna; ***procesos excepcionalmente asociados a neoplasia interna.
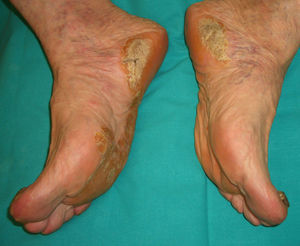
Este apartado lo encabeza la acroqueratosis paraneoplásica de Bazex (*), que fue descrita en 1965. Es un cuadro «psoriasiforme» que afecta a varones entre 60-70 años de edad. Cursa con áreas eritematosas y descamativas, de distribución simétrica, localizadas en las manos, los pies, los codos y las rodillas, en cuya evolución surge una queratodermia palmoplantar con coloración violácea y una importante distrofia ungueal (fig. 8). Posteriormente se afectan las orejas, la nariz, el tronco y el cuero cabelludo. En conjunto son lesiones psoriasiformes que no responden al tratamiento habitual. El estudio histológico difiere de la psoriasis y revela hiperqueratosis con paraqueratosis focal, acantosis, queratinocitos disqueratósicos e infiltrado perivascular linfocitario.
El diagnóstico diferencial con la psoriasis es obligado, ya que las lesiones son de aspecto psoriasiforme, pero mal definidas, con una escama fina pitiriasiforme y tinte azulado; pueden desarrollarse vesículas y ampollas. La hiperqueratosis palmoplantar es mayor en puntos de apoyo respetando la zona central.
Puede preceder en un año al diagnóstico del tumor, habitualmente carcinomas epidermoides de orofaringe, laringe, esófago y pulmón48,49, pero existen aportaciones de otras asociaciones menos frecuentes: adenocarcinoma ductal de mama, colangiocarcinoma, adenocarcinoma de colon, adenocarcinoma de próstata50, metástasis ganglionares en el cuello, liposarcoma51, etc.
En su patogenia se barajan varios factores: una reacción cruzada antigénica entre el tumor y la piel, la producción de un factor de crecimiento de los queratinocitos, la deficiencia de vitamina A y la susceptibilidad genética. La investigación exhaustiva de una neoplasia oculta puede mejorar el pronóstico de estos pacientes2,3,20,23–25,32.
Otras entidades que cursan con lesiones eritematodescamativas asociadas de manera anecdótica a tumores malignos son parapsoriasis en pequeñas placas (***) descrita junto a un liposarcoma52, pitiriasis rubra pilaris (***) con carcinoma de Merkel, carcinoma epidermoide cutáneo, hepatocelular, de mama y carcinoma broncogénico53. Se cuestiona el carácter paraneoplásico de la poroqueratosis diseminada superficial (***) con malignidades hematológicas, hepatocarcinoma, colangiocarcinoma, carcinoma de esófago y de ovario54–57.
La queratodermia palmoplantar (**) se puede observar en el contexto de procesos no malignos como psoriasis, pitiriasis rubra pilaris, climaterio o, como se expuso con anterioridad, acompañando a un síndrome de Bazex, a una acantosis nigricans (palmas con aspecto de tripa), a eritema gyratum repens y a otros procesos.
Existe una forma hereditaria de queratodermia palmoplantar que corresponde al síndrome de Howell-Evans y se asocia a mayor incidencia de cáncer de esófago. También puede observarse en el arsenicismo crónico que predispone al desarrollo de algunas neoplasias.
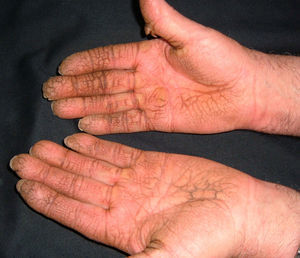
El inicio repentino de la queratodermia palmoplantar y la ausencia de otros datos inducen a descartar una neoplasia subyacente. Esta queratodermia puede ser punctata, focal o difusa y asociarse a hiperhidrosis (fig. 9). Significa mal pronóstico y puede ser la expresión de un carcinoma de pulmón, de esófago y, menos frecuentemente, de mama, de páncreas o un mieloma2,20,32,58.
Engrosamiento e induración cutáneaLa piel puede adquirir de forma progresiva una textura más gruesa e indurada de lo habitual, y cambiar la fisonomía del paciente. Este aspecto cutáneo se observa en enfermedades de depósito, como ocurre en la amiloidosis y en el escleromixedema, o por una induración progresiva propia de la esclerodermia y escleredema. En otras ocasiones es por un excesivo crecimiento/engrosamiento de todo el espesor cutáneo observable en procesos como la paquidermoperiostosis (PDP).
Todas estas entidades pueden tener carácter paraneoplásico, aunque en muchas ocasiones siguen un curso benigno sin relacionarse con la malignidad (tabla 7).
Dermatosis con engrosamiento e induración cutánea y posible neoplasia asociada
| Amiloidosis sistémica primaria** |
| Escleromixedema** |
| Escleredema** |
| Esclerosis sistémica o esclerodermia** |
| Paquidermoperiostosis u osteopatía hipertrófica secundaria** |
**Procesos ocasionalmente asociados a neoplasia interna.
Se produce por el depósito extracelular de una proteína fibrilar insoluble en los tejidos que se detecta en el estudio histológico con rojo congo, y da una birrefringencia verdosa con luz polarizada. El aspirado de grasa subcutánea del abdomen es el lugar preferido para su demostración.
Se clasifica en amiloidosis primaria (incluye una forma idiopática y la asociada a mieloma múltiple) y amiloidosis secundaria a procesos inflamatorios crónicos.
En la amiloidosis sistémica primaria la piel se afecta en el 25% de los casos, adquiriendo un aspecto céreo generalizado, y purpúrico con pequeños traumatismos, lo que se denomina la «púrpura del pellizco». Esta púrpura es más notoria en la región periorbitaria, la cara y el cuello (fig. 10). El paciente puede desarrollar pápulas, placas, ampollas, nódulos, alopecia y adquirir un aspecto esclerodermiforme. La infiltración de la lengua produce macroglosia. La afectación de otros órganos da lugar a insuficiencia cardiaca, síndrome del túnel del carpo, polineuropatía, insuficiencia renal, etc.
El carácter paraneoplásico viene determinado por su asociación a mieloma múltiple en el 15% de los casos3,24,25,59,60.
Escleromixedema (**)Representa la variante generalizada del liquen mixedematoso. Las lesiones son papulosas, céreas, milimétricas, agrupadas de forma lineal y de distribución simétrica en las manos, codos, antebrazos, tronco, cara y cuello (figs. 11 y 12). Las pápulas confluyen dando un aspecto engrosado y esclerodermiforme a la piel, con dificultad de la movilidad articular. En la cara el aumento de los pliegues puede ocasionar una facies leonina e inexpresiva. En la afectación sistémica destaca la disfagia, debilidad muscular proximal, neuropatías periféricas, síndrome del túnel del carpo y afectación renal.
Detalle de la figura 11 (escleromixedema).
Histológicamente se aprecia una proliferación de fibroblastos, fibrosis y depósitos dérmicos de mucina. Se asocia a gammapatía monoclonal en el 80% de los casos, y en una minoría se detecta mieloma múltiple, macroglobulinemia de Waldenstrom, linfoma Hodgkin o no Hodgkin y leucemia. También puede ser expresión de un síndrome POEMS26 o de un carcinoma tímico61.
El curso del escleromixedema es crónico y progresivo y los hallazgos cutáneos preceden a la afectación sistémica3,22,25,59,62.
Escleredema (**)El escleredema de Buschke del adulto se asocia frecuentemente con diabetes mellitus, pero se ha descrito como síndrome paraneoplásico en linfomas y mieloma. Se inicia con induración y edema no depresible alrededor del cuello y la parte superior del tórax. Debe distinguirse clínicamente del escleromixedema y de la esclerodermia. La biopsia pone de manifiesto el engrosamiento del colágeno con mucina en amplios espacios edematosos, pero no existe proliferación fibroblástica. Puede haber afectación de otros órganos25,62.
Esclerosis sistémica o esclerodermia (***)Es un proceso inflamatorio crónico de naturaleza autoinmune caracterizado por anomalías vasculares, activación del sistema inmune, fibrosis cutánea y de otros órganos. En la piel se establece una induración progresiva (fig. 13). El fenómeno de Raynaud, que afecta a la mayoría de pacientes y suele ser el síntoma inicial, expresa la afectación de los pequeños vasos.
En estudios retrospectivos ya se ha demostrado el aumento del riesgo de malignidad, sobre todo del cáncer de pulmón y del de mama, pero también de linfoma B. La alteración de la función de las células B se implica en la patogenia de la esclerosis sistémica, y esto puede conducir al desarrollo de malignidades linfoides59,63–65.
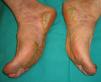
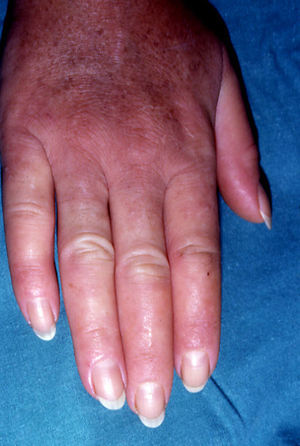
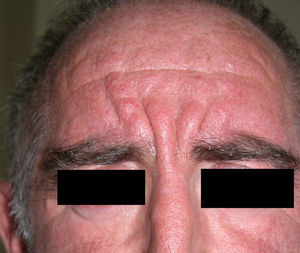
Paquidermoperiostosis u osteopatía hipertrófica (**)Este síndrome engloba acropaquia (dedos en palillo de tambor) (fig. 14), osteoartropatía hipertófica y afectación cutánea que se caracteriza por el desarrollo progresivo de un engrosamiento difuso de la piel con seborrea, acné, foliculitis, poros dilatados, aumento de los pliegues cutáneos, hiperhidrosis palmoplantar y disminución del vello facial y pubiano (fig. 15). En conjunto el paciente puede presentar un aspecto tosco y acromegaloide.
Existe una forma primaria, habitualmente hereditaria, que evoluciona lentamente y otra forma secundaria a trastornos cardiopulmonares. Esta forma secundaria es la que tiene carácter paraneoplásico, asociándose en el 80% de los casos a cáncer de pulmón, a tumores metastásicos en el pulmón, a carcinomas nasofaríngeos y otros menos frecuentes19,25,29,66,67.
Lesiones vascularesLas manifestaciones vasculares de la piel en el contexto de malignidades son bastante inespecíficas5. En este amplio grupo se incluyen signos variados como telangiectasias, púrpura, lesiones isquémicas, vasculitis, tromboflebitis, livedo reticularis y eritema palmar (tabla 8). La presencia de circulación colateral, a veces muy evidente, ya se comentó en el síndrome de la vena cava superior.
Lesiones vasculares con posible asociación a neoplasias internas
| Telangiectasias*** |
| Púrpura y equimosis*** |
| Isquemia cutánea*** |
| Vasculitis** |
| Tromboflebitis** |
| Livedo reticularis*** |
| Eritema palmar*** |
**Procesos ocasionalmente asociados a neoplasia interna; ***procesos excepcionalmente asociados a neoplasia interna.
Dada la frecuencia del curso benigno de estos procesos y su etiología multifactorial, el carácter paraneoplásico se investiga en los casos atípicos de causa incierta, y es obligada una historia clínica detallada para poder establecer una correlación lógica.
Telangiectasias (***)Las telangiectasias agrupadas y localizadas en la cara anterior del tórax pueden ser un marcador de cáncer de mama. También pueden revelar la presencia de una metástasis subcutánea. Se han descrito en tumores carcinoides y en el adenocarcinoma hepático.
Telangiectasias generalizadas pueden ser la manifestación de una angioendoteliomatosis maligna (linfoma intravascular), que en este caso asientan sobre lesiones específicas y son induradas y dolorosas13.
En los pacientes con ataxia-telangiectasia/síndrome de Louis-Bar (síndrome heredado con inmunodeficiencia), caracterizado por dificultad al caminar en el segundo o tercer año de vida, las telangiectasias surgen en la conjuntiva, en los párpados, en las orejas y en las mejillas. El riesgo de malignidad estriba en los tumores linfoides, más frecuentes que en la población general23.
Púrpura y equimosis (***)Las lesiones purpúricas no palpables y las equimosis a veces revelan una trombocitopenia o una púrpura trombopénica idiopática, frecuente en mieloma múltiple, macroglobulinemia de Waldenstrom, linfoma, leucemia linfoide crónica, cáncer de mama, de ovario, de cuello uterino, de próstata y broncogénico indiferenciado.
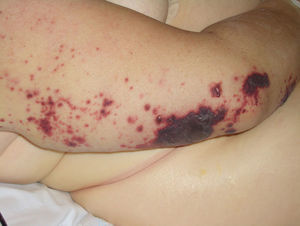
La coagulación intravascular diseminada es causa de púrpura maligna (fig. 16) en varios procesos hematológicos malignos y en algunos tumores sólidos, como el de páncreas, los gastrointestinales y el de próstata.
La púrpura trombótica trombocitopénica es un signo tardío asociado a cáncer gástrico y mamario.
La púrpura también se asocia a situaciones de hiperglobulinemia (linfoma o mieloma). Cuando es secundaria a la presencia de crioglobulinas, las lesiones son acrales y se acompañan de fenómeno de Raynaud5,10.
Isquemia cutánea (***)La isquemia digital es un trastorno paraneoplásico infrecuente, pero puede presentarse como un dolor urente con sensación de quemazón en los pies y calentamiento en las extremidades sin signos físicos; posteriormente se afectan las manos. Esto se denomina eritromelalgia y puede preceder a la malignidad en más de 2 años. Los procesos malignos en que surge son consecuencia de una leucostasis, fenómeno conocido en las leucemias con un recuento de leucocitos superior a 150.000/mm3, y es causante también de infartos y hemorragias. En la policitemia vera ocurre algo similar. Los pacientes pueden tener lesiones cutáneas parecidas a la perniosis.
La isquemia periférica, síndrome acral vascular, también se asocia con carcinoma de páncreas, de estómago, de intestino delgado, de ovario, de riñón y con linfomas68,69.
La isquemia secundaria a crioglobulinemia se provoca por aumento de la viscosidad sanguínea y se asocia a mieloma múltiple, a macroglobulinemia de Waldestrom y a linfomas13,24.
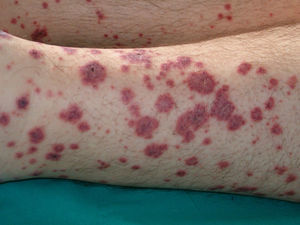
Vasculitis (**)La prevalencia de malignidades en pacientes con vasculitis oscila entre el 3-8%. Casi el 80% de estos pacientes asocian malignidad hematológica, y el resto corresponde a tumores sólidos y a origen inespecífico. En ciertos subtipos de vasculitis predominan algunos tumores, como en la púrpura de Schönlein-Henoch y en la arteritis de la temporal, con más frecuencia asociadas a tumores sólidos, mientras que en la vasculitis cutánea leucocitoclástica y en la poliarteritis nodosa es mayor la proporción de linfomas y leucemias. La presentación clínica es heterogénea con púrpura palpable, pápulas, nódulos, urticaria, necrosis y ulceración (fig. 17)2,5.
En cuanto a las malignidades hematológicas asociadas a vasculitis se describen leucemia de células peludas, leucemia linfoide crónica, mieloma70, linfoma de Hodgkin y no Hodgkin, leucemia mieloblástica aguda, histiocitosis maligna y síndromes mielodisplásicos.
En los tumores sólidos el más común es el de pulmón, seguido por los tumores gastrointestinales, los renales, los de vías urinarias, el de próstata y el de mama71.
En su patogenia se postulan varias hipótesis: formación de complejos inmunes antígeno-anticuerpo asociados al tumor, daño vascular directo contra las células endoteliales por una reacción cruzada con antígenos presentes en las células tumorales y efecto directo de las células leucémicas (células peludas) en la pared vascular72–75.
La vasculitis puede preceder en 2-4 años al proceso maligno, de ahí la importancia del seguimiento de estos enfermos. Suponen una alerta paraneoplásica cuando son crónicas o persistentes, con mala respuesta al tratamiento en pacientes de edad avanzada5,71.
En cuanto a la urticaria vasculitis se ha visto asociada a mieloma múltiple, adenocarcinoma metastático de colon, teratoma metastático de testículos, linfoma no Hodgkin y carcinoma renal76,77.
Tromboflebitis (**)La tromboflebitis venosa aislada rara vez es marcador de una malignidad, pero cuando son episodios espontáneos, recurrentes, múltiples, superficiales y migratorios corresponde al síndrome de Trousseau, que se asocia en el 50% de los casos a cáncer de páncreas, de pulmón, de próstata, de estómago, de colon, a linfomas y leucemias. Se relaciona con un estado de hipercoagulabilidad generalizado.
La incidencia de tromboembolismo venoso como consecuencia de una trombosis venosa profunda (TVP), aumenta mucho en pacientes con cáncer: suelen ser enfermos que no tienen factores de riesgo para TVP, mayores de 50 años y que responden mal al tratamiento anticoagulante. La TVP del miembro superior se asocia con mayor frecuencia a malignidad que la de la extremidad inferior. Los tumores más frecuentemente detectados son los adenocarcinomas secretantes de mucina localizados en el tracto gastrointestinal, urogenital, en el pulmón y en la mama.
La tromboflebitis de las venas subcutáneas de la cara anterolateral de tórax y abdomen constituye el síndrome de Mondor, habitualmente producido por eventos traumáticos, actividad física, procesos inflamatorios, infecciones (mastitis, abscesos) o mamas péndulas. Su importancia reside en que en algunos casos es la clave diagnóstica para detectar un cáncer de mama; por tanto, se aconseja realizar mamografías en todos los casos13,20,23,24.
Livedo reticularis (***)Cualquier proceso que aumenta la visibilidad del plexo venoso puede dar lugar a una livedo reticularis. La venodilatación y la desoxigenación de la sangre en el plexo venoso son su causa fundamental (fig. 18). Por tanto, el vasoespasmo por frío o injurias anatómicas, la trombosis arterial y venosa y el aumento de la viscosidad sanguínea pueden producirla. Esto explicaría que procesos malignos como el mieloma múltiple, la trombocitemia esencial o la policitemia vera puedan acompañarse de livedo reticularis. También se han descrito asociaciones a linfoma cutáneo B, T y linfoma angiotropo, leucemia linfoide aguda, carcinoma renal y carcinoma inflamatorio de mama. En la mayoría de estos casos sucede por obstrucción vascular78.
Eritema palmar (***)Es un síndrome acral vascular cuyas causas más conocidas son el embarazo, la disfunción hepática y la artritis reumatoide, aunque también se observa en la población normal. Se atribuye a vasodilatación (fig. 19).
Se ha observado cierta relación con tumores malignos: carcinoma bronquial, enfermedad de Hodgkin, síndrome mieloproliferativo, adenocarcinoma gástrico y tumores cerebrales79.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.