Las ictiosis congénitas autosómicas recesivas (ICAR) son trastornos infrecuentes de la queratinización que se engloban en las formas no sindrómicas de ictiosis. Clásicamente se distinguían en este grupo la ictiosis laminar (IL) y la eritrodermia ictiosiforme congénita (EIC). Actualmente se incluyen también la ictiosis arlequín, el bebé colodión autorresolutivo, el bebé colodión autorresolutivo acral y la ictiosis en traje de baño.
Se ha estimado una prevalencia conjunta para IL y EIC de 1:138.000-1:300.000. En algunos países o regiones, como Noruega y la costa gallega, la prevalencia podría ser mayor debido a la existencia de efectos fundadores. Desde el punto de vista genético son muy heterogéneas. Seis genes se han asociado a estas entidades: TGM1, ALOXE3, ALOX12B, NIPAL4, CYP4F22 y ABCA12. En este trabajo se pretenden revisar los conocimientos actuales en el campo de las ICAR, incluyendo aspectos clínicos, histológicos, ultraestructurales, genético-moleculares y de tratamiento.
The term autosomal recessive congenital ichthyosis (ARCI) refers to a group of rare disorders of keratinization classified as nonsyndromic forms of ichthyosis. This group was traditionally divided into lamellar ichthyosis (LI) and congenital ichthyosiform erythroderma (CIE) but today it also includes harlequin ichthyosis, self-healing collodion baby, acral self-healing collodion baby, and bathing suit ichthyosis.
The combined prevalence of LI and CIE has been estimated at 1 case per 138 000 to 300 000 population. In some countries or regions, such as Norway and the coast of Galicia, the prevalence may be higher due to founder effects. ARCI is genetically highly heterogeneous and has been associated with 6 genes to date: TGM1, ALOXE3, ALOX12B, NIPAL4, CYP4F22, and ABCA12. In this article, we review the current knowledge on ARCI, with a focus on clinical, histological, ultrastructural, genetic, molecular, and treatment-related aspects.
La nueva clasificación de consenso de las ictiosis1 distingue dos grandes formas de ictiosis: las no sindrómicas, que se manifiestan exclusivamente en la piel y las sindrómicas, que se presentan en la piel y en otros otros órganos (tabla 1). Dentro de las formas no sindrómicas se diferencian 4 grupos: las ictiosis comunes, las ictiosis congénitas autosómicas recesivas (ICAR), las ictiosis queratinopáticas y otras formas de ictiosis menos frecuentes.
Clasificación de consenso basada en la clínica de las ictiosis1
| Formas no sindrómicas | Formas sindrómicas |
| Ictiosis comunesIctiosis vulgarIctiosis recesiva ligada a X (no sindrómica)ICARFormas mayoresIctiosis arlequínIctiosis laminarEritrodermia ictiosiforme congénitaFormas menoresBebé colodión autorresolutivoBebé colodión autorresolutivo acralIctiosis en traje de bañoIctiosis queratinopáticasFormas mayoresIctiosis epidermolíticaIctiosis epidermolítica superficialFormas menoresIctiosis epidermolítica anularIctiosis de Curth-MacklinIctiosis epidermolítica autosómica recesivaNevus epidermolíticoOtras formasQueratodermia loricrinaEritroqueratodermia variabilisSíndrome de la piel exfoliadaEritrodermia ictiosiforme reticular congénitaSíndrome KLICK | Ictiosis sindrómica ligada a XIctiosis recesiva ligada a X (sindrómica)Ictiosis folicular-atriquia-fotofobia (síndrome IFAP)Síndrome de Conradi-Hünermann-Happle (condrodisplasia puntacta 2)Ictiosis sindrómicas autosómicasTrastornos del peloSíndrome de NethertonSíndorme ictiosis-hipotricosisSíndrome ictiosis-hipotricosis-colangitis esclerosanteTricotiodistrofiaTrastornos neurológicoSíndrome de Sjögren-LarssonSíndrome de RefsumSíndrome MEDNIKCurso de la enfermedad letalSíndrome de Gaucher tipo 2Déficit múltiple de sulfatasasSíndrome CEDNIKSíndrome ARCOtros signos asociadosSíndrome KIDSíndrome de Chanarin-DorfmanSíndrome ictiosis-prematuridad |
ICAR:ictiosis congénitas autosómicas recesivas.
Clásicamente, en el grupo de las ICAR se distinguían únicamente dos trastornos: la ictiosis laminar (IL) y la eritrodermia ictiosiforme congénita (EIC). En la nueva clasificación1 se añadió a este grupo la ictiosis arlequín (IA), puesto que se ha visto que mutaciones inactivantes en el gen ABCA12 causan esta entidad2,3, mientras que mutaciones nonsense en el mismo gen pueden dar lugar a un fenotipo de IL4 o EIC5,6. Otras variantes menos frecuentes también incluidas son el bebé colodión autorresolutivo (BCAR), el bebé colodión autorresolutivo acral (BCARA) y la ictiosis en traje de baño (ITB)7–9.
Existen pocos datos sobre la epidemiología de las ICAR. En Estados Unidos se ha estimado una prevalencia al nacimiento de 1:100.000 para la IL y 1:200.000 para la EIC. Otros estudios han calculado una prevalencia conjunta para IL y EIC de 1:200.000-300.00010,11. En algunos países, como Noruega, la prevalencia estimada es mayor (1:91.000) debido a la existencia de mutaciones fundadoras12. El hallazgo de una o varias mutaciones recurrentes en una población puede deberse a que dicha mutación se haya producido en un momento determinado de la historia, y después haya pasado de generación en generación (mutación fundadora), o a que la región del genoma en donde se encuentra presente una secuencia de ADN propensa a mutar (mutación hotspot). En España se ha estimado una prevalencia de ICAR de 1:138.000 en la población general y de 1:61.700 en la población menor de 10 años13. En determinadas regiones de España la prevalencia podría ser incluso mayor. En la zona costera de Galicia alcanzaría el 1:33.000 debido también a la existencia de un efecto fundador14.
Ictiosis laminar y eritrodermia ictiosiforme congénitaCaracterísticas clínicasAunque originariamente se pensó que la IL y la EIC eran distintas entidades, existen pacientes con manifestaciones clínicas intermedias y ambas condiciones pueden ser causadas por mutaciones en el mismo gen15,16. Además, pacientes con la misma mutación, incluso dentro de una misma familia, pueden desarrollar distintos fenotipos12,15.
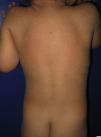
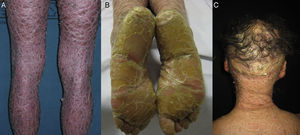
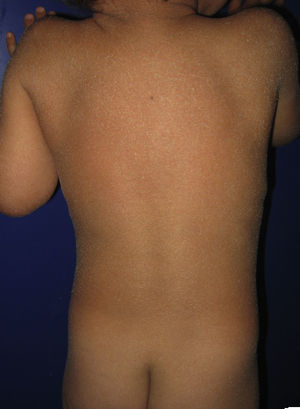
La mayoría de los pacientes nacen envueltos en una membrana colodión que desaparece progresivamente en las primeras semanas de vida y es reemplazada por el fenotipo definitivo (fig. 1A). Tanto en la IL como en la EIC es frecuente la hipohidrosis, la intolerancia severa al calor y la distrofia ungueal17–19. Los pacientes con IL tienen habitualmente un cuadro clínico más severo que los pacientes con EIC. Presentan escamas laminares grandes, y habitualmente oscuras, que ocupan toda la superficie corporal y no asocian eritrodermia, o esta es mínima. Suelen tener ectropion y a veces eclabium, hipoplasia de los cartílagos auriculares y nasales, alopecia cicatricial, especialmente en la periferia del cuero cabelludo, y queratodermia palmoplantar (figs. 1B yC). La EIC se caracteriza por la presencia de eritrodermia y descamación fina blanquecina generalizada (fig. 2). Algunos pacientes presentan marcado eritema y escamas generalizadas que pueden ser grandes y oscuras, sobre todo en las superficies extensoras de las piernas. En los casos menos severos el eritema es leve y la descamación fina.
Los cambios histopatológicos no son diagnósticos. En la IL se observa hiperqueratosis ortoqueratósica masiva, habitualmente dos veces mayor que en la EIC. La epidermis es acantósica y en ocasiones presenta un patrón psoriasiforme. La tasa de proliferación celular es normal o está ligeramente elevada17–19. Los pacientes con EIC presentan hiperqueratosis menos marcada, con paraqueratosis focal o extensa, granulosa normal o aumentada y acantosis más pronunciada. La tasa de renovación epidérmica está incrementada17–19.
UltraestructuraAunque hasta la fecha no se ha establecido una correlación estricta entre los hallazgos moleculares, clínicos y ultraestructurales, la microscopía electrónica puede ser útil para excluir otras formas de ictiosis y orientar el estudio genético en algunos casos. Se han descrito 4 tipos de ictiosis congénitas (tabla 2).
Clasificación ultraestructural de las ictiosis congénitas
| Tipo | Característica principal | Otras características | Mutaciones | Cuadro clínico |
| 1 | Ausencia de marcadores ultraestructurales de las ictiosis 2, 3 y 4 | Gotas o anillos lipídicos en la capa córnea (+ frecuente)Gránulos de queratohialina pequeñosCuerpos de Odland vesiculosos o lobulados | TGM1 (33,3%)ALOX12B (2 casos) | EIC |
| 2 | Cristales de colesterol en la capa córnea | Ausencia o adelgazamiento de la envoltura cornificadaGránulos de queratohialina pequeñosGotas lipídicas | TGM1 (89-100%) | IL |
| 3 | Estructuras membranosas laminadas en la capa granulosa y/o córnea | Anomalías de los cuerpos de OdlandGotas lipídicasFocos de vacuolas yuxtanucleares prominentes en la granulosa | NIPAL4 (93%) | EIC (+ frecuente)IL |
| 4 | Paquetes de estucturas membranosas trilaminares que rellenan algunas células de las capas granulosa y córnea | Anomalías de los cuerpos de Odland | FTAP4 | Síndrome de ictiosis prematuridad (100%) |
Se caracteriza por la ausencia de marcadores ultraestructurales de las ictiosis tipo 2, 3 y 4. Por ello, su diagnóstico solo puede hacerse tras excluir previamente las demás. El hallazgo más frecuente es la presencia de gotas o anillos lipídicos en la capa córnea (fig. 3A)20. Estas gotas lipídicas no son constantes ni específicas del grupo, pues no están presentes en todos los casos20 y pueden verse en otros tipos de ictiosis21,22. Clínicamente, la mayoría de los pacientes presenta un cuadro de EIC12,20. Un tercio de los pacientes presenta mutaciones en el gen TGM116. También se ha identificado este tipo ultraestructural asociado a mutaciones en el gen ALOX12B23,24.
Imágenes de microscopía electrónica. A.Ictiosis congénita tipo 1 mostrando gotas lipídicas en el estrato córneo y ausencia de marcadores ultraestructurales de los demás tipos de ictiosis. B.Ictiosis congénita tipo 2 caracterizada por la presencia de cristales de colesterol (flecha) en los corneocitos.
Se caracteriza por la presencia de cristales de colesterol en la capa córnea (fig. 3B)21. Son un hallazgo constante de la enfermedad, ya que se detectan en distintas biopsias en un mismo paciente y no se modifican con el tratamiento con retinoides orales12,25. En algunos sujetos con déficit en la actividad de la enzima TGasa 1 se observó también la existencia de agregados electrodensos en la periferia de los corneocitos26–28. Clínicamente, los pacientes presentan un cuadro de IL severa12. Este tipo ultraestructural se asocia de forma marcada a las mutaciones en el gen TGM112,16.
Ictiosis congénita tipo 3Se caracteriza por presentar estructuras membranosas laminadas al nivel de las capas granulosa y/o córnea. Habitualmente se disponen a modo de bandas que bordean un espacio vacío cercano al núcleo22,29–31. El cuadro clínico difiere del resto; el comienzo de la ictiosis es variable, la descamación y el eritema pueden ser parcheados o generalizados y las flexuras están especialmente afectadas. Las mutaciones en el gen NIPAL4 son responsables del 93% de las ictiosis tipo 332.
Ictiosis congénita tipo 4De forma característica algunas células de las capas granulosa y córnea están repletas de paquetes de estructuras membranosas trilaminares33. Estos hallazgos son patognomónicos del síndrome ictiosis prematuridad, cuadro que se engloba actualmente dentro de las formas sindrómicas de ictiosis34,35.
Estudios molecularesDesde el punto de vista genético las ICAR son muy heterogéneas. El gen TGM1 es el responsable de la mayoría de los casos, pero se han descrito mutaciones en otros 5 genes: el ALOX12B, el ALOXE3, el NIPAL4, el CYP4F22 y el ABCA12. Fischer et al.36, estudiaron 520 familias con ICAR identificaron mutaciones en alguno de estos genes en el 78% de ellas (32% en el TGM1, 16% en el NIPAL4, 12% en el ALOX12B, 8% en el CYP4F22, 5% en el ALOXE3 y 5% en el ABCA12). En otro estudio de 250 pacientes con ICAR de distintos orígenes el 38% presentaba mutaciones en el TGM1, el 6,8% en el ALOXE3 y el 6,8% en el ALOX12B37. En Galicia identificamos mutaciones en los genes TGM1, ALOX12B, ALOXE3, NIPAL4 y CYP4F22 en el 75% de las familias estudiadas, pero la distribución de las mutaciones fue diferente. El gen TGM1 estaba mutado en el 68,7% de los casos y el gen ALOXE3 en un solo paciente. No detectamos mutaciones en los otros tres genes estudiados14.
TGM1El gen TGM1 está situado en el cromosoma 14q11.2 y tiene 15 exones (GenBank NM-000359.2). Codifica la enzima TGasa 1, que es una de las tres TGasas que se encuentran en la epidermis38. Esta enzima participa en la formación de la envoltura cornificada catalizando las uniones cruzadas, dependientes de calcio, de diversas proteínas como la involucrina, la loricrina y las proteínas ricas en prolina39,40. También cataliza la unión de las ¿-hidroxiceramidas de la capa externa de la envoltura cornificada con las proteínas de su capa interna41,42. En los pacientes con mutaciones en el TGM1 la envoltura cornificada falta y la actividad de la enzima TGasa 1 está disminuida o abolida43–47.
Desde que en el año 1995 se identificó este gen como responsable de algunos casos de ICAR48–50 se han descrito más de 110 mutaciones en pacientes de diversos orígenes. Las mutaciones en el TGM1 son la causa más común de ICAR36,37. En Estados Unidos se identificaron en el 55% de los casos y en Noruega en el 84%12,51. La mutación más frecuente es la c.877-2A>G, que ha sido encontrada en el 34% de los alelos mutados descritos hasta la fecha52. La alta frecuencia de esta mutación en países como Estados Unidos y Noruega se debe a un efecto fundador12,53. La segunda mutación más frecuente es la p.Arg142His. Esta y otras mutaciones similares han sido descritas en países como Egipto, Alemania, Finlandia y Estados Unidos15,49–51,54–56, y parece que se trata de mutaciones hotspot57. La mutación p.Arg307Trp es frecuente en la población japonesa5. En Galicia las mutaciones p.Arg760X, c.1223_1227delACACA y la c.984+1G>A en el TGM1 fueron identificadas en el 81,82% de las familias con mutaciones en ese gen, sugiriendo un efecto fundador14 que fue confirmado mediante el estudio de haplotipos (trabajo pendiente de publicación).
Las mutaciones en el TGM1 son responsables de la mayoría de los casos de IL15,27,44,46,56,58–63 y de un pequeño porcentaje de pacientes con EIC43,47,64,65. También pueden dar lugar a otras formas de ICAR, como el BCAR, el BCARA y la ITB.
Muchos estudios han intentado mostrar asociaciones genotipo-fenotipo entre las mutaciones en este gen y los hallazgos ultraestructurales o la clínica, sin que hasta la fecha se haya visto una correlación estricta15,16,53. En general los pacientes con mutaciones en el gen TGM1 están más gravemente afectados que los que no las tienen. Un estudio de 83 pacientes con ICAR de Suecia y Estonia66 mostró asociación entre la presencia de ectropion y membrana colodión y mutaciones en el TGM1, así como mayor frecuencia de eritema en pacientes sin mutaciones en ese gen. Otro trabajo reveló que el tipo de escamas es la principal diferencia entre portadores y no portadores de mutaciones en el TGM1, al evidenciar que el 100% de los pacientes con mutaciones en este gen presentaban escamas de tipo laminar, mientras que el 80% de los pacientes sin mutaciones en el TGM1 presentaban descamación fina14. Además, se ha visto que las mutaciones truncantes se asocian más frecuentemente a hipohidrosis y alteraciones en la sudoración que las mutaciones missense51. En la población norteamericana se ha desarrollado un modelo, basado en la presencia de ciertas características clínicas, que predice que los pacientes que nacen con membrana colodión y presentan problemas oculares y/o alopecia tienen 4 veces más probabilidad de tener mutaciones en el TGM151.
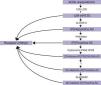
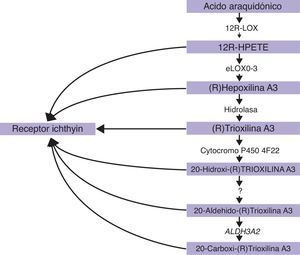
ALOXE3 y ALOX12BLos genes ALOXE3 y ALOX12B se sitúan en el cromosoma 17p13.167. Tienen una estructura similar conformada por 15 exones y codifican las LOX epidérmicas eLOX-3 y 12R-LOX68,69. Su expresión predominante en las capas suprabasales de la epidermis apoya su papel en las fases avanzadas de la diferenciación epidérmica, participando en el procesamiento de los cuerpos lamelares24,70. Ambas enzimas actúan secuencialmente en la vía de las hepoxilinas (fig. 4). La 12R-LOX transforma el ácido araquidónico en un ácido 12R-hidroxieicosatetraenoico y la eLOX-3 convierte este producto en un isómero epoxialcohol69,71 que pertenece a la familia de la hepoxilina A372. Este producto hepoxilina es inestable y es hidrolizado en las células a un derivado trihidroxi específico (trioxilina). Aunque el papel exacto de los productos de la vía de las hepoxilinas no se conoce, se ha especulado que puedan participar en la formación de los lípidos intercelulares de la capa córnea o actuar como señales para promover la diferenciación de los queratinocitos.
Los genes ALOX12B y ALOXE3 se identificaron por primera vez en el año 200273,74. Desde entonces se han descrito más de 30 mutaciones en el gen ALOX12B23,24,37,75–77 y aproximadamente 10 en el gen ALOXE337,74,75. Son responsables del 14-17% de las ICAR36,37 y del 72,2% de los BCAR23,78,79. La relación causal entre estas mutaciones y el fenotipo de los pacientes se confirmó al demostrarse que la actividad catalítica de las LOX epidérmicas estaba totalmente abolida en ellos75,80, y al reproducirse en modelos murinos un fenotipo ictiosiforme que remeda claramente al humano81–83. Ambos genes son responsables de un porcentaje similar de casos de ICAR. Sin embargo, pocas mutaciones diferentes se han identificado en el ALOXE3, debido a la alta frecuencia de 2 mutaciones, la p.Arg234X y la p.Pro630Leu, que parecen representar hotspots37,74,75.
Los pacientes con mutaciones en los genes ALOXE3 y ALOX12B presentan habitualmente cuadro clínico de EIC74,75,77. La descamación es leve o moderada, y de color blanquecino o marrón claro, y pueden asociar eritema. Hasta el 76% de los pacientes nacen como bebés colodión y el 88% presentan alteraciones en la sudoración37. Los pacientes con mutaciones en el gen ALOX12B muestran descamación más discreta y blanquecina en comparación con los portadores de mutaciones en el gen ALOXE3 que tienen escamas marronáceas y adherentes. La presencia de eritema, la hiperqueratosis palmoplantar y la acentuación de los pliegues palmoplantares también se asocia a defectos en el ALOX12B37.
Ichthyin/NIPAL4El gen NIPAL4, también conocido como ichthyin, está localizado en el cromosoma 5q33. Tiene 6 exones que codifican una proteína con varios dominios transmembrana cuya función se desconoce84. Se ha hipotetizado que participe en la misma vía metabólica que las LOX. Podría actuar como receptor para la trioxilinas A3 y B3 o para otros metabolitos de la vía metabólica de las hepoxilinas84. De esta forma estaría implicado en la formación de los cuerpos lamelares o en su transporte hacia el espacio extracelular32. A favor de este supuesto destacan dos hechos: en primer lugar, las mutaciones en este gen se asocian en un 93% de los casos a un patrón ultraestructural de ictiosis congénita tipo 3, caracterizado por las anomalías en los cuerpos lamelares y la presencia de membranas perinucleares elongadas al nivel de la granulosa32; y en segundo lugar, el NIPAL4 se expresa fundamentalmente al nivel de la capa granulosa de la epidermis, que es la zona donde los cuerpos lamelares están presentes85.
Desde que el gen NIPAL4 se descubrió en el año 200484 tan solo 9 mutaciones han sido descritas en pacientes procedentes de países mediterráneos como Argelia, Turquía y Siria84, de países escandinavos32, de Paquistán85, de las islas Feroe32 y de Sudamérica84.
El espectro clínico de los pacientes con mutaciones en este gen es muy amplio, incluso entre miembros de la misma familia. La presencia de membrana colodión al nacimiento es variable, presentándose entre el 60%84 y el 3,7%32 de los casos. Cuando la membrana desaparece la mayoría de los pacientes desarrollan un cuadro de EIC, con descamación fina y blanquecina sobre una base eritematosa en la cara y el tronco y escamas más grandes y marronáceas en el cuello, las nalgas y las piernas84. Pueden presentar xerosis marcada, placas hiperqueratósicas reticuladas marronáceas generalizadas que se acentúan en los pliegues cutáneos y discromía facial32,85. Además, es frecuente que presenten queratodermia palmoplantar y, en ocasiones, contracturas de los dedos y curvatura de las uñas. En algunos trabajos se han descrito rasgos más típicos de IL32,85. También se ha descrito la presencia de signos y síntomas de dermatitis atópica en algunos pacientes, sin que en ninguno de ellos se detectaran mutaciones en el gen FLG85.
CYP4F22El gen FLJ39501 o CYP4F22 se localiza en el cromosoma 19p13.1286 y tiene 12 exones87. Codifica un citocromo P450, familia 4, subfamilia F, polipéptido 2, homólogo del leucotrienio B4-¿-hidroxilasa (CYP4F2). La reacción catalizada por FLJ39501 en la piel y sus sustratos pueden ser deducidos por analogía con lo que se sabe de sus homólogos CYP4F2 y CYP4F388. Se ha hipotetizado que participen en la vía de las hepoxilinas, catalizando el paso de trioxilina A3 a 20-hidroxi(R)-trioxilina A387 y que el producto final de esta vía, la 20-carboxi-trioxilina A3, pueda tener un efecto biológico regulatorio clave en la piel89.
Hasta la fecha solo se han descrito 8 mutaciones en este gen en 12 familias consanguíneas procedentes de países del mediterráneo87 y en una de origen israelí62.
En las familias descritas por Lefèvre et al.87 la mayoría de pacientes presentaron un fenotipo de EIC al nacimiento que progresó más tarde a IL. Habitualmente nacieron con marcada eritrodermia, aunque sin membrana colodión. Con el tiempo desarrollaron descamación generalizada blanquecino-grisácea, más exagerada en la región periumbilical, las nalgas y la parte inferior del cuerpo. Fue frecuente la hiperlinearidad palmoplantar y la descamación en el cuero cabelludo, en algunos casos de tipo pitiriasiforme87. En otra familia los tres miembros afectos nacieron como bebés colodión y desarrollaron un cuadro de eritrodermia intensa, descamación generalizada y queratodermia palmoplantar62.
ABCA12En 2003 el gen ABCA12 fue descrito como responsable de algunos casos de IL y fue mapeado en el cromosoma 2q344. Posteriormente se confirmó que mutaciones en este gen también eran responsables de la IA2,3. Codifica para 53 exones. El ABCA12 pertenece a una familia de transportadores ABC, que ligan la adenosina trifosfato al tiempo que ayudan al transporte de varias moléculas a través de la membrana celular90. Los miembros de la subfamilia ABCA están todos implicados en el transporte lipídico91. Los defectos en el ABCA12 conllevan la alteración del transporte de lípidos a nivel de los cuerpos lamelares determinando la disminución de lípidos intercelulares en la capa córnea3.
Estudios ultraestructurales han demostrado que el ABCA12 se sitúa en los cuerpos lamelares asociado a las glucosilceramidas91. Se han relacionado las alteraciones en el ABCA12 con la alteración en la distribución y el transporte de glucosilceramidas y con la disminución de los niveles de hidroxiceramidas, uno de los componentes principales de la barrera lipídica, a nivel del espacio intercelular3,6,92,93. La enorme hiperqueratosis que se produce en estos pacientes podría ser una respuesta compensadora ante el defecto de la barrera lipídica94, o deberse a la falta de descamación de los corneocitos93. Los defectos en el transporte de ciertas proteasas, como la calicreína 5 y la catepsina D, causadas por las alteraciones en los cuerpos lamelares, podrían determinar la deficiente descamación95. Modelos murinos y estudios in vitro indican que el defecto del ABCA12 tiene también efecto sobre la diferenciación epidérmica95–97.
Hasta la fecha se han descrito más de 50 mutaciones en el gen ABCA12 en pacientes con ICAR procedentes de África, Europa, Paquistán y Japón. Las mutaciones más frecuentes son la p.Val244SerfsTer282,98,99, identificada en población paquistaní e india, y la p.Asn1380Ser4, identificada en familias africanas. Ambas podrían ser mutaciones fundadoras.
La gravedad de las mutaciones que afectan al ABCA12 se relaciona con el fenotipo. Las mutaciones que producen pérdida completa de su función resultan en fenotipo de IA2,3,98–102. Por el contrario, en la IL y la EIC la mayoría de las mutaciones son missense, que alteran la función de la proteína de forma menos grave4–6,103. Las mutaciones que subyacen el fenotipo de IL parece que se concentran en la región del primer cassette ligador de ATP4. Clínicamente, los pacientes con EIC y mutaciones en el gen ABCA12 presentan escamas de mediano tamaño, algo más grandes que las que habitualmente se observan en los pacientes con este fenotipo.
Ictiosis arlequínLa IA o feto arlequín es una forma de ictiosis grave y generalmente fatal. El niño es frecuentemente prematuro. Nace con placas hiperqueratósicas extensas y brillantes, separadas por fisuras profundas, que recubren todo el tegumento. Tienden a configurar patrones geométricos que remedan a las vestimentas de los payasos arlequines, de ahí el nombre de la entidad. La tirantez de la piel resulta en marcada eversión de los párpados y labios, desarrollo rudimentario de los cartílagos auriculares y nasales, y en ocasiones, microcefalia. No suelen tener pestañas ni cejas, aunque el pelo del cuero cabelludo puede estar conservado. Las manos y los pies están hinchados y edematosos, muchas veces cubiertos por una coraza a modo de guante. Pueden tener contracturas de los dedos.
El riesgo de mortalidad de estos niños durante el periodo neonatal es muy alto104. La ventilación pulmonar está comprometida, las pérdidas transepidérmicas de agua conducen a la deshidratación, al desequilibrio hidroelectrolítico y a la inestabilidad térmica, y el riesgo de infecciones está aumentado. La tirantez facial y el eclabium dificultan la succión, y por tanto la alimentación del niño, agravando la deshidratación. Los neonatos afectados rara vez sobrevivían más allá de las primeras semanas de vida. En los últimos años las probabilidades de supervivencia a largo plazo han aumentado notablemente, debido fundamentalmente al uso de los retinoides sistémicos y a los avances de los cuidados intensivos neonatales105. En un estudio reciente el 83% de los pacientes tratados con retinoides orales sobrevivieron frente al 24% de los no tratados. Sin embargo, la mayoría de las muertes ocurrieron en los tres primeros días de vida, mientras que en muchos de los supervivientes el tratamiento se introdujo más tarde104. Esto sugiere que muchas de estas muertes tempranas hubieran ocurrido igual, independientemente del tratamiento.
Los niños que sobreviven al periodo neonatal por lo general desarrollan un cuadro de EIC severa106. La naturaleza y localización de las mutaciones en el gen ABCA12 y el nivel de pérdida de funcionamiento del transportador pueden tener alguna relevancia en la diferencia de pronóstico3,92,107. Pacientes que conservan cierta cantidad de actividad de la proteína, aunque sea mínima, pueden tener mayores posibilidades de supervivencia. Los portadores de mutaciones homocigotas presentan una mayor mortalidad104.
La característica histológica principal de la IA es la presencia de un estrato córneo ortoqueratósico extremadamente engrosado y compacto. Los folículos pilosos y los ductos sudoríparos tienen prominentes tapones hiperqueratósicos107,108. Ultraestructuralmente presentan cuerpos lamelares anormales o ausentes, inclusiones lipídicas o remanentes de organelas o núcleos en los corneocitos y ausencia de los lípidos intercelulares108,109. Los folículos pilosos muestran marcada acumulación concéntrica de material queratósico, lo que es una característica diagnóstica de IA que ha sido usada para el diagnóstico prenatal.
Hasta la fecha la tasa de detección de mutaciones en el gen ABCA12 en pacientes con IA es cercana al 100%, por lo que parece que es un cuadro genéticamente homogéneo.
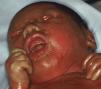
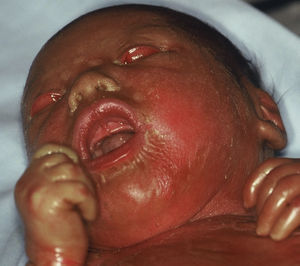
Bebé colodión. Bebé colodión autorresolutivoLos bebés colodión son habitualmente prematuros y su morbilidad y mortalidad perinatal están aumentadas. Al nacimiento el neonato está cubierto por una membrana brillante, transparente y tirante que recuerda a una envoltura de celofán (fig. 5). Presentan ectropion, eclabium e hipoplasia de los cartílagos nasales y auriculares. La succión y la ventilación pulmonar pueden estar dificultadas110 y las pérdidas transepidérmicas de agua y el riesgo de infecciones aumentadas110,111.
El bebé colodión es habitualmente la forma de presentación de la IL y la EIC. La IL autosómica dominante112,113, el síndrome de Sjögren-Larsson110, la tricotiodistrofia114, la enfermedad de Gaucher infantil110, la enfermedad por almacenamiento de lípidos neutros, el síndrome de Conradi-Hünermann-Happle, el síndrome de Hay-Wells y las displasias ectodérmicas115 también pueden manifestarse ocasionalmente como bebé colodión. En el 10-24% de los neonatos110,116 la membrana desaparece espontáneamente y deja la piel totalmente normal. En el pasado estos casos se conocían como IL del recién nacido117, y actualmente como BCAR118. Algunos autores proponen hablar de bebé colodión con auto-mejoría, porque muchos pacientes, cuando son reexaminados en la juventud o en la edad adulta presentan un grado variable de anhidrosis e intolerancia al calor y signos leves de ictiosis, como xerosis y descamación fina, especialmente en las axilas y el cuello78.
Tanto la microscopía óptica como la ultraestructura del bebé colodión no son específicas. Por ello, es preferible diferir la biopsia cutánea hasta que se haya desarrollado el fenotipo definitivo.
Mutaciones en los genes TGM17,119, ALOXE378 y ALOX12B23,78,79 han sido identificadas en pacientes con BCAR, siendo el ALOX12B el gen más frecuentemente mutado. En una serie de 15 pacientes con BCAR de Escandinavia se identificaron mutaciones en el ALOX12B en el 67%, en el ALOXE3 en el 25% y en el TGM1 en el 8,3%78. En algunos pacientes no se encontraron mutaciones, por lo que otros genes deben de estar implicados. Se ha especulado que estas mutaciones reducen la actividad enzimática en el útero, pero no en vivo7. En el útero, donde la presión hidrostática es elevada, la quelación de moléculas de agua convierte a la enzima mutada en una conformación inactiva. Después del nacimiento, al bajar la presión, la enzima vuelve a su forma activa e incrementa su actividad hasta niveles suficientes para mantener el fenotipo normal o mínimamente alterado7.
Bebé colodión autorresolutivo acralAunque el bebé colodión es un cuadro generalizado, se han descrito casos localizados a nivel acral. Finlay et al.120 describieron, en 1952, un caso de membrana colodión que afectaba exclusivamente a las manos y los pies y que siguió un curso autorresolutivo. Recientemente se ha descrito un nuevo caso de BCARA asociado a mutaciones en el gen TGM18. No se conoce por qué las lesiones se restringen a las zonas acrales, aunque podrían existir factores reguladores de la actividad enzimática dependientes de localización8.
Ictiosis en traje de bañoAunque previamente se habían descrito casos de ictiosis de distribución peculiar121–123, fue en 2005 cuando se describió la ITB como una variedad independiente de ICAR. Se ha detectado mayoritariamente en pacientes de origen Sudafricano9, pero también en individuos procedentes de Europa y países del mediterráneo124. Al nacimiento presentan una membrana colodión generalizada. Cuando esta se desprende se observa la distribución característica de las escamas. El tronco, la zona proximal de las extremidades superiores, incluyendo la axila, el cuello y el cuero cabelludo están afectados. La zona central de la cara, las extremidades y el área lumbar suprarrenal están respetadas9. Las escamas son grandes, laminares y oscuras. Puede haber descamación más fina en los huecos poplíteos y en las fosas antecubitales124,125. Las palmas y las plantas presentan leve hiperqueratosis difusa. El dorso de manos y de los pies y las uñas no están alterados.
El estudio histopatológico de la piel afectada muestra marcada hiperqueratosis sin paraqueratosis, granulosa normal, acantosis leve o moderada y leve infiltrado linfocítico en la dermis alta9. La microscopía electrónica en la mayoría de los casos es compatible con la ictiosis congénita tipo 2. La piel no afectada no presenta alteraciones124,125. En la piel sana la actividad de la enzima TGasa 1 está ligeramente reducida y se localiza de forma normal a nivel pericelular. En la piel afectada la actividad enzimática es residual, y se localiza de forma anormal a nivel citoplasmático124.
Se han detectado mutaciones en el gen TGM1 en todos los pacientes con ITB estudiados hasta la fecha119,124–126. La mutación más frecuente es la p.Arg315Leu, que se ha identificado en la mayoría de pacientes sudafricanos y podría ser una mutación fundadora. Oji et al.124 sugirieron que la temperatura de la piel podría desempeñar un papel en el desarrollo de este cuadro, y demostraron mediante termografía digital una fuerte correlación entre la temperatura corporal y la presencia de descamación, siendo las zonas más calientes del cuerpo las afectadas. Aufenvenne et al.127 demostraron que existe reducción de la temperatura óptima para la actividad de la enzima TGasa 1 en los pacientes con ITB que no se observa en controles sanos ni en la IL generalizada, y que explicaría su fenotipo. La temperatura óptima para la enzima normal es de 37°C, mientras que para la mutada es de 31°C.
TratamientoEl objetivo primario del tratamiento en las ictiosis es eliminar las escamas y reducir la xerosis sin causar mucha irritación (tabla 3). Antes de indicarlo hay que tener en cuenta aspectos como la edad y sexo del paciente, el tipo y gravedad de la enfermedad y la extensión y localización de las lesiones128.
Estrategia terapéutica en las ictiosis congénitas autosómicas recesivas
| Estrategia terapéutica de las ICAR | |
| Baño y eliminación mecánica de las escamas | Baño con bicarbonato sódico o almidón de trigo, maíz o arroz, eliminando mecánicamente las escamas (1 o 2 veces al día) |
| Tratamiento tópico (secuencial) | Emolientes con ureaQueratolíticos con propilenglicolQueratolíticos combinados (propilenglicol, alfa-hidroxiácios o urea)Queratolíticos combinados con ácido salicílicoRetinoides tópicosEn neonatos y niños pequeños aplicar un vehículo sin medicación. Evitar urea, ácido salicílico y ácido láctico por riesgo de absorción sistémica |
| Tratamiento oral | Retinoides orales (acitretino o isotretinoína) |
| Otras medidas | Seguimiento del ectropion por oftalmologíaLimpieza periódica del oído externo por OtorrinolaringologíaTerapia física para evitar contracturasEvitar actividades extenuantes cuando la temperatura es altaHidroterapia |
ICAR: ictiosis congénita autosómica recesiva.
Es recomendable que los pacientes con ICAR se bañen a diario para eliminar mecánicamente las escamas y los restos de crema. Esto es más sencillo si el paciente está en inmersión 15-30 minutos antes. Algunos autores recomiendan añadir bicarbonato sódico al baño, pues desnaturaliza las queratinas y hace el agua alcalina, ayudando a eliminar las escamas129. Otros aditivos que se pueden emplear son el almidón de trigo, el maíz o el arroz. El aceite de baño no es tan adecuado porque puede producir oclusión, con el consiguiente riesgo de proliferación bacteriana y empeoramiento de la distermorregulación.
Tratamiento tópicoLos emolientes y los queratolíticos tópicos suelen ser la primera opción terapéutica. Mejoran la función barrera de la piel y facilitan la descamación. Pueden producir leves efectos adversos locales, como prurito, irritación o escozor transitorio.
Como agentes hidratantes y lubrificantes se pueden emplear el cloruro sódico, la urea, la vitamina E acetato, el glicerol y la vaselina. En los pacientes con escamas gruesas e hiperqueratois marcada se puede añadir uno o más agentes queratolíticos como los α-hidroxiácidos (ácido láctico y glicólico)130, el ácido salicílico, la N-acetilcisteína131–133, la urea (>5%)134 y el propilenglicol. También se pueden usar moduladores de la diferenciación de los queratinocitos, como los retinoides tópicos (tretinoína, adapaleno y tazaroteno)135,136, el calcipotriol137 y el dexpantenol.
Los retinoides tópicos causan con frecuencia irritación y pequeñas fisuras muy dolorosas137. Además, si se usan de forma generalizada, existe riesgo de absorción y teratogenicidad en mujeres en edad fértil138. Para aumentar la efectividad de los queratolíticos o emolientes puede emplearse la terapia oclusiva en áreas concretas rebeldes al tratamiento139. También se puede conseguir un efecto aditivo o sinérgico combinando dos o más agentes queratolíticos o emolientes140–142. El tratamiento debe optimizarse en cada caso, porque existe gran variabilidad individual en la sensibilidad de la piel y su respuesta a cada tratamiento. Para ello pueden hacerse comparaciones lado a lado, tratando cada mitad del cuerpo de forma diferente. Los neonatos y los niños pequeños deben tratarse con un vehículo sin medicación, porque su piel es más fina y sensible y no toleran la mayoría de queratolíticos. Además, el riesgo de absorción percutánea de productos tópicos como la urea, el ácido salicílico y el ácido láctico es mayor143–145.
Tratamiento sistémicoLos retinoides orales tienen efectos queratolíticos que facilitan la eliminación de las escamas y previenen la hiperqueratosis excesiva. Tanto la isotretinoína como los retinoides aromáticos (acitretino y etretinato) han sido eficaces en el tratamiento de las ICAR128,146,147. El acitretino a dosis de 0,5-1mg/kg/día es el fármaco más usado, especialmente en la IL148. Los pacientes con EIC pueden responder de forma más completa y con dosis más bajas.
Los principales efectos adversos son las alteraciones mucocutáneas, la teratogenicidad, las alteraciones musculoesqueléticas y del perfil lipídico y la elevación de las transaminasas149–152. En cuanto a la teratogenicidad, en el caso del etetrinato y del acitretino, se debe evitar el embarazo durante el tratamiento y hasta tres años después de suspenderlo151. La isotretinoína tiene una vida media más corta y se elimina totalmente del organismo al cabo de un mes, por ello puede ser preferible en mujeres que consideren el embarazo128.
Se recomienda para monitorizar el tratamiento realizar una analítica con función hepática y perfil lipídico antes de iniciarlo, un mes después y luego cada tres meses. En las mujeres en edad fértil debe realizarse un test de embarazo en las dos semanas previas a iniciar la terapia y una contracepción efectiva desde 4 semanas antes de iniciar el tratamiento hasta tres años después (en el caso del acitretino). Cuando se requiere tratamiento prolongado con retinoides se deben monitorizar los parámetros de crecimiento y desarrollo óseo. Aunque algunos autores proponen realizar un estudio óseo previo y un seguimiento anual151, las guías más recientes no recomiendan la realización de radiografías rutinarias por sus potenciales efectos dañinos152. Solo en el caso de que el paciente presente dolores musculoesqueléticos atípicos se recomienda realizar radiografías selectivas152.
Una alternativa al tratamiento con retinoides sistémicos es utilizar fármacos conocidos como RAMBAs, que bloquean el catabolismo del ácido retinoico y aumentan así sus niveles endógenos. Uno de ellos es el liarozole, que ha sido declarado medicación huérfana para el tratamiento de la IL, EIC e IA por la Agencia Europea del Medicamento (EMEA) y por la FDA153–155. Este fármaco ha demostrado, en ensayos clínicos, ser más eficaz que el acitretino y ofrecer mejor tolerabilidad y perfil farmacocinético154.
Otros cuidadosEn los pacientes con ectropion la aplicación de lágrimas artificiales y lubricantes oculares y la hidratación de la piel de la cara, sobre todo de las mejillas, disminuye la retracción palpebral. La corrección quirúrgica es una opción válida en casos graves, pero habitualmente tiene que repetirse al cabo de unos años. El tratamiento con hidroterapia puede aportar beneficios156. Se debe recomendar al paciente que evite actividades extenuantes cuando la temperatura es alta, puesto que la hipohidrosis conlleva riesgo de golpes de calor y convulsiones. Los retinoides orales pueden mejorar la distermorregulación157. La terapia física es importante para evitar contracturas en flexión, especialmente en la IA. La limpieza periódica del conducto auditivo externo por un otorrinolaringólogo evita la acumulación de escamas a ese nivel que podría causar pérdidas auditivas.
Consejo genético y diagnóstico prenatalCuando se diagnostica a un paciente de ictiosis se le debe ofrecer consejo genético apropiado, explicando la naturaleza del trastorno, su modo de herencia y la probabilidad de futuras manifestaciones en la familia. El diagnóstico prenatal nos permite saber si el feto está afectado, y por tanto llevar a cabo la preparación psicosocial en la familia, anticipar problemas del embarazo y del parto, y dar a los padres la opción de interrumpir voluntariamente el embarazo en los casos en los que no existe tratamiento. Además, de existir en el futuro un tratamiento génico adecuado nos permitiría que este se realizara lo más temprano posible.
Durante más de 20 años el diagnóstico prenatal se realizaba a partir de una biopsia de piel fetal que era estudiada mediante microscopía óptica, microscopía electrónica o immunohistoquímica158,159. Este procedimiento invasivo solo se podía llevar a cabo en las fases tardías del embarazo, entre las semanas 15 y 23 de la gestación, y se asociaba a un riesgo de pérdida fetal de un 1-3%160,161. La identificación de las bases moleculares de los desórdenes cutáneos hereditarios ha permitido llevar a cabo el diagnóstico prenatal en etapas más tempranas mediante técnicas basadas en el estudio del ADN102,162–164. En estos casos el ADN fetal se obtiene mediante la amniocentesis realizada entre las semanas 15 y 20 o mediante la biopsia de vellosidades coriónicas (BVC) obtenida entre las semanas 10 y 12. El riesgo de pérdida fetal con estas técnicas es menor del 0,5-1%165. Otros métodos no invasivos que se están desarrollando son el estudio de ADN de células fetales o ADN fetal libre en la circulación materna166 y el uso de ultrasonografía tridimensional167,168.
El diagnóstico genético preimplantacional podrá permitir que los embriones sean estudiados tras la fertilización in vitro, de modo que solo los que no portan mutaciones sean implantados en el útero, eliminando la necesidad de aborto en la mayoría de los casos169.
Futuras estrategias para el tratamiento génico de las ictiosisAl igual que se han producido avances importantes en el diagnóstico genético de las ictiosis, también se están desarrollando nuevas estrategias de tratamiento para estas enfermedades170. La piel es el órgano más accesible para las terapias de transferencia genética de modo mínimamente invasivo171, pero tiene unas características immunológicas únicas que son desfavorables para la expresión a largo plazo de un producto transgénico172. En la IL, empleando transferencia génica ex vivo, se consiguió restaurar la expresión normal del TGM1 y corregir la expresión fenotípica de la piel transplantada en la espalda de ratones immunodeprimidos173,174. Recientemente también se ha conseguido la recuperación fenotípica de queratinocitos cultivados derivados de pacientes con IA con mutaciones en el gen ABCA123.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses