Las neoplasias melanocíticas con morfología spitzoide (nevo de Spitz, tumor de Spitz atípico y melanoma spitzoide) abarcan un espectro desde lesiones benignas a malignas. Debido al potencial maligno incierto de los tumores de Spitz atípicos, el abordaje terapéutico ha generado durante años controversia. El desarrollo de nuevas técnicas moleculares parece prometedor y ha contribuido a una mejor predicción del comportamiento biológico de los tumores de Spitz. Nuestro objetivo es revisar las características citogenéticas de los tumores de Spitz, el pronóstico y actualizar las últimas recomendaciones de manejo.
Melanocytic neoplasms with spitzoid morphology (Spitz nevi, atypical Spitz tumors, and spitzoid melanomas) may be benign or malignant. Because the malignant potential of atypical Spitz tumors is uncertain, the proper therapeutic approach has been much debated over the years. Promising new techniques for molecular analysis have enabled better predictions of the biological behavior of these tumors. We review their cytogenetic features and prognosis and also provide an update of the most recent recommendations for management.
En las últimas décadas, se ha enfatizado la investigación de las características moleculares de los nevos de Spitz (NS) con el fin de determinar unos patrones que permitan distinguirlos del melanoma y poder caracterizar el potencial de malignidad de los tumores de Spitz atípicos (TSA).
La hibridación genómica comparada permitió observar inicialmente que algunas alteraciones presentes en el melanoma (aumento del número de copias de 1q, 6p, 7p, 8q, 17q, 20q y pérdidas de los cromosomas 6q, 8p, 9p y 10q) no se encontraban en los nevos melanocíticos benignos1. Mediante hibridación in situ con fluorescencia (FISH) se demostró que entre el 12 y el 20% de los NS presentaban amplificaciones en el cromosoma 11p2.
El aumento del número de copias del gen HRAS, localizado en el área 11p, da lugar a unos tumores spitzoides con unas características similares al melanoma (mayor tamaño, localización predominantemente dérmica, desmoplasia y crecimiento infiltrante). En ausencia de alteraciones genéticas adicionales, dichos tumores muestran un comportamiento benigno con una actividad proliferativa limitada3-8. Los NS, a diferencia de los melanomas, no tienen mutaciones en BRAF y NRAS, pero pueden tener mutaciones en HRAS (15-30%). Estas mutaciones pueden estar presentes también con menor frecuencia en el TSA (10%)3,9-11.
Posteriormente se describió un conjunto de TSA esporádicos conocidos como nevos de Wiesner o BAPomas, asociados a mutaciones somáticas de BAP1 (gen supresor tumoral localizado en el cromosoma 3p21), a menudo en combinación con la mutación p.V600E en BRAF12-14. Las mutaciones en BAP1, cuando afectan a la línea germinal, predisponen a múltiples tumores melanocíticos spitzoides dentro del síndrome del tumor BAP115; que asocia tumores malignos como el melanoma cutáneo, melanoma uveal, mesotelioma, carcinoma renal de células claras, meningioma y adenocarcinoma de pulmón16.
Clínicamente, los BAPomas son unos tumores generalmente cupuliformes, de superficie lisa, bien delimitados y ocasionalmente pediculados, con una tonalidad de color que varía entre el de la piel normal, el marrón o el rojizo. Habitualmente se manifiestan como unas lesiones múltiples localizadas en el tronco, de un tamaño medio de 5mm, cuya apariencia hace que puedan confundirse con los nevos de Miescher. Los hallazgos histopatológicos revelan un tumor, principalmente dérmico, constituido por unos melanocitos epitelioides con un citoplasma abundante, los núcleos agrandados con una cromatina vesicular y los nucléolos prominentes, con o sin infiltrado linfocítico asociado, y generalmente no son pigmentados. Muestran unas características citológicas semejantes al NS; sin embargo, están ausentes ciertos rasgos como la hiperplasia epidérmica, la hipergranulosis, los cuerpos de Kamino, los melanocitos fusiformes y las hendiduras alrededor de la unión de los melanocitos12-14. La mutación de BAP1 se correlaciona con la pérdida de expresión nuclear de BAP1 identificada mediante inmunohistoquímica12. La importancia de reconocer estas lesiones radica en sus posibles implicaciones genéticas dentro del síndrome de predisposición a tumores asociado a mutaciones en BAP115,16.
Se han detectado mutaciones del promotor de la transcriptasa inversa de telomerasa (p-TERT) en la mayoría de los melanomas pediátricos, incluido el melanoma spitzoide, y en el 22-71% de los adultos. Se ha postulado que los tumores no mutados se asocian a un pronóstico más favorable que los que portan mutaciones en p-TERT, los cuales presentan un comportamiento más agresivo17.
El 55% de los NS, el 56% de los TSA y el 39% de los melanomas spitzoides muestran fusiones de la quinasa de ROS1, NTRK1, ALK, BRAF o RET18. La presencia de estas translocaciones no parece relacionarse con mayor incidencia de enfermedad agresiva17,19. Los tumores de Spitz con translocaciones de ALK suelen presentarse como unas lesiones aisladas, cupuliformes, generalmente localizadas en las extremidades. Suelen ser amelanóticas y con menor frecuencia pigmentadas. La histopatología muestra unos fascículos plexiformes de melanocitos fusiformes en la dermis, que muestran una expresión de ALK en el estudio con inmunohistoquímica18,19.
Gerami et al. proponen emplear la FISH para detectar el número de copias de los genes RREB1 (6p25), MYB (6q23) y CCND1 (11q13) y del centrómero 6 (Cep 6)5. La ausencia de estas alteraciones es sugestiva de NS, mientras que la presencia de aberraciones cromosómicas sugiere el diagnóstico de melanoma y de algunos TSA con un comportamiento agresivo20, con una sensibilidad del 86,7% y una especificidad del 95,4%5. Tras analizar por grupos de edad, se observó un mayor número de falsos positivos en niños21. Posteriormente, se ha propuesto emplear CDKN2A (9p21), RREB1 (6p25), CCND1 (11q13) y MYC (8q24) debido a su mayor especificidad para detectar lesiones spitzoides22.
En un estudio de casos y controles que analiza el comportamiento agresivo de los tumores spitzoides atípicos, al estratificar el riesgo en función del resultado del FISH, se observó que los casos con deleción 6q23 aislada son de bajo riesgo, mientras que la presencia de aberraciones cromosómicas como la ganancia en 6p25 o 11q13 tenían un riesgo intermedio; en cambio, la pérdida homocigota de 9p21 se asociaba con un comportamiento agresivo23. Lee et al. evaluaron también el resultado de FISH y la frecuencia del comportamiento tumoral agresivo en una cohorte de neoplasias spitzoides atípicas en población pediátrica y estimaron que menos del 25% de los niños con neoplasias spitzoides atípicas con deleciones homocigotas de 9p21 experimentarán una recurrencia después de la escisión completa y menos del 12,5%, metástasis a distancia19.
La espectrometría de masas por imágenes, un nuevo método recientemente empleado para el diagnóstico diferencial de lesiones spitzoides, identifica una firma molecular que permite un diagnóstico específico a través de una combinación distintiva de entre 5 y 20 proteínas. Lazova et al. demostraron, a través de la identificación de una combinación de 5 péptidos, que hay diferencias proteómicas entre el NS y el melanoma spitzoide; estos autores sugieren que el empleo de esta combinación podría proporcionar información útil en la evaluación del riesgo del TSA24.
En un estudio en el que se secuenció el exoma de 77 lesiones melanocíticas (NS, melanomas spitzoides y nevos melanocíticos benignos), se observó que las mutaciones en MEN1, PRKAR1A y DNMT3A en melanomas spitzoides pueden indicar la participación de la vía de la proteína quinasa A, o un papel de la metilación del DNA. Destacan que la carga de mutación somática es menor en el nevo convencional y en el NS frente al melanoma convencional y al melanoma spitzoide25.
Las técnicas moleculares son unas herramientas prometedoras complementarias a la evaluación histológica en los tumores de potencial maligno desconocido. Actualmente, aunque parecen contribuir a una mejor predicción de su comportamiento biológico, puede existir en ocasiones un solapamiento de los perfiles genéticos, por lo que su valor predictivo sigue siendo incierto. El coste y la falta de disponibilidad, en su mayoría restringida a centros de investigación, hacen que la extensión a la práctica clínica diaria sea limitada26.
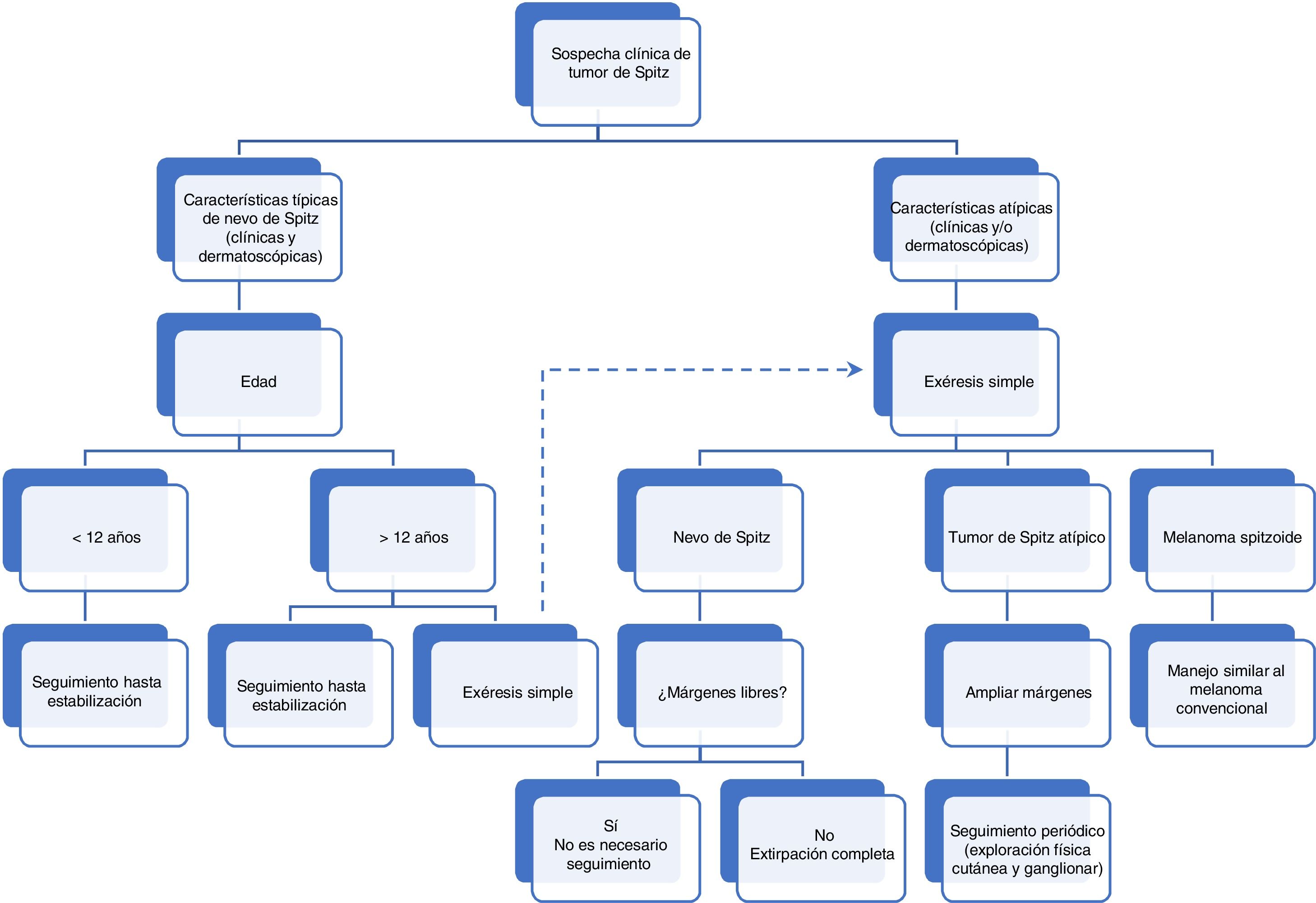
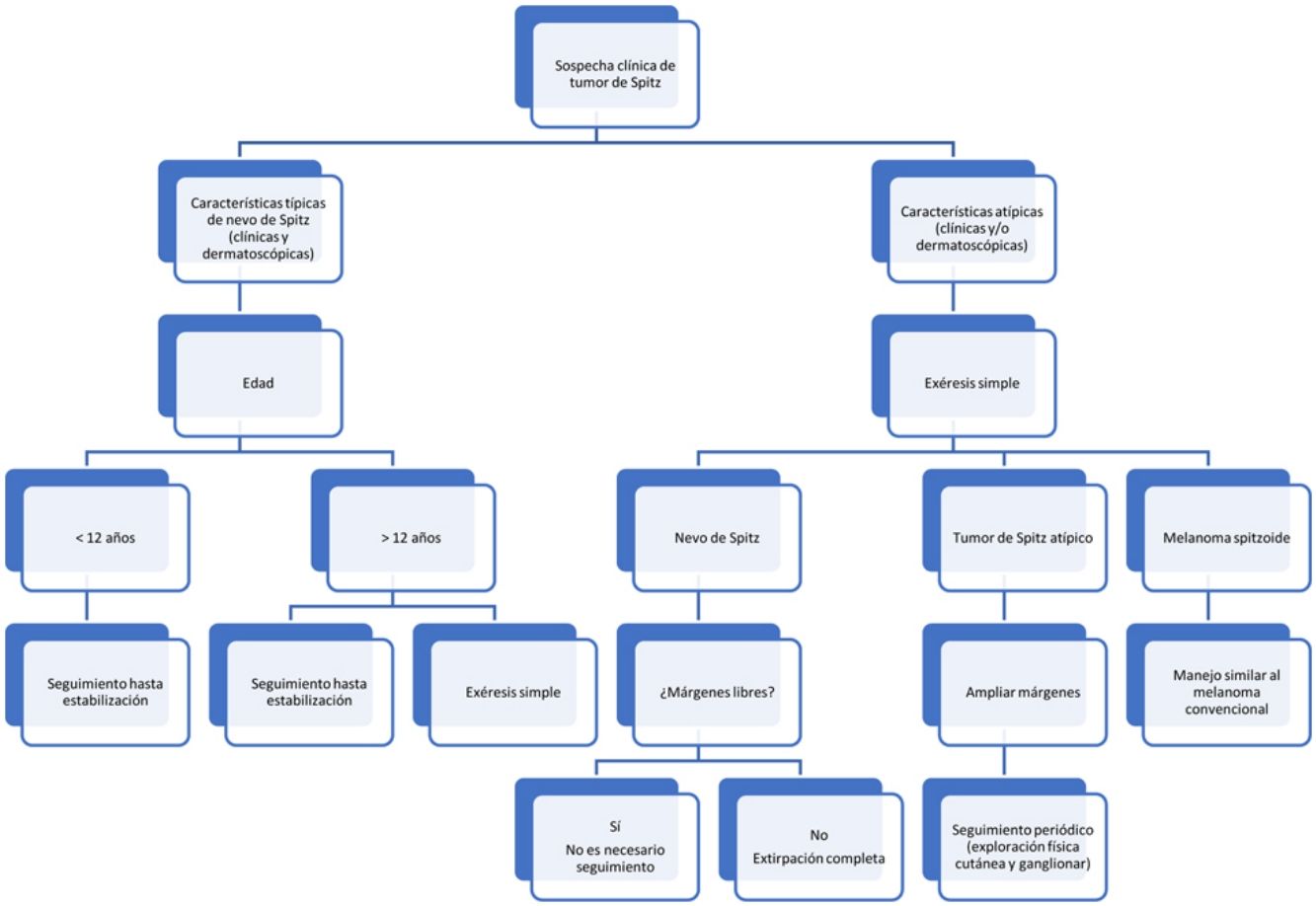
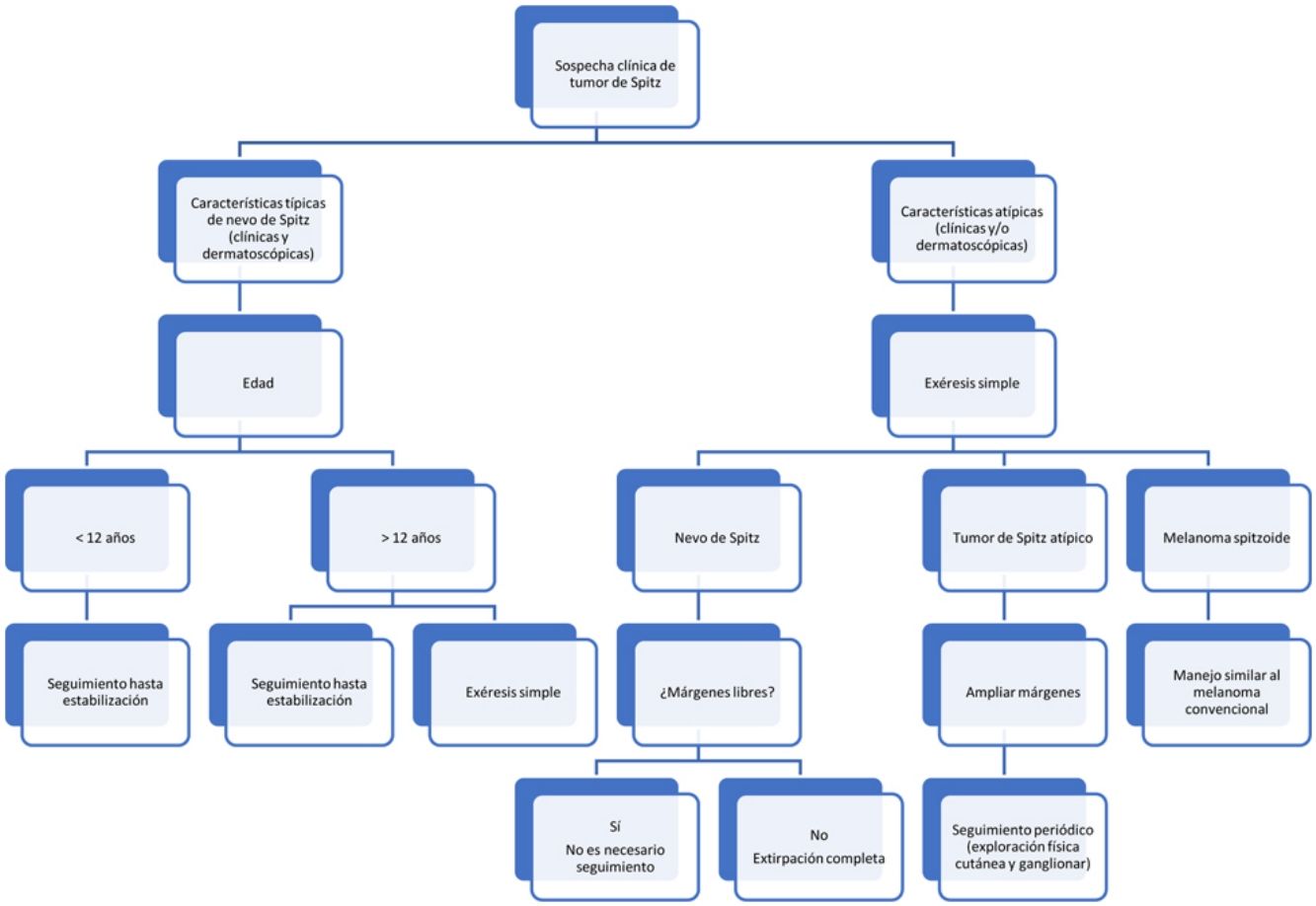
Pronóstico y manejoNevo de SpitzNo existe un consenso establecido para el manejo de los tumores spitzoides. Algunos autores sugieren realizar la exéresis de todas estas lesiones, incluidos los NS clásicos, debido a su semejanza ocasional con el melanoma27. Sin embargo, los NS convencionales son completamente benignos y recientemente se ha observado que hasta en el 80% de los casos se produce una involución espontánea o una conversión a otro tipo más común de nevo melanocítico28. Los casos de NS con metástasis han sido considerados como errores de diagnóstico y se han diagnosticado retrospectivamente de melanomas29. No obstante, el melanoma es muy poco frecuente en la edad pediátrica30. En un estudio realizado por Lallas et al. basado en una cohorte de 384 pacientes de 12 años o más con lesiones que mostraban características spitzoides, los autores observaron un riesgo de melanoma del 13,3%, y este riesgo aumentó significativamente con la edad del paciente, siendo la probabilidad de tratarse de un nevo igual que la de melanoma después de los 50 años y sugieren que un patrón dermatoscópico spitzoide a los 70 años es predictivo de melanoma31. Por esto, ante un NS convencional en la infancia, fundamentalmente en niños menores de 12 años, sin características clínicas o dermatoscópicas atípicas, parece recomendable realizar solamente un seguimiento clínico periódico32. Nino et al. proponen realizar seguimiento cada 6 meses los 2-3 primeros años y posteriormente una vez al año33. Además, en este grupo de edad, las lesiones se localizan frecuentemente en áreas visibles y, por tanto, una actitud más conservadora puede evitar posibles secuelas, como cicatrices inestéticas secundarias a la extirpación de una lesión benigna. Dado que la incidencia de melanoma aumenta con la edad, es compresible que la extirpación se realice con más frecuencia en adultos.
En una actualización reciente sobre el manejo de lesiones spitzoides, se recomienda la escisión quirúrgica completa después de los 12 años para lesiones sin características atípicas (tablas 1 y 2, parte 1) y como alternativa, monitorización digital hasta la estabilización32. La escisión debe plantearse también en todos aquellos tumores spitzoides con características clínicas o dermatoscópicas atípicas independientemente de la edad del paciente32,33. Con base en el hallazgo de un estudio previo que muestra que las lesiones nodulares están asociadas a un mayor riesgo de ser melanomas que las de superficie plana (32% frente al 12% respectivamente)32, se recomienda:
- a)
En aquellas lesiones clínicamente típicas de aspecto más nodular, realizar extirpación o, como alternativa, monitorización clínica y dermatoscópica. Esta monitorización inicialmente debe realizarse a los 15 días y posteriormente, si no se detectan cambios, a las 4 y 8 semanas, hasta alcanzar 6 meses sin crecimiento o si se encuentra en involución hasta su desaparición, momento en el cual el seguimiento puede suspenderse. En caso de detectar crecimiento entre 2 visitas se recomienda la extirpación32.
- b)
Para las lesiones clínicamente típicas de superficie plana se propone realizar seguimiento cada 2-3 meses; se consideran no alarmantes las lesiones que muestren un patrón dermatoscópico en estallido de estrellas, globular, vasos puntiformes o los cambios naturales producto de la evolución secuencial que suele presentar el NS hasta adquirir el aspecto de un nevo convencional o hasta su involución. Al igual que para las lesiones de aspecto nodular, la monitorización debe mantenerse hasta que transcurran 6 meses en ausencia de crecimiento32. Recientemente los autores de esta guía de manejo han propuesto una modificación: tras argumentar que no han detectado ningún caso de melanoma o TSA con un patrón inicial en estallido de estrellas simétrico, defienden la posibilidad de no llevar a cabo más acciones o solo seguimiento, aunque se produzcan cambios asimétricos posteriores34.
Todavía hoy existen dudas sobre el potencial biológico de los TSA. Se cree que constituyen un conjunto heterogéneo con un comportamiento biológico distinto, benigno en una gran parte de los casos y solo en un pequeño porcentaje constituirán melanomas35. En estos casos, ante la incertidumbre de si seguir o no el protocolo de tratamiento del melanoma convencional, Kelley y Cockerell36 propusieron evaluar el estado del ganglio centinela como método diagnóstico en los casos dudosos de 1,0mm de grosor o más, y se consideró la presencia de melanocitos con atipias citológicas en el parénquima o en el seno subcapsular del ganglio linfático, al igual que en el melanoma convencional, como enfermedad metastásica. Posteriormente, se ha visto que en los TSA los ganglios linfáticos están afectados con una mayor frecuencia que en el melanoma convencional en el adulto (38-39% frente al 10-16%, respectivamente)35,37. Ludgate et al. observaron una tasa de positividad del ganglio centinela del 47% en una cohorte de 67 pacientes con TSA. Pese a esta alta incidencia, ningún paciente con un resultado positivo en la biopsia selectiva del ganglio centinela (BSGC) mostró recurrencia y todos estaban libres de enfermedad tras un seguimiento medio de 3,6 años. Además, los autores encuentran que una edad menor se asocia significativamente con una mayor frecuencia de positividad del ganglio pero con un mejor pronóstico, al igual que lo descrito hasta el momento para el melanoma38,39. Estos resultados revelaron que quizá el resultado positivo del ganglio centinela podría no ser tan significativo en determinar el potencial maligno de los TSA, como previamente se pensaba26. No obstante, proponen llegar a un consenso con el paciente tras explicar los riesgos y beneficios de la BSGC para TSA38.
Con el fin de evitar la realización de procedimientos diagnósticos y terapéuticos agresivos innecesarios, en una revisión sistemática que incluyó 541 pacientes con TSA, Lallas et al. evaluaron el papel de la BSGC como un método de pronóstico en el tratamiento de estos pacientes. Esta revisión incluyó 303 pacientes a los que se les realizó BSGC, que resultó positiva en 119 de ellos (39%). Se observó que la mayoría de los pacientes con TSA siguen un curso clínico favorable: el 99% de los que mostraron un resultado positivo en la BSGC no presentaron progresión extraganglionar a los 5 años35, mientras que el 32-37% de pacientes con melanoma convencional y BSGC positiva presentan progresión de la enfermedad a los 3 años40. Del grupo de 541 pacientes con TSA, solo 5 (<1%) tuvieron recidiva local durante el seguimiento: 2 de entre 238 que habían sido tratados con escisión local amplia sin realizarse BSGC, 2 de entre 184 pacientes con un resultado negativo en la BSGC, y uno de entre 119 pacientes con una BSGC positiva35.
La presencia de agregados de melanocitos en los ganglios no tiene el mismo significado que en el melanoma41; así, algunas proliferaciones melanocíticas benignas que incluyen nevos azules42, nevos congénitos y adquiridos43, y de manera análoga algunos NS, pueden mostrar depósitos en los ganglios linfáticos debido a un proceso de migración de células melanocíticas benignas del nevo.
Una serie de 24 pacientes en edad pediátrica con TSA tratados mediante escisión completa y sin BSGC reveló, tras un seguimiento medio de 3 años, que todos los pacientes se encontraban libres de enfermedad44. Por tanto, no parece existir evidencia concluyente que apoye la BSGC en pacientes con TSA, ya que conlleva una cierta morbilidad sin obtener un beneficio pronóstico35,38,44.
Aunque no se han llevado a cabo estudios que evalúen los márgenes óptimos, empleando una herramienta de evaluación y diagnóstico de la patología melanocítica (MPATH-Dx) que se basa en un sistema de notificación de tumores melanocíticos, se incluyeron los NS en la categoría 2, que implica escisión con un margen <5mm, y los TSA en la categoría 3, es decir, escisión con un margen de 5-9mm. Los melanomas se incluyen en categoría 3 o 4, escisión amplia con margen ≥1cm45. Sin embargo, la recomendación de muchos autores para los TSA es realizar una escisión amplia, y los márgenes empleados con mayor frecuencia son de 1cm26,35,38. Tampoco existe consenso con respecto a la vigilancia para los TSA extirpados; las últimas recomendaciones incluyen un seguimiento clínico periódico de al menos una vez año durante 3 años, asociado a ecografía ganglionar en caso de ganglios linfáticos palpables32,35. En la figura 1 se resume el algoritmo para el manejo de tumores spitzoides.
En conclusión, las lesiones spitzoides representan un desafío tanto en el diagnóstico como en el manejo clínico. La integración de la forma de presentación clínica, los hallazgos histopatológicos, los patrones de expresión inmunohistoquímicos, la dermatoscopia y las nuevas técnicas de genética molecular nos pueden ayudar a aclarar el potencial biológico de los TSA. No debe olvidarse que el melanoma en la infancia es muy infrecuente, por lo que la edad del paciente es uno de los factores más importantes a considerar.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.