El nevo de Spitz es una neoplasia melanocítica de células epitelioides o fusiformes que suele aparecer en la infancia. Su naturaleza es benigna, aunque en ocasiones puede mostrar unas características difíciles de distinguir del melanoma. En las últimas décadas se han clasificado las neoplasias melanocíticas spitzoides en 3tipos: nevus de Spitz, tumor de Spitz atípico y melanoma spitzoide. El tumor de Spitz atípico hace referencia a las neoplasias melanocíticas spitzoides que tienen unas características histopatológicas atípicas insuficientes para realizar el diagnóstico de melanoma y cuyo potencial maligno, actualmente, es incierto. Nuestro objetivo es revisar los aspectos clínicos, dermatoscópicos, histopatológicos e inmunohistoquímicos de este conjunto de tumores.
A Spitz nevus is a melanocytic neoplasm of epithelioid and/or spindle cells that usually appears in childhood. These lesions are by nature benign, but their features can sometimes make them difficult to distinguish from melanomas. Spitzoid melanocytic lesions have been grouped into 3 types in recent decades: Spitz nevi, atypical Spitz tumors, and spitzoid melanomas. Atypical Spitz tumors are spitzoid melanocytic proliferations that have atypical histopathologic features that are insufficient to support a diagnosis of melanoma. The malignant potential of these lesions is at present uncertain. This review examines the clinical, dermoscopic, and histopathologic features of this group of lesions.
El nevo de Spitz (NS) es una neoplasia melanocítica de células epitelioides o fusiformes descrita por primera vez en 1910 por Darier y Civatte1 y caracterizada en 1948 por Spitz bajo el nombre de «melanoma juvenil» como un tumor melanocítico, presente en la infancia, con unas características clínicas y patológicas parecidas a un melanoma pero con un comportamiento benigno2. Posteriormente, se observó que afectaba a todos los grupos de edad3. Desde su descripción inicial hasta la fecha actual ha constituido una entidad polémica debido a su semejanza con el melanoma y a la ausencia de un consenso que establezca tanto sus características diagnósticas como una estrategia de manejo clínico.
Las neoplasias melanocíticas con una morfología spitzoide incluyen un espectro de progresión entre lesiones benignas y malignas. En las últimas décadas predomina una tendencia a clasificarlas en 3tipos, en ocasiones difíciles de distinguir entre sí: NS convencional, tumor de Spitz atípico (TSA) y melanoma spitzoide. Este concepto de categoría intermedia, denominada TSA o de potencial maligno incierto, hace referencia a aquellos cuadros histológicos con unas características atípicas insuficientes para realizar un diagnóstico de melanoma4-6. Esta categoría ha sido motivo de numerosas críticas. Algunos autores creen que debería haber una clara distinción entre los tumores benignos y malignos, y afirman que la introducción de este término ha generado confusión acerca de su significado y de su comportamiento biológico7. Sin embargo, la literatura reciente muestra que muchos patólogos aceptan este concepto de lesiones intermedias8 y que existe un espectro de alteraciones genéticas en estas lesiones (véase la parte 2).
EpidemiologíaLa incidencia general de los NS no está bien documentada, oscila entre 1,4 y 7 casos nuevos por cada 100.000 personas por año9-11. Representan menos del 1% de los tumores melanocíticos que se extirpan en la infancia12.
Los NS aparecen generalmente en la infancia o en adultos jóvenes, aunque pueden afectar a todos los grupos de edad. Son extremadamente infrecuentes a partir de la cuarta década de la vida10. Los casos congénitos, presentes al nacimiento o en los primeros 24 meses de vida, son excepcionales13. Un estudio de 349 pacientes detectó que el 40% aparece en menores de 15 años y el 77% se presenta a una edad inferior a 30 años14. El riesgo de que una lesión de aspecto spitzoide sea de hecho un melanoma aumenta con el transcurso de los años, mientras que disminuye la probabilidad de que sea un NS.
No hay una predilección por sexos, aunque se ha visto que entre los 15 y 30 años existe un ligero predominio femenino (3:1). Se ha sugerido que este hecho podría estar relacionado con una posible influencia hormonal3,12,15,16.
Los NS son más frecuentes en individuos de raza caucásica que en la población asiática o africana16,17.
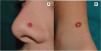
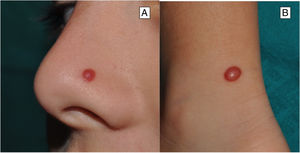
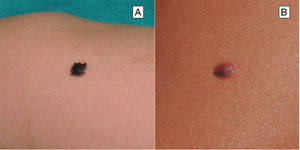
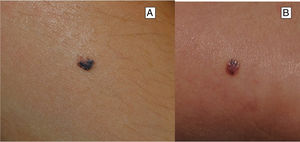
ClínicaNevo de SpitzEl NS aparece generalmente en la infancia como una pápula o tuberosidad solitaria, bien circunscrita, cupuliforme, de consistencia firme y cuya tonalidad varía entre el color carne, rosa, rojizo o marronáceo (fig. 1). El color, con frecuencia rojizo, se debe al bajo contenido en melanina y a la alta vascularización, aunque un 10% son pigmentados (fig. 2)3. Crecen rápidamente durante un periodo de 3-6 meses y, aunque su tamaño es generalmente inferior a 5-6mm, pueden alcanzar un diámetro de 1-2cm. Tras esta fase de crecimiento rápido la lesión puede mantenerse estática durante años, mostrar una transformación progresiva hasta adquirir el aspecto de un nevus melanocítico común o involucionar hasta su desaparición completa18,19. En adultos suele presentarse como una lesión pigmentada de tonalidad entre marrón y negra.
Aunque pueden localizarse en cualquier área, incluidas las mucosas, en la infancia muestran una predilección por la cabeza y el cuello (37%), mientras que en adultos jóvenes se localizan preferentemente en las extremidades inferiores (28%)20,21.
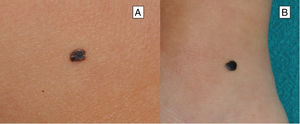
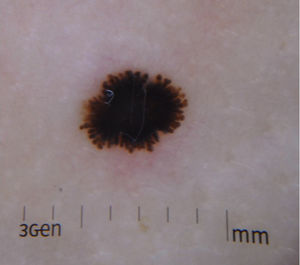
Nevo de Reed o nevo pigmentado de células fusiformesEl nevo de Reed (NR) se describió en 1975 como una lesión melanocítica benigna, muy pigmentada, de tonalidad marrón oscura o negra y de un tamaño generalmente inferior a 8mm22 (fig. 3). Suele presentarse en las extremidades inferiores de niños mayores y adolescentes, con una predilección por los muslos en las mujeres jóvenes, y también se manifiesta en el tronco de los adultos23. Algunos autores consideran el NR como un subtipo del NS y otros lo reconocen como una entidad independiente. Su detección parece haber aumentado con la introducción de la dermatoscopia18.
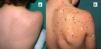
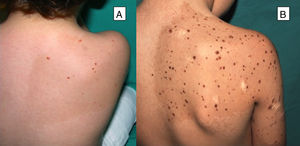
Nevo de Spitz múltiplesSe caracterizan por la presencia de 2o más NS en un solo paciente. Es una presentación infrecuente que, dependiendo de su distribución, puede dividirse en 2subgrupos: agrupados o diseminados24. Los NS múltiples agrupados se pueden desarrollar sobre una mancha café con leche25 (fig. 4), sobre una piel normal o, menos frecuentemente, sobre un fondo hipopigmentado. Cuando surgen NS múltiples con un patrón diseminado, si se desarrollan en un periodo corto, se han denominado NS múltiples eruptivos. Su etiología es desconocida, se ha postulado que su aparición podría estar relacionada con una predisposición genética o con factores desencadenantes. Se han notificado casos tras una quemadura solar, un estrés perioperatorio, un embarazo, el abuso de fármacos, una enfermedad de Addison, la quimioterapia y tras el trasplante alogénico de células madre hematopoyéticas24.
Nevo de Spitz desmoplásicoEs un subtipo raro de NS, más frecuente en la adolescencia tardía o en adultos que en niños. Clínicamente, se presenta como una pápula con escasa o ninguna pigmentación melanocítica, de bordes mal delimitados y con una consistencia leñosa. Se localiza con una mayor frecuencia en las extremidades26.
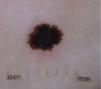
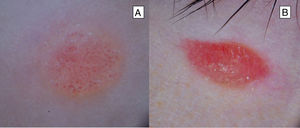
Tumores de Spitz atípicosSuelen tener un tamaño mayor (> 10mm) que el NS clásico y, a diferencia de este, su forma suele ser asimétrica, los bordes generalmente son irregulares y la superficie puede estar ulcerada3,6 (tabla 1) (fig. 5). En un estudio retrospectivo que incluye 72 neoplasias spitzoides en pacientes de entre 1 y 18 años, se observó que el 7% constituye TSA27.
Características clínicas del nevo de Spitz convencional y del tumor de Spitz atípico
| Características clínicas | Nevo de Spitz clásico | Tumor de Spitz atípico |
|---|---|---|
| Edad | <10 años | >10 años |
| Localización | Cara, cuello y extremidades | Tronco |
| Tamaño | <10mm (generalmente 5-6 mm) | >10 mm |
| Bordes | Bien definidos y regulares | Mal definidos e irregulares |
| Superficie | Lisa | Irregular, ulcerada |
| Color | Rosa, rojizo | Heterocromía |
Adaptado de Luo et al3.
El melanoma es poco frecuente en edad pediátrica; no obstante, la mayoría de los melanomas diagnosticados en niños son melanomas spitzoides. Estos constituyen una variante poco frecuente de melanoma que histopatológicamente pueden simular un NS. En general, suele manifestarse como una lesión amelanótica o pigmentada, heterocrómica, que presenta un crecimiento progresivo, pudiendo alcanzar más de 1cm de diámetro y con frecuencia muestra ulceración. Suele localizarse en la cabeza, el cuello o las extremidades. Su comportamiento biológico es como el del melanoma convencional, aunque se ha observado un curso más favorable en los melanomas spitzoides de niños menores de 10 años o prepúberes28,29.
DiagnósticoEl diagnóstico del NS puede ser difícil por su semejanza clínica con otros tumores cutáneos y plantea diagnósticos diferenciales (tabla 2).
Principales diagnósticos diferenciales nevo de Spitz
| Nevo de Spitz convencional o hipopigmentado | Granuloma piogénico |
| Mastocitoma | |
| Hemangioma | |
| Angiofibroma | |
| Xantogranuloma juvenil | |
| Molusco contagioso | |
| Melanoma amelanótico | |
| Nevo de Spitz pigmentado | Nevos melanocíticos congénitos y adquiridosMelanoma |
| Nevo de Spitz desmoplásico | QueloideDermatofibroma |
| Nevo de Spitz múltiples | Melanoma metastásico |
La introducción de la dermatoscopia ha permitido obtener una mayor precisión en el diagnóstico del NS debido a la identificación de una variedad de patrones que proporcionan información adicional sobre su morfología (tabla 3)30,31. Aunque la identificación de estos patrones ha contribuido a mejorar el reconocimiento de estos tumores, ninguno es específico del NS y pueden estar presentes en el melanoma, por lo que es fundamental realizar una interpretación cuidadosa32.
Patrones dermatoscópicos presentes en lesiones spitzoides
| Patrón en lesiones spitzoides pigmentadas | Descripción |
|---|---|
| Patrón en estallido de estrellas | Pigmentación central entre grisácea, azulada y negra, homogénea con proyecciones (rayas/vetas o seudópodos) radiales regulares en la periferia |
| Patrón globular | Pigmentación azul-negra central y presencia de estructuras redondeadas u ovaladas regulares de color marrón-negro en la periferia distribuidas regularmente |
| Patrón homogéneo | Pigmentación marrón, gris-azulada o gris-negra difusa en ausencia de otras estructuras |
| Patrón atípico o multicomponente | Distribución desigual de colores y estructuras |
| Patrón reticular | Red de pigmento similar al presente en los nevos melanocíticos adquiridos |
| Patrón de red en negativo | Red de pigmento invertida (líneas blancas que rodean a los glóbulos pigmentados) |
| Patrón en lesiones spitzoides hipopigmentadas | Descripción |
|---|---|
| Patrón vascular puntiforme | Vasos puntiformes con distribución regular |
| Patrón vascular glomerular | Capilares tortuosos o enrollados |
| Patrón vascular con vasos en horquilla | Vasos en forma de lazo o bucle. |
| Patrón vascular en estallido de estrellas | Líneas vasculares radiales, regulares en la periferia |
| Color rosado homogéneo | Tonalidad rosada con o sin restos de pigmentación parduzca en ausencia de otras estructuras |
| Despigmentación reticular | Red blanquecina que rodea los vasos |
| Estructuras de crisálidas | Rayas lineales, ortogonales o desordenadas de color blanco brillante. Se pueden ver con dermatoscopia de luz polarizada, asociadas al patrón anterior |
Adaptado de Lallas et al.31.
El NS clásico se ha asociado con una mayor frecuencia con la presencia de un patrón vascular punteado. Este consiste en vasos puntiformes y monomorfos, distribuidos regularmente sobre un fondo rosado (fig. 6). Este patrón está presente en el 51% de los NS. En el NS pigmentado se observa con mayor frecuencia un patrón en estallido de estrellas o un patrón globular, que se caracterizan por una pigmentación central entre grisácea, azulada y negra, homogénea con proyecciones radiales regulares en la periferia en el patrón en estallido de estrellas (fig. 7) y estructuras redondeadas u ovaladas de color marrón-negro, distribuidas regularmente en la periferia en el patrón globular, presentes en el 51 y el 17% de los NS, respectivamente30,31,33. Otro patrón, inicialmente asociado con el melanoma, pero que está presente también en el NS, es el llamado red de pigmento en negativo o despigmentación reticular que consiste en líneas blancas entrecruzadas que rodean a los glóbulos pigmentados o a los vasos32. Este último patrón puede presentarse asociado al patrón vascular punteado o en coma, o al patrón globular34,35. Es interesante destacar que si el patrón globular no está asociado a despigmentación reticular, no es característico del NS, ya que estas estructuras redondeadas u ovaladas regulares en la periferia están frecuentemente presentes en los nevos melanocíticos de los niños27,36. Otros patrones, como el homogéneo, que se caracteriza por una pigmentación marrón o negra en ausencia de otras estructuras, o el patrón reticular, en el que se observa una red de pigmento similar a los nevos melanocíticos adquiridos, pueden estar presentes en la evolución natural del NS. Se ha descrito una evolución secuencial en la cual un NS puede pasar por diferentes patrones dermatoscópicos, con una transformación progresiva desde un patrón globular hasta un estallido de estrellas, y este hasta un patrón homogéneo hasta su involución y desaparición espontánea en más del 50% de los casos18,37-39. El patrón multicomponente se caracteriza por una distribución no uniforme de colores y estructuras33,40. En un estudio que evaluó las características dermatoscópicas de los TSA se observó que la mayoría mostraba este patrón y un 16,4% mostraba un patrón global vascular puntiforme41.
Aunque es una técnica útil, la dermatoscopia no siempre es suficiente para diferenciar los NS del melanoma. La simetría en la disposición de las estructuras y colores en toda la lesión caracteriza al patrón spitzoide y nos debe orientar al diagnóstico de un NS, mientras que la asimetría, la presencia de un patrón multicomponente o la visualización de crisálidas, aunque pueden estar presentes en el NS, nos obligan a descartar un melanoma31. En un estudio de casos y controles, realizado en población pediátrica en el que se compararon las características dermatoscópicas según grupos de edades (0-6, 7-12 y 13-18 años), se observó que los patrones vasculares y globulares fueron más prevalentes en los niños preescolares, mientras que en los niños en edad escolar predominó un patrón en estallido de estrellas o multicomponente, y en adolescentes se objetivó con mayor frecuencia un patrón de red de pigmento en negativo27. Sin embargo, una revisión sistemática en la que se incluyeron 15 estudios de casos y controles y series de casos con pacientes de todas las edades, pero con un predominio de adultos, concluyen que el tipo de patrón no se relaciona con la edad del paciente31.
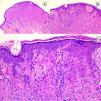
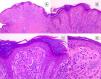
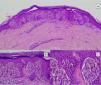
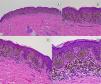
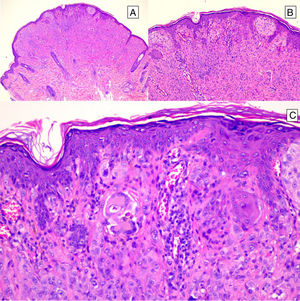
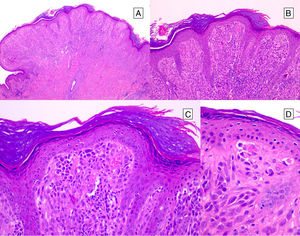
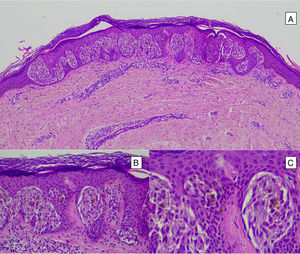
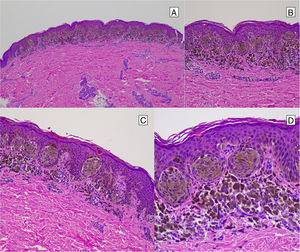
HistopatologíaNevo de SpitzLos NS son unas lesiones melanocíticas simétricas y bien circunscritas, generalmente compuestas, aunque al igual que otros nevos melanocíticos, pueden ser de la unión o intradérmicos. Se caracterizan por la presencia de unos melanocitos epitelioides (redondeados o poligonales) o fusiformes con los núcleos agrandados y regulares con una marginación periférica, que muestran un citoplasma abundante y unos nucléolos prominentes centrales. Se distribuyen formando unos nidos uniformes con orientación vertical y, ocasionalmente, puede haber una dispersión pagetoide de melanocitos aislados en las capas más altas de la epidermis o en la unión. El componente dérmico madura en profundidad y, en menor medida, hacia la periferia. La epidermis puede estar preservada o mostrar una hiperplasia regular, los vasos dérmicos suelen estar dilatados y se observan hendiduras entre los nidos de melanocitos14,41-44. En la epidermis o en la dermis papilar se reconocen a menudo unos glóbulos eosinófilos, que contienen proteínas de la membrana basal, también conocidos como cuerpos de Kamino45. Estas estructuras son características del NS, pero pueden estar presentes también en el melanoma, aunque en este último no suelen ser de gran tamaño ni estar tan bien conformados46. Se puede observar un infiltrado inflamatorio linfocítico en la base y perivascular. También puede aparecer ocasionalmente alguna mitosis típica (generalmente menos de 2/mm2) en la parte media o superior de la lesión; son más raras en la dermis profunda y no se observan mitosis atípicas. El pigmento suele ser granular y localizarse en la parte superficial14,41-44 (tabla 4) (figs. 8-10).
Características histopatológicas del nevo de Spitz y del melanoma spitzoide
| Nevo de Spitz | Melanoma spitzoide |
| Simetría | Asimetría |
| Buena delimitación | Mala delimitación |
| Epidermis intacta o hiperplásica | Epidermis puede estar ulcerada |
| Cuerpos de Kamino | Ausencia de cuerpos de Kamino |
| Maduración en profundidad | Ausencia de maduración en profundidad |
| Escasa dispersión pagetoide | Intensa dispersión pagetoide |
| Menos de 2 mitosis/mm2 | Frecuentes mitosis en la dermis, pueden ser atípicas |
| Baja relación núcleo/citoplasma | Elevada relación núcleo/citoplasma |
| Núcleos aumentados de tamaño, pero ausencia de pleomorfismo nuclear | Pleomorfismo celular, atipia citológica de alto grado |
Nevo de Spitz intraepidérmico. Aunque la mayoría de los NS son compuestos, una pequeña proporción de ellos pueden estar limitados a la unión dermoepidérmica. Las características citológicas, no obstante, son similares a las del NS compuesto. A) A poco aumento destaca una lesión intraepidérmica compuesta por grandes tecas de células névicas fusiformes. B) y C) A mayor aumento puede apreciarse la celularidad fusocelular sin atipia y con escaso pigmento melánico citoplasmático, así como la presencia de cuerpos de Kamino.
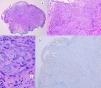
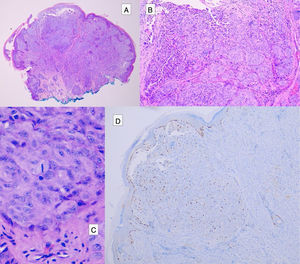
En estas lesiones, no se encuentran todas las características histopatológicas típicas del NS y tampoco se llegan a cumplir criterios de melanoma. El TSA muestra al menos una de las siguientes características: asimetría, mala delimitación lateral, mayor extensión en profundidad, falta de maduración en la dermis, ulceración, ausencia de cuerpos de Kamino, presencia mitosis en dermis (generalmente>2-6 mitosis/mm2) y abundantes melanocitos aislados en la dermis superficial en lugar de nidos3,47,48 (fig. 11).
Se considera que la presencia de un elevado número de mitosis profundas, asimetría, atipia citológica de alto grado y ulceración son los criterios histopatológicos que se correlacionan con un mayor riesgo de metástasis47.
Nevo pigmentado de células fusiformes o nevo de ReedEs una lesión melanocítica, pequeña, bien circunscrita, constituida por una proliferación simétrica de células fusiformes con una pigmentación intensa. Las células se disponen formando unos nidos redondeados con una disposición vertical u horizontal en la unión dermoepidérmica y suelen ser más pequeñas que las células fusiformes de la mayoría de los NS convencionales (fig. 12). Aunque puede haber actividad mitótica, no se suelen ver figuras de mitosis atípicas, las cuales nos deben hacer descartar un melanoma de células fusiformes, extremadamente infrecuente en la infancia44.
Nevo de Spitz desmoplásicoEs una proliferación intradérmica de melanocitos fusiformes rodeados por una gran cantidad de haces de colágeno engrosados, que forman nidos a nivel superficial y en la periferia las células están más dispersas. Se pueden encontrar algunas mitosis superficiales, pero no en profundidad. Debe realizarse el diagnóstico diferencial con el melanoma desmoplásico44,49.
Nevo de Spitz combinadoSe caracteriza por mostrar componentes de 2subtipos diferentes de nevos: NS y otro tipo de nevo, como el nevo melanocítico adquirido o el nevo azul44.
Nevo de Spitz recurrente o persistenteLa recurrencia del NS tras una extirpación parcial o completa puede simular un melanoma; se solapan los criterios histológicos del NS clásico con la presencia de asimetría y de dispersión pagetoide sobre las áreas cicatriciales. Puede constituir un diagnóstico difícil, especialmente cuando se produce una recurrencia multifocal. Es de utilidad evaluar de nuevo la pieza de extirpación inicial50,51.
Halo nevo de SpitzSe observa la arquitectura del NS con un infiltrado linfocítico inflamatorio notable. Clínicamente, se manifiesta como un eritema, un aumento de tamaño o prurito en la localización del NS y suele extirparse antes de que revele el halo de despigmentación44.
Nevo de Spitz pagetoideSe caracteriza por unos melanocitos aislados abundantes con extensión pagetoide intraepidérmica, cuya distinción de un melanoma in situ puede ser difícil52,53.
Nevo de Spitz tubularEs una variante excepcional de NS con una apariencia tubular. Alrededor de un centro ópticamente vacío se disponen unos nódulos intradérmicos, pequeños, compuestos por las células epitelioides del nevo. Puede asociar un infiltrado inflamatorio intenso14,44,54.
Se han postulado varias teorías con respecto a su apariencia tubular: inicialmente se ha atribuido al producto de la apoptosis de las células centrales del nevo54 y, posteriormente, se ha considerado un fenómeno artefacto de retracción secundario a la fijación en formaldehído más que una variante verdadera del NS55.
Nevo de Spitz de células balonizadasSe caracteriza por presentar, además de las células del NS convencional, unas células de gran tamaño con los citoplasmas vacuolados y con núcleos basófilos pequeños, llamadas células balonizadas. Estas últimas deben representar, al menos, el 50% de las células del nevo56.
Nevo de Spitz mixoide o hialinizanteSe producen unos cambios mixoides o hialinizantes en el contexto de un NS57,58.
Nevo de Spitz plexiformeMuestra la arquitectura del NS con melanocitos que forman nidos con un crecimiento fascicular dérmico prominente. En ocasiones, se ha considerado como un tipo de TSA59.
Otras variantesEntre otras variantes, se encuentran el NS polipoide y el NS verrucoso, ambos caracterizados por una morfología marcadamente exofítica60. El NS angiomatoide, considerado originalmente como una variante de NS desmoplásico, es un NS clásico con una proliferación vascular notable44,61.
Melanoma spitzoideComo ya hemos mencionado, los melanomas spitzoides pueden mostrar gran parecido con los NS, mostrando nidos de melanocitos epitelioides o fusiformes asociados a un mayor número de características atípicas que los TSA, como la mala delimitación, la asimetría, la dispersión pagetoide extensa, el crecimiento dérmico con una maduración en profundidad ausente o escasa y con mitosis atípicas, así como una atipia celular de alto grado28,29 (tabla 4).
InmunohistoquímicaLos marcadores inmunohistoquímicos se emplean como una herramienta complementaria cuando el diagnóstico histopatológico de NS es dudoso, con el fin de diferenciar mejor los NS de los TSA y del melanoma (tabla 5). Aunque es una herramienta auxiliar útil en la identificación de características de malignidad, la interpretación puede ser subjetiva entre los patólogos.
- •
MIB1: es un anticuerpo monoclonal que reacciona contra la proteína Ki-67, una proteína nuclear implicada en la regulación del ciclo celular. Es un marcador de proliferación que se expresa en mayor proporción en los núcleos de los melanomas y TSA en comparación con los NS. Su expresión disminuye progresivamente de las lesiones malignas a las benignas, siendo de un 37% en los melanomas, de un 10% en los TSA, de un 5% en los NS y de un 0,5% en los nevos convencionales62,63.
- •
HMB45: es un marcador de maduración en relación con la profundidad. Se expresa en las zonas superficiales con un efecto gradiente disminuyendo hacia la base en el NS y desestructurado con la pérdida del gradiente (distribución más uniforme, persistiendo en dermis) en el melanoma. No está establecido el patrón de expresión en los TSA y una tinción negativa no descarta el diagnóstico de melanoma64.
- •
p53: muestran índices de expresión más bajos en el NS que en el melanoma, aunque el patrón de expresión no es constante65.
- •
p21 y ciclina D1: se sobreexpresan en el NS y su expresión está disminuida en el melanoma no spitzoide66.
- •
p16: es una proteína reguladora del ciclo celular, codificada por el gen CDKN2A, localizada en el cromosoma 9p. Muestra una reactividad más intensa en la dermis en el NS que en el melanoma. Se tiñe intensamente en los tumores de Spitz desmoplásicos, a diferencia del melanoma desmoplásico donde suele estar ausente67-69. Se han identificado 3patrones en los tumores melanocíticos spitzoides:
- ∘
Expresión homogénea: suele observarse en el NS y representa la pérdida heterocigota del cromosoma 9p o un cromosoma 9p intacto.
- ∘
Pérdida completa de la expresión: común en el melanoma y se corresponde con la pérdida homocigota del cromosoma 9p, una mutación puntual en CDKN2A o la metilación del promotor de CDKN2A.
- ∘
Pérdida heterogénea de expresión: puede observarse en tumores compuestos por clones mixtos. Se duda si tiene valor para diferenciar TSA y melanoma, ya que en los TSA la pérdida puede ser bastante variable; el 67% de los TSA con pérdida heterocigota de 9p21 muestran expresión de p16, mientras que los que presentan pérdida homocigota no la expresan70,71.
- •
E-cadherina: Es un antígeno que se expresa difusamente en el NS y otras lesiones benignas.
- •
CD99: es una glucoproteína transmembrana expresada con una frecuencia mayor en el melanoma (56%) que en el NS (5%). En el melanoma la tinción suele ser difusa, a diferencia del NS que, cuando muestra expresión, generalmente es focal72.
- •
MART1: es un antígeno de diferenciación melanocítica que se expresa tanto en el NS como en el melanoma73.
- •
S100: tinción débil en el NS en comparación con el melanoma74.
- •
S100A6: la tinción es más intensa y difusa en el NS, con un patrón parcheado o negatividad en el NR, mientras que es más débil y desigual en el melanoma75.
Patrones de expresión de los marcadores inmunohistoquímicos empleados para el diagnóstico diferencial de tumores spitzoides
| Antígeno | Nevo de Spitz | Melanoma |
|---|---|---|
| Ki-67 | Mal expresado (5%), unión y dermis papilar | Altamente expresado (37%), difuso |
| HMB45 | Expresión superficial, menos intensa en profundidad | Pérdida del gradiente, se mantiene la expresión en profundidad |
| p16 | Intensa expresión | Se suele perder su expresión |
| p53 | Expresión baja | Expresión alta |
| E-cadherina | Expresión difusa (también en otras lesiones benignas) | Se pierde su expresión |
| S100 | Expresión débil | Expresión intensa |
| S100A6 | Expresión intensa y difusa | Expresión débil y desigual |
| Ciclina D1 | Expresión intensa | Expresión baja en melanoma no spitzoide |
| p21 | Expresión intensa | Expresión baja en melanoma no spitzoide |
| CD99 | Expresión focal | Expresión difusa |
Los autores declaran no tener ningún conflicto de intereses.