La hidradenitis supurativa es un proceso inflamatorio crónico que en los últimos años ha adquirido una elevada importancia, por la subestimación de su prevalencia, y por tratarse de un proceso que produce una importante alteración en las relaciones interpersonales, de autoestima y de percepción de la imagen personal y de la imagen pública.
A pesar de ser un proceso patológico de elevada importancia, por su repercusión no solo psicológica, sino también por su posible limitación física, que puede llegar incluso a reducir de forma definitiva la movilidad en este tipo de pacientes debido a la formación de cicatrices retráctiles en áreas de movilidad de las extremidades, las evidencias con respecto a su epidemiología y a su etiopatogenia eran hasta hace bien poco escasas.
En la presente revisión se pretende analizar los últimos avances en el conocimiento de los diferentes aspectos epidemiológicos y clínicos de la hidradenitis supurativa. A su vez, se revisarán los diferentes sistemas de clasificación empleados actualmente en la evaluación de la gravedad de la enfermedad, así como la entrada de la ecografía cutánea como una técnica relevante en el seguimiento de este proceso inflamatorio crónico.
Hidradenitis suppurativa is a chronic inflammatory disorder that has attracted increasing attention in recent years due to underestimations of prevalence and the considerable impact of the condition on interpersonal relationships, physical appearance, self-esteem, and body image. Although hidradenitis suppurative has a significant psychological impact on patients and can even cause physical limitations when thick scarring results in limb mobility limitation, until very recently little evidence was available relating to its epidemiology, etiology, or pathogenesis. In this review, we highlight the latest advances in our understanding of the epidemiological and clinical aspects of hidradenitis suppurativa. We will also look at the different classification systems for hidradenitis suppurativa and discuss the emergence of skin ultrasound as a promising technique for monitoring the course of this chronic inflammatory disease.
La hidradenitis supurativa (HS) se ha definido como una enfermedad cutánea inflamatoria crónica, recurrente y debilitante, que habitualmente se presenta tras la pubertad con lesiones profundas, inflamadas y dolorosas, afectando a las áreas corporales con presencia de glándulas apocrinas, siendo las regiones más frecuentemente afectadas la axilar, inguinal y anogenital1.
A esta entidad se la ha conocido históricamente en la literatura científica como enfermedad de Verneuil, dado que fue este cirujano francés quien a mediados del siglo xix relacionó la enfermedad con las glándulas apocrinas y la denominó HS2. Posteriormente, fue atribuida la patogenia a la oclusión del folículo pilosebáceo, y se la relacionó por tanto con otras enfermedades como el acné conglobata, la celulitis disecante del cuero cabelludo o el sinus pilonidal, formando parte inicialmente de la tríada y posteriormente de la tétrada de oclusión folicular. En 1989 se introdujo el término acné invertido3 y hasta la actualidad, y de forma paralela al conocimiento de los mecanismos etiopatogénicos implicados, la denominación de la entidad ha sido motivo de controversia en la literatura4. Algunos autores sostienen que con los conocimientos recientes en relación con la patogenia de la enfermedad probablemente ninguno de los términos mencionados sea el más adecuado para definirla1.
EpidemiologíaLa mayor parte de los estudios publicados que analizan aspectos epidemiológicos de la HS se han realizado en población europea o norteamericana. Dado que no existen, al menos en la literatura por nosotros revisada, estudios al respecto en población española haremos referencia a continuación a los datos estimados en las poblaciones mencionadas.
Existe en la literatura científica gran variabilidad en relación con los datos de prevalencia comunicados para la entidad, lo cual sea probablemente atribuible a las diferencias poblacionales y metodológicas de los distintos estudios diseñados para estimar este parámetro. Múltiples publicaciones citan unos valores de entre el 1% y el 4%, haciendo referencia a los datos obtenidos en el estudio de Jemec et al. realizado en población danesa en la década de los 90 del pasado siglo, y representan la prevalencia de periodo (un año) calculada en población no seleccionada y la prevalencia puntual en población joven, respectivamente5. Otro estudio posterior publicado en 2008 por Revuz et al.6, realizado mediante encuestas remitidas a población francesa mayor de 15 años, estima una prevalencia de HS del 0,97%. El único estudio poblacional realizado para calcular la prevalencia de la HS se ha realizado en los Estados Unidos (Minnesota)7, y estima un valor del 0,13%, el cual es sustancialmente inferior a los previamente comunicados. Esta diferencia se atribuye a cuestiones metodológicas, al tratarse este de un estudio poblacional, y a las sobreestimaciones que probablemente hagan otros estudios en los que se asume el diagnóstico en función de encuestas contestadas por los pacientes sin otra confirmación objetiva. Otros trabajos norteamericanos confirman prevalencias inferiores a uno por 1.000, como el de Cosmatos et al.8, un estudio retrospectivo realizado a partir de una base de datos de pacientes asegurados que estima un valor del 0,053%, y el de Shlyankevich et al.9, otro estudio retrospectivo de casos y controles que determina una prevalencia de 0,08%.
Con respecto a la distribución etaria, la enfermedad habitualmente se inicia tras la pubertad, generalmente al inicio de la tercera década, y suele permanecer activa durante la tercera y cuarta décadas de la vida. Además, se ha observado que en las mujeres existe con frecuencia una mejoría tras la instauración de la menopausia, y por tanto suelen ser varones los pacientes que mantienen actividad de la enfermedad a partir de los 50 años10.
En relación con la distribución por sexos se ha observado que la HS es más frecuente en mujeres que en varones11,12. A partir de los datos de los estudios publicados se cuantifica que la ratio mujer:varón es de aproximadamente 3:1, oscilando los valores comunicados en algunos de los estudios más relevantes desde 2,6:113,14 a 3,3:16.
La distribución racial o por etnias ha sido un tema escasamente abordado en la literatura científica, existiendo muy pocos trabajos que proporcionen datos objetivos al respecto. Un reciente estudio retrospectivo en población norteamericana ha mostrado que la HS es más frecuente en la raza negra15.
La HS se ha asociado desde el punto de vista epidemiológico a múltiples comorbilidades16–22 que se resumen en la tabla adjunta (tabla 1). Algunas de estas comorbilidades comparten mecanismos fisiopatológicos o una base genética común con la HS, pero en otros casos la asociación probablemente sea debida simplemente a factores de confusión.
Comorbilidades de la HS9–22
| Enfermedad inflamatoria intestinal |
| Enfermedad de Crohn |
| Colitis ulcerosa |
| Enfermedades endocrino-metabólicas |
| Síndrome metabólico |
| Enfermedad de Cushing |
| Acromegalia |
| Enfermedades tiroideas |
| Síndromes de oclusión folicular |
| Acné conglobata |
| Celulitis disecante del cuero cabelludo |
| Sinus pilonidal |
| Trastornos genéticos asociados a oclusión folicular |
| Paquioniquia congénita |
| Enfermedad de Dowling-Degos |
| Esteatocistoma múltiple |
| Enfermedades articulares |
| Espondiloartropatía |
| Enfermedades psiquiátricas |
| Depresión |
| Ansiedad |
| Dependencia de alcohol o drogas |
| Neoplasias |
| Epiteliomas cutáneos (carcinoma epidermoide) |
| Linfomas |
| Enfermedades dermatológicas |
| Pioderma gangrenoso (síndrome PASH) |
| Pitiriasis rubra pilaris |
| Acantosis nigricans |
| Paniculitis (eritema nudoso) |
| Enfermedad de Fox-Fordyce |
| Enfermedades renales |
| Síndrome nefrótico |
| Nefritis intersticial aguda |
| Anemia |
| Amiloidosis |
| Síndrome de ovario poliquístico |
| Enfermedad de Behçet |
| Síndrome de Sjögren |
| Síndrome PAPA |
| Síndrome SAPHO |
| Síndrome de Down |
| Síndrome queratitis-ictiosis-sordera |
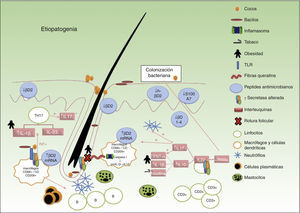
La HS es considerada en la actualidad una enfermedad inflamatoria del folículo pilosebáceo en la que subyace un desequilibrio del sistema inmunológico, en una persona predispuesta genéticamente. Sobre este actúan determinados factores exógenos desencadenantes o agravantes que modifican el curso de la enfermedad23.
La secuencia tradicionalmente aceptada por la cual se desarrolla cada una de las lesiones es la siguiente (fig. 1): 1) hiperqueratosis y taponamiento folicular; 2) dilatación de la unidad pilosebácea; 3) rotura y extrusión del contenido folicular a la dermis; 4) reacción inflamatoria secundaria; y 5) llegada de células inflamatorias y liberación de nuevas citoquinas perpetuando el proceso. No obstante, no se conoce con exactitud cuál es el mecanismo responsable de la inflamación crónica de la unidad pilosebácea que da lugar a la cascada anteriormente mencionada, y que posteriormente perpetuará el proceso con la formación de abscesos y trayectos fistulosos.
La asociación con enfermedades autoinmunes y autoinflamatorias, como el pioderma gangrenoso y la enfermedad de Crohn, junto con los hallazgos obtenidos en ensayos clínicos y de laboratorio han probado la existencia de un desequilibrio inmunológico en la HS, y por lo tanto apunta a un mal control de la respuesta inflamatoria en torno a los folículos pilosos de las grandes áreas intertriginosas corporales.
Factores predisponentes de hidradenitis supurativaAspectos genéticosAproximadamente el 40% de los pacientes tiene familiares afectos24. El patrón de herencia más frecuentemente observado es autosómico dominante. Los genes implicados se encuentran situados en los locus 1p21.1-1q25.324.
Se han descrito mutaciones inactivantes en los genes presenilina i (PSENI), potenciador de presinilina ii (PSENEN) y nicastina NCSTN en familias que presentaban formas clínicas graves y atípicas. Estos genes codifican 3 de las 4 subunidades de la ¿-secretasa implicada en la vía de los receptores Notch. Estas mutaciones se han asociado con alteraciones epidérmicas y foliculares, con ausencia o alteración en la formación de las glándulas sebáceas en estudios en ratones25–27.
Interleuquina 1βSe demostró en muestras de tejido de las lesiones y también en piel sana perilesional una elevación significativa (31 veces superior) respecto a la piel sana y significativamente más elevada en piel afecta de HS en comparación con la piel psoriásica. Existe además una correlación entre los niveles de interleuquina 1β (IL-1β) y la severidad de los síntomas28. Es significativa la mayor reducción en los valores de IL-1β con fármacos anti FNT-α en comparación con el resto de IL proinflamatorias28. La IL-1β está implicada en la mayoría de procesos autoinflamatorios, como en los síndromes SAPHO, PAPA, PAPASH y PASH, siendo esta citoquina la diana terapéutica de los antagonistas selectivos del receptor de la IL-1 (anakinra).
Factor de necrosis tumoral αAunque existe disparidad en los resultados en diferentes estudios, se ha demostrado una elevación del factor de necrosis tumoral α (TNF-α) y de su mARN en biopsias de piel lesional y sana perilesional, siendo estos valores hasta 5 veces más altos que en la psoriasis (Pso)29,30. De la misma forma que con la IL-1β se han relacionado los niveles de TNF-α en piel lesional con la severidad de la enfermedad31.
Microbioma y biofilmEl microbioma humano o flora microbiana normal está compuesto por el conjunto de microorganismos que viven en el ser humano de forma simbiótica. Las alteraciones en el microbioma se han relacionado con el desarrollo de enfermedades autoinmunes como la EII32,33.
Algunos estudios han demostrado la presencia del biofilm en los folículos pilosos y en los sinus de los trayectos fistulosos de la HS34–37. Aunque desconocemos qué papel desempeña el biofilm en el desarrollo de la enfermedad, parece lógico entender que ante una colonización bacteriana, facilitada por el desequilibrio en los péptidos antimicrobianos, encontremos un estímulo para la cascada inflamatoria y la producción de citoquinas a partir del reconocimiento de patógenos por los receptores Toll-like (TLR) de los macrófagos37.
Otros factores predisponentes (tabla 2)38–46Factores desencadenantes- a)
Tabaco: aproximadamente del 70% al 88,9% de pacientes afectos de HS son fumadores47–49. La nicotina del tabaco estimula la sobreproducción de IL-1033, y se relaciona con la disfunción de la vía de señalización de la γ-secretasa y Notch50.
- b)
Obesidad: está considerada un factor exacerbante, más que desencadenante. El síndrome metabólico, al igual que en otros trastornos autoinmunes, parece estar relacionado de forma estadísticamente significativa con la HS51,52. Además influye en la irritación mecánica, la oclusión y la maceración.
Tabla 2.Otros factores predisponentes
Vía de la inflamación Alteración Referencia Il 10 Sobreexpresión de IL-10 en la piel afecta y perilesional. Los niveles de esta citoquina también se relacionan con la actividad de la enfermedad Micheletti36, Gold et al.37 IL 17 Sobreexpresión tisular de esta proteína y de mARN en la HS entre 7 y 30 veces con respecto a piel normal Van der Zee et al.29 IL 12/23 Disparidad de los resultados obtenidos en los diferentes estudios tisulares realizados Schlapbach et al.38 IL 22 Niveles de mARN elevados comparados con piel sana, pero proporcionalmente más bajos que en Pso o en dermatitis atópica Schlapbach et al.38, Hofmann et al.39 β defensina 2 Elevación de su mARN a nivel tisular en áreas afectas en la HS Emelianov et al.41 Receptores toll-like Elevación de la expresión de TLR2 (mARN y proteína) y supresión de otros TLR, especialmente TLR4 Schlapbach et al.38 Vía de señalización Notch Alteración de la supresión que ejerce la vía de señalización Notch sobre el TLR4 Van Der Zee et al.28, Van Der Zee et al.29, Van Der Zee et al.30 Inmunidad celular Papel desconocido del linfocito T en la HS Pink et al.26 - c)
Factores endocrinológicos: el predominio de casos en el sexo femenino, la existencia de brotes premenstruales, el inicio después de la menarquia o en la adolescencia y la mejoría experimentada por algunas pacientes durante el embarazo o tras la menopausia, sustentaban la hipótesis del hiperandrogenismo47–49. Sin embargo, el tratamiento con anticonceptivos hormonales orales o inhibidores de la 5α reductasa no han alcanzado las tasas de respuesta terapéutica esperada, y los estudios analíticos hormonales en las pacientes afectas no refrendan estas hipótesis47.
- d)
Ropa ajustada: las fuerzas de cizallamiento y fricción estimulan la aparición de lesiones por la rotura de los folículos.
- e)
Desodorantes o depilación: los irritantes actúan como exacerbantes de la enfermedad, no como desencadenantes51,52.
- f)
Fármacos: el litio, los anticonceptivos o la isotretinoína son alguno de los medicamentos que pueden generar brotes de repetición de la enfermedad51.
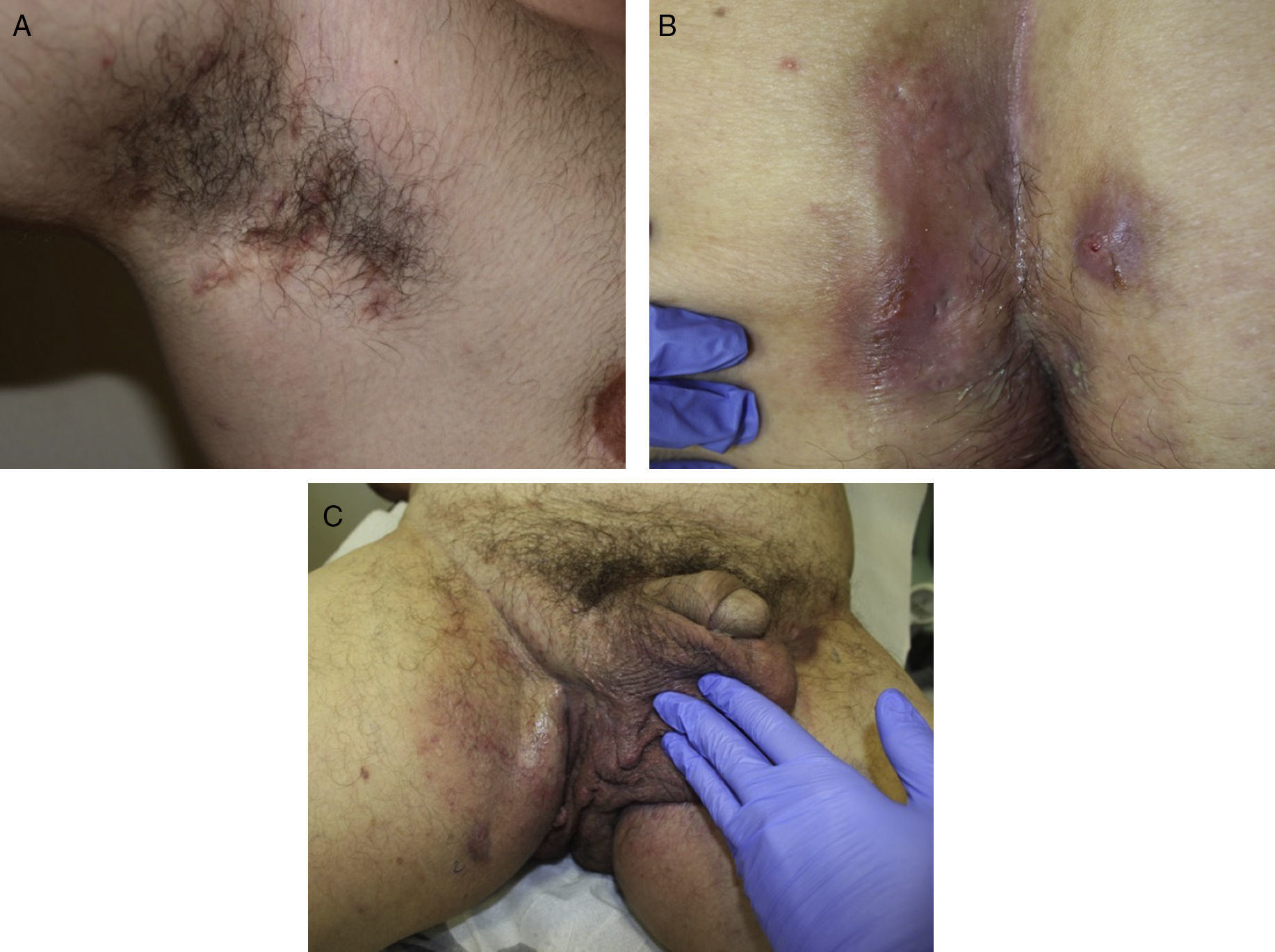
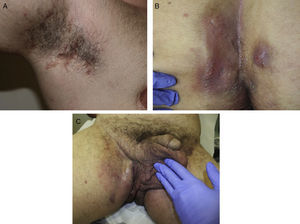
Las manifestaciones clínicas de la enfermedad son muy heterogéneas, pero se suele manifestar con lesiones inflamatorias, dolorosas y profundas que incluyen nódulos, fístulas y abscesos53 (fig. 2A-C). Los dobles comedones son característicos y se han descrito en los pliegues de niños como posibles precursores de lesiones de HS54.
Los empeoramientos se asocian con aumento del dolor y de la supuración, y en mujeres con frecuencia (40%) ocurren justo antes de la menstruación. Sin tratamiento los brotes mejoran espontáneamente en unos 7-10 días55.
La HS suele iniciarse en la 2.ª-3.ª década de la vida, aunque se han descrito casos de comienzo temprano en niños56. Recientemente, el comienzo precoz de la enfermedad se ha asociado a una mayor susceptibilidad genética con una historia familiar del 55% frente al 34% en los casos de comienzo pospuberal y una mayor extensión de las lesiones57,58.
Las localizaciones más frecuentes son las axilas, las ingles, los glúteos y las áreas perianal, perineal, mamaria e inframamaria. Esta distribución de localizaciones varía por sexo, siendo en las mujeres más frecuentes la inframamaria, la axilar y la inguinal, mientras que en los hombres las zonas más habitualmente afectadas son la glútea, la perianal y las localizaciones atípicas (como la nuca y la retroauricular)58-60.
En 2013 Canoui-Poitrine et al. definieron 3 fenotipos de pacientes con HS, los pacientes LC1 (axilo-mamaria) se caracterizaban por tener lesiones en las axilas y las mamas y más riesgo de cicatrices hipertróficas13. En los pacientes LC2 (folicular), además, la enfermedad se localizaba en las orejas, el tórax, la espalda y las piernas, y asociaban lesiones foliculares (sinus pilonidal y comedones), acné grave e historia familiar, siendo varones más frecuentemente, fumadores y su enfermedad era más grave. Por último, los pacientes LC3 (glútea), se manifestaban por localización glútea, pápulas y foliculitis, menor obesidad y menor gravedad61. Recientemente se ha sugerido un nuevo fenotipo, la HS fulminante, más habitual en varones de origen afro-caribeño y que asociaría con frecuencia síntomas reumatológicos (artritis y/o espondilitis) y anemia, además el índice de masa corporal no estaría aumentado62. Se ha sugerido que esta clasificación por fenotipos puede ser de ayuda para elegir tratamientos personalizados para cada paciente63.
Aspectos histológicosInicialmente considerada una enfermedad de las glándulas apocrinas, la HS se define actualmente como una enfermedad folicular64,65. Von Laffert ha descrito los hallazgos microscópicos de 60 pacientes con HS. La hiperqueratosis folicular se encontró en el 82%, la hiperplasia del epitelio folicular era evidente en el 77% y la perifoliculitis en el 68% de los casos, estos 3 datos parecen preceder a la rotura del folículo. Otros hallazgos relevantes en este trabajo son la presencia de un infiltrado subepidérmico de células inflamatorias en las áreas de epidermis interfolicular (78%) y de una hiperplasia epidérmica psoriasiforme, con crestas epidérmicas de longitud similar (58%). La combinación de estas 2 últimas características histopatológicas estaba presente en el 36% de los especímenes estudiados.
El examen inmunohistoquímico del infiltrado inflamatorio perifolicular y subepidérmico reveló resultados muy similares, siendo mixto con presencia de linfocitos, neutrófilos, células plasmáticas e histiocitos66. Otro hallazgo llamativo es la presencia de linfocitos CD8 positivos con importante foliculotropismo y epidermotropismo67. Por último, se ha demostrado un aumento del número de mastocitos en la dermis de lesiones iniciales y en piel perilesional, lo que podría explicar en parte el prurito referido por muchos pacientes68.
La aparición de fístulas con epitelio escamoso estratificado, rodeadas de fibrosis e inflamación es el hallazgo propio de lesiones más evolucionadas69. Por otro lado, no se han podido demostrar diferencias en la expresión de receptores de estrógenos ni andrógenos en las glándulas apocrinas de pacientes con HS frente a controles70.
Finalmente, es importante resaltar que pueden desarrollarse carcinomas epidermoides sobre lesiones de hidradenitis supurativa, suelen darse en varones con enfermedad grave y de larga evolución de localización glútea y perineal. Estos carcinomas, aunque poco agresivos desde el punto de vista histopatológico (bien diferenciados o carcinomas verrucosos), presentan un comportamiento muy agresivo (supervivencia a los 5 años del 61%) y con frecuencia se asocian a infección por virus del papiloma humano de alto riesgo71.
Modelos de clasificación de la enfermedadExisten varios modelos de clasificación y estadificación de la HS. Algunos de ellos cualitativos, como la estadificación de Hurley, y otros cuantitativos, como los de Sartorius y Sartorius modificados, el Hidradenitis Suppurativa Physician Global Assessment (HS-PGA), o el Hidradenitis Suppurativa Clinical Response (HiSCR), entre otros. Ninguno de ellos es perfecto, todos tienen sus ventajas y limitaciones. En la práctica clínica habitual la más utilizada es la estadificación de Hurley, aunque algunos de los nuevos modelos de clasificación más dinámicos y prácticos están adquiriendo mayor protagonismo, como el HS-PGA o el HiSCR, para valorar la evolución y respuesta al tratamiento.
Estadificación de HurleyPropuesta en 1989 por Hurley, fue el primer modelo de clasificación descrito. Se divide en 3 niveles de gravedad (tabla 3)72–74.
Actualmente, la clasificación de Hurley es muy utilizada debido a su sencillez y rapidez de uso, pero tiene algunas limitaciones; entre ellas el hecho de que se trata de una clasificación cualitativa y estática: no se tiene en cuenta el número de zonas afectadas por la HS ni el número de lesiones en cada área. Además, se basa en algunas características de la enfermedad que son fijas/invariables, como las cicatrices y las fístulas. Por lo tanto, es poco útil para la evaluación de la respuesta terapéutica.
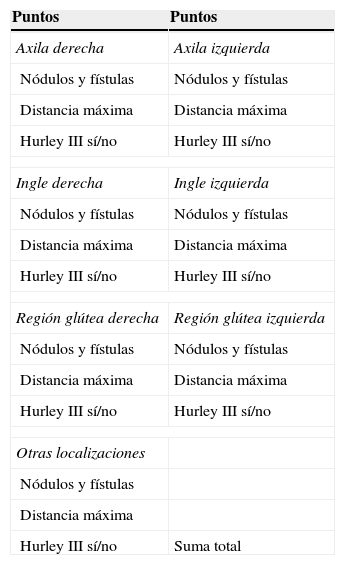
Puntuación de Sartorius (Hidradenitis suppurativa score o Sartorius score)Años después de la publicación de la estadificación de Hurley, Sartorius et al. propusieron una nueva estadificación de la gravedad de la HS más detallada, que posteriormente fue modificada por el propio Sartorius (Sartorius score modificado; tabla 4)35,74,75 y también por Revuz (Sartorius score modificado por Revuz)76.
Sartorius score modificado por Sartorius
| Puntos | Puntos |
|---|---|
| Axila derecha | Axila izquierda |
| Nódulos y fístulas | Nódulos y fístulas |
| Distancia máxima | Distancia máxima |
| Hurley III sí/no | Hurley III sí/no |
| Ingle derecha | Ingle izquierda |
| Nódulos y fístulas | Nódulos y fístulas |
| Distancia máxima | Distancia máxima |
| Hurley III sí/no | Hurley III sí/no |
| Región glútea derecha | Región glútea izquierda |
| Nódulos y fístulas | Nódulos y fístulas |
| Distancia máxima | Distancia máxima |
| Hurley III sí/no | Hurley III sí/no |
| Otras localizaciones | |
| Nódulos y fístulas | |
| Distancia máxima | |
| Hurley III sí/no | Suma total |
| Parámetros | Puntos/parámetro |
|---|---|
| 1. Número de zonas afectadas | 3 |
| Tres puntos por zona | |
| 2. Número y gravedad de las lesiones | |
| Nódulos | 1 |
| Fístulas | 6 |
| 3. Distancia mayor entre 2 lesiones relevantes (o tamaño si la lesión es única) | |
| <5cm | 1 |
| 5-10cm | 3 |
| >10cm | 9 |
| 4. ¿Están todas las lesiones claramente separadas por piel normal? | |
| Sí | 0 |
| No (Hurley III) | 9 |
| Reportado por el paciente (no incluido en el score): | |
| Número de forúnculos durante el último mes ____ | |
| Dolor de la lesión más sintomática ____ | |
| Escala visual analógica (VAS [0-10]) | |
| El dermatólogo anota |
| Las regiones afectadas: axilar, inguinal, glútea (derecha/izquierda), u otras áreas; 3 puntos por área |
| El número y tipo de lesiones, con su puntuación correspondiente (nódulo 1 punto, fístula 6 puntos) en cada zona |
| La distancia mayor entre 2 lesiones relevantes (o tamaño si la lesión es única) en cada zona:<5cm, 1 punto; 5-10cm, 3 puntos;>10cm, 9 puntos |
| Si las lesiones están separadas por piel normal: sí, 0; no (=Hurley III), 9 puntos |
| Se anotan y se suman las puntuaciones de cada área para resultar en la puntuación total del paciente |
| El dolor o molestia de la lesión más sintomática en el momento de la consulta se valora mediante una (VAS), del 0 al 10 |
En la puntuación de Sartorius «original» se valoran de forma aislada cada una de las zonas afectadas por HS, y se otorga una puntuación a cada tipo de lesión presente (absceso, fístula drenante, fístula no drenante, nódulo inflamatorio, nódulo no inflamatorio, cicatriz hipertrófica), a la distancia entre 2 lesiones relevantes y al hecho de que las lesiones estén separadas por piel normal. De la suma de todos estos factores obtenemos una puntuación global74,75.
En la puntuación de Sartorius modificada aparecen algunas modificaciones a la anterior, simplificándola y enfocándola más a la presencia de lesiones inflamatorias, con la intención de mejorar su utilidad para valorar la respuesta terapéutica (tabla 4)76.
La puntuación de Sartorius modificada tiene en cuenta, como la «original», las regiones afectadas, el número y tipo de lesiones en cada zona, la distancia entre las 2 lesiones más relevantes, y la presencia de piel normal entre ellas; pero centra su atención en el recuento de lesiones inflamatorias (nódulos y fístulas), en 3 localizaciones (axilas, ingles y glúteos). La estimación es por regiones, y se obtiene una puntuación para cada área y una general76.
Los autores recomiendan completarla con una determinación del dolor mediante una escala visual analógica y con el número de forúnculos presentados durante el último mes, reportados por el paciente76.
La variabilidad interobservador en la puntuación de Sartorius modificada ha demostrado ser baja, y se correlaciona positivamente con la presencia de factores riesgo y con otras mediciones de gravedad (como el DLQI)77. Sin embargo, su aplicabilidad se encuentra limitada en casos graves, en los que las lesiones separadas acaban confluyendo77. Además, aunque se trata de una herramienta más dinámica que el Hurley score, incluye lesiones difícilmente modificables con tratamiento médico (distancia entre 2 lesiones relevantes)74. Asimismo, deja de valorar de forma individualizada la región submamaria.
El Sartorius score modificado por Revuz es parecido al anterior, pero mantiene en la valoración la región perineal y pectoral (infra e intermamaria) y las cicatrices hipertróficas.
Evaluación global efectuada por el facultativo (Hidradenitis Suppurativa Physician Global Assessment)Es uno de los modelos de clasificación actuales más utilizados en ensayos clínicos para evaluar la respuesta terapéutica (a tratamientos médicos).
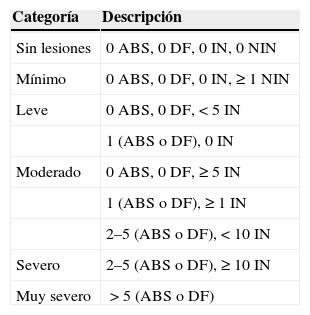
Clasifica la gravedad de la enfermedad en categorías, teniendo en cuenta el total de abscesos, fístulas, nódulos inflamatorios y nódulos no inflamatorios presentes (sumando todas las zonas afectadas)78. El último HS-PGA desarrollado cataloga la gravedad en 6 grados78 (tabla 5).
Severidad de la enfermedad caracterizada por HS-PGA en 6 grados
| Categoría | Descripción |
|---|---|
| Sin lesiones | 0 ABS, 0 DF, 0 IN, 0 NIN |
| Mínimo | 0 ABS, 0 DF, 0 IN, ≥1 NIN |
| Leve | 0 ABS, 0 DF,<5 IN |
| 1 (ABS o DF), 0 IN | |
| Moderado | 0 ABS, 0 DF, ≥5 IN |
| 1 (ABS o DF), ≥1 IN | |
| 2–5 (ABS o DF),<10 IN | |
| Severo | 2–5 (ABS o DF), ≥10 IN |
| Muy severo | >5 (ABS o DF) |
ABS: abscesos; DF: fístula drenante; IN: nódulos inflamatorios; NIN: nódulos no inflamatorios.
Modificada de Kimball A, et al.78
Es sencilla, rápida de realizar y dinámica. Permite hacer un seguimiento de la progresión de la enfermedad, pero tiene el inconveniente de que las zonas afectadas se valoran de forma conjunta.
Respuesta clínica en hidradenitis supurativa (Hidradenitis Suppurativa Clinical Response)Más que un modelo de clasificación es un nuevo parámetro de medición de la respuesta al tratamiento médico para la HS, recientemente validado, que pretende cuantificar la gravedad de la enfermedad y determinar un objetivo clínico79.
El HiSCR se define como una reducción ≥50% en el recuento de lesiones inflamatorias (suma de abscesos y nódulos inflamatorios [AN]), sin incremento en el número de abscesos o fístulas drenantes respecto a la situación basal79 (tabla 6).
El HiSCR es, por lo tanto, un objetivo clínico que se basa en el recuento total de lesiones inflamatorias que presenta un paciente afecto de HS en un momento determinado. De esta forma, se puede definir también el porcentaje de reducción de abscesos y nódulos inflamatorios respecto a basal: AN50, AN75 y AN100 (reducción del 50%, 75% y 100% en el número de AN frente a la situación basal, respectivamente).
Este parámetro es especialmente útil en la medición de la respuesta al tratamiento médico (tiene en cuenta lesiones inflamatorias y no incluye lesiones estáticas, como cicatrices) y es rápido de realizar.
Índice de severidad de la hidradenitis supurativa (Hidradenitis Suppurativa Severity Index)Este sistema de medición de la gravedad de la HS incluye variables categóricas objetivas y subjetivas80. Ha sido utilizado en 2 publicaciones donde se evaluaba la eficacia clínica de infliximab80,81 y en una de adalimumab82.
Papel de la ecografía en hidradenitis supurativaEl principal factor limitante en la determinación de la severidad o de la actividad de la enfermedad es la existencia de lesiones subclínicas no identificables en la exploración física general. Así, la palpación clínica en la exploración de las lesiones tiene una baja sensibilidad en el momento de diferenciar entre nódulos inflamatorios, no inflamatorios y fístulas. Este hecho es de vital importancia, dado que la presencia de tractos fistulosos o colecciones fluidas habitualmente requieren la modificación del tratamiento médico-quirúrgico.
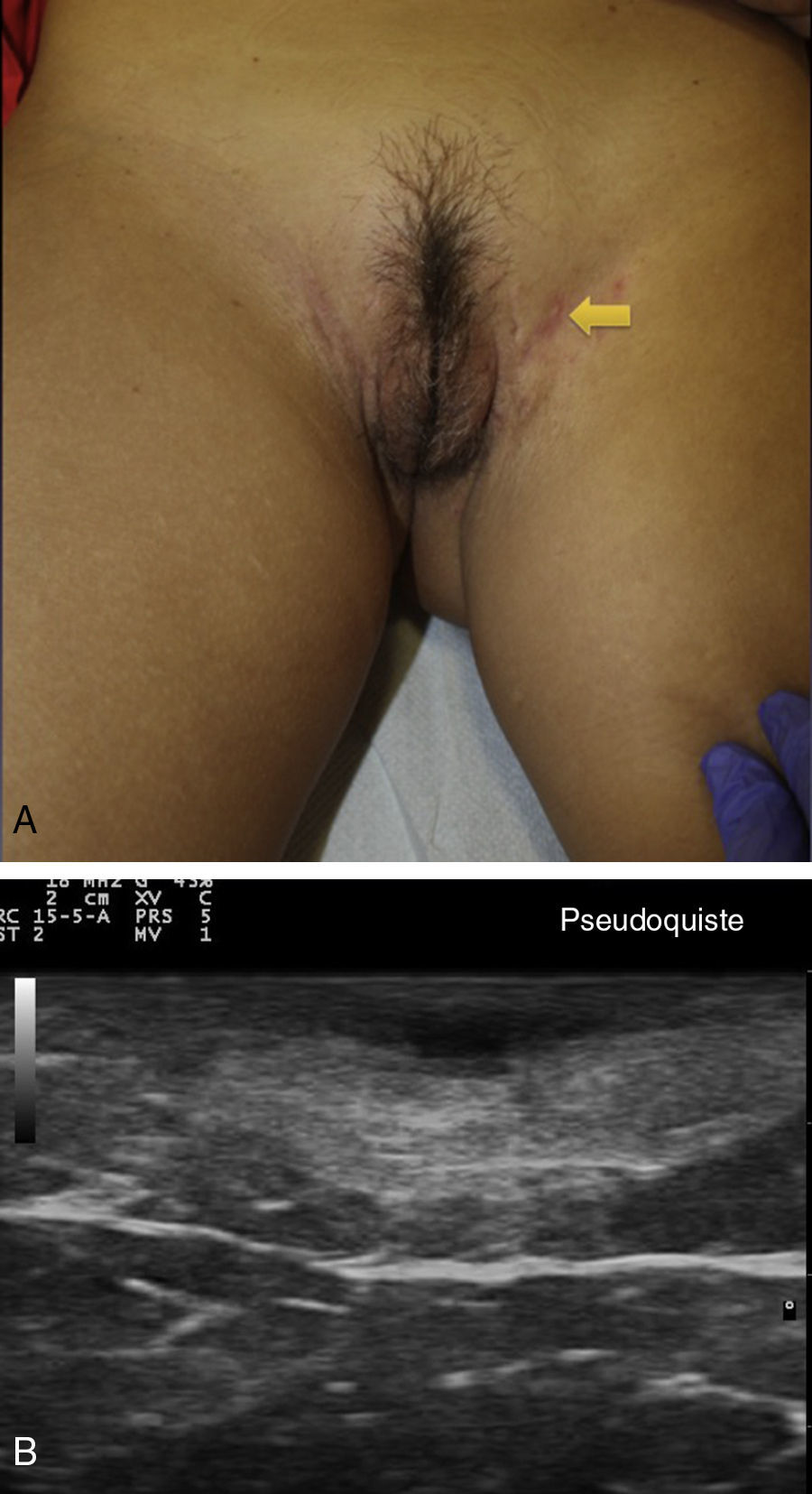
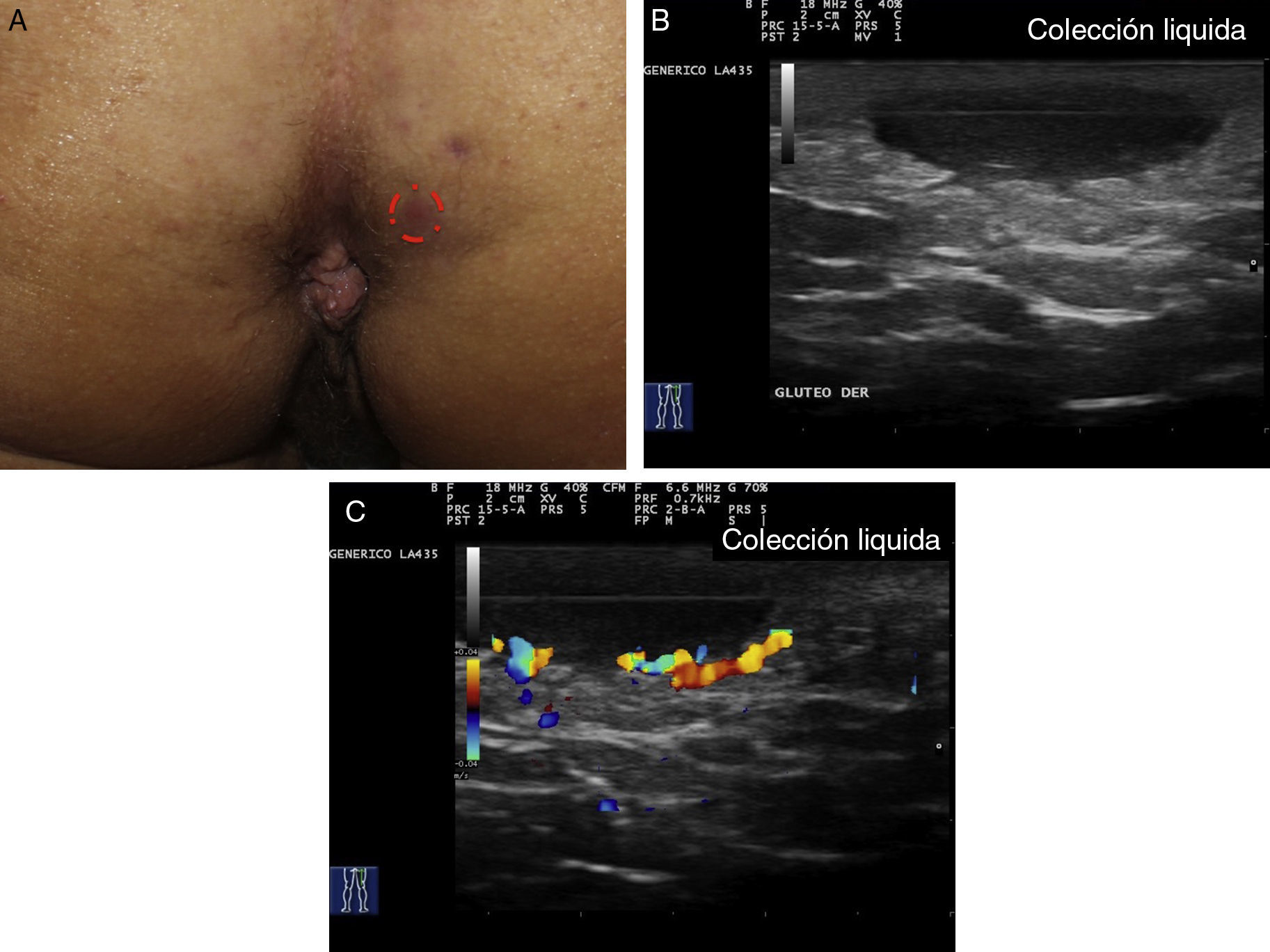
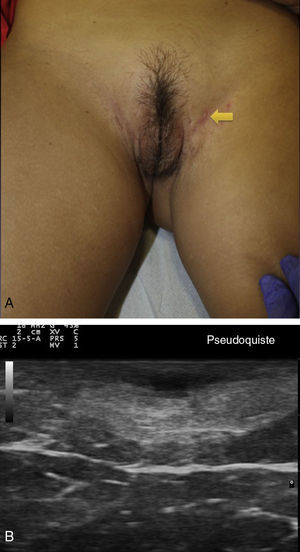
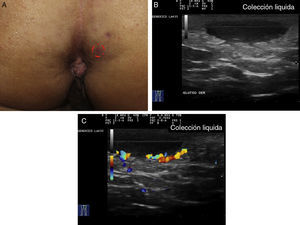
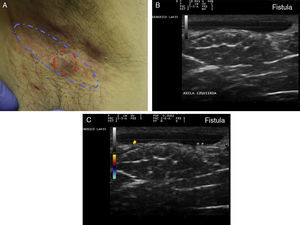
Criterios ecográficos de las lesiones elementales de la hidradenitis supurativaLos principales hallazgos ecográficos de la HS incluyen una alteración difusa del patrón dérmico, un engrosamiento dérmico, la presencia de pseudoquistes dérmicos, el engrosamiento del folículo piloso y la detección de colecciones fluidas y de tractos fistulosos (figs. 3–5)83.
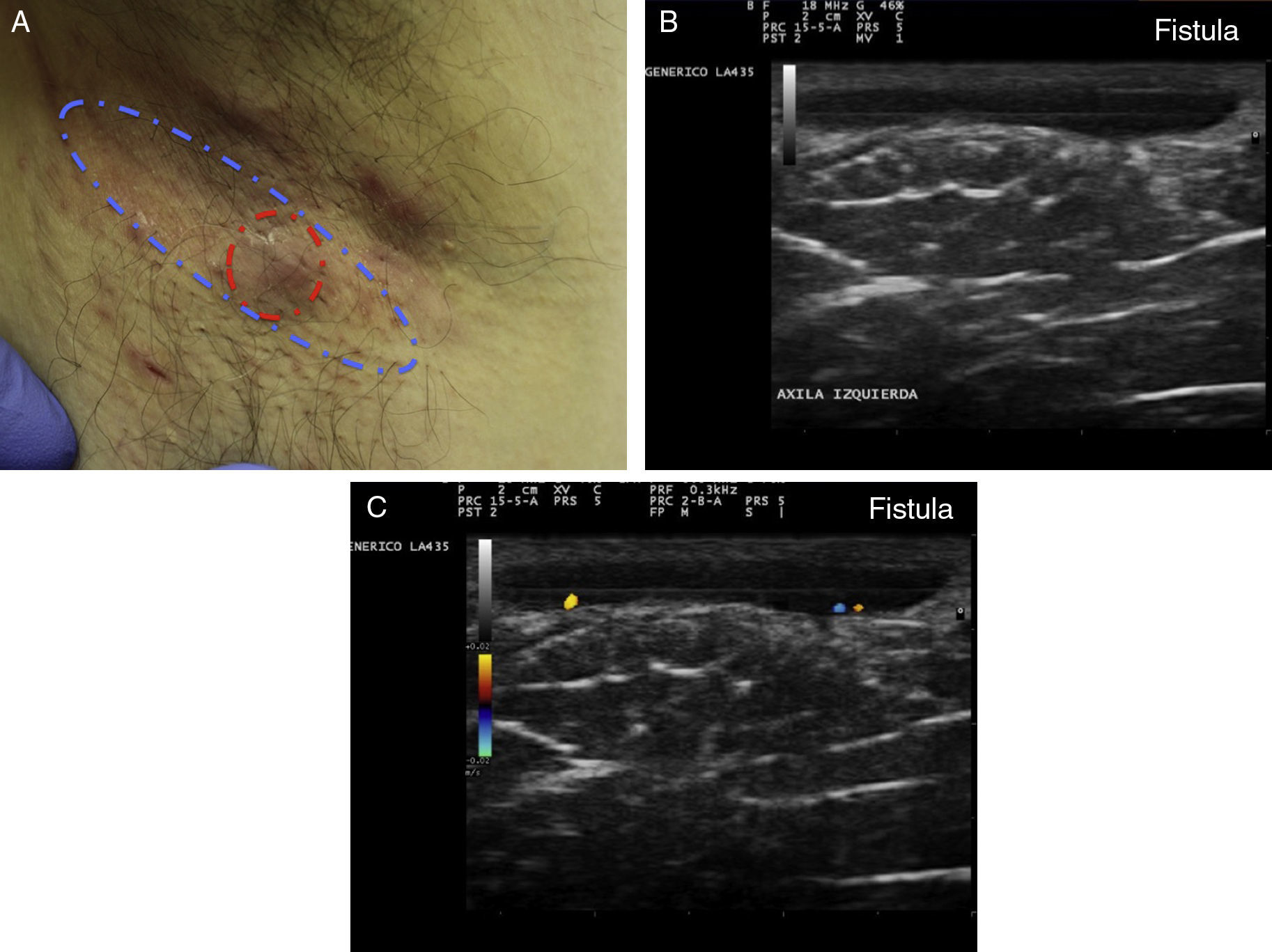
Hidradenitis supurativa. A. Lesión alargada eritematosa que ocupa la axila derecha. En rojo, el área clínicamente afecta. En azul, el área ecográficamente afecta. B. Imagen ecográfica que muestra la existencia de un trayecto fistuloso subyacente. C. La función doppler muestra una actividad inflamatoria leve.
Los pasos ecográficos que definirían la progresión clínica de la enfermedad serían como a continuación se detalla: en primer lugar se observa un engrosamiento del folículo piloso, que parece desempeñar un papel clave en el desarrollo de la enfermedad.
A continuación se produciría una alteración del patrón dérmico, inicialmente perifolicular y posteriormente difuso, con la presencia de un engrosamiento dérmico, que refleja el marcado proceso inflamatorio subyacente principalmente provocado por diferentes mediadores de la inmunidad innata. Así, la mayor o menor hipoecogenicidad y la extensión de la misma nos puede orientar hacia el grado de inflamación subyacente que presenta la enfermedad (figs. 3–5)83.
En aquellos casos con elevada carga inflamatoria aparecerían los denominados nódulos pseudoquísticos dérmicos (fig. 3 A y B), que ecográficamente se caracterizan por estructuras nodulares redondeadas u ovaladas hipo o anecoicas. El siguiente paso sería la aparición de colecciones fluidas que se caracterizan en la ecografía por depósitos fluidos hipo o anecoicos en la dermis o en la hipodermis conectados habitualmente a la base del folículo piloso alterado (fig. 4 A-C).
Finalmente se producirían los tractos fistulosos (estructuras hipoecoicas o anecoicas en banda que atraviesan diferentes estructuras a través de las diferentes capas de la piel en la dermis o en la hipodermis, conectados a la base de estructuras foliculares alteradas [fig. 5 A-C]).
Propuesta de clasificación clínico-ecográfica de la hidradenitis supurativa (clinical-sonographic scoring system in HS)Wortsman et al.83, a partir de un análisis de 34 pacientes, desarrollaron una propuesta de modelo de clasificación de la HS basada en criterios ecográficos (tabla 7). Este método, a pesar de no estar validado actualmente, puede resultar de utilidad en el seguimiento de los pacientes con HS.
Estadificación ecográfica de la hidradenitis supurativa (clinical-sonographic scoring system in HS [SOS-HS])
| Estadio | Descripción |
|---|---|
| I | Una única colección fluida y cambios dérmicos (presencia de nódulos pseudoquísticos hipo o anecoicos, engrosamiento de los folículos pilosos, alteraciones en el grosor dérmico)Afectando un área corporal (por ejemplo: axila, ingle, mama, nalga) (uni o bilateral)Sin trayectos fistulosos |
| II | De 2 a 4 colecciones fluidas o un trayecto fistuloso, con cambios dérmicosafectando una o 2 áreas corporales (uni o bilateral) |
| III | ≥5 colecciones fluidas o ≥2 trayectos fistulosos, con cambios dérmicoso afectación de ≥3 áreas corporales (uni o bilateral) |
Modificada de Wortsman80.
La HS es una enfermedad inflamatoria crónica con una prevalencia importante que clínicamente se manifiesta siguiendo patrones claramente definidos. Este hecho debe de ayudarnos a reducir el retraso diagnóstico de este cuadro, que en ocasiones provoca situaciones invalidantes para nuestros pacientes. La ecografía cutánea nos ayudará a objetivar la carga de enfermedad de los pacientes con HS, dado que se trata de una enfermedad con gran componente profundo, que en muchas ocasiones no resulta clínicamente evidente.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.