INTRODUCCIÓN
El xantogranuloma necrobiótico es una rara enfermedad crónica granulomatosa descrita inicialmente en 1980 por Kossard y Winkelmann que afecta a la piel y se caracteriza por la presencia de xantogranulomatosis y necrobiosis en el examen histológico1-2. Generalmente se asocia a gammapatía monoclonal de tipo inmunoglobulina G (IgG), aunque también puede aparecer sin ella o precederla. Es frecuente la afectación periocular y, en algunos casos, se ha demostrado afectación sistémica1,3.
Se presenta el caso de una paciente con xantogranuloma necrobiótico asociado a leucemia linfática crónica sin gammapatía monoclonal y sin afectación periocular.
DESCRIPCIÓN DEL CASO
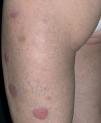
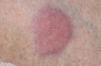
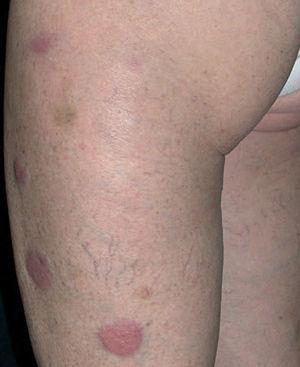
Una mujer de 64 años de edad consultó en el servicio de dermatología en marzo de 2004 por unas lesiones asintomáticas, de 3 años de evolución, localizadas en extremidades superiores e inferiores. Refería que las lesiones comenzaron a aparecer en los brazos, sobre unas cicatrices presentes desde la infancia producidas por distintas vacunaciones. Las lesiones habían sido biopsiadas en distintas ocasiones en otros centros, con el diagnóstico anatomopatológico de granuloma a cuerpo extraño, necrobiosis lipoídica y sarcoidosis. Algunas de las lesiones que le habían sido extirpadas recidivaron en la misma localización. Como antecedentes patológicos destacaban una leucemia linfocítica crónica en estadio A diagnosticada en noviembre de 2003 y episodios de fibrilación auricular paroxística desde el año 1998. La exploración física mostraba lesiones en placa, localizadas en brazos y en muslos, principalmente, con alguna lesión aislada en la pantorrilla izquierda (fig. 1). Las placas tenían una consistencia fibroelástica y presentaban una coloración eritematosa amarillenta con telangiectasias en superficie (fig. 2).
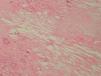
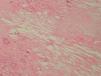
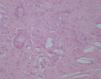
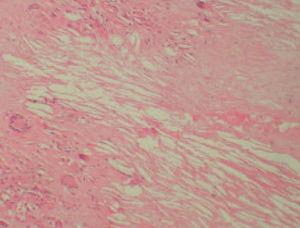
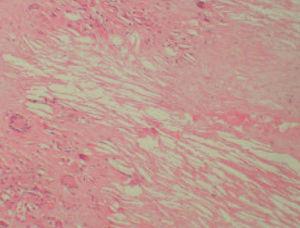
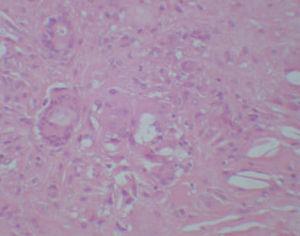
Se realizó una biopsia de una de las lesiones y el estudio histopatológico mostró, bajo una epidermis ligeramente adelgazada, un infiltrado granulomatoso que ocupaba la dermis y el tejido subcutáneo. Se apreciaban, entre los focos granulomatosos, zonas de necrosis hialina y espacios claros aciculares que sugerían la presencia de cristales de colesterol (fig. 3). Los granulomas estaban formados por histiocitos, células espumosas y células gigantes multinucleadas tipo Langhans y tipo cuerpo extraño (fig. 4). Se realizaron tinciones para lisozima y CD-68 que fueron positivas en las células histiocíticas. Todos los cultivos realizados para micobacterias y hongos fueron negativos.
Dentro de los estudios complementarios realizados destacaba una leucocitosis de 10,5 × 109 células/l con el 74 % de linfocitos y un inmunofenotipo B y una enzima conversora de la angiotensina (ECA) de 93 (normal hasta 55 U/l). Las crioglobulinas fueron negativas y el complemento se encontró en niveles dentro de la normalidad. En la tomografía computarizada (TC) toracoabdominal se detectó un aumento homogéneo del tamaño del bazo y de los ganglios periportales y axilares. No se detectaron adenopatías mediastínicas ni alteraciones en el parénquima pulmonar. La prueba de Mantoux fue negativa. No se hallaron alteraciones en el proteinograma y las pruebas funcionales respiratorias fueron normales.
Fig. 1.—Placas eritematosas amarillentas localizadas en las piernas.
Con el diagnóstico clinicopatológico de xantogranuloma necrobiótico, la paciente fue remitida al servicio de cardiología para la realización de una ecocardiografía que mostró un aumento de intensidad ecogénica miocárdica en el septo inferior. El servicio de hematología desestimó el tratamiento de la paciente por encontrarse en un estadio temprano de la leucemia linfática crónica. La paciente rehusó el tratamiento con interferón alfa-2b (IFN-2b) y corticoides para una enfermedad dermatológica.
DISCUSIÓN
La afectación cutánea por el xantogranuloma necrobiótico se ha visto en todos los casos, presentándose como pápulas, nódulos o placas de un color que puede variar entre el violáceo y el rojo-anaranjado. Es frecuente encontrar zonas amarillentas, especialmente en lesiones perioculares, telangiectasias y, en las lesiones de mayor tamaño, atrofia o ulceración central. Las lesiones se parecen a las de la necrobiosis lipoídica pero, a diferencia de éstas, se desarrollan preferentemente en las zonas cicatrizales y la zona periocular y, aunque también suelen afectar al tronco y a las extremidades, respetan la zona pretibial. Hasta el 50 % de los casos puede presentar afectación ocular en forma de masas, ectropión, queratitis, epiescleritis, lesiones palpebrales y conjuntivales y uveítis anterior. En la mayoría de los casos se asocia a paraproteinemia, pero también se han observado casos asociados a crioglobulinemia, hipocomplementemia, discrasias de células plasmáticas, leucopenia y, con menos frecuencia, a otros procesos linfoproliferativos. Estas patologías pueden preceder, coincidir o suceder en años a la aparición de las lesiones cutáneas1-3.
Fig. 2.—Detalle de una de las placas: se aprecia la superficie brillante de color amarillento y la presencia de telangiectasias.
Fig. 3.—Infiltrado localizado en dermis en el que se aprecia necrobiosis y la presencia en la misma de unos espacios claros (espacios claros aciculares de colesterol). (Hematoxilina-eosina, ×100.)
Fig. 4.—Detalle de una célula multinucleada gigante y de los espacios claros de colesterol. (Hematoxilina-eosina, ×200.)
Las alteraciones histopatológicas cutáneas se localizan principalmente en la dermis reticular e hipodermis, respetando la epidermis y la dermis papilar. Se presentan amplias zonas de necrosis hialina asociada a granulomas «en empalizada», compuestos por células espumosas, histiocitos, folículos linfoides y células gigantes que pueden ser aberrantes, a cuerpo extraño o tipo Touton. En las zonas de necrobiosis se pueden apreciar, hasta en un tercio de los casos, espacios claros aciculares que se corresponden con depósitos de colesterol1-3. Se ha encontrado infiltración histológica de otros órganos por los xantogranulomas1,2,4,5, lo que demuestra que el xantogranuloma necrobiótico es una enfermedad sistémica con afectación cutánea. Las lesiones cutáneas han sido bien caracterizadas en la literatura médica, pero hay poco descrito sobre la afectación sistémica4. Se han encontrado lesiones en laringe, pulmón, corazón, sistema reticuloendotelial y ojos. En el caso de la afectación cardíaca se han visto afectados el pericardio y miocardio. Los diagnósticos definitivos se realizaron post mortem y no hubo previamente ninguna prueba de imagen, por lo que algunos autores recomiendan realizar ecocardiografía y pruebas de imagen cardíacas dinámicas a los pacientes con xantogranuloma necrobiótico3,4.
El tratamiento no está bien establecido dada la baja frecuencia de la enfermedad. Se han realizado distintos ensayos terapéuticos con clorambucilo y melfalán con resultados variables6. En 1995, Venencie et al7 comunicaron un caso que mostró mejoría clínicamente y disminuyó su IgG monoclonal con el uso de IFN-2b subcutáneo en combinación con corticoides orales. En el año 2001, Chave et al6 comunicaron un caso de xantogranuloma necrobiótico recalcitrante que respondió a altas dosis de dexametasona oral en pulsos seguida de tratamiento de mantenimiento con dexametasona oral administrada diariamente6.
El caso de nuestra paciente difiere de la presentación clásica descrita en la literatura especializada al carecer de afectación periocular y de paraproteinemia3. Aunque las lesiones de nuestra paciente se manifestaron 3 años antes del diagnóstico de leucemia linfática crónica, pensamos que su aparición está relacionada con este proceso linfoproliferativo. Las pruebas de imagen realizadas a nuestra paciente demostraron una esplenomegalia homogénea y una alteración de la refringencia en el miocardio, lo cual podría estar relacionado con la infiltración de estos órganos por xantogranuloma necrobiótico pero, dado que estas alteraciones no están descritas en la literatura médica4 y que nuestra paciente no quiso continuar los estudios, la relación no puede asegurarse.
Correspondencia:
Laura Mahiques. Servicio de Dermatología.
Hospital General Universitario de Valencia. España.
laura_mahiques@aedv.es
Recibido el 6 de abril de 2004.
Aceptado el 6 de julio de 2004.