La onicomicosis, o infección fúngica de las uñas, constituye una de las enfermedades micóticas más prevalentes en la población. Su tratamiento tiene una efectividad limitada, además de ser largo y tedioso y, en el caso de los antifúngicos sistémicos, no está exento de efectos adversos. La terapia fotodinámica (TFD) podría ser una buena alternativa para las infecciones cutáneas superficiales, entre ellas la onicomicosis.
El presente artículo revisa la experiencia publicada, tanto in vitro como in vivo, acerca de la utilidad de la TFD en las onicomicosis, mostrando el potencial de diversos fotosensibilizantes, así como sus limitaciones. Desde el punto de vista clínico el azul de metileno y el ácido 5-aminolevulínico muestran tasas de curación del 80% y el 43% respectivamente al año de seguimiento.
Finalmente, basado en la bibliografía y en la propia experiencia, se propone un protocolo de 3 sesiones de TFD, usando metil-aminolevulinato 16% como fotosensibilizante y luz roja (λ=630nm, 37J.cm−2), separadas por 1 o 2 semanas. Estas irán precedidas de la aplicación de urea 40% durante unos días. Nuevos ensayos clínicos deben optimizar los protocolos y establecer qué pacientes se benefician especialmente de recibir este tratamiento.
Onychomycosis, or fungal infection of the nails, is one of the most prevalent fungal diseases in the general population. Treatment is of limited effectiveness, tedious, and must be administered for long periods. Furthermore, systemic antifungal agents are associated with adverse effects. Photodynamic therapy (PDT) may prove to be a viable alternative in the treatment of superficial skin infections, including onychomycosis. We review articles relating to the usefulness of PDT in onychomycosis in both in vitro and in vivo settings and discuss the potential and limitations of various photosensitizing agents. In vivo, methylene blue and 5-aminolevulinic acid have led to cure rates in 80% and 43% of cases, respectively, at 12 months. Finally, based on data in the literature and our own experience, we propose a protocol of 3 PDT sessions, separated by an interval of 1 or 2 weeks, using methyl aminolevulinate 16% as a photosensitizing agent and red light (λ=630nm, 37J.cm−2). Each session is preceded by the topical application of urea 40% over several days. Clinical trials are needed to optimize PDT protocols and to identify those patients who will benefit most from this treatment.
La onicomicosis es la infección fúngica de las uñas de los pies o de las manos. Representa hasta el 50% de todas las onicopatías, y aproximadamente el 30% de las dermatomicosis1. La prevalencia descrita oscila entre un 2 y un 40%, en función de la población estudiada y de los medios diagnósticos utilizados. Es una enfermedad común en los adultos2, y está relacionada con diferentes factores predisponentes, como la ocupación laboral, la clase social, el clima, las distintas enfermedades de base (diabetes, insuficiencia vascular periférica, inmunodeficiencia, psoriasis, etc.) y la edad2,3.
Los dermatofitos son la causa más frecuente de onicomicosis, y entre ellos Trichophyton rubrum es el agente etiológico más frecuente4–8. Los hongos filamentosos no dermatofitos (especies de Fusarium, Aspergillus, Scopulariopsis, Acremonium, etc.) causan del 2 al 13% de los casos9–12 y las levaduras son responsables de alrededor del 21% de las onicomicosis, afectando generalmente a las uñas de las manos8,12.
En cuanto al tratamiento, a pesar del avance logrado por los nuevos antimicóticos, tanto la falta de respuesta (40-70%)2 como las recaídas y/o recurrencias (20-25%)13 son frecuentes. La dificultad de penetración en la lámina ungueal, la falta de adhesión al tratamiento (que se prolonga durante meses), la mala respuesta de algunos hongos a los antifúngicos y la cierta susceptibilidad personal son factores que las favorecerían14. De todo ello se deriva la necesidad de ampliar las opciones terapéuticas, intentando asimismo reducir los efectos adversos. En este sentido, las terapias basadas en dispositivos15 como láser16,17, iontoforesis18 o terapia fotodinámica (TFD)19,20 pueden ayudar a solventar las citadas limitaciones.
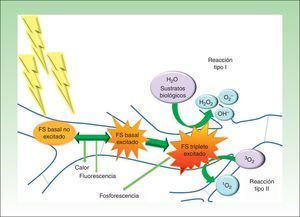
La TFD se basa en el uso de agentes fotosensibilizantes que se localizan selectivamente en determinadas células, por lo que cuando se activan con una luz de longitud de onda apropiada y en presencia de oxígeno se produce la muerte celular (fig. 1)21.
Diagrama modificado de Jablonski: base molecular y mecanismo de acción en terapia fotodinámica. La absorción de luz por un fotosensibilizador (FS) en su estado basal no excitado promueve un electrón a un orbital de mayor energía (FS basal excitado). A continuación, este puede volver a su estado basal por emisión de calor y/o fluorescencia o puede cambiar la orientación de su momento angular de espín (FS triplete excitado). El largo tiempo de vida del estado electrónico triplete favorece la formación de oxígeno singlete y/o radicales libres que dañan estructuras claves de la célula y finalmente causan su muerte. Finalizado el proceso el FS regresa a su estado fundamental, listo para realizar un nuevo ciclo fototerapéutico.
La aplicación de la TFD a las infecciones ha dado lugar a la denominada terapia fotodinámica antimicrobiana (TFA), representando un campo emergente de investigación en el tratamiento de infecciones localizadas19. Así, diversos artículos relativos a experiencias in vitro e in vivo apoyan su utilidad en el tratamiento de infecciones causadas por virus, bacterias, hongos y parásitos19. Este tratamiento ofrece una serie de ventajas frente a las terapias antimicrobianas tradicionales, como son: 1) amplio espectro de acción; 2) eficacia independiente del patrón de resistencia a los antimicrobianos; 3) fotoinactivación de los microorganismos, proceso multidiana que hace muy improbable la selección de cepas fotoresistentes; 4) disponibilidad de formulaciones que permiten la liberación específica del fotosensibilizante a la zona infectada sin dañar el tejido sano adyacente; 5) uso de fuentes luminosas de bajo coste para activar el agente fotosensibilizante; y 6) compatibilidad para combinarse con cualquier fármaco de acción antibiótica o antimicótica.
Sin embargo, la TFD todavía no tiene indicación clínica antimicrobiana aprobada y su aplicación es anecdótica. Con respecto a las infecciones por hongos, hay series de casos de tiñas de piel lampiña22 y de candidiasis23 con resultados diversos. La onicomicosis, al ser una infección localizada para la que los tratamientos existentes son de limitada eficacia, sería quizás la micosis cutánea en la que la TFA podría tener una mayor aplicación.
Esta revisión pretende dar respuesta a una serie de preguntas acerca de las evidencias básicas, in vitro, y clínicas, in vivo, sobre el uso de la TFD en las onicomicosis.
¿La terapia fotodinámica es eficaz in vitro frente a los hongos filamentosos que causan onicomicosis?La eficacia antifúngica de la TFD ha sido evaluada, in vitro, utilizando diferentes fotosensibilizadores a distintas concentraciones, fuentes de luz de variadas longitudes de onda y en diferentes tipos de hongos. La tabla 1 resume los estudios más relevantes.
Investigación in vitro de la terapia fotodinámica en hongos filamentosos
| Referencias | Microorganismo | Fotosensibilizante | Luz | Efecto de la TFD | |||
|---|---|---|---|---|---|---|---|
| λ (nm) | Dosis (J/cm2) | Fluencia (mW/cm2) | Fuente | ||||
| Morton et al. 31 (2014) | T. rubrum | Rosa de Bengala | 530 | 24 | 13,4 | Three 3-watt H-HP803PG LED | Fungicida 100% con dosis 140μM |
| Paz-Cristobal et al.30 (2014) | T. rubrumT. mentagrophytes | Hipericina | 602 | 37 | 10,3 | LED | Fungicida. reducción 3log, con dosis 10-50μM |
| Amorim et al.29 (2012) | T. rubrum | Azul de toluidina O | 630 | 18-90 | NE | LED | Fungicida con dosis 25μM y una densidad de energía de 72J/cm2 |
| Smijs et al.44 (2009) | T. rubrum(modelo ex vivo estrato córneo humano) | Sylsens B(pH 5,2) | 340-550 | 18 | 30 | UVA-1 | Fungicida.CMI de Sylsens B 10μM con el aislado clínico, 1μM cepa de laboratorio |
| Smijs et al.27 (2007) | T. rubrum(modelo ex vivo estrato córneo humano) | Sylsens BDP mme | 580-870 | 108 | 30 | «MASIVE» (n.° 74900/21). 1×500W-230V-R7s, IP44 con filtro de corte a 600nm | Fungicida en diferentes fases de crecimiento conidial.Sylsens B:- 1μM a las 8h- 5μM a las 17 y 24hDP mme:- 80μM a las 8h |
| Donnely et al.45 (2005) | Trichophyton interdigitale | ALA(0-100mM) | 635 | 100 | 100 | Paterson Lamp (Phototherapeutics Ltd.) | Fungistático≤79% |
| Kamp et al.28 (2005) | T. rubrum(cultivo líquido) | ALA(1-10mmol l−1) | NE (luz blanca) | 10J por 60min (≈128Jcm−2) | 36,8 | Quartz-halogen Zeiss KL 2500 LCD | Fungistático: reducción del número o del diámetro de las colonias |
| Smijs et al.26 (2004) | T. rubrum(suspensión de hifas y microconidias) | Sylsens BDP mme | 580-870 | 108 | 30 | «MASIVE» (n.° 74900/21). 13 máx. 500 W-230V-R7s, IP44 con filtro de corte a 600nm | Fungicida para microconidias:-Sylsens B 1μM-DPmme >5μMFungicida para hifas:-Sylsens B 10μM-DPmme 40μM |
| Smijs et al.25 (2003) | T. rubrum(cultivo líquido) | Sylsens BDP mme | NE (luz blanca) | 108 | 30 | «MASIVE» (n.° 74900/21). 13 máx. 500 W-230V-R7s, IP44 | Fungicida (3μgmL−1) con Sylsens B y DPmme.Fungistático con ftalocianinas y Photofrin de unasemana de duración |
| Ouf et al.46 (2003) | T. rubrumTrichophyton verrucosumTrichophyton violaceumMicrosporum canisM. gypseumEpidermophyton floccosum (solución de esporas) | Derivado de hematoporfirina, azul de metileno, azul de toluidina | NE (luz visible) | 72-144 | 40 | Oriel solar simulator | Fungicida con hematoporfirina y azul de metileno a 10−3M para M. canis, T. mentagrophytes y T. verrucossum |
| Propst y Lubin24 (1978) | T. mentagrophytesM. gypseum(suspensión mixta de esporas y micelios) | Azul de metileno.Rojo neutro. Proflavina hemisulfato (3mM) | 455 | ≈1,1 | ≈1,8 | Luz azul | Fungicida con proflavina (3mM) |
ALA: ácido 5-aminolevulínico; DP mme: deuteroporfirín monometiléster; NE: no especificado; Sylsens B: 5, 10, 15-tris (4-metilpiridinio)-20-fenil-[21H, 23H] tricloruro de porfina.
Propst y Lubin, en 1978, demostraron que los hongos dermatofitos pueden ser fotosensibles in vitro a colorantes heterocíclicos, observando un efecto fungicida de la proflavina y luz azul (455nm) sobre Trichophyton mentagrophytes y Microsporum gypseum24.
Smijs et al., en diferentes estudios in vitro25,26, demostraron el efecto fungicida, persistente incluso varias semanas después de la TFD, frente a T. rubrum usando diferentes porfirinas (Sylsens B y deuteroporfirín monometiléster) activadas por luz blanca y roja de banda ancha. El efecto se observó en las diferentes fases de crecimiento fúngico, aunque con diferencias interesantes en la sensibilidad a la TFD, ya que las esporas en suspensión se mostraron más susceptibles que las colonias del hongo en cultivo líquido26. El hecho de que la TFD destruya las hifas e inactive las esporas del hongo es importante para poder establecer su posible utilidad como tratamiento de las micosis superficiales. En una situación clínica las esporas son responsables del inicio de la infección, y con frecuencia se mantendrán y sobrevivirán en la piel después del tratamiento favoreciendo las reinfecciones.
La adherencia de los hongos dermatofitos a estructuras queratinizadas es fundamental en la patogénesis de las dermatofitosis. Para investigar el comportamiento de la TFD en una situación próxima a lo que sucede en la clínica, Smijs et al. cultivaron T. rubrum en un modelo ex vivo de estrato córneo de piel humana27. Este modelo permitió investigar la susceptibilidad en las diversas etapas de crecimiento del hongo a la TFD, demostrando la importancia de la adherencia a una estructura queratinizada en la virulencia fúngica. Así, observaron que, en comparación con los estudios in vitro, la susceptibilidad del micelio maduro a la TFD disminuye mientras la de los conidios no. De esta forma, la TFD con Sylsens B 160μM y luz roja (108J/cm2) tuvo un efecto fungicida solo en el 65% de los tratamientos, aumentando al 90% si se añadía un inhibidor de la enzima queratinasa a la mezcla de incubación. Los autores también comprobaron que, cuando la inhibición fotodinámica no tuvo éxito, el fotosensibilizador no había penetrado en la pared celular fúngica.
Kamp et al.28 observaron una reducción de casi el 50% del crecimiento de T. rubrum in vitro utilizando ácido 5-aminolevulínico (ALA) como fotosensibilizante. Este efecto fungistático podría ser debido a que el ALA es una molécula hidrofílica, por lo que su absorción y metabolización por T. rubrum fue extremadamente lenta, observando la primera formación de protoporfirina ix (PpIX) a los 10-14 días de incubación. Probablemente la esterificación del ALA, al aumentar su lipofilia, mejore sus propiedades de difusión, captación y conversión por T. rubrum28.
Otros autores han demostrado propiedades antifúngicas in vitro de la TFD empleando diferentes FS como fenotiazinas (Amorim et al.)29, hipericina (Paz-Cristobal et al.)30 o rosa de Bengala (Morton et al.)31.
¿Qué evidencia clínica apoya el uso de la terapia fotodinámica en las onicomicosis?La experiencia clínica sobre el uso de la TFD en onicomicosis no es muy amplia, y no existe un protocolo de actuación estandarizado. La tabla 2 recoge los casos y ensayos clínicos publicados hasta la fecha. La mayoría de ellos incluyen pacientes en los que los tratamientos antifúngicos previos habían fracasado o presentaban enfermedades de base que contraindicaban el tratamiento oral. Todos utilizan una fuente de luz con una longitud de onda dentro del color rojo, cuyo espectro no es absorbido por la hemoglobina y puede penetrar más profundamente en el tejido vivo, propiedad que es particularmente importante en el tratamiento de las infecciones ungueales. Por lo general, se ha utilizado una lámpara de diodos emisores de luz (LED) con una longitud de onda de 630±10nm (Aktilite®)22,32–35. Los LED son compactos, requieren menos energía para emitir luz con las longitudes de onda deseadas, no producen daño térmico en los tejidos biológicos y se fabrican en varias longitudes de onda26.
Estudios de onicomicosis tratadas con terapia fotodinámica
| Referencias | Tipo de onicomicosis | CasosN.° | Agente causal | Localización | Urea previa a TFD(%) | Fotosensibilizante | Tiempo de incubación |
|---|---|---|---|---|---|---|---|
| Watanabe D et al.32 (2008) | Subungueal distal y lateral | 2 | DTF NE | 1.ª uña pie | Sí, urea 20% | ALA 20% | 5h |
| Sotiriou E et al.22 (2010) | Subungueal distal y lateral | 30 | T. rubrum | 1.ª uña pie (22 pacientes)Otra uña pie (8 pacientes) | Sí, urea 20%+abrasión mecánica | ALA 20% | 3h |
| Piraccini et al.36 (2008) | Onicodistrofia totalSubungueal proximal | 1 | T. rubrum | Primeras uñas pies | Sí, urea40%+ abrasión mecánica | MAL 16% | 3h |
| Aspiroz et al.34 (2011) | Blanca superficial | 1 | Acremonium sclerotigenum | 5.ª uña mano | No | MAL al 16% (Metvix®) | 4h |
| Gilaberte et al.35 (2011) | Onicodistrofia | 1 | Fusarium oxysporum | 4.ª uña mano | Sí, urea al 40% | MAL al 16% (Metvix®) | 4h |
| Gilaberte et al.35 (2011) | Blanca superficial | 1 | Aspergillus terreus | 1.ª a 5.ª uña mano | Sí, urea al 40% | MAL al 16% (Metvix®) | 4h |
| Aspiroz et al.33 (2011) | Onicodistrofia. Onicólisis distal | 1 | Candida albicans+Malassezia furfur | 3.ª y 4.ª mano | Sí, urea al 40% | MAL al 16% (Metvix®) | 3h |
| Silva et al.39(2013) | Subungueal distal y lateral. Onicodistrofia | 1 | NE | 1.ª uña ambos pies | Sí, urea al 20%+abrasión mecánica | Derivado de hematoporfirina (Photogem© 1ml,mg/ml) | 1h |
| Figueiredo Souza et al.37 (2014) | Subungueal distal y lateral | 40 | T. rubrum T. mentagrophytesE. floccosumAspergillus nigerCandida sp.Fusarium sp. | NE | Abrasión mecánicaa | Solución acuosa de azul de metileno al 2% | 3min |
| Figueiredo Souza et al.38 (2014) | Subungueal distal y lateral | 22 | T. rubrum | NE | Abrasión mecánicaa | Solución acuosa de azul de metileno al 2% |
| Referencias | Seguimiento (meses) | Calidad de evidencia | N.° de sesiones de TFD | Luz | Tasa de curación clínica/microbiológica | |||
|---|---|---|---|---|---|---|---|---|
| λ (nm) | Fluencia (J/cm2) | Irradiancia (mW/cm2) | Fuente | |||||
| Watanabe D et al.32 (2008) | 3 y 6 | III | 6-7 | 630 | 100 | NE | Láser pulsado de colorante excimer (Hamamatsu Photonics KK) | 2 (100%) |
| Sotiriou E et al.22 (2010) | 12 y 18 | II | 3 | 570-670 | 40 | 40 | Waldmann TFD 1200 | A los 12 meses seguimiento: 43%A los 18 meses seguimiento: 37% |
| Piraccini et al.36 (2008) | 24 | III | 3 | 630 | 37 | NE | Aktilite® | 1 (100%) |
| Aspiroz et al.34 (2011) | 3, 6, 9 y 12 | III | 3 | 630 | 37 | NE | Aktilite® | 1 (100%) |
| Gilaberte et al.35 (2011) | 6 | III | 3 | 630 | 37 | NE | Aktilite® | 1 (100%) |
| Gilaberte et al.35 (2011) | 6 | III | 3 | 630 | 37 | NE | Aktilite® | 1 (100%) |
| Aspiroz et al.33 (2011) | 6 y 18 | III | 3 | 630 | 37 | NE | Aktilite® | 1 (100%) |
| Silva et al.39(2013) | No | III | 6 | 630 | 54 | NE | LED | 1 (100%) |
| Figueiredo Souza et al.37 (2014) | 1 y 12 | II-1 | 12 | 630 | 18 | 100 | LED | Al final del tratamiento: 90%A los 12 meses seguimiento: 80% |
| Figueiredo Souza et al.38 (2014) | 1 y 12 | 12 | 630 | 36 | 100 | LED | Onicomicosis leve-moderada: 100%Onicomicosis grave: 63,3% | |
Aktilite: Photocure ASA, Oslo, Noruega. DTF: hongo dermatofito; MAL: metil aminolevulinato; NE: no especificado; Waldman TF 1200: Waldmann-Medizin-Technik, Villingen-Schwenningen, Alemania.
A pesar de que in vitro presenta un efecto fungistático, el fotosensibilizante más utilizado en la bibliografía es ALA al 20%22,32 o su derivado metil-aminolevulinato (MAL) al 16%33–36. Ambos se han mostrado efectivos aplicados de forma tópica y tras 24-48h de su aplicación se han eliminado totalmente de los tejidos23. Otros fotosensibilizantes empleados han sido azul de metileno al 2%37,38 y un derivado de la hematoporfirina (Photogem®)39.
Al final del tratamiento la mayoría de los estudios describen un 90-100% de curación clínica y microbiológica, porcentaje que disminuye con el seguimiento. Por otro lado, la eficacia de la TFD parece depender de la realización de un pretratamiento de las uñas con urea y/o abrasión de la uña para aumentar la permeabilidad del fotosensibilizante22,32, así como de la eliminación activa de la hiperqueratosis22,36.
Los primeros casos publicados de onicomicosis tratados con TFD son de 2008. Watanabe et al.32 tratan a 2 pacientes con onicomicosis subungueal distal y lateral por dermatofitos en la primera uña del pie, que previamente habían recibido otros tratamientos antifúngicos sin éxito terapéutico. Ambos pacientes recibieron un pretratamiento con urea al 20% durante 10h para facilitar la penetración del fotosensibilizante ALA (incubado durante 5h). Posteriormente se irradió con láser pulsado a una longitud de onda de 630nm y 100J/cm2. El tratamiento fue repetido una vez por semana hasta observar mejoría clínica y confirmar la desaparición de los dermatofitos por KOH y cultivo. Los pacientes experimentaron dolor leve durante la TFD, que se resolvió al final del día. La curación clínica y microbiológica persistía a los 3 meses de seguimiento en un paciente y a los 6 meses en otro.
Posteriormente, Piraccini et al.36 publicaron el caso de una paciente con onicomicosis por T. rubrum en las primeras uñas de ambos pies, tratada sin éxito con antifúngico tópico y que presentaba contraindicaciones para recibir tratamiento oral. Tras la aplicación los días previos de urea al 40% y eliminación de la hiperqueratosis ungueal el día de la TFD, aplicaron MAL 16% con incubación de 3h en cura oclusiva e irradiaron con luz roja (Aktilite®) (630nm, 37J/cm2). Tras 3 sesiones de TFD, con un intervalo de 15 días entre ellas y sin describir efectos adversos, obtuvieron curación clínica y micológica mantenida a los 24 meses de seguimiento.
El grupo de Aspiroz33,34 y Gilaberte35, basándose en el protocolo de actuación de Piraccini et al., publicaron varios casos de onicomicosis por hongos no dermatofitos (Acremonium sclerotigenum, Fusarium oxysporum, Aspergillus terreus) y por levaduras (infección mixta por Candida albicans y Malassezia furfur). En todos ellos las lesiones se localizaron en las uñas de las manos y fueron tratadas con éxito, lo que apoyaría el uso de la TFD en este tipo de onicomicosis que muestran escasa respuesta a los antifúngicos orales y tópicos40.
Silva et al.39 describen la eficacia de la TFD utilizando un derivado de hematoporfirina (Photogem®) en onicomicosis de años de evolución, con cultivo negativo tras la finalización del tratamiento, aunque sin seguimiento posterior.
Hasta la fecha solo existen 3 ensayos clínicos publicados. Sotiriou et al.22 utilizan ALA 20% y 40J/cm2 de luz roja (Waldmann PDT 1200, Waldmann-Medizin-Technik, Villingen-Schwenningen, Alemania) y tratan 30 pacientes con onicomicosis subungueal distal y lateral por T. rubrum, sin respuesta al tratamiento antifúngico tópico y con contraindicaciones confirmadas para usar antifúngicos orales. De ellos, 22 (73,3%) presentaban afectación de la primera uña del pie. El número de sesiones de tratamiento y los intervalos entre las mismas fueron similares a los utilizados por Piraccini et al., con la diferencia de una preparación las 10 noches previas con urea al 20% en cura oclusiva. Tras 12 meses de seguimiento, 13 pacientes (43,3%) presentaban curación clínica y microbiológica, de los que solo 5 (16,6%) presentaron ausencia completa de los signos clínicos y 8 (26,6%) cambios residuales que afectaban a menos de 10% de la placa de la uña y cultivo negativo. A los 18 meses la tasa de curación se redujo a 11 pacientes (36,6%), lo que pudo deberse a la pobre penetración del ALA, o a que solo trataron una uña en casos de afectación múltiple.
El grupo de Figueiredo Souza realiza 2 estudios usando azul de metileno como fotosenbilizante. El mayor ensayo publicado hasta la fecha incluye 80 pacientes diagnosticados de onicomicosis de diferentes etiologías37: T. rubrum, T. mentagrophytes, Epidermophyton floccosum, Aspergillus spp., Candida spp. y Fusarium spp. Se trata de un estudio ciego en el que utilizan TFD con azul de metileno al 2% con un intervalo de 15 días entre cada sesión frente a fluconazol oral durante 24 semanas. En ambos grupos aquellos pacientes que presentaban hiperqueratosis>2mm, onicomicosis longitudinal o dermatofitomas fueron tratados con abrasión mecánica de la uña con el fin de facilitar la penetración del fotosensibilizante. Al final del tratamiento se observó una tasa de curación del 90% en el grupo de TFD con azul de metileno frente al 45% en el grupo que había recibido fluconazol oral (p<0,002). En el primer grupo la tasa de curación fue del 80% a los 12 meses de seguimiento, independientemente de si habían recibido abrasión previa o no. Este estudio muestra que la TFD puede ser utilizada como un tratamiento eficaz para la onicomicosis, independientemente del hongo causal. No obstante, el utilizar fluconazol oral como comparador puede suponer un sesgo, ya que es menos eficaz que la terbinafina o el itraconazol41,42. La tasa de curación clínica del 90% es la más alta conseguida con TFD, probablemente debido a la utilización de la abrasión mecánica en lesiones hiperqueratósicas, con dermatofitoma y vetas longitudinales de hongos, habituales determinantes en el fracaso del tratamiento43.
ConclusionesLa TFD es un tratamiento local, bien tolerado, fácilmente reproducible, que no presenta interacciones con otros fármacos y que ofrece la posibilidad de ser combinada con cualquier antifúngico. Es una opción de tratamiento en onicomicosis de larga evolución sin respuesta a los antifúngicos habituales, en pacientes con enfermedades subyacentes, polimedicados y en aquellos que no desean tratamientos prolongados en el tiempo.
La variabilidad de los resultados obtenidos en los diferentes estudios clínicos de TFD en onicomicosis podría ser debida a factores dependientes de la técnica, tipo de fotosensibilizante, número de sesiones administradas, preparación previa de las uñas, número de uñas afectadas, gravedad de la onicomicosis, así como al agente causal.
En función de todo lo expuesto y basado en nuestra experiencia a lo largo de 5 años (figs. 2 y 3), opinamos que la TFD puede ser una buena opción para pacientes con onicomicosis de cualquier etiología limitada a pocas uñas, no tributarios de tratamiento sistémico, o en los que se prevea una baja adherencia al mismo. La existencia de signos clínicos de tiña del pie o de la mano, o la existencia de infección subclínica, obliga a la asociación con el tratamiento adecuado de la misma.
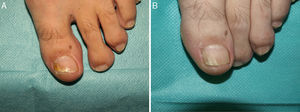
Onicomicosis subungueal distal y lateral por T. mentagrophytes. Antes (A) y 36 semanas después (B) de tratamiento con 3 sesiones, separadas por una semana, de terapia fotodinámica con metilaminolevulinato al 16% y Aktilite (Photocure ASA, Oslo, Noruega; 37J/cm2). Antes de cada sesión se realizó preparación con urea al 40% en oclusiva las 5 noches previas.
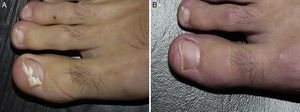
Onicomicosis blanca superficial por Fusarium oxysporum. Antes (A) y 48 semanas después (B) de tratamiento con 3 sesiones, separadas por una semana de terapia fotodinámica con metilaminolevulinato al 16% y Aktilite (Photocure ASA, Oslo, Noruega; 37J/cm2). Antes de cada sesión se realizó preparación con urea al 40% en oclusiva las 3 noches previas, y eliminación mecánica activa de lámina ungueal justo antes de la aplicación del fotosensibilizante.
La tabla 3 recoge el protocolo de TFD para onicomicosis utilizado por nuestro grupo, en el que no se han registrado efectos adversos significativos. Un aspecto importante del mismo es la aplicación previa de urea al 40%, así como la eliminación mecánica de los restos ungueales y zonas hiperqueratósicas, que parece favorecer la penetración del fotosensibilizante, mejorando la respuesta clínica a la TFD. No obstante, son necesarios ensayos clínicos, no solo para establecer la eficacia real, sino para optimizar el procedimiento y sobre todo determinar qué subgrupos de pacientes pueden beneficiarse de este tratamiento.
Protocolo de terapia fotodinámica para el tratamiento de onicomicosis
| Días previos |
| Aplicar urea 40% en cura oclusiva, 12-24h, con cuidado de no macerar demasiado la piel periungueal: |
| En uñas de pies o manos con hiperqueratosis > 2 mm, se aplicará diariamente, durante los 5 días previos a la terapia fotodinámicaaEn uñas de manos o pies con hiperqueratosis < 2 mm bastaría con 2 o 3 días de aplicación de ureaa |
| Día del tratamiento |
| 1. Limpiar con alcohol al 70% los restos de urea de la lámina ungueal y de la piel de alrededor2. Eliminación mecánica de restos ungueales y zonas hiperqueratósicas con bisturí o con abrasivos como limas (recomendado, podría mejorar los resultados)3. Limpiar con alcohol al 70% la lámina ungueal y la piel de alrededor4. Aplicar el fotosensibilizante en la uña y la zona periungueal (ayudarse de un depresor o con el dedo para su aplicación)5. Se cubrirá todo con apósito plástico oclusivo, y cubrir con apósito opaco para proteger de la luz durante 3h en el caso del ácido 5-metilaminolevulinato al 16% (Metvix©, Galderma, La Défense Cedex, Francia)6. Iluminar con LED 635nm (Aktilite®) con fluencia de 37J/cm27. Proteger de la luz el área tratada 24-48h8. Repetir el mismo protocolo cada 1-2 semanas, hasta completar 3 sesionesb |
Los autores declaran no tener ningún conflicto de intereses.
Los autores quieren hacer constar su agradecimiento al Ministerio de Economía y Competitividad por el apoyo proporcionado a su investigación en terapia fotodinámica (Proyecto CTQ2013-48767-C3-2-R), así como al Grupo de Investigación B85 del Gobierno de Aragón.