En la última edición del manual de la American Joint Committee on Cancer (AJCC) se modificó la estadificación para el carcinoma epidermoide cutáneo (CEC), introduciendo características tumorales de alto riesgo que definen el estadio tumoral (T), con el propósito de identificar aquellos tumores con mayor riesgo de metástasis. Nuestro objetivo fue definir las características asociadas al CEC que cumplía criterios de alto riesgo definidos por la AJCC para ser estadio T2.
Pacientes y métodoEstudio observacional analítico tipo casos-casos de 18 meses donde se han incluido pacientes con diagnóstico de CEC. Se recogieron datos clínicos, antropométricos y tumorales. Para el análisis estadístico se ha utilizado la versión 18.0 del programa PASW Statistics (SPSS).
ResultadosEl número total de pacientes incluidos fue 118. La edad media de la población fue de 77 años, con predominio del sexo masculino. Más del 70% de los CEC se presentaron en la región cefálica, y la mayoría fue ≤2cm. La prevalencia de CEC T2 fue del 61,9%. Los factores de riesgo estadísticamente significativos asociados al CEC estadio T2 fueron: la edad (>85 años, OR: 4,48), la localización en la cabeza y el cuello (OR 3,38), la presencia de elastosis solar en el tejido peritumoral (OR 2,08), la tasa de crecimiento más elevada (>1,5 mm*sem-1, OR: 5,73) y el grupo de mayor exposición tabáquica (>20 años/paquete; OR: 3,63).
ConclusionesLa edad avanzada, la localización en la cabeza y el cuello, la presencia de elastosis solar, la velocidad de crecimiento más elevada y la exposición tabáquica intensa son los factores de riesgo que se asociaron a la presencia de CEC estadio T2.
In the latest edition of its cancer staging manual, the American Joint Committee on Cancer (AJCC) revised the criteria for staging squamous cell carcinoma (SCC) by introducing high-risk tumor features to define tumor stage (T) and help to identify tumors with a higher risk of metastasis. The aim of this study was to investigate the characteristics associated with SCC meeting the high-risk criteria defined by the AJCC for T2 lesions.
Patients and methodWe performed a case-case observational study in which patients with SCC were included over a period of 18 months. We collected clinical, anthropometric, and tumor data, and analyzed these using PASW Statistics (SPSS) version 18.
ResultsOne-hundred eighteen patients, the majority of whom were men, were included. Mean age was 77 years. Over 70% of the tumors were located in the head region and a majority of tumors measured 2cm or less. The prevalence of SCC T2 was 61.9%. The risk factors significantly associated with SCC T2 were an age of over 85 years (odds ratio [OR], 4.48), location in the head and neck region (OR, 3.38), presence of solar elastosis in the peritumoral tissue (OR, 2.08), a higher tumor growth rate (>1.5mm·wk−1; OR, 5.73), and higher cumulative exposure to smoking (>20pack-years, OR, 3.63).
ConclusionsAdvanced age, location in the head and neck region, presence of solar elastosis, high tumor growth rate, and high cumulative smoking exposure were all significantly associated with the presence of SCC T2.
En global, el cáncer cutáneo no melanoma (CCNM) es el cáncer más frecuente que afecta a individuos de piel blanca, y su incidencia está aumentando en todo el mundo1–4. Respecto a los datos concretos del carcinoma epidermoide cutáneo (CEC), este incremento es especialmente importante en las últimas décadas, habiendo estudios publicados que cifran este aumento de incidencia entre el 3% y 10% por año. La tasa anual para el CEC en España de 72/100.000 habitantes para el sexo femenino, y de 100/100.000 habitantes para el masculino5. El CEC se origina de los queratinocitos epidérmicos y su etiología es multifactorial, interviniendo en su patogénesis como factor más importante la exposición a la radiación ultravioleta (UV, PUVA, cabinas de bronceado)6. Otros factores que intervienen favoreciendo la aparición y el desarrollo del CEC son la exposición a radiaciones ionizantes7, contacto con sustancias químicas como pesticidas, alquitrán, hidrocarburos policíclicos aromáticos y la exposición al arsénico8. Los pacientes inmunodeprimidos también presentan con mayor frecuencia CEC, y con comportamiento más agresivo y mayor poder metastatizante que la población general, cobrando especial importancia los trasplantados de órgano sólido, como corazón o riñón. La infección por el virus del papiloma humano (VPH) se ha relacionado con la patogenia del CEC, sobre todo el subtipo β, que es el que se relaciona con el CEC no localizado en la mucosa, siendo su prevalencia mayor en los CEC de pacientes inmunodeprimidos9–11. La existencia previa de lesión inflamatoria, dermatitis o heridas/úlceras crónicas de largo tiempo de evolución, y el haber tenido otro carcinoma cutáneo previo se consideran también factores de riesgo para el desarrollo de CEC.
En el año 2010 la AJCC incluyó en la séptima edición de su manual la última estadificación del carcinoma epidermoide cutáneo, tras incorporar novedades importantes respecto a la edición anterior, con el objetivo de proporcionar una mejor aproximación pronóstica y, por tanto, terapéutica12–14. Una modificación importante es que en esta edición separó el CEC del resto de CCNM, como el CBC y el carcinoma de células de Merkel. Respecto a las características tumorales, además del tamaño (>2cm), se han tenido en cuenta otros factores importantes como la profundidad de la lesión (superior a 2mm), las estructuras en profundidad afectadas (nivel de Clark IV o superior), la localización en zonas de alto riesgo (pabellón auricular o mucosa labial) o el grado de diferenciación (pobremente diferenciado). Si un tumor cumple 2 o más de los criterios de «alto riesgo» pasaría a formar parte de una T superior del que le correspondería por el tamaño, y por lo tanto, tendría un peor pronóstico. No obstante, aunque con esta nueva edición se alcanza una mejor predicción del pronóstico, hay otros factores de alto riesgo que conllevan una mayor tasa de recidiva y metástasis, y que no están incluidos, como la invasión linfovascular del tumor, la inmunosupresión del paciente, la existencia de lesiones previas en la zona y la aparición del tumor en otras localizaciones consideradas también de «alto riesgo» diferentes al labio y al pabellón auricular15,16.
El objetivo de nuestro estudio fue determinar la prevalencia del CEC que cumplía criterios de «alto riesgo» según la AJCC en nuestra muestra poblacional, así como los factores que se asociaban a su presencia.
Pacientes y métodoSe ha llevado a cabo un estudio con diseño observacional en el que se ha realizado un análisis de la información, concretamente un caso-control anidado. El comité de ética del centro hospitalario, tras valoración del proyecto, autorizó su realización en julio de 2012. El reclutamiento de los pacientes se ha realizado en el servicio de dermatología de dicho centro, durante un período de 18 meses de duración.
Los criterios de inclusión considerados fueron los siguientes: diagnóstico de CEC, pacientes mayores de 18 años de edad que aceptaron participar y firmaron el consentimiento informado, atendidos en el departamento de dermatología de un centro hospitalario español de la zona de levante-mediterráneo, que presentaba un área poblacional de 379.000 habitantes.
Se excluyeron aquellos pacientes que, aunque fueron diagnosticados de CEC, rechazaron firmar el consentimiento informado, fallecieron antes del tratamiento tumoral, diagnosticados o con sospecha clínica de cualquier síndrome genético relacionado con el desarrollo de neoplasias cutáneas, o si se produjo una recogida de las muestras de forma inadecuada o no válida para su procesamiento. No se incluyeron los CEC localizados en la mucosa genital.
A partir de la historia clínica previa y de la entrevista con el paciente durante la visita de inicio, se recogieron:
Datos clínicos- -
Sexo y edad.
- -
Fotoexposición habitual: hemos considerado años de fotoexposición tanto ocupacional como recreacional, creando 3 grupos en función de la intensidad de la misma:
Leve: fotoexposición ocasional sobre todo recreacional, no mantenida.
Moderada: fotoexposición ocupacional inferior a 15 años o recreacional de menos de 3h diarias, principalmente estival.
Intensa: fotoexposición diaria ocupacional mayor a 15 años o recreacional estival mayor de 3h al día o recreacional mantenida.
- -
Fototipo por escala Fitzpatrick (I-VI).
- -
Tabaquismo: clasificación según la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) en función de la cantidad de cigarrillos/día y años de consumo. El cálculo es n.° de cigarrillos al día×años de hábito tabáquico/20, y se expresa en la unidad «años/paquete». Una cifra inferior a 10 años/paquete se considera leve, entre 10 y 20 años/paquete moderado, y más de 20 años/paquete grave.
- -
Consumo de alcohol (unidades/día) y de fármacos (n.° y tipo).
- -
Índice de masa corporal (kg/m2).
- -
Comorbilidades crónicas como dislipidemia, diabetes mellitus, hipertensión arterial, enfermedades inflamatorias, etc.
- -
Inmunosupresión primaria o secundaria: trastornos hematológicos, toma de inmunosupresores, infección por el virus de la inmunodeficiencia humana, trasplantados, etc.
- -
Antecedentes de enfermedad dermatológica: queratosis actínicas, carcinoma epidermoide in situ tipo enfermedad de Bowen, CCNM.
- -
Contacto con carcinógenos como arsénico, productos alquitranados, radiaciones ionizantes.
- -
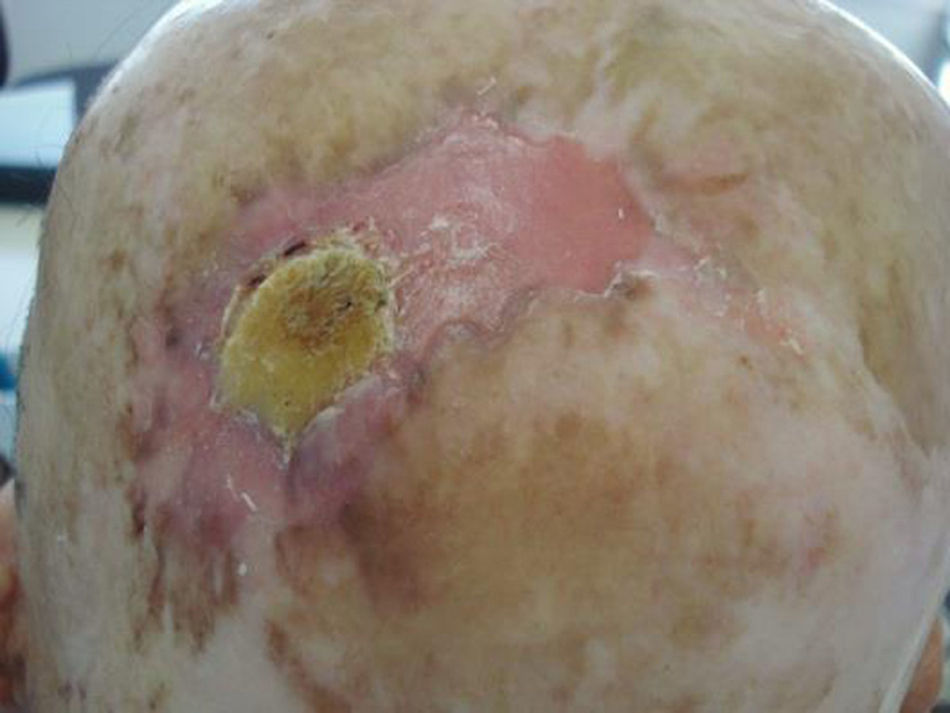
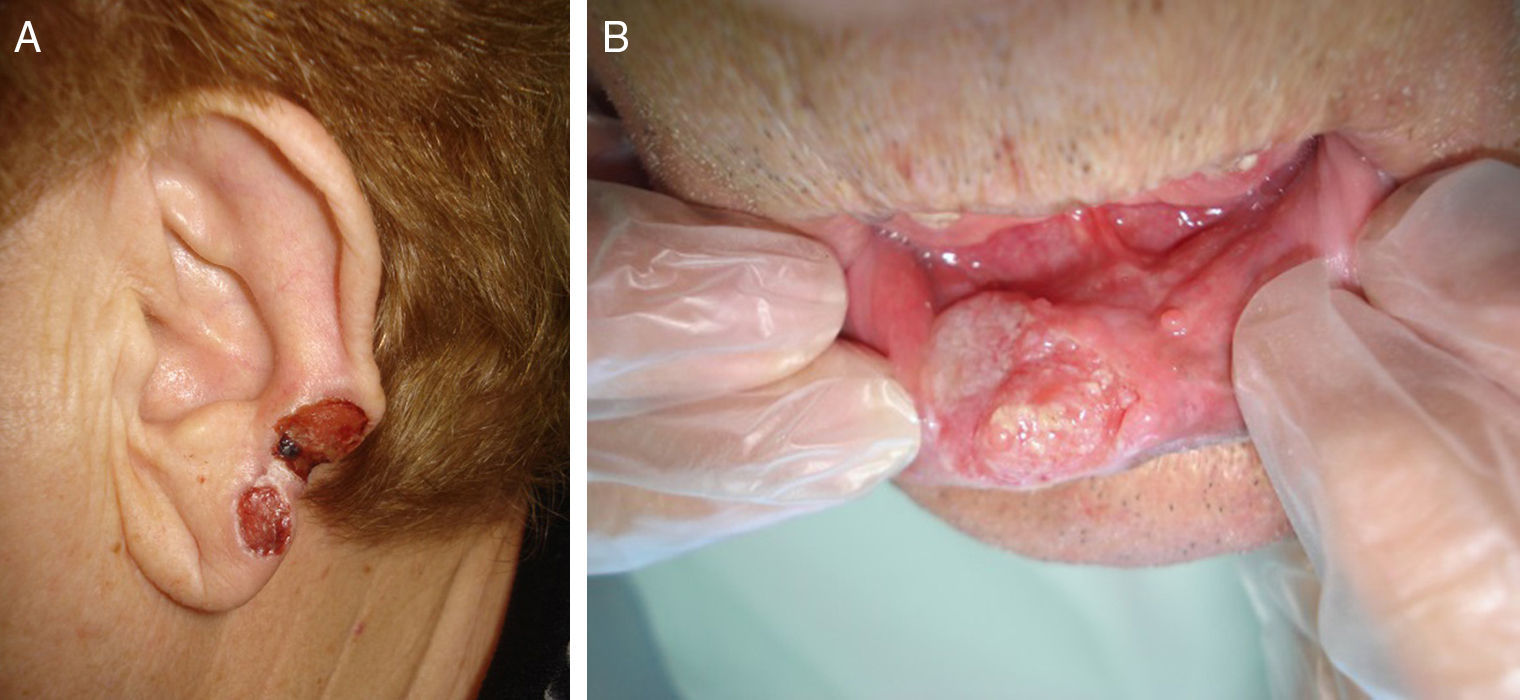
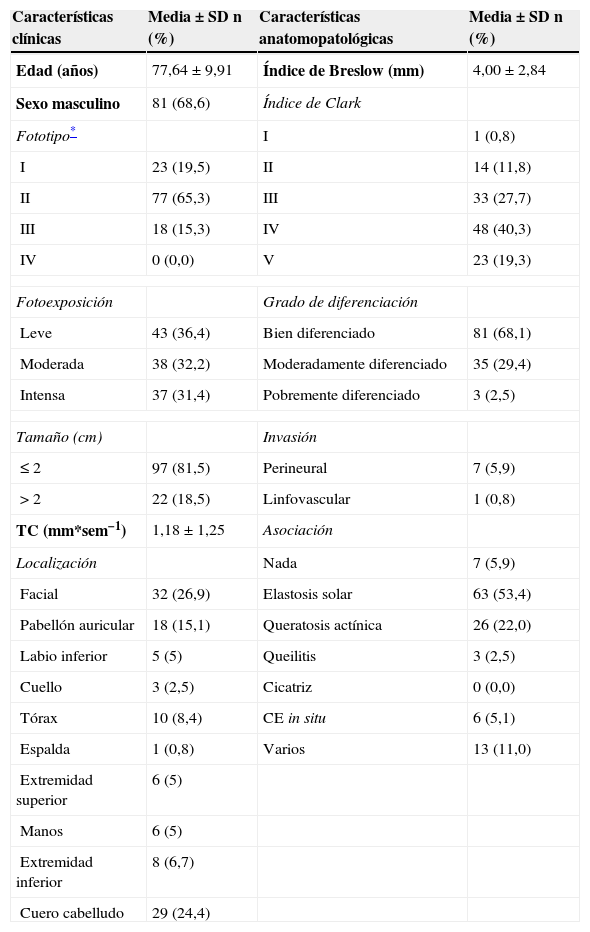
Existencia de lesiones cutáneas previas en la zona tumoral como úlceras crónicas, cicatrices por quemadura (fig. 1), queratosis actínicas o CCNM.
- -
Tiempo de evolución (meses) desde que el paciente evidenció la lesión hasta que fue extirpada.
- -
Localización tumoral: región centrofacial, pabellones auriculares, mucosa labial, cuero cabelludo, cuello, espalda, tórax, abdomen, extremidades superiores, manos, extremidades inferiores, pies. En el estudio descriptivo se agruparon por áreas de alto riesgo consideradas por la AJCC, y en el estudio multivariante también por «cabeza y cuello» y «resto de localizaciones».
- Características histológicas, determinadas por el estudio anatomopatólogico del tumor. En todos los casos se ha aplicado el protocolo adaptado para el examen del carcinoma epidermoide cutáneo propuesto por la AJCC en la séptima edición de su manual, que incluye:
- •
Tamaño tumoral (cm).
- •
Profundidad tumoral (expresada en niveles de Clark y Breslow en mm).
- •
Presencia o no de invasión perineural o linfovascular.
- •
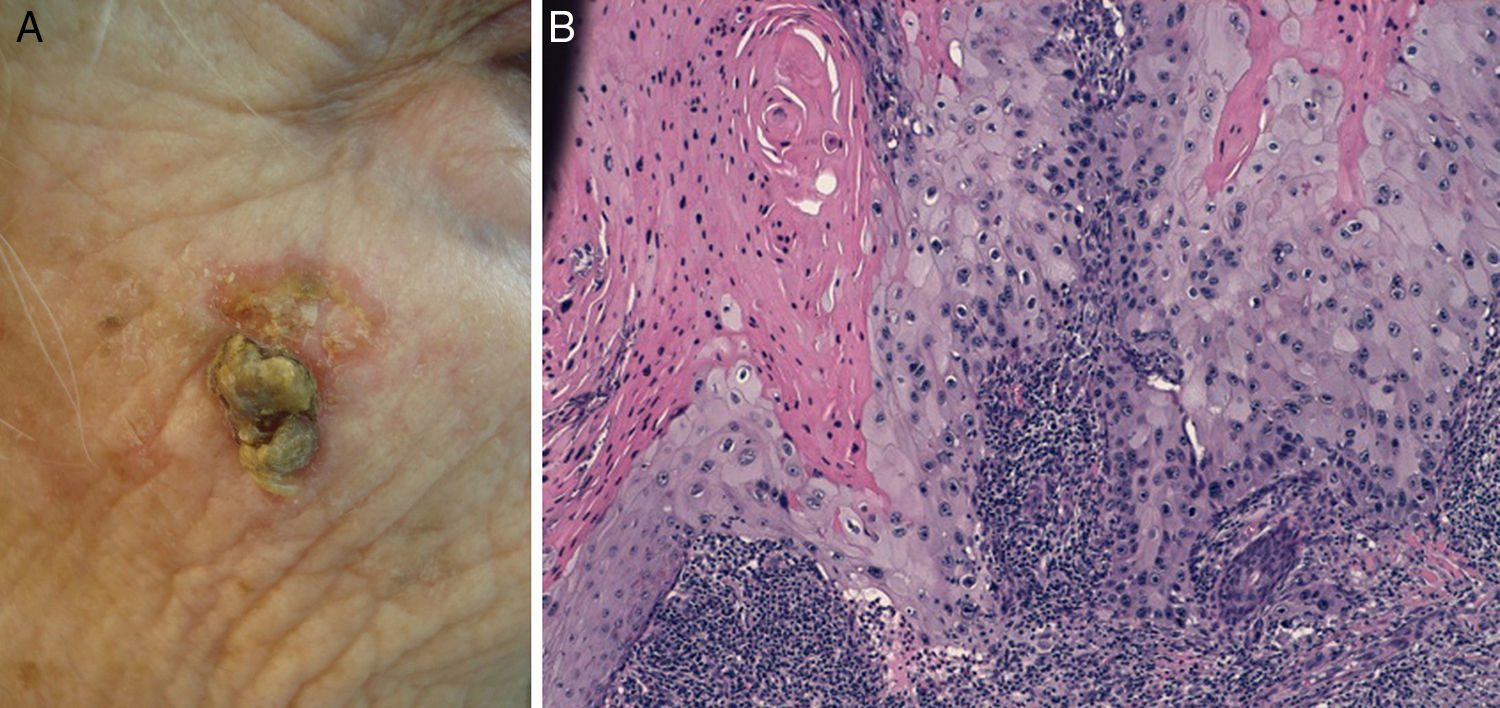
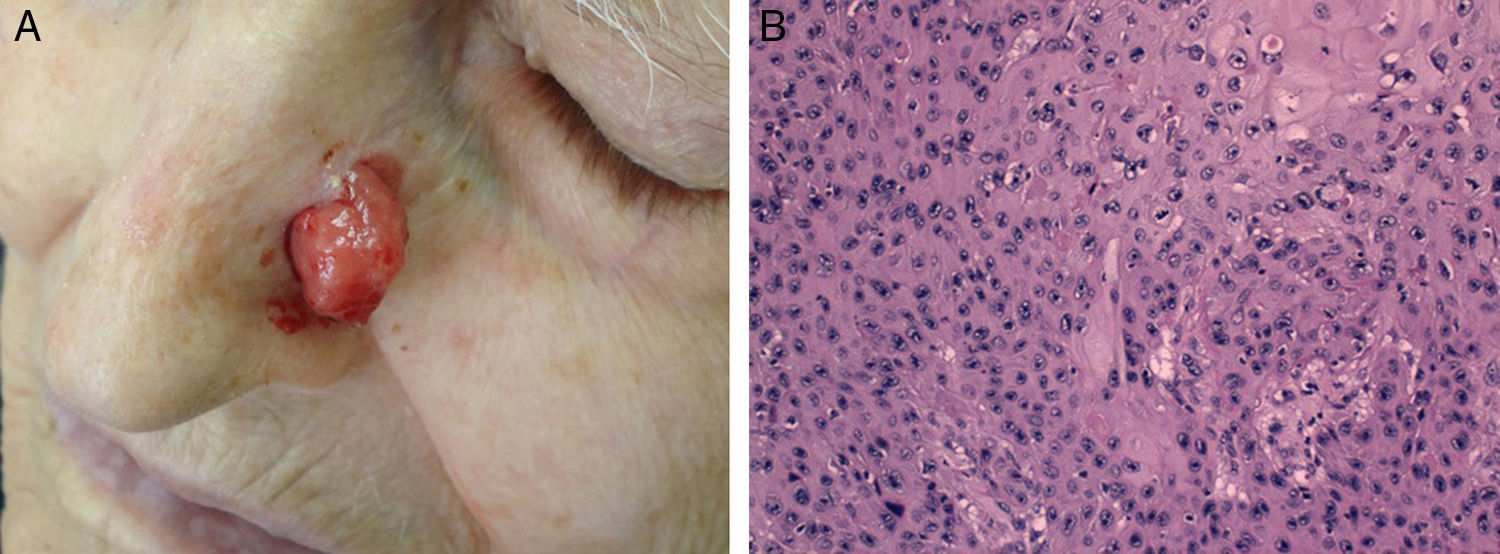
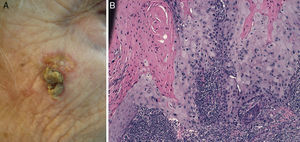
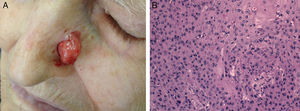
Diferenciación celular (figs. 2 y 3): bien diferenciado, moderadamente diferenciado, pobremente diferenciado.
- •
Mitosis (n.°/mm2), necrosis o neovascularización.
- •
Subtipo histológico: queratósico, nodular, ulcerado, verrucoso, aplanado, de células claras, varios (si coexistían varios subtipos en el mismo tumor), otros (no recogidos en este listado).
- •
Asociación en el tejido peritumoral: elastosis solar, carcinoma epidermoide in situ, cicatriz, queratosis actínica.
- •
Márgenes laterales y profundos libres de tumor tras la extirpación (mm).
Además, se consideró la tasa de crecimiento (TC) (mm*sem−1), que se calculó con la siguiente fórmula: TC (mm*sem–1)=ET (mm)/T2-T1 (semanas).
- •
ET: espesor tumoral o Breslow, medido en mm.
- •
T1: momento en que el paciente se nota la lesión.
- •
T2: momento en que se extirpa la lesión.
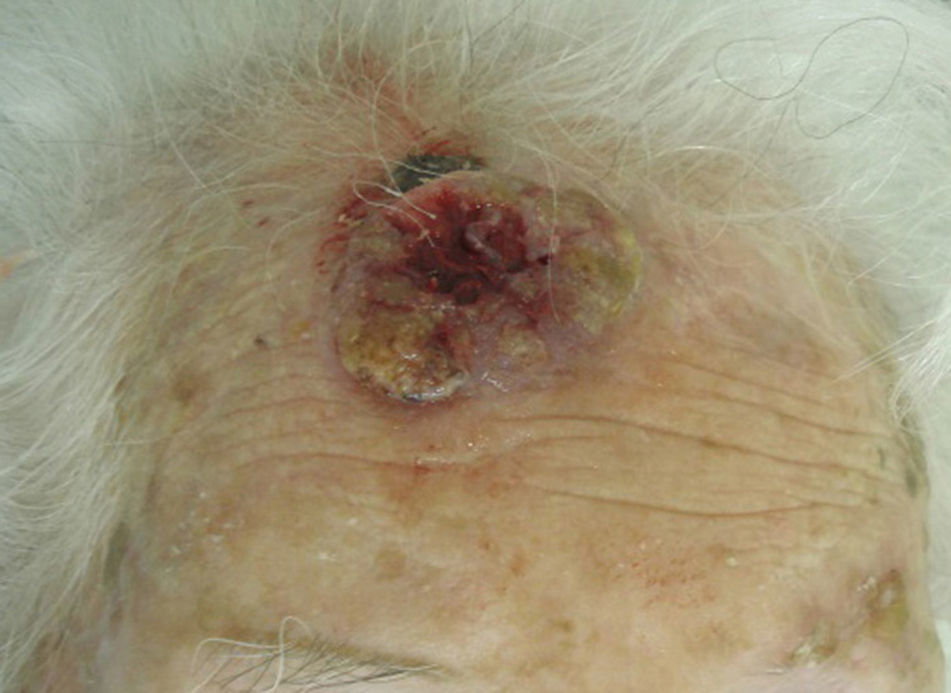
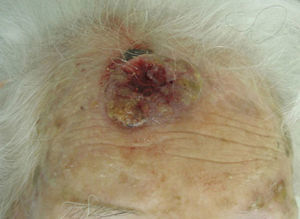
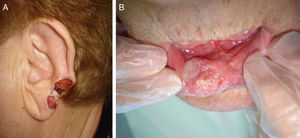
En función de las características tumorales, se ha definido como carcinoma epidermoide de peor pronóstico o T2 aquel que ha cumplido con los criterios establecidos por la AJCC en la séptima edición de su manual13, es decir, tamaño>2cm (fig. 4) y/o al menos 2 de las siguientes características: localización en zonas de alto riesgo (pabellones auriculares o labios [fig. 5]), profundidad>2mm o Clark≥4, y diferenciación (tumores pobremente diferenciados).
En cuanto al análisis estadístico, la descripción de las variables cuantitativas se realizó en primer lugar con una valoración de su normalidad (test de normalidad de Kolmogorov-Smirnov). Las variables que se presenten con distribuciones normales se describieron mediante media, desviación estándar e intervalo de confianza (IC 95%); las que se identificaron como no normales fueron descritas con su mediana y rango interquartílico. Las variables cualitativas se describieron mediante proporciones (%).
La prueba de Chi-cuadrado se utilizó para comparar las diferencias en los porcentajes en las variables dicotómicas. Se empleó el «t»-test para comparar las diferencias en las variables continuas entre los 2 grupos. Los coeficientes de correlación de Pearson se calcularon para describir la asociación cruda entre las variables. El análisis de regresión lineal multivariado se aplicó para estudiar la relación independiente entre las características que determinan de alto riesgo del CEC y los demás parámetros analizados. Por último, un análisis de regresión logística se aplicó para estimar las tasas ajustadas, no ajustadas y multivariada ratio (OR) e intervalo de confianza del 95% (IC), para determinar los factores que determinaban el CEC que cumplía criterios de alto riesgo según la AJCC o CEC estadio T2. Estos puntos de corte se calcularon a partir de los valores normales del grupo de control±una desviación estándar (SD). Los datos se expresaron como media±una desviación estándar.
Para la inferencia estadística, un acuerdo bilateral de valor de p<0,05 fue considerado estadísticamente significativo.
ResultadosEl número total de pacientes incluidos en el estudio fue de 118. La edad media de la población fue de 77,6 años (mediana=79; intervalo intercuartílico=13), con un predominio del sexo masculino (68,8%, n=81). Más de la mitad presentaron un fototipo ii (65,3%, n=77), seguido de aquellos con fototipo i (19,5%, n=23). Los niveles de fotoexposición se distribuyeron de forma similar en los 3 grupos: 36,4% (n=43) tuvieron una fotoexposición leve, seguida del 32,2% (n=38) que fue moderada y por último un 31,4% (n=37) que fue intensa.
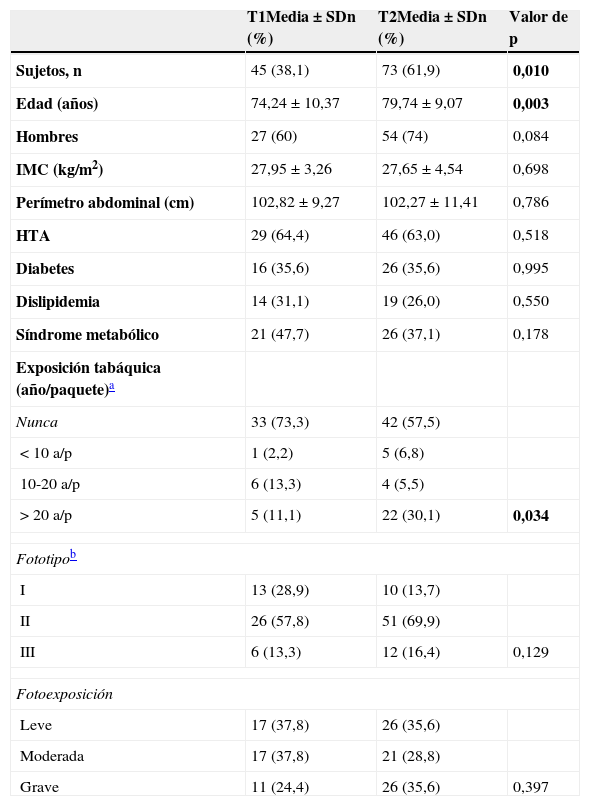
La mayoría de los pacientes presentaron un CEC menor o igual a 2cm (81,5%, n=97), con una tasa de crecimiento media de 1,18mm a la semana. La localización predominante del CEC fue en la zona facial (26,9%, n=32) y el cuero cabelludo (24,4%, n=29), seguido del pabellón auricular (15,1%, n=18), siendo en global más del 70% los CEC que se presentaron en la región cefálica. En cuanto a la morfología, la más frecuente fue la queratósica (42,4%, n=50), seguida de la nodular (21,2%, n=25) y ulcerada (9,3%, n=19). El índice de Breslow medio o profundidad alcanzada máxima fue de 4±2,84mm; casi un 60% (n=71) alcanzaron la dermis reticular o el tejido celular subcutáneo (nivel de Clark IV y V respectivamente). Todas estas características quedan reflejadas en la tabla 1.
Características clínicas y anatomopatológicas generales de la muestra poblacional estudiada con CEC (n=118 pacientes)
| Características clínicas | Media±SD n (%) | Características anatomopatológicas | Media±SD n (%) |
|---|---|---|---|
| Edad (años) | 77,64±9,91 | Índice de Breslow (mm) | 4,00±2,84 |
| Sexo masculino | 81 (68,6) | Índice de Clark | |
| Fototipo* | I | 1 (0,8) | |
| I | 23 (19,5) | II | 14 (11,8) |
| II | 77 (65,3) | III | 33 (27,7) |
| III | 18 (15,3) | IV | 48 (40,3) |
| IV | 0 (0,0) | V | 23 (19,3) |
| Fotoexposición | Grado de diferenciación | ||
| Leve | 43 (36,4) | Bien diferenciado | 81 (68,1) |
| Moderada | 38 (32,2) | Moderadamente diferenciado | 35 (29,4) |
| Intensa | 37 (31,4) | Pobremente diferenciado | 3 (2,5) |
| Tamaño (cm) | Invasión | ||
| ≤2 | 97 (81,5) | Perineural | 7 (5,9) |
| >2 | 22 (18,5) | Linfovascular | 1 (0,8) |
| TC (mm*sem−1) | 1,18±1,25 | Asociación | |
| Localización | Nada | 7 (5,9) | |
| Facial | 32 (26,9) | Elastosis solar | 63 (53,4) |
| Pabellón auricular | 18 (15,1) | Queratosis actínica | 26 (22,0) |
| Labio inferior | 5 (5) | Queilitis | 3 (2,5) |
| Cuello | 3 (2,5) | Cicatriz | 0 (0,0) |
| Tórax | 10 (8,4) | CE in situ | 6 (5,1) |
| Espalda | 1 (0,8) | Varios | 13 (11,0) |
| Extremidad superior | 6 (5) | ||
| Manos | 6 (5) | ||
| Extremidad inferior | 8 (6,7) | ||
| Cuero cabelludo | 29 (24,4) | ||
CE: carcinoma epidermoide; TC: tasa de crecimiento.
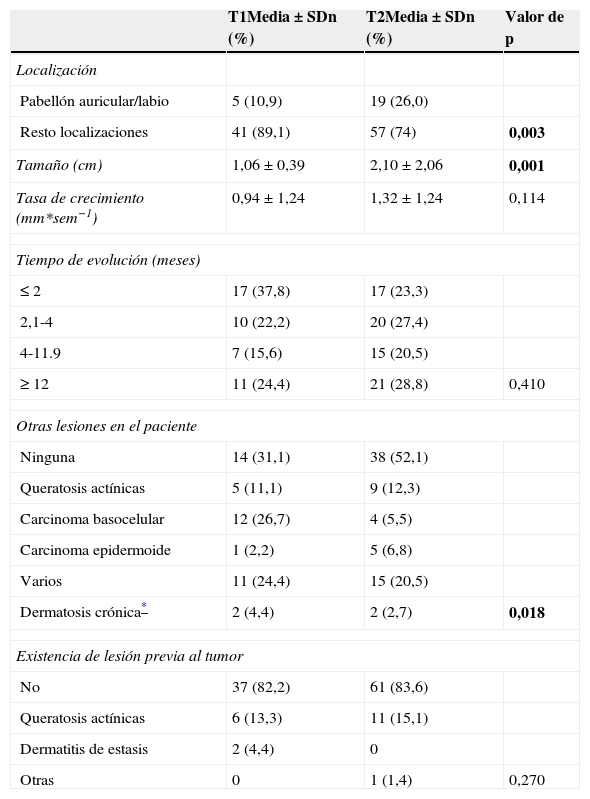
Al comparar las características demográficas, antecedentes personales y hábitos tóxicos de ambos grupos (estadio T1 frente a estadio T2 o CEC de peor pronóstico) (tabla 2), destacamos lo siguiente: los pacientes que desarrollaron un CEC estadio T2 eran mayores que los que desarrollaron T1; en ambos grupos predominó el sexo masculino, aunque estaba más presente en el grupo de CEC estadio T2 (p=0,084). Respecto al consumo de tabaco se observó que el grupo de CEC estadio T1 presentó mayor prevalencia de no fumadores frente a los de estadio T2; además, en estos últimos la intensidad de la exposición fue mucho mayor, llegando a triplicarse el porcentaje de pacientes fumadores de más de 20 años/paquete.
Comparación de las características demográficas y antropométricas, comorbilidades y hábito tabáquico de los pacientes con CEC T1 vs T2
| T1Media±SDn (%) | T2Media±SDn (%) | Valor de p | |
|---|---|---|---|
| Sujetos, n | 45 (38,1) | 73 (61,9) | 0,010 |
| Edad (años) | 74,24±10,37 | 79,74±9,07 | 0,003 |
| Hombres | 27 (60) | 54 (74) | 0,084 |
| IMC (kg/m2) | 27,95±3,26 | 27,65±4,54 | 0,698 |
| Perímetro abdominal (cm) | 102,82±9,27 | 102,27±11,41 | 0,786 |
| HTA | 29 (64,4) | 46 (63,0) | 0,518 |
| Diabetes | 16 (35,6) | 26 (35,6) | 0,995 |
| Dislipidemia | 14 (31,1) | 19 (26,0) | 0,550 |
| Síndrome metabólico | 21 (47,7) | 26 (37,1) | 0,178 |
| Exposición tabáquica (año/paquete)a | |||
| Nunca | 33 (73,3) | 42 (57,5) | |
| <10 a/p | 1 (2,2) | 5 (6,8) | |
| 10-20 a/p | 6 (13,3) | 4 (5,5) | |
| >20 a/p | 5 (11,1) | 22 (30,1) | 0,034 |
| Fototipob | |||
| I | 13 (28,9) | 10 (13,7) | |
| II | 26 (57,8) | 51 (69,9) | |
| III | 6 (13,3) | 12 (16,4) | 0,129 |
| Fotoexposición | |||
| Leve | 17 (37,8) | 26 (35,6) | |
| Moderada | 17 (37,8) | 21 (28,8) | |
| Grave | 11 (24,4) | 26 (35,6) | 0,397 |
La tasa de crecimiento fue mayor en el grupo de CEC estadio T2 (p=0,114) (tabla 3). El resto de características clínicas y anatomopatológicas comparadas entre ambos grupos se muestran en las tablas 3 y 4.
Comparación de las características clínicas del tumor de los pacientes con CEC T1 vs T2
| T1Media±SDn (%) | T2Media±SDn (%) | Valor de p | |
|---|---|---|---|
| Localización | |||
| Pabellón auricular/labio | 5 (10,9) | 19 (26,0) | |
| Resto localizaciones | 41 (89,1) | 57 (74) | 0,003 |
| Tamaño (cm) | 1,06±0,39 | 2,10±2,06 | 0,001 |
| Tasa de crecimiento (mm*sem−1) | 0,94±1,24 | 1,32±1,24 | 0,114 |
| Tiempo de evolución (meses) | |||
| ≤2 | 17 (37,8) | 17 (23,3) | |
| 2,1-4 | 10 (22,2) | 20 (27,4) | |
| 4-11.9 | 7 (15,6) | 15 (20,5) | |
| ≥12 | 11 (24,4) | 21 (28,8) | 0,410 |
| Otras lesiones en el paciente | |||
| Ninguna | 14 (31,1) | 38 (52,1) | |
| Queratosis actínicas | 5 (11,1) | 9 (12,3) | |
| Carcinoma basocelular | 12 (26,7) | 4 (5,5) | |
| Carcinoma epidermoide | 1 (2,2) | 5 (6,8) | |
| Varios | 11 (24,4) | 15 (20,5) | |
| Dermatosis crónica* | 2 (4,4) | 2 (2,7) | 0,018 |
| Existencia de lesión previa al tumor | |||
| No | 37 (82,2) | 61 (83,6) | |
| Queratosis actínicas | 6 (13,3) | 11 (15,1) | |
| Dermatitis de estasis | 2 (4,4) | 0 | |
| Otras | 0 | 1 (1,4) | 0,270 |
Comparación de las características anatomopatológicas del tumor entre los pacientes con un CEC T1 vs T2
| T1Media±SDn (%) | T2Media±SDn (%) | Valor de p | |
|---|---|---|---|
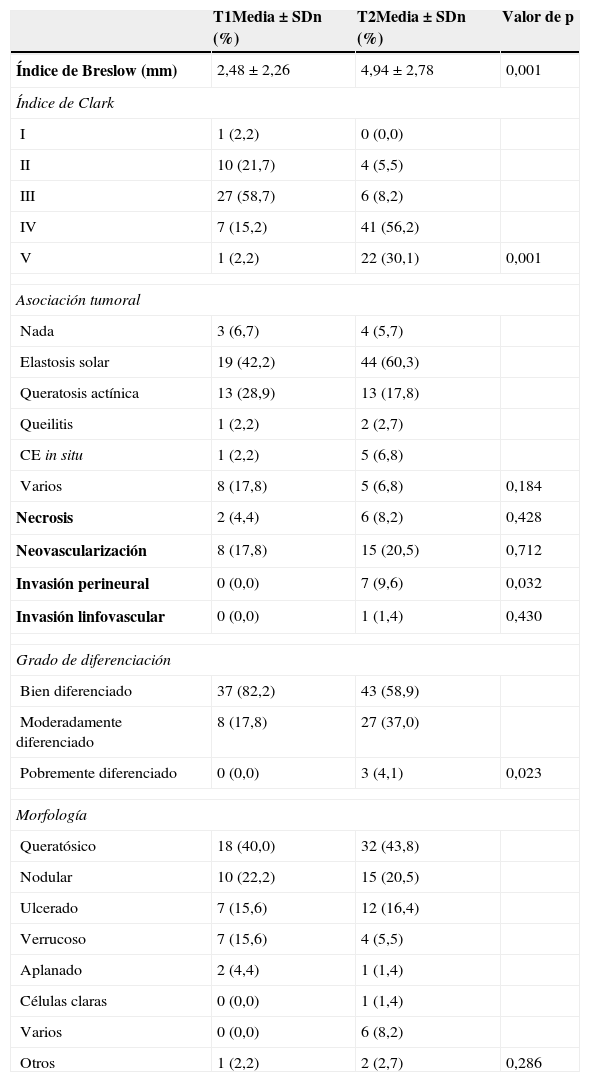
| Índice de Breslow (mm) | 2,48±2,26 | 4,94±2,78 | 0,001 |
| Índice de Clark | |||
| I | 1 (2,2) | 0 (0,0) | |
| II | 10 (21,7) | 4 (5,5) | |
| III | 27 (58,7) | 6 (8,2) | |
| IV | 7 (15,2) | 41 (56,2) | |
| V | 1 (2,2) | 22 (30,1) | 0,001 |
| Asociación tumoral | |||
| Nada | 3 (6,7) | 4 (5,7) | |
| Elastosis solar | 19 (42,2) | 44 (60,3) | |
| Queratosis actínica | 13 (28,9) | 13 (17,8) | |
| Queilitis | 1 (2,2) | 2 (2,7) | |
| CE in situ | 1 (2,2) | 5 (6,8) | |
| Varios | 8 (17,8) | 5 (6,8) | 0,184 |
| Necrosis | 2 (4,4) | 6 (8,2) | 0,428 |
| Neovascularización | 8 (17,8) | 15 (20,5) | 0,712 |
| Invasión perineural | 0 (0,0) | 7 (9,6) | 0,032 |
| Invasión linfovascular | 0 (0,0) | 1 (1,4) | 0,430 |
| Grado de diferenciación | |||
| Bien diferenciado | 37 (82,2) | 43 (58,9) | |
| Moderadamente diferenciado | 8 (17,8) | 27 (37,0) | |
| Pobremente diferenciado | 0 (0,0) | 3 (4,1) | 0,023 |
| Morfología | |||
| Queratósico | 18 (40,0) | 32 (43,8) | |
| Nodular | 10 (22,2) | 15 (20,5) | |
| Ulcerado | 7 (15,6) | 12 (16,4) | |
| Verrucoso | 7 (15,6) | 4 (5,5) | |
| Aplanado | 2 (4,4) | 1 (1,4) | |
| Células claras | 0 (0,0) | 1 (1,4) | |
| Varios | 0 (0,0) | 6 (8,2) | |
| Otros | 1 (2,2) | 2 (2,7) | 0,286 |
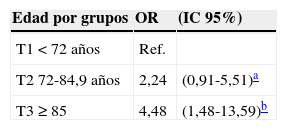
En el estudio de riesgos y multivariante destacamos los siguientes resultados (tablas 5 y 6): la edad elevada se asoció al desarrollo de CEC estadio T2; al dividir esta característica por terciles, según su distribución en la muestra poblacional estudiada, se observó que a mayor edad mayor era el riesgo de desarrollar la variante de peor pronóstico o T2 (tabla 5). En el grupo de mayor edad (≥85 años) el riesgo se cuadruplicó, siendo de 4,48 (IC 95%: 1,48-13,59).
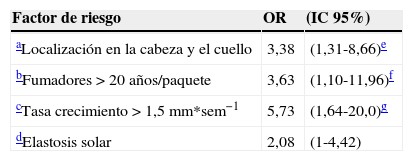
Odds ratio de desarrollar un CEC de peor pronóstico respecto a la localización, exposición tabáquica, tasa de crecimiento y presencia de elastosis solar, ajustada por edad, sexo, IMC y fotoexposición
La presencia de elastosis solar en el tejido peritumoral se asoció al CEC estadio T2 (OR: 2,08). La OR de presentar CEC estadio T2 fue 4,12 veces superior en la cabeza y el cuello que en el resto de localizaciones, y se confirmó superior (OR 3,38) ajustando por edad, sexo, IMC y fotoexposición (tabla 6). Para evitar sesgo de selección se calculó la OR ajustada por las mismas variables, pero eliminando los CEC de labio y pabellón auricular, manteniéndose la «localización en la cabeza y el cuello» como el factor de riesgo asociado a CEC de peor pronóstico (OR: 2,90; IC 95%: 1,12-7,49).
La mayor exposición tabáquica (>20 años/paquete) supuso un riesgo elevado (OR: 3,42) para desarrollar CEC estadio T2, y se mantuvo elevado al ajustar por edad y sexo (OR 3,63) (tabla 6). Igualmente, se calculó la OR ajustada eliminando aquellos CEC localizados en el labio inferior para evitar un sesgo de selección, ya que es conocido el consumo de tabaco como factor de riesgo para desarrollar CEC en la mucosa oral (OR: 4,04; IC 95%: 1,11-14,7).
La OR de desarrollar un CEC de peor pronóstico o estadio T2 en el grupo de mayor tasa de crecimiento era muy superior respecto al grupo de menor tasa de crecimiento (OR: 4,58), y se confirmó elevado al ajustar por edad y sexo (OR 5,73).
DiscusiónLa edad avanzada, la localización en la cabeza y el cuello, la velocidad de crecimiento elevada y la exposición tabáquica intensa fueron los factores de riesgo independientes que se asociaron a la presencia de CEC estadio T2, según los resultados obtenidos en el presente estudio.
La prevalencia de CEC que cumplía criterios de alto riesgo por la AJCC en la última edición de su manual12,13 fue del 61,9%. En el estudio publicado por Chu et al.17, donde incluyeron 257 CEC del Departamento de Dermatología del Centro Médico Universitario de Sant Louis (EE. UU.) y los analizaron según los criterios de la AJCC en la 7.ª edición de su manual, obtuvieron que tan solo el 13,9% pertenecían al estadio T2, cifra muy inferior a la nuestra.
Un hallazgo que no hemos podido comparar con ningún estudio similar previo es la asociación de elastosis solar en el tejido peritumoral a las características que implican un peor pronóstico del CEC, aunque sí lo hay sobre melanoma18. En nuestro estudio la presencia de esta característica se asoció al CEC estadio T2. No obstante, el grado o intensidad de la elastosis solar no fue establecido, al no estar especificado en el protocolo anatomo-patológico, por lo que no hemos podido correlacionarlo con otras variables clínicas como la intensidad de la fotoexposición o la localización19.
La edad avanzada se asoció al desarrollo de un CEC estadio T2, siendo la edad media de este grupo en torno a 79 años, y la del grupo de CEC de bajo riesgo o T1 de 74 años. De hecho, al estratificar nuestros pacientes en 3 grupos de edad, observamos que en el de mayor edad (mayor o igual a 85 años), el riesgo de asociarse a un CEC estadio T2 se cuadruplicó respecto al de menor edad (menos de 72 años). Este hecho se explicaría porque si consideramos la edad avanzada como un estado de inmunosupresión del paciente, es normal que a mayor edad más probabilidades tengan de presentar un tumor más agresivo, porque la inmunosupresión es mayor, según afirman también Corbalán-Vélez et al.19.
La localización del CEC a la hora de considerarlo variante de alto riesgo también es tema de debate actualmente, ya que la AJCC considera solo el labio y el pabellón auricular y otros comités de expertos el resto de regiones cefálicas y el cuello20. De hecho, son múltiples las publicaciones que se centran solo en el carcinoma epidermoide de cabeza y cuello para lograr datos de pronóstico y supervivencia de este tipo de tumor21–26. En nuestro estudio, el CEC estadio T2 se asoció fuertemente a la localización del tumor en la cabeza y el cuello, incluso considerando posibles factores confusionales en el estudio multivariante (por ejemplo, la localización en el labio y el pabellón auricular).
El grupo de mayor velocidad de crecimiento (tasa de crecimiento mayor a 1,5 mm*sem−1) quintuplicó el riesgo de asociación al CEC estadio T2. Este dato se correspondió con el que comunicaron Martorell et al.27 en el 42.° Congreso Nacional de Dermatología y Venereología; ellos realizaron un estudio donde observaron que aquellos CEC que presentaban una tasa de crecimiento mayor a 5mm/mes se asociaban a la variante de alto riesgo. Ambos resultados son muy similares, ya que en nuestro estudio se asoció a partir de una tasa de crecimiento de 6mm/mes, con la diferencia de que nosotros hemos considerado otras características que se asocian a esta variante de alto riesgo.
Otro hecho que hemos constatado es que el hábito tabáquico se asocia a la presencia de CEC de alto riesgo. Clásicamente, el tabaquismo se ha relacionado con una mayor incidencia de CEC, como ya se explicó en la introducción; no obstante, en los últimos años ha habido varias publicaciones de estudios de cohortes28,29 en las que no encontraron asociación entre el consumo de tabaco (considerando también intensidad, duración y tipo de tabaco) y la aparición de CEC. En nuestro estudio la presencia de CEC T2 se asoció al grupo de pacientes con una mayor intensidad tabáquica (consumo de más de 20 años/paquete), confirmándose mediante análisis multivariante.
En cuanto a otros factores que definen el perfil del paciente que presenta un CEC de alto riesgo, no encontramos relación ni con la intensidad de la fotoexposición, el sexo ni con el fototipo del paciente, así como tampoco con la presencia de otras comorbilidades como hipertensión arterial, diabetes mellitus, dislipidemia ni síndrome metabólico, lo cual nos indicaría que estas características no influirían en el desarrollo de un CEC de peor pronóstico.
Dado el importante problema de salud pública que representa el CEC, por su elevada prevalencia y comorbilidad, es imprescindible detectar qué pacientes presentan un tumor previsiblemente más agresivo, ya que su manejo debe ser optimizado y su seguimiento realizarse de forma más estrecha. De momento, son pocos los estudios que, como el que acabamos de desarrollar, intentan definir las características y los factores de riesgo asociados a esta variante tumoral con comportamiento más agresivo.
Las limitaciones de nuestro estudio son las inherentes a un estudio observacional analítico: la medición de las exposiciones y eventos en los sujetos de estudio en un momento determinado, y que algunas de estas exposiciones sean facilitadas y medidas por el propio paciente (hábito tabáquico, fotoexposición, momento en que advirtieron la lesión), con el consecuente grado de subjetividad que implica.
Debido a la elevada prevalencia obtenida de CEC que cumple criterios de «alto riesgo» según la AJCC, nos planteamos si los parámetros que la definen pudieran considerarse «muy amplios» para determinar un peor pronóstico tumoral. Por ello, pensamos que son necesarias líneas de investigación futuras orientadas a definir qué características son las que mejor definen un CEC de alto riesgo, así como estudios de cohortes que expresen datos de supervivencia y capacidad de metástasis a medio-largo plazo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.