Los corticoides pueden producir reacciones de hipersensibilidad, sobre todo retardadas. Se ha propuesto una nueva clasificación para el estudio de la alergia a corticoides que los divide en 3 grupos según su estructura molecular y establece 2 perfiles de pacientes según estén sensibilizados a uno o varios grupos. Los objetivos de este estudio son describir las características clínicas de nuestros pacientes alérgicos a corticoides, compararlas con las del resto de la población estudiada y analizar su distribución según la nueva clasificación.
Material y métodosEstudio retrospectivo de 11 años que incluye los casos de pacientes con reacciones de hipersensibilidad retardada a corticoides en la Unidad de Alergia Cutánea del Servicio de Dermatología de un hospital terciario.
ResultadosEstudiamos a 2.857 pacientes, de los cuales 33 presentaron uno o más parches positivos a los corticoides. Estos pacientes presentaron menos dermatitis atópica y menor afectación de las manos. Todos fueron alérgicos a algún corticoide del grupo 1 y la budesonida fue el más frecuente (87,9%). Con la batería específica de corticoides observamos que 14 (42,4%) eran, además, alérgicos a corticoides del grupo 2 o 3. Ninguno fue alérgico solo a corticoides del grupo 2 o 3. El 61,9% (13/21) de los pacientes que fueron testados con cremas con un corticoide del grupo al cual era alérgicos no presentó reacción a aquellas.
ConclusionesLa batería estándar española tiene solo marcadores para la alergia a corticoides del grupo 1. Recomendamos aplicar una batería específica de corticoides y los fármacos propios si los marcadores son positivos para poder clasificarlos mejor y adecuar su manejo terapéutico.
Corticosteroids can cause hypersensitivity reactions, particularly delayed-type allergic reactions. A new classification system for testing hypersensitivity to corticosteroids distributes the drugs into 3 groups according to molecular structure; patients are classified according to whether they are allergic to agents in 1 or more of the groups. We aimed to describe the clinical characteristics of corticosteroid-allergic patients treated at our clinic and apply the new classification system to them; we also compared these patients’ characteristics to those of others treated at our clinic.
Material and methodsRetrospective study of cases of delayed-type corticosteroid hypersensitivity treated in the skin allergy clinic of a tertiary level hospital over an 11-year period.
ResultsWe reviewed the records of 2857 patients, finding 33 with at least one positive patch test result showing corticosteroid hypersensitivity. Atopic dermatitis and hand involvement were less common in our corticosteroid-allergic patients. All were allergic to a group 1 corticosteroid (most often, budesonide, the culprit in 87.9%). Testing with a specific corticosteroid series revealed that 14 (42.4%) were also allergic to corticosteroids in group 2 and/or group 3. None were allergic exclusively to group 2 or group 3 agents. Twenty-one patients were exposed to a corticosteroid cream from a group their patch test results indicated allergy to; 13 of them (61.9%) did not develop a hypersensitivity reaction.
ConclusionsThe Spanish standard series only contains group 1 corticosteroids. In the interest of improving allergy management, we recommend testing with a specific corticosteroid series and a patient's own creams whenever patch testing with a standard series reveals a hypersensitivity reaction to corticosteroids.
Los corticoides son fármacos ampliamente utilizados en dermatología. Se introdujeron como fármacos tópicos en 19521 y, aunque son muy eficaces, no son infrecuentes sus efectos adversos asociados. A pesar de sus propiedades antiinflamatorias e inmunomoduladoras, los corticoides también pueden comportarse paradójicamente como alérgenos, dando lugar sobre todo a reacciones de hipersensibilidad retardada2–6.
La dermatitis alérgica de contacto por corticoides se diagnostica cada vez con mayor frecuencia y su prevalencia varía entre un 0,2 y un 5%. Se ha intentado clasificar los corticoides en grupos para poder encuadrar mejor la sensibilización a estas sustancias. Clásicamente los corticoides se clasificaron en 1989 en 4 grupos A, B, C y D7, este último dividido posteriormente en el año 2000 en 2: D1 y D28 en función de su estructura y patrones de reacción cruzada. Los que tenían mayor poder sensibilizante se encontraban en el grupo A y en el D2. Posteriormente se observó que en ocasiones las reacciones cruzadas no eran las predecibles ni tampoco las esperadas según la clasificación, por lo que fue modificada. En 2009 Baeck et al. estudiaron los modelos moleculares de los corticoides y las pruebas epicutáneas de 315 pacientes sensibilizados a corticoides9, y en 2011 propusieron una nueva clasificación más simplificada que divide los corticoides en 3 grupos10,11 (tabla 1). En el grupo 1 se encuentran los que producen reacciones alérgicas con más frecuencia y en el grupo 3 los de menor poder sensibilizante y los que producen menos reacciones cruzadas12. Además, estos autores dividen a los pacientes en 2 perfiles según la sensibilización a uno o a varios grupos, de forma que los pacientes del perfil 1 solo reaccionan ante un único grupo y los del perfil 2 ante varios grupos.
Clasificación de corticoides según Baeck et al.10
| Grupo 1 | Grupo 2 | Grupo 3 |
|---|---|---|
| Moléculas no metiladas ni halogenadas | Moléculas halogenadas (excepto *) con estructura cis-ketal o diol en C16/C17 | Moléculas halogenadas y metiladas en C16 |
| Corresponden a budesonida+grupo A+grupo D2 de la clasificación de Coopman et al. | Corresponden al grupo B de la clasificación de Coopman et al. | Corresponden al grupo C+Grupo D1 de la clasificación de Coopman et al. |
| BudesonidaCloprednolAcetato de cortisonaAcetato de diclorisonaDipluprednatoAcetato de fludrocortisonaFluorometolonaAcetato de fluprednisolonaHidrocortisonaHidrocortisona aceponatoAcetato de hidrocortisona17-butirato de hidrocortisona21-butirato de hidrocortisonaHidrocortisona hemisuccinatoAcetato de isofluprednonaMazipredonaMedrisonaAcetato de metilprednisolonaAceponato de metilprednisolonaMetilprednisolona hemisuccinatoPrednicarbatoPrednisolonaCaproato de prednisolonaPivalato de prednisolonaPrednisolona sodio metasulfobenzoatoSuccinato de prednisolonaPrednisonaPivalato de tixocortol | TriamcinolonaAmcinonidaDesonida*FlucoronidaFlumoxonidaFlunisolidaAcetónido de fluocinolonaFluocinonidaHalcinonida*Acetónido de triamcinolonaBenetónido de triamcinolonaDiacetato de triamcinolonaHexacetónido de triamcinolona | Dipropionato de alclometasonaDipropionato de beclometasonaBetametasona17-valerato de betametasonaDipropionato de betametasonaBetametasona sodio fosfatoPropionato de clobetasolClobetasona butiratoDesoximetasonaDexametasonaAcetato de dexametasonaDexametasona sodio fosfatoValerato de diflucortolonaDiacetato de diflorasonaPivalato de flumetasonaFluocortina butiloFluocortolonaCaprilato de fluocortolonaPivalato de fluocortolonaAcetato de fluocortolonaAcetato de fluprednideneHalometasonaMeprednisonaPropionato de fluticasonaFuroato de mometasona |
El objetivo principal de este estudio es analizar las características clínicas y demográficas de los pacientes sensibilizados a corticoides estudiados en la consulta de alergia cutánea de nuestro Servicio de Dermatología durante los últimos 11 años. Los objetivos secundarios son: comparar estas características con las del resto de la población estudiada y distribuir a estos pacientes según la nueva clasificación.
Material y métodosDiseño del estudioEl estudio se ha realizado en la Unidad de Alergia Cutánea del Servicio de Dermatología del Hospital General Universitario de Alicante. Se trata de un estudio retrospectivo en el que se revisan todos los casos de pacientes con reacciones de hipersensibilidad retardada a corticoides, diagnosticados desde enero de 2004 hasta diciembre de 2014.
Población estudiadaSe ha incluido a todos los pacientes estudiados con pruebas epicutáneas que han presentado una sensibilización a algún corticoide. Los datos clínicos recogidos de cada uno de los pacientes fueron los siguientes: edad y sexo, profesión, existencia de antecedentes de atopia y localización de las lesiones cutáneas que motivaron la consulta y utilización posterior de corticoides. Los resultados recogidos de la realización de las pruebas epicutáneas fueron: positividad a corticoides, a cremas comerciales propias y la cosensibilización a otros alérgenos. Comparamos los datos clínicos de estos pacientes con los del resto de los pacientes a los que les hemos realizado pruebas epicutáneas durante este periodo de tiempo mediante la utilización del índice MOALHFA. Los datos han sido extraídos de la base de datos informatizada de dicha consulta.
Método y lectura de las pruebas epicutáneasTodos los pacientes fueron parcheados con la batería estándar del Grupo Español para la Investigación de la Dermatitis de Contacto y Alergia Cutánea (GEIDAC) que incluye la budesonida y el tixocortol-21-pivalato como marcadores de alergia a corticoides. Además, los pacientes estudiados a partir de octubre de 2008 (un total de 20) también fueron parcheados con 17-butirato de hidrocortisona. La budesonida se aplicó al 0,01% en vaselina, el tixocortol-21-pivalato al 0,1% en vaselina y la 17-butirato de hidrocortisona al 1% en alcohol, todos ellos suministrados por Chemotechnique Diagnostics AB (Malmo, Suecia). Aquellos pacientes que presentaron una positividad a alguno de estos marcadores fueron estudiados con una batería específica de corticoides Chemotechnique Diagnostics AB (Malmo, Suecia), que incluye además de los corticoides de nuestra batería estándar: acetónido de triamcinolona (1,0% vaselina), dexametasona-21-fosfato (1,0% vaselina), clobetasol-17-propionato (1,0% vaselina), betametasona-17-valerato (1,0% vaselina) y alclometasona-17-21-dipropionato (1,0% vaselina). Muchos pacientes fueron testados con cremas comerciales con corticoides que ellos mismos aportaban o que teníamos en nuestra consulta. Los parches fueron preparados sobre tiras adhesivas Finn-Chamber (fabricado por SmartPractice, Phoenix, Estados Unidos y permanecieron adheridos a la piel de la espalda durante 48 h. La lectura de los resultados se realizó a las 48 y a las 96 h, y a los 7 días, siguiendo los criterios de valoración (+, ++ y +++) recomendados por la International Contact Dermatitis Research Group (ICDRG).
Análisis estadísticoEl procesamiento de los datos se realizó con el programa estadístico SPSS. Para el análisis de las variables cualitativas se utilizó el test estadístico de chi-cuadrado y el test exacto de Fisher cuando no se cumplieron las condiciones para aplicar el test anterior. En la interpretación de la prueba se consideró que las diferencias fueron estadísticamente significativas cuando el valor de «p» fue igual o inferior a 0,05. Finalmente se realizó el análisis e interpretación de los resultados y la comparación con los obtenidos en estudios similares.
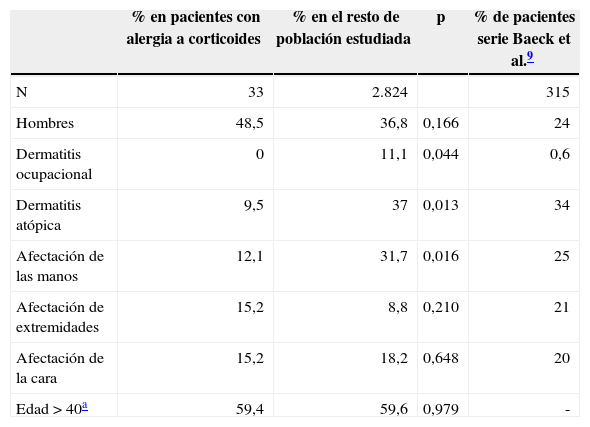
ResultadosCaracterísticas clínicas de los pacientes sensibilizados a corticoides y comparación con los datos de la población total estudiada y con los datos de la serie de Baeck et al.9Se realizaron pruebas epicutáneas a 2.857 pacientes, de los cuales 33 presentaron positividad para uno o más corticoides. Esto supone una prevalencia de sensibilización a los corticoides del 1,16%. Las características clínicas y demográficas de estos pacientes, las del resto de la población estudiada y la de los pacientes de la serie de Baeck et al.9 queda reflejada en la tabla 2. Destaca que la afectación de las manos fue menos frecuente en los pacientes alérgicos a corticoides que en el resto de la población estudiada, y que hasta un 21,2% (7/33) de estos pacientes presentaron un eccema generalizado. No se detectó ningún caso profesional en los pacientes alérgicos a corticoides. Llama la atención que tan solo el 9,5% de los pacientes con alergia a corticoides padezca una dermatitis atópica de base, lo cual contrasta con el 37% encontrado en el resto de la población estudiada.
Características clínicas y demográficas de los pacientes sensibilizados a corticoides de nuestra serie, las del resto de la población estudiada con pruebas epicutáneas en nuestro servicio y la de los pacientes de la serie de Baeck et al.9 mediante el índice MOAHLFA
| % en pacientes con alergia a corticoides | % en el resto de población estudiada | p | % de pacientes serie Baeck et al.9 | |
|---|---|---|---|---|
| N | 33 | 2.824 | 315 | |
| Hombres | 48,5 | 36,8 | 0,166 | 24 |
| Dermatitis ocupacional | 0 | 11,1 | 0,044 | 0,6 |
| Dermatitis atópica | 9,5 | 37 | 0,013 | 34 |
| Afectación de las manos | 12,1 | 31,7 | 0,016 | 25 |
| Afectación de extremidades | 15,2 | 8,8 | 0,210 | 21 |
| Afectación de la cara | 15,2 | 18,2 | 0,648 | 20 |
| Edad >40a | 59,4 | 59,6 | 0,979 | - |
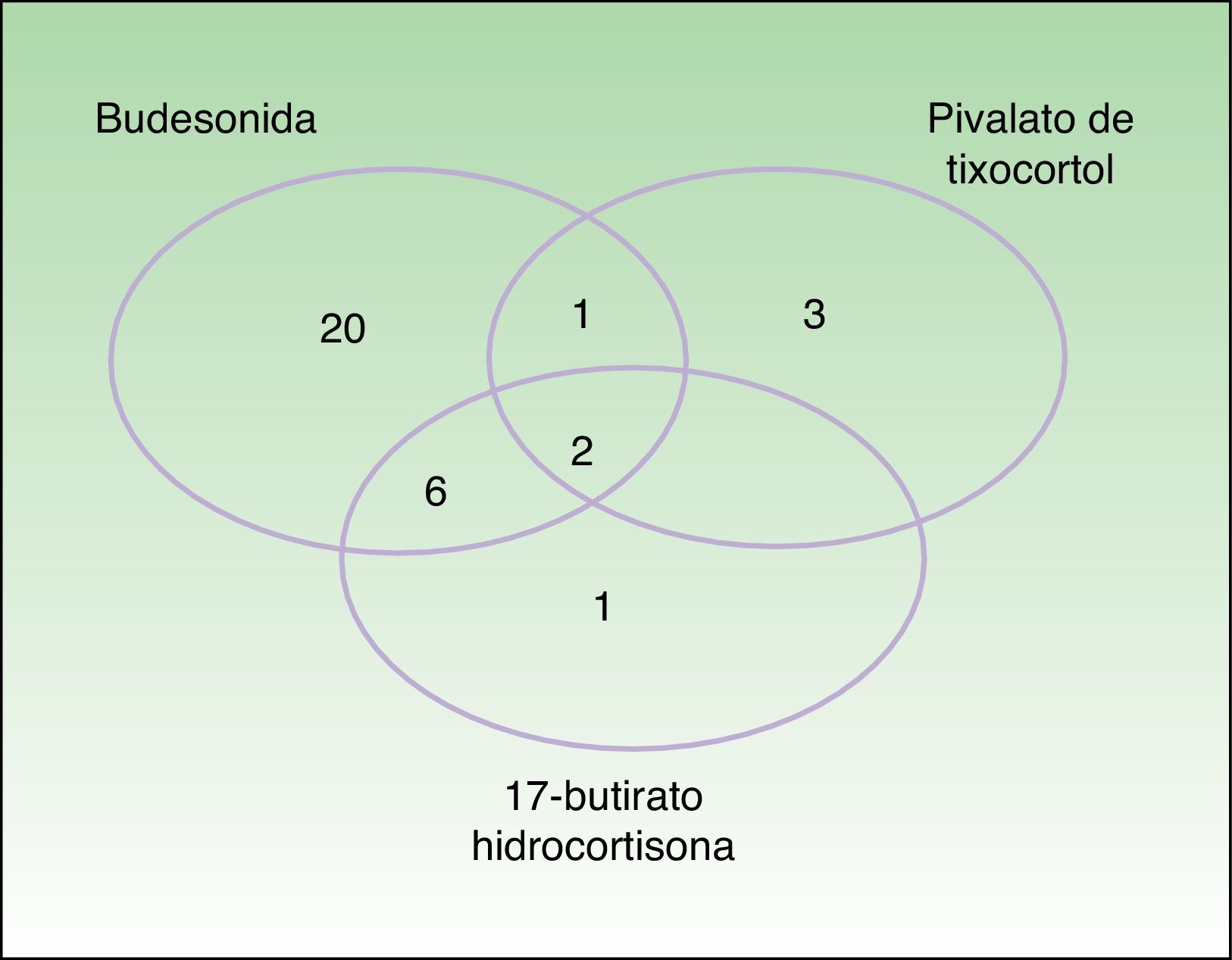
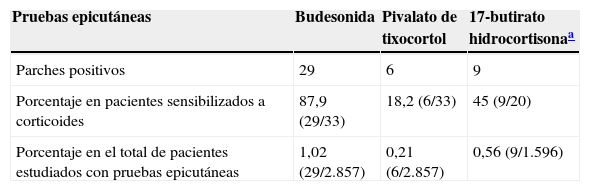
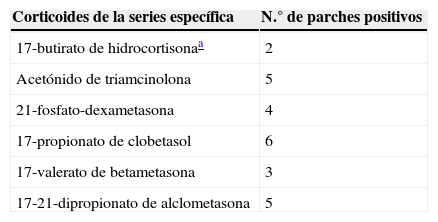
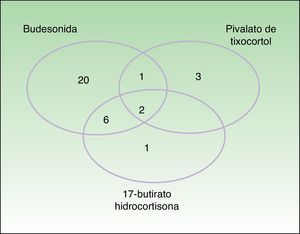
Los marcadores de la alergia a corticoides de nuestra batería estándar fueron positivos en 33 pacientes. La prevalencia de la alergia a budesonida fue del 87,9% (29/33), la del pivalato de tixocortol del 18,2% (6/33) y la de la 17-butirato hidrocortisona del 45% (9/20) (tabla 3). La distribución de positividades a los distintos corticoides de la batería estándar queda reflejada en la figura 1. Destaca que tan solo 4 pacientes presentaron negatividad para la budesonida, 3 de ellos fueron detectados por el pivalato de tixocortol y uno con la 17-butirato hidrocortisona. Los resultados de la batería específica de corticoides quedan representados en la tabla 4. La batería específica permitió detectar 14 pacientes que además de ser alérgicos a corticoides del grupo 1 también lo eran a corticoides de los grupos 2 o 3, pero llama la atención que no hubo ningún paciente alérgico solo a corticoides del grupo 2 o del 3. La distribución de los pacientes de acuerdo con la nueva clasificación de Baeck et al.10 queda reflejada en la figura 2.
Frecuencia de positividad de los marcadores de alergia a corticoides de la batería estándar
| Pruebas epicutáneas | Budesonida | Pivalato de tixocortol | 17-butirato hidrocortisonaa |
|---|---|---|---|
| Parches positivos | 29 | 6 | 9 |
| Porcentaje en pacientes sensibilizados a corticoides | 87,9 (29/33) | 18,2 (6/33) | 45 (9/20) |
| Porcentaje en el total de pacientes estudiados con pruebas epicutáneas | 1,02 (29/2.857) | 0,21 (6/2.857) | 0,56 (9/1.596) |
Frecuencia de positividad de los corticoides estudiados en la serie específica en los pacientes con dermatitis alérgica de contacto a corticoides de nuestra serie
| Corticoides de la series específica | N.° de parches positivos |
|---|---|
| 17-butirato de hidrocortisonaa | 2 |
| Acetónido de triamcinolona | 5 |
| 21-fosfato-dexametasona | 4 |
| 17-propionato de clobetasol | 6 |
| 17-valerato de betametasona | 3 |
| 17-21-dipropionato de alclometasona | 5 |
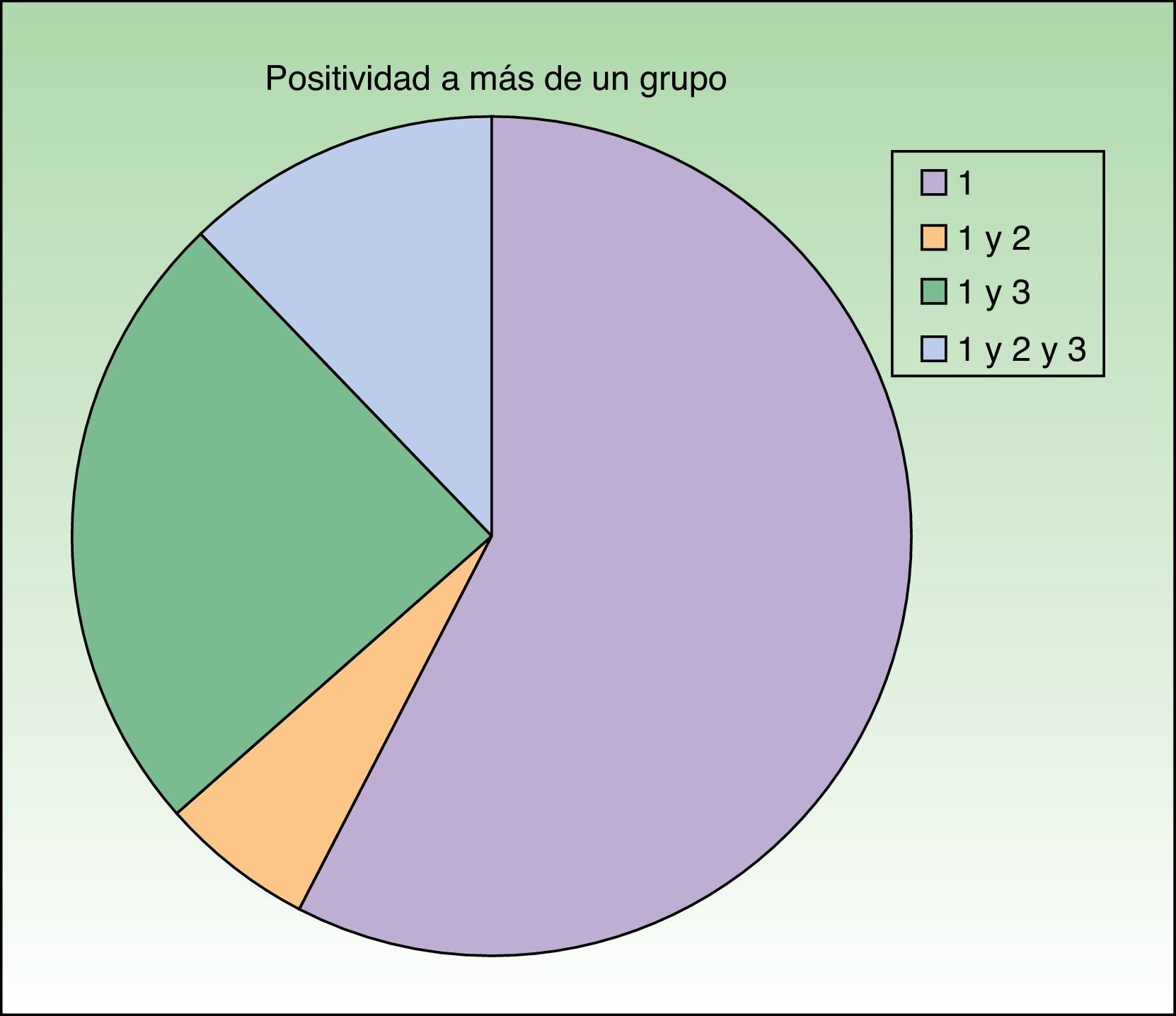
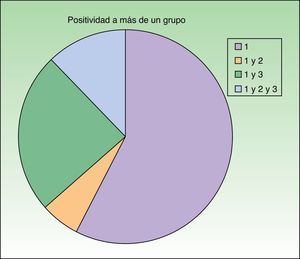
Distribución de los pacientes de acuerdo con la nueva clasificación de Baeck et al.10 Todos los pacientes presentaron sensibilización al grupo 1. El 57,6% (19) presentó positividad para el grupo 1 de forma aislada y el 42,4% (14) positividad para más de un grupo con la siguiente distribución: el 6,1% (2) para los grupos 1 y 2, el 24,2% (8) para los grupos 1 y 3 y el 12,1% (4) para los grupos 1, 2 y 3.
Realizamos pruebas epicutáneas con cremas comerciales de corticoides en 21/33 (63,6%), pero, en el 61,9% de ellos (13/21), no encontramos reacción tras testar una crema que contenía un corticoide del grupo al cual el paciente era alérgico. Por la historia clínica pudimos comprobar que tras el diagnóstico de alergia a corticoides a 5 pacientes, se les había prescrito un corticoide tópico del mismo grupo al cual estaban sensibilizados sin presentar reacción, y que, en otros 5 pacientes que habían tomado prednisona oral, tampoco se registró ninguna reacción. Tan solo un paciente que era alérgico a corticoides de los 3 grupos presentó una reacción generalizada tras la aplicación de acetónido de triamcinolona intralesional para un pólipo nasal, mientras que no se observó reacción tras la inhalación de acetónido de fluocinolona.
Respecto a la cosensibilización con otros alérgenos, 30 pacientes (90,9%) presentaron reacciones positivas a otros alérgenos. Resaltamos que 8 (24,2%) fueron alérgicos a fragancias, tasa superior a la del resto de población estudiada cuya sensibilización a fragancias fue del 8,3%. También destaca que 6 pacientes (18,2%) presentaron cosensibilización con el dihidrocloruro de etilendiamina y 3 (9,1%) con la neomicina.
DiscusiónLa prevalencia de sensibilización a los corticoides que hemos encontrado en nuestro trabajo (1,16%) es similar a la de otras series españolas13–15, entre ellas un estudio similar en nuestro hospital que se llevó a cabo entre los años 2004 y 2007. Sin embargo, estos porcentajes de sensibilización son menores que en otros trabajos realizados en Europa (2,6%)16, en Estados Unidos (4,6%)17 y en Asia (3,29%)18. Esto puede deberse a que en Europa utilizamos concentraciones más bajas de corticoides para las pruebas epicutáneas. También es posible que en España utilicemos los corticoides con menor poder sensibilizante, realicemos un tratamiento más precoz o pautemos tratamientos menos prolongados que en el resto de Europa.
La población que padece una alergia a corticoides presenta unos rasgos demográficos particulares. Así, en nuestra serie no hemos encontrado un porcentaje tan alto de mujeres si lo comparamos con el resto de la población estudiada con pruebas epicutáneas, aunque las diferencias no son estadísticamente significativas; ni tampoco un porcentaje tan alto de mujeres como en otras series (51,8 respecto al 76%)9. Nos ha sorprendido el bajo porcentaje de pacientes con dermatitis atópica afectos, dado que estos pacientes se aplican corticoides tópicos en la piel y usan aerosoles con corticoides con mayor frecuencia. Esto no coincide con la serie de Baeck, mucho mayor, en la que el 34% de los pacientes eran atópicos9 por lo que no está claro si la atopia es un factor de riesgo para desarrollar alergia a corticoides. La distribución por áreas corporales afectas también es particular, pues suele presentarse de una forma generalizada o difusa con una afectación preferencial del tronco y su presentación como eccema de manos es mucho menos frecuente que en el resto de la población estudiada mediante pruebas epicutáneas. No tenemos explicación para este hecho, pues los eccemas de manos tienden a la cronicidad y al uso continuado de corticoides; es posible que sea debido a que se utilizan corticoides de alta potencia (17-propionato de clobetasol, fuorato de mometasona) que pertenecen a los grupos 2 y 3. No hemos registrado ningún caso profesional, dato que era de esperar dada la excepcionalidad de esta condición reflejada en la literatura19.
En la batería estándar del GEIDAC solo están presentes la budesonida y el pivalato de tixocortol y no forma parte de ella el 17-butirato de hidrocortisona. En nuestra serie llama la atención que la mayoría de nuestros pacientes alérgicos a corticoides han sido detectados con la budesonida, lo cual coincide con los datos previos existentes en la literatura de series españolas13–15. Sin embargo, en Estados Unidos el más frecuente es el tixocortol20, mientras que en Europa la budesonida, el tixocortol y el 17-butirato de hidrocortisona parecen tener tasas de sensibilización similares21. Pensamos que estas diferencias se deben a factores como el hábito de prescripción de cada país y a las pruebas utilizadas para el diagnóstico (en la batería estándar americana la budesonida y el tixocortol se parchean a mayor concentración, al 0,1 y 1% respectivamente). Respecto a la utilidad de estas sustancias como marcadores de alergia a corticoides, se estima que la budesonida junto con el tixocortol llega a detectar al 90% de los pacientes alérgicos a corticoides22. Creemos que no sería necesario añadir 17-butirato de hidrocortisona a la batería estándar del GEIDAC. No hemos detectado alergia a corticoides de los grupos 2 o 3 de forma aislada, debido a que todos los marcadores de la batería estándar pertenecen al grupo 1. Pensamos que deberíamos añadir temporalmente a la batería estándar corticoides de estos 2 últimos grupos para poder conocer la prevalencia de la alergia a los corticoides incluidos en ellos.
El estudio con la serie específica de corticoides y cremas comerciales ha sido de gran utilidad porque ha permitido detectar a 14 pacientes con sensibilización a los grupos 2 o 3 (fig. 3). Creemos que lo más conveniente sería contar con una batería específica cuyo contenido reflejara el uso de corticoides de cada país. Recomendamos la realización de pruebas epicutáneas con las cremas comerciales con corticoides propias del paciente porque ayudan a elegir los corticoides que va a poder utilizar. No es raro observar que el paciente tolera corticoides pertenecientes a un grupo al que en teoría es alérgico. Por ello, aunque la clasificación reciente de Baeck et al.10 ha permitido reclasificar mejor los corticoides según se estructura química y a los pacientes según su alergia a corticoides de un solo grupo o de varios, no es ideal, ya que gran parte de los pacientes posteriormente no presenta reacciones tras la utilización de corticoides tópicos del grupo al cual están sensibilizados y tampoco parece ser útil para recomendar la utilización de corticoides inhalados o por vía sistémica.
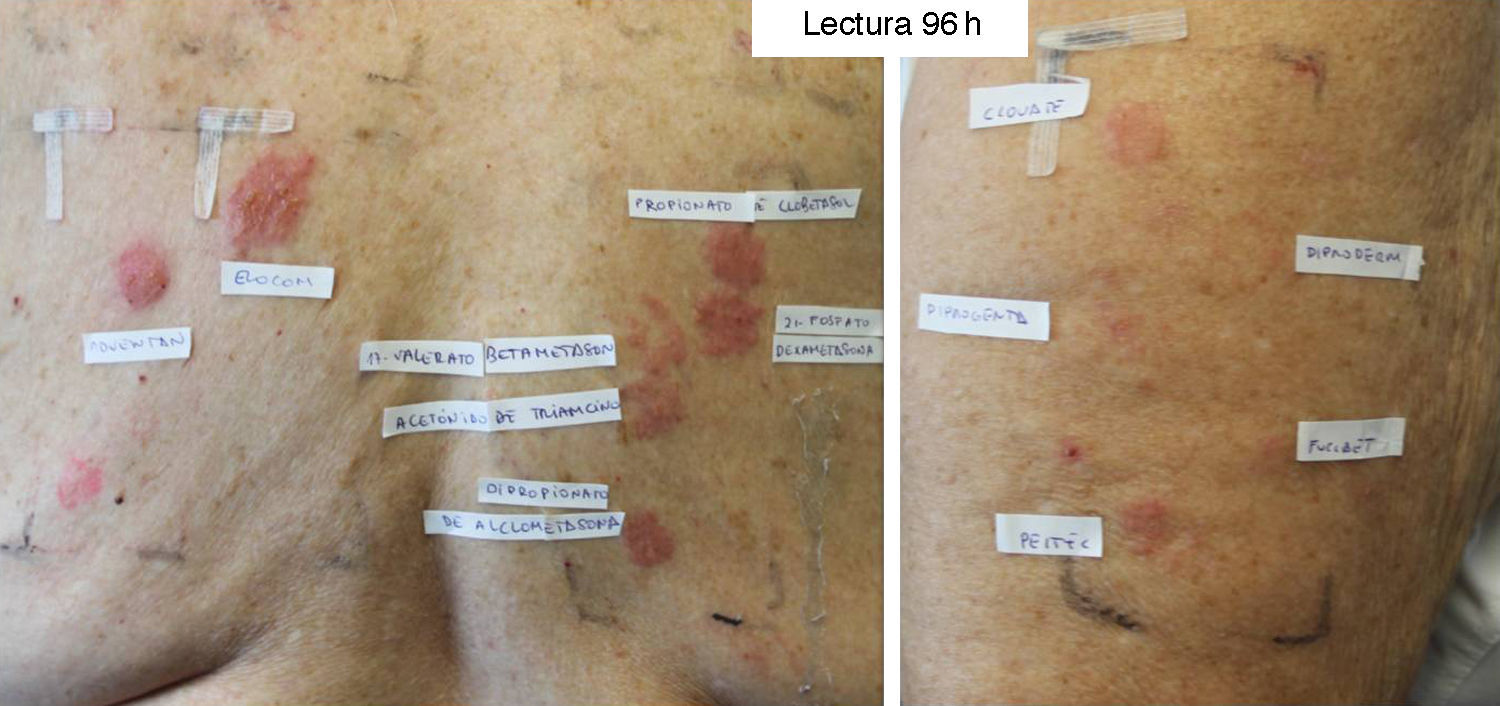
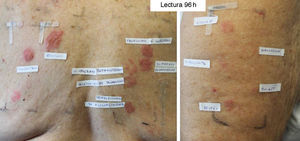
Paciente con diagnóstico de Hailey-Hailey sensibilizada a los 3 grupos de corticoides. Con la batería estándar se detectó positividad para la budesonida, el pivalato de tixocortol y la 17-butirato-hidrocortisona. Lectura a las 96h con corticoides propios: adventan® +++, elocom® +++, clovate® ++, diproderm®+ diprogenta®+ fucibet®+ peitel® ++ y con batería de corticoides: propionato de clobetasol +++, 21-fosfato-dexametasona +++, 17-valerato-betametasona++, acetónido de triamcinolona ++, dipropionato de alclometasona ++.
La existencia de cosensibilización o sensibilización a múltiples alérgenos en los pacientes alérgicos a corticoides es bien conocida. Los alérgenos que clásicamente han sido implicados son el sulfato de neomicina y el dihidrocloruro de etilendiamina y ha sido atribuida a la presencia de todos estos alérgenos en una misma crema farmacéutica. En nuestra serie llama la atención el alto porcentaje de cosensibilización con las fragancias. No sabemos si esta consensibilización es debida a la presencia de fragancias en los tratamientos tópicos o a la utilización de productos perfumados por los pacientes con eccema crónico.
ConclusionesLa dermatitis alérgica de contacto a corticoides supone una importante restricción para el paciente y un reto diagnóstico y terapéutico para el dermatólogo. Actualmente contamos con 2 buenos marcadores en la batería estándar del GEIDAC para detectar la alergia a corticoides del grupo 1. Sin embargo, es probable que no sean de utilidad para detectar la alergia a los corticoides de otros grupos, por lo que deberíamos introducir, al menos temporalmente, en nuestra batería estándar algún representante de los grupos 2 y 3. Testar la batería específica de corticoides y los productos propios en aquellos pacientes que presentan positividad a alguno de los marcadores de la batería estándar es altamente recomendable, pues nos ayudará a conocer el perfil de sensibilidad del paciente. No obstante, existen muchas incongruencias entre los resultados encontrados en las pruebas epicutáneas y la tolerancia de estos pacientes a las distintas cremas comerciales con corticoides en la vida real, por lo que su manejo terapéutico es muy complicado y es difícil establecer recomendaciones. Por el momento, parece prudente aconsejar a los pacientes alérgicos a corticoides que eviten todos los corticoides del grupo al cual son alérgicos. Además, sería conveniente parchear o hacer una prueba de uso con los probables candidatos a utilizar. Otra alternativa sería utilizar los inhibidores de la calcineurina, y reservar los corticoides como último escalón terapéutico. El uso de corticoides orales también debería ser restringido, sobre todo en los pacientes sensibilizados a corticoides de varios grupos, aunque la mayoría de nuestros pacientes no han presentado problemas tras su uso.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al Dr. Sánchez (Servicio de Medicina Preventiva del Hospital General Universitario de Alicante) por la ayuda en el estudio estadístico.