Los «nidos seudomelanocíticos», más comúnmente conocidos como «seudonidos», aparecen descritos en la literatura como una trampa diagnóstica para los patólogos1. Son nidos que se tiñen con algunos marcadores melanocíticos, pero cuyo estudio detenido muestra una falta de correspondencia entre la etiología melanocítica y el cuadro clínico e inmunohistoquímico posterior. Los seudonidos ha sido descritos en lesiones que finalmente se diagnosticaron como lupus eritematoso discoide, reacciones fototóxicas liquenoides, liquen plano pigmentoso, exantema fijo medicamentoso y liquen plano1–4. Constituyen una trampa diagnóstica cuando se confunden con un proceso melanocítico, en especial cuando se utiliza una única tinción, tal y como sucede con el antígeno de melanoma reconocido por células T1 (MART-1), o con otras tinciones relacionadas como la Melan-A2. La literatura advierte que la positividad de MART-1/Melan-A puede ser engañosa, ya que el antígeno citoplasmático de MART-1/Melan-A localizado en el melanosoma puede transferirse entre las células durante la inflamación1,3,5.
Presentamos el caso de un paciente diagnosticado tras la biopsia inicial de melanoma maligno in situ (MMIS) con marcada regresión que, tras una biopsia posterior, y la correlación con la clínica cutánea que presentaba, resultó más congruente con un liquen estriado.
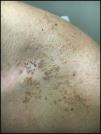
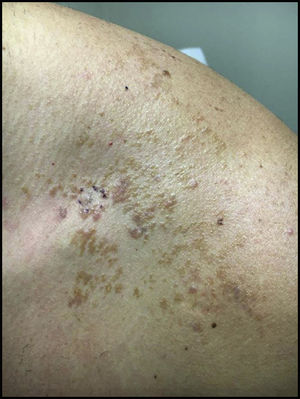
Caso clínicoUn varón de 32 años con una lesión que había sufrido cambios, situada en cara anterior del hombro. Se realizó una biopsia para hacer el diagnóstico diferencial entre una lesión melanocítica atípica frente a un nevo de Becker (fig. 1).
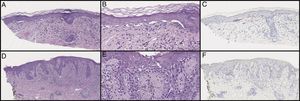
El examen histológico inicial mostró células aisladas y atípicas en la unión dermoepidérmica (fig. 2). Con MART-1 se evidenciaron algunos agregados celulares (fig. 2). Las células lentiginosas atípicas de la unión fueron sospechosas de MMIS con marcada regresión. Se remitió el paciente a oncología, quien consultó con el patólogo, realizándose de nuevo una biopsia de la lesión.
La biopsia inicial mostró reducción de las crestas de Rete y células atípicas en nidos y como células individuales con un infiltrado linfohistiocítico con la tinción de hematoxilina-eosina (H&E). Bajo (A) y elevado aumento (B). MART-1 mostró una tinción débil de las células lesionales (C). Las biopsias sucesivas mostraron menos anidamientos con H&E. Bajo (D) y elevado aumento (E). Con la tinción SOX10 no mostraron una neoplasia melanocítica (F). La panqueratina y la S100 fueron positivas únicamente de manera focalizada (sin imagen).
Las nuevas muestras revelaron menor cantidad de seudonidos y el gen SOX10 (SRY-related HMG-box Gene 10) no evidenció una neoplasia melanocítica (fig. 2). Después del estudio de las biopsias, así como de la imagen clínica, se concluyó que la lesión representaba un proceso liquenoide con marcada incontinencia pigmentaria, más congruente con un liquen estriado con seudonidos melanocíticos.
DiscusiónEste caso pone de manifiesto una trampa diagnóstica que se da en los procesos liquenoides con seudonidos, en los que un diagnóstico erróneo repercute en el tratamiento y manejo de la enfermedad. Los hallazgos clínicos e histológicos apuntan a un proceso liquenoide y no son congruentes con un MMIS.
Tras describirse por primera vez los seudonidos, otros estudios alertaron del empleo de MART-1/Melan-A en lesiones pigmentadas por daño solar crónico1,3,6. A pesar de que los estudios que sugerían que los seudonidos eran poco frecuentes, Silva et al. advirtieron contra su exclusión del diagnóstico diferencial y recalcaron la necesidad de ser precavidos antes de utilizar diferentes tinciones2.
El factor de transcripción asociado a microftalmia (MITF, del inglés Microphtalmia-Associated Transcription Factor), un epítopo nuclear, y el SOX10, un regulador para el MIFT, son tinciones más específicas pues los epítopos nucleares no se transfieren fácilmente entre las células en el proceso inflamatorio5. Por todo ello, con el fin de verificar la presencia de componentes melanocíticos verdaderos con reorganización benigna, otras investigaciones han utilizado tinciones adicionales, como SOX10 o MIFT2,4,7. Una vez identificadas sin lugar a dudas las células con tinciones como la S100 o la SOX10, la tinción MIFT diferenció los seudonidos de las lesiones melanocíticas verdaderas2,5. La tinción S100, al no originar tinciones aberrantes, aparece en la literatura como la tinción más sensible para las lesiones melanocíticas y específica frente a los nidos seudomelanocíticos8,9. Esta es la razón por la que la eficacia de la MIFT fue cuestionada en 30 casos de lupus eritematoso cutáneo con dermatitis de interfase liquenoide en los que se encontraron nidos MIFT positivos/S100 negativos8. Los autores propusieron la hipótesis de que la MIFT tiñe de forma semejante a la MART-1/Melan-A e insistieron en la importancia de la correlación clínica y de la realización de la tinción S100 cuando tanto MART-1/Melan-A y MIFT son positivos8. El término «seudonidos melanocíticos» fue propuesto para lesiones benignas con nidos positivos a la tinción MART-1/Melan-A en más de 1-2 células y cuya clínica no hacía sospechar de MMIS2. En la tabla 1 se muestra un resumen de los estudios y la positividad de la tinción de nido.
Nidos seudomelanocíticos o seudonidos melanocíticos en la literatura
| Autor | Edad/sexo, localización, presentación clínica | Tinción nido positiva/negativa | Diagnóstico final | |
|---|---|---|---|---|
| Maize et al., 20031 | 35/hombre (H), sien izqda., máculas gris azuladas | + | Melan-A/MART-1 | Lupus eritematoso discoide |
| − | HMB45M, S100M, TirosinasaM y BCL2M | |||
| El Shabrawi-Caelen et al., 20046 | 4 casos NC con nidos tinción positiva en 10 casos de queratosis actínica pigmentada | + | Melan-A/MART-1 | Queratosis actínica pigmentada |
| − | HMB45M, S100M,LE y tirosinasaM | |||
| Beltraminelli et al., 20093 | 60/H, ambas mejillas, pigmentación marrón grisácea, enfermedad circunscrita | + | Melan-A/MART-1 | Reacción liquenoide fototóxica |
| O | CK | |||
| − | HMB45M y S100M | |||
| Beltraminelli et al., 20093 | 59/H, parte superior cabeza, pigmentación irregular reticulada parcialmente confluente | + | Melan-A/MART-1 | Liquen plano pigmentoso |
| O | CK | |||
| − | HMB45M y S100M | |||
| Beltraminelli et al., 20093 | 52/mujer (M), región infraorbitaria, placa escamosa pequeña | + | Melan-A/MART-1 | Queratosis liquenoide pigmentada |
| O | CK | |||
| − | HMB45M y S100M | |||
| Nicholson y Gerami, 20105 | 39/M, frente, máculas hiperpigmentadas imprecisas | + | Melan-A/MART-1 | Exantema fijo medicamentoso |
| O | CK, CD68 y CD3 | |||
| R | MITFM | |||
| − | HMB45M y S100M | |||
| Nicholson y Gerami, 20105 | 76/M, periocular dcha., parche hiperpigmentado bien delimitado | + | Melan-A/MART-1 | Exantema fijo medicamentoso |
| O | CK y CD3 | |||
| − | MITFM, HMB45, S100 y CD68 | |||
| Silva et al., 20112 | 48/H, región submandibular izqda., parche poligonal, no blanqueable, bien circunscrito, de color violáceo a hiperpigmentado | + | Melan-A/MART-1, MITF, SOX10 y S100 focal | Liquen plano pigmentoso/ Eritema discrómico perstans |
| O | CK | |||
| Gavino et al., 20117 | 4 casos NC con nidos tinción positiva en 70 casos de liquen plano queratósico | + | Melan-A/MART-1 y MIFT | Nevos melanocíticos benignos con inflamación liquenoide |
| − | CK y CD3 | |||
| Abuzeid et al., 20118 | Un caso NC nido tinción positiva en 53 casos de lupus eritematoso cutáneo (5 casos NC nidos tinción negativa) | + | Melan-A/MART-1 y MIFT* | Lupus eritematoso cutáneo |
| − | S100 | |||
| Hall et al., 20159 | 48/H, centro del pecho, parche irregular de color marrón a violáceo | + | Melan-A/MART-1, MIFT, SOX10, S100* y CD1aLEN | Liquen plano actínico |
| − | ACsM | |||
| Chung et al., 20154 | 40/H, espalda, tobillos y pies, pápulas violáceas, poligonales, planas, ligeramente pruriginosas | + | Melan-A/MART-1 y SOX10 | Liquen plano |
| Caso actual | 32/H, región anterior del hombro, placa marrón multifocal con protuberancias | + | Melan-A/MART-1, S100 focal y CK focal | Proceso liquenoide con marcada incontinencia del pigmento y seudonidos melanocíticos |
| − | SOX10 | |||
LE: células de Langerhans en epidermis; LEN: células de Langerhans en epidermis y nidos; M: distribución normal de los melanocitos en la unión dermoepidérmica; NC: no conocido; O: células ocasionales en nidos; R: célula rara en nidos; +: nidos tinción positiva; −: nidos tinción negativa; *: algunas células muestran núcleos sin tinción.
Para explicar la causa de las tinciones MART-1/Melan-A aberrantes se enunciaron otras composiciones de los nidos: células o desechos celulares de melanocitos, melanófagos, linfocitos o queratinocitos2,7. Silva et al. han planteado la inflamación liquenoide como origen de los seudonidos ya sea por reclutamiento o por reorganización benigna de melanocitos verdaderos2; para diferenciar los melanocitos de la unión de las células de Langerhans epidérmicas, ambas positivas a S100, Hall et al. usaron adenil-ciclasa soluble (ACs), ya que los melanocitos son ACs positivos mientras que las Langerhans son positivas a CD1a9. Otras causas de discrepancia son protocolos de tinción, tipos de estudio, y curso de la enfermedad7.
Esta controversia hace que sea importante tener en cuenta las diferentes características histológicas que permitan distinguir las lesiones más allá de las tinciones. Así, la ausencia de diseminación pagetoide o de proliferación melanocítica lentiginosa circundante hace que el MMIS sea poco probable2, mientras que los nidos MIFT positivos con núcleos no teñidos sugieren orígenes no melanocíticos8. Por el contrario, la abundancia de nidos de la unión con tinción positiva4, la confluencia de melanocitos no anidados, la elastosis solar, la pérdida de las crestas de Rete y la presencia de células gigantes de Starburst10, son características que apuntan hacia lesiones melanocíticas atípicas.
ConclusiónEs fundamental que los dermatólogos conozcan los nidos seudomelanocíticos para poder evitar una trampa diagnóstica grave. Los médicos deben ser conscientes de la posible existencia de seudomelanocitos en aquellos casos en los que el diagnóstico diferencial incluye un proceso liquenoide y en el que el informe anatomopatológico describe una neoplasia melanocítica atípica. Así, para alcanzar un diagnóstico correcto, en presencia de positividad Melan-A/MART-1, es fundamental realizar un panel para múltiples marcadores melanocíticos (S100 y/o MIFT [o SOX10]) y marcadores de origen queratinocítico, así como correlacionar la histología con el cuadro clínico. Es necesario llevar a cabo más estudios para poder determinar la verdadera naturaleza de los seudonidos y conocer las sensibilidad/especificidad de las tinciones empleadas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.