La mutación en el oncogén BRAF en melanoma y la aparición de terapias dirigidas frente a ella han supuesto un antes y un después en el tratamiento de esta enfermedad. El estudio del estado mutacional en las metástasis y su concordancia con el tumor primario tiene además una gran implicación terapéutica en estos pacientes, pues permite seleccionar candidatos a estos tratamientos. El objetivo de esta revisión es conocer las evidencias disponibles sobre el grado de concordancia en los distintos tipos de metástasis en el melanoma cutáneo, así como las ventajas y desventajas de los distintos métodos de detección de la mutación en BRAF.
The identification of B-Raf proto-oncongene (BRAF) mutation and the emergence of targeted therapy marked a turning point in the treatment of melanoma. The study of mutation status concordance between primary tumors and metastases in this cancer has major treatment implications as it facilitates the selection of candidates for targeted therapy. This review analyzes the evidence on the level of mutation status concordance between primary tumors and different types of metastases in cutaneous melanoma and provides an overview of the advantages and disadvantages of the various methods used to detect BRAF mutations.
La concordancia mutacional entre el tumor primario y sus metástasis es una investigación de gran relevancia en el campo de la oncología. Dicho estudio adquiere una mayor importancia en el caso de mutaciones que son la diana de tratamientos dirigidos, como es el caso de las mutaciones del oncogén BRAF en melanoma.
Esta correlación ha sido estudiada intensamente en otros tumores malignos, pero no así en el melanoma. La mayor parte de los estudios en otras neoplasias muestran una elevada concordancia: HER-2 en cáncer de esófago (85% de concordancia)1, BRAF en cáncer de colon (98-100% de concordancia)2–5 y KRAS en cáncer de colon (92-100% concordancia)2,3,6–14. Aunque algunos autores han reflejado una tasa de discordancia nada despreciable entre el tumor primario y sus correspondientes metástasis: HER-2 en cáncer de esófago (hasta un 22,5% de discordancia)15 y KRAS en cáncer de colon (hasta un 32,4%)5,16.
En melanoma son pocos los estudios que analizan la correlación mutacional entre la lesión primaria y sus metástasis. Los resultados son heterogéneos, encontrando algunos autores una elevada concordancia17,18 mientras que otros muestran tasas alrededor del 50%19–21. La mayor parte de estas publicaciones basan sus resultados en un solo método de determinación de la mutación y un tamaño muestral bajo que no permite obtener conclusiones válidas. El objetivo de esta publicación es revisar la evidencia científica actual en el melanoma cutáneo respecto a los distintos métodos de detección de la mutación en BRAF utilizados en la práctica clínica y la concordancia mutacional entre el tumor primario y sus correspondientes metástasis.
La mutación BRAF en melanomaLa proteína BRAF es uno de los miembros clave de la vía de las MAPK. Se encuentra codificada en el oncogén BRAF en el cromosoma 7q3422. De entre las mutaciones en el gen BRAF, la mutación en un nucleótido en el codón 600 (V600E) en el exón 15 causante de la sustitución de valina por ácido glutámico (GTG>GAG) en la proteína es la más frecuente, ocurriendo hasta en el 85-90% de los casos22–24. La segunda mutación en frecuencia (V600K) es la que da lugar a la sustitución de valina por lisina (GTG>AAG) con hasta un 20-21% de los casos mutados25–28, habiéndose registrado una mayor prevalencia en algunas poblaciones25,28. Otras mutaciones como V600R (GTG>AGG), V600D (GTG>GAT), V600E2 (GTG>GAA), V600A, V600G, K601N, K601E, L597R, L597Q, G596R y D594N son más infrecuentes29,30.
La alteración en la proteína BRAF produce una activación constitutiva de la vía de las MAPK, evitando así la necesidad de activación por parte de RAS. Su mutación genera una actividad quinasa de la proteína 10 veces superior a la forma no mutada (BRAFWT)22,31, conduciendo a la proliferación neoplásica mediada por una transcripción continuada. La mutación somática en el oncogén BRAF está presente con mayor frecuencia en el melanoma cutáneo que en otros tumores22. Por otro lado, esta mutación está presente en hasta el 50-70% de los melanomas, siendo con diferencia la mutación más frecuente en el melanoma cutáneo respecto a otras como NRAS, p16 o p5332,33.
Métodos de detección de las mutaciones en BRAFExisten distintos métodos que permiten la detección de las mutaciones en BRAF. La elección de uno u otro método se ve justificada por su facilidad/rapidez de realización, su sensibilidad/especificidad, así como por su coste.
SecuenciaciónLa secuenciación de Sanger y la pirosecuenciación son los métodos para determinar el estado mutacional utilizados más ampliamente en investigación. Durante años la secuenciación de Sanger de ADN previamente amplificado mediante la reacción en cadena de la polimerasa (PCR) se ha considerado el método de referencia para la detección de mutaciones adquiridas en tumores y para la secuenciación del genoma humano. Se trata de una técnica que permite detectar sustituciones de bases, deleciones e inserciones, aunque no alteraciones en las copias cromosómicas o translocaciones30. Este tipo de secuenciación precisa de un tiempo elevado para su realización (18-19h), un equipo específico no siempre disponible en muchos laboratorios y un personal cualificado para la lectura de los resultados. Posee una alta especificidad, pero su mayor limitación es que posee una baja sensibilidad (92,5%)34, lo cual obliga a disponer de una carga tumoral de hasta un 5% en las muestras a analizar30. Su tasa superior de falsos negativos condiciona un mayor riesgo de que pacientes portadores de la mutación no sean tratados con los BRAFi.
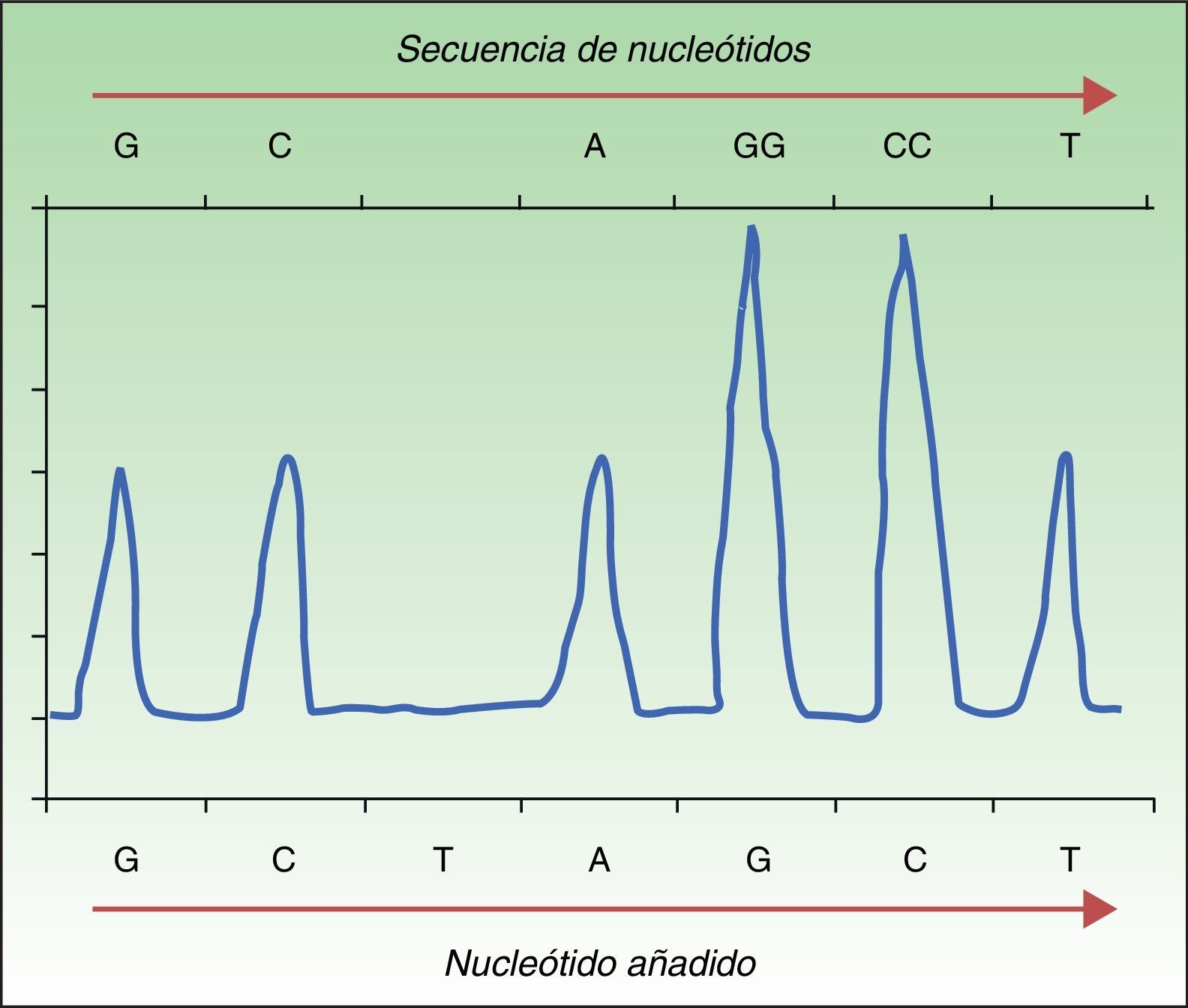
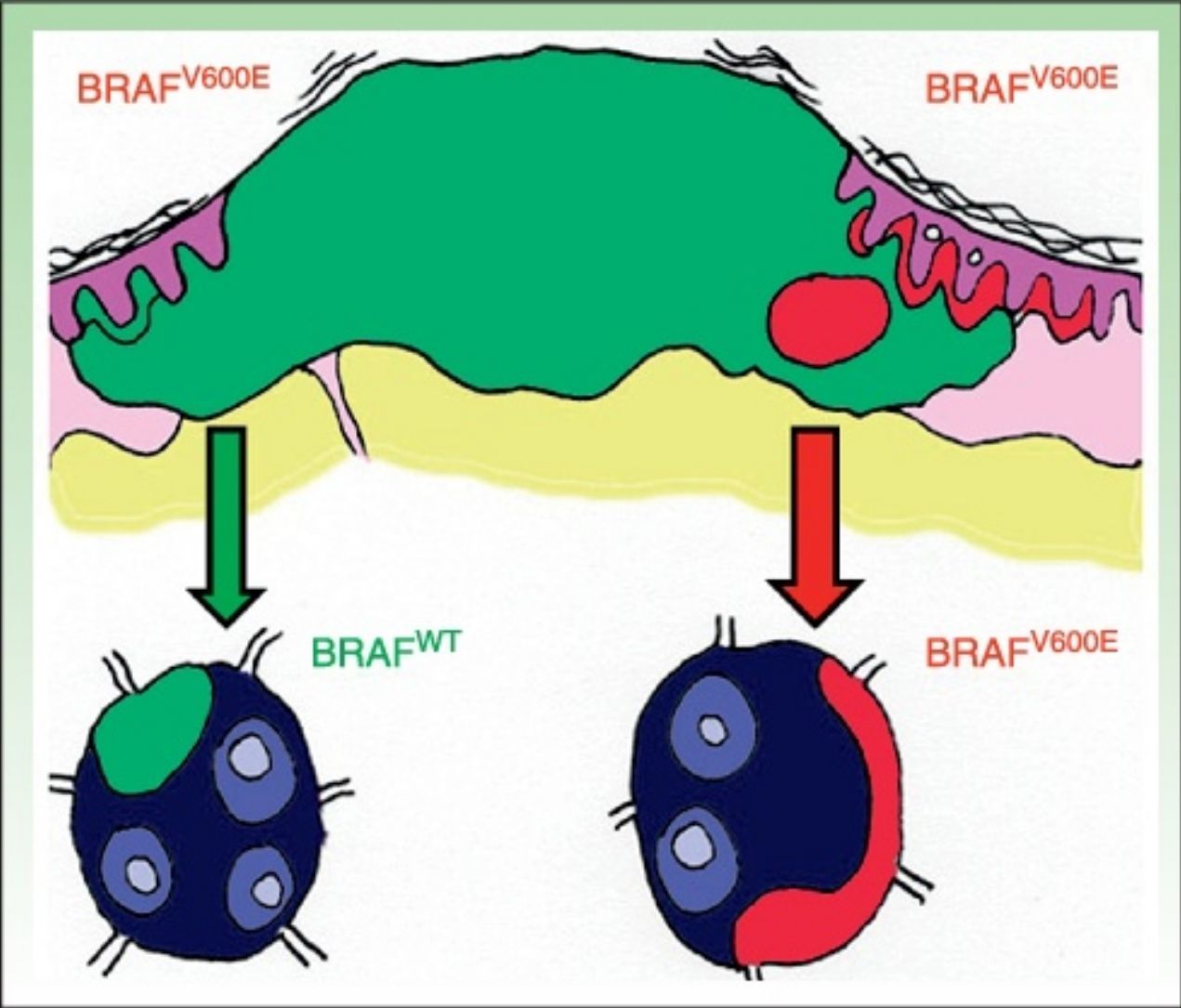
La pirosecuenciación o secuenciación por síntesis se basa en la liberación de pirofosfato por la ADN polimerasa al añadir nucleótidos de forma complementaria a la cadena de ADNss. Para su realización se realiza una amplificación del ADN mediante PCR, se hibrida la cadena de ADNss con un primer y finalmente se incuba con las enzimas. Posteriormente se añaden y lavan secuencialmente soluciones con los nucleótidos A, C, G y T. El pirofosfato liberado con la incorporación de un nucleótido se acopla a las enzimas ATP sulfurilasa y luciferasa para generar luz detectable mediante una reacción de quimioluminiscencia. La liberación de luz producida es detectada cada vez que una base es añadida, y la señal queda registrada como un pico en un gráfico llamado pirograma (fig. 1). La intensidad de la luz representada por la altura de dicho pico determinará si hay más de un nucleótido repetido35,36. Esta técnica permite detectar no solo la presencia o ausencia de mutación, sino también el porcentaje de ADN que porta la mutación. La pirosecuenciación ha mostrado una sensibilidad muy superior a la secuenciación de Sanger30, detectando también no solo la mutación BRAFV600E, sino también otras mutaciones menos frecuentes como V600K, V600D, V600R, K601E30,34. Se trata de una técnica rápida (<24h) pero que, con frecuencia, produce errores en secuencias con un mismo nucleótido repetido 6-7 veces (homopolímeros). A diferencia de la secuenciación de Sanger, que permite detectar longitudes de 800-1000 nucleótidos, esta técnica permite solo detectar 300-500 nucleótidos. La mayor desventaja es el coste elevado de los reactantes y la necesidad de un equipo específico, no siempre disponible en los laboratorios convencionales.
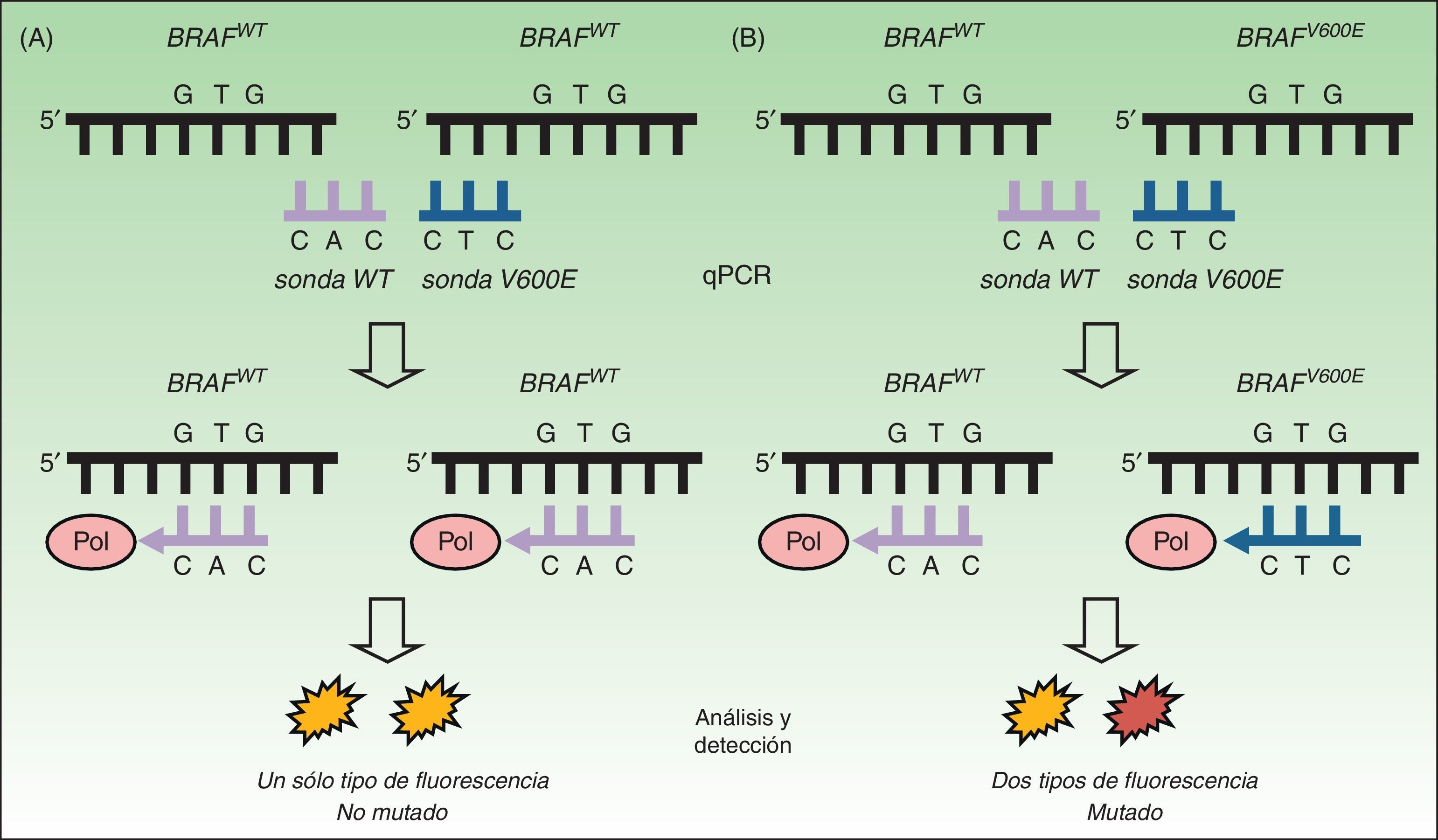
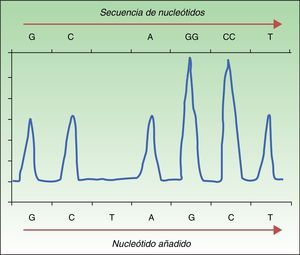
Reacción en cadena de la polimerasa a tiempo realLas pruebas diagnósticas basadas en reacción en cadena de la polimerasa a tiempo real (RT-qPCR) se han convertido en el método más utilizado en los laboratorios clínicos para la detección de mutaciones en tejido tumoral. Se trata de una técnica más rápida (<8h) y con sensibilidad superior a la secuenciación de Sanger de hasta un 97,5%34,37,38. La técnica in vitro se basa en el uso de un termociclador incorporando un lector de fluorescencia (fig. 2). El objetivo es la detección mediante fluorescencia de la mutación presente en ADN extraído de muestras tisulares fijadas en formalina y embebidas en parafina. En el caso de la mutación en el protooncogén BRAF el estudio se dirige hacia una secuencia específica en el exón 15. El resultado nos permite conocer la presencia o ausencia de mutación. Se trata, por tanto, de una técnica rápida y económica, que permite analizar lotes de 3 muestras sin reducción del rendimiento del reactivo y la utilización de dispositivos ya presentes en el laboratorio para la detección de otras mutaciones solicitadas en la práctica clínica diaria (como KRAS en cáncer de colon o EGFR en carcinoma de pulmón no microcítico).
Técnica de la RT-qPCR para la detección de mutaciones en BRAF V600. A. Estudio de ADN tumoral sin mutación BRAFV600E mostrando cómo la unión con la sonda no mutada (sonda WT) emite una fluorescencia única que es interpretada como «NO MUTADO». B. Estudio de ADN tumoral con mutación BRAFV600E mostrando cómo la unión con ambas sondas emite 2 tipos de fluorescencia que son interpretadas como «MUTADO».
Fuente: adaptado de Curry et al.30.
Actualmente se encuentran aprobados varios dispositivos para la realización de RT-qPCR, siendo la plataforma Cobas® 4800 BRAF V600 Mutation Test (Roche Molecular Systems) la más ampliamente utilizada tras su aprobación en 2011 por la FDA para pacientes candidatos a tratamiento con vemurafenib. La utilidad clínica del test Cobas® ha sido validada para la identificación de tumores portadores de la mutación BRAFV600E (100% de las muestras detectadas)39, mostrándose también de utilidad para la determinación de las mutaciones BRAFV600K (70% de las muestras detectadas)39, BRAFV600D y BRAFV600E238,40. El límite inferior de detección de la mutación con la plataforma Cobas® es de 4,4% alelos mutados por 1,25ng/μl. En el caso de mutaciones como la V600K y V600E2 se requieren porcentajes más elevados (31% y 68% respectivamente)30. Los errores objetivados con esta técnica frecuentemente se deben al pigmento melánico, considerado un inhibidor de la PCR.
Yancovitz et al.21 determinaron la presencia de la mutación BRAFV600E con esta técnica en 112 muestras de melanoma hallando una positividad en el 75,9% (66,7% primarios y 77,7% metástasis) frente a la obtenida mediante secuenciación convencional en las mismas muestras del 32,1% de los casos (38,9% primarios y 30,9% metástasis). En estos casos, además, no hallaron ningún tumor mutado que fuese detectado por la secuenciación, pero no por la PCR a tiempo real.
En el caso de las muestras citológicas obtenidas por punción algunos autores41 han mostrado también la utilidad de este método para su estudio. Se ha hallado una concordancia del 93% con respecto a la secuenciación en 117 muestras parafinadas y citológicas, conteniendo estas últimas al menos un 50% de células tumorales.
Anticuerpo monoclonal VE1Recientemente se ha desarrollado un anticuerpo monoclonal frente a la proteína mutada BRAFV600E (VE1)42–44. Este anticuerpo permite la detección de la mutación mediante técnicas inmunohistoquímicas en muestras parafinadas de los tumores. La técnica ha mostrado una sensibilidad de hasta el 100%34,45 en la detección de la mutación BRAFV600E, aunque no permite detectar otras mutaciones incluyendo la BRAFV600K. Dado que la inmunohistoquímica es una técnica rápida y económica utilizada rutinariamente en el laboratorio anatomopatológico hospitalario, su aplicación se muestra como una herramienta rápida y eficiente para la práctica clínica diaria. El problema es que se trata de un método no aprobado por el momento por la FDA o la EMEA para la detección de la mutación en pacientes candidatos a tratamiento con BRAFi. Por otro lado, teniendo en cuenta que los BRAFi se han mostrado eficaces en el tratamiento de tumores con la mutación BRAFV600K, la utilización de la inmunohistoquímica como técnica de detección exclusivamente impediría que los pacientes con dicha mutación se beneficiasen del tratamiento.
Biopsia líquidaLa llamada «biopsia líquida» es una técnica que ha sido estudiada en otros tumores sólidos46 y está adquiriendo cada vez más relevancia en melanoma. Este término abarca tanto la detección en sangre periférica de células tumorales circulantes, como de ADN tumoral circulante (ctADN) o de microARN circulantes47. El estudio en plasma mediante RT-qPCR tanto de células tumorales circulantes como de ADN tumoral circulante liberado tras la apoptosis o necrosis celular supone un campo prometedor en el seguimiento de los pacientes con melanoma metastásico. Actualmente se encuentra en validación su utilidad no solo en la existencia de discordancia mutacional con el tumor primario, sino también en la valoración de la respuesta a tratamientos y la recaída tumoral.
Parece razonable, por tanto, la utilización combinada de técnicas como la inmunohistoquímica con técnicas moleculares como la RT-qPCR o la pirosecuenciación para la detección de la mutación BRAF en pacientes con melanoma metastásico.
Concordancia mutacional de BRAF entre el tumor primario y las metástasisDado que la discordancia entre el estado mutacional del tumor primario y las metástasis ya ha sido objetivada en otros tumores48, y esta constituye una causa de resistencia al tratamiento, su estudio resulta esencial para pacientes oncológicos candidatos a terapias dirigidas. En el melanoma metastásico el estudio de otras mutaciones, como NRAS, ha mostrado una concordancia elevada49.
Si revisamos los estudios publicados hasta la fecha sobre concordancia mutacional de BRAF en melanoma podremos objetivar que la mayoría de ellos han sido realizados con un bajo tamaño muestral19–21. Son una excepción a ello los publicados por Colombino et al.17 y, más recientemente, por nuestro grupo50. Si revisamos las tasas de concordancia en los estudios publicados podemos evidenciar que muestran resultados dispares (tabla 1).
Concordancia de la mutación BRAFV600 en melanoma primario y metastásico; publicaciones previas
| N prim | N met | Linfáticas | P. blandas | Hematógenas | Método | Discordantes | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| N | Conc | Disc | N | Conc | Disc | N | Conc | Disc | |||||
| Riveiro et al.50 | 140 | 171 | 100 | 100 (100%) | 0 | 62 | 62 (100%) | 0 | 9 | 9 (100%) | 0 | PCR+IH+S | – |
| Colombino et al.17 | 102 | 165 | 84 | 78 (93%) | 6 (7%) | 36 | 29 (81%) | 7 (19%) | 45 | 43 (96%) | 2 (4%) | S | BRAFM/BRAFWT |
| Saroufim et al.51 | 33 | 33 | 22 | 20 (91%) | 2 (9%) | 7 | 4 (57%) | 3 (43%) | 4 | 2 (50%) | 2 (50%) | PCR+IH | BRAFM/BRAFWT |
| Shinozaki et al.19 | 13 | 13 | 12 | 7 (58%) | 5 (42%) | 1 | 1 (100%) | 0 | S | BRAFWT | |||
| Lin et al.20 | 2 | 10 | 5 | 2 (40%) | 3 (60%) | 2 | 0 | 2 (100%) | 3 | 1 (33%) | 2 (67%) | S | BRAFM/BRAFWT |
| No especificadas | |||||||||||||
| Omholt et al.18 | 71 | 51a | 49 (96%) | 2 (4%) | S | BRAFWT | |||||||
| Houben et al.54 | 24 | 24a | 19 (79%) | 5 (21%) | S | BRAFM/BRAFWT | |||||||
| Akslen et al.52 | 17 | 17a | 15 (88%) | 2 (12%) | S | BRAFWT | |||||||
| Yancovitz et al.21 | 18 | 18a | 10 (56%) | 8 (44%) | S+PCR | BRAFM/BRAFWT | |||||||
| Busam et al.53 | 1 | 1a | 1 (100%) | 0 | S+IH | – | |||||||
Se indican en primer lugar aquellos autores que especifican el tipo de metástasis y en segundo lugar aquellos que incluyen metástasis no especificadas.
Conc: concordancia; Disc: discordancia; IH: inmunohistoquímica; PCR: reacción en cadena de la polimerasa; S: secuenciación Sanger.
Colombino et al.17 encuentran una baja tasa de discordancia (15 de 165 casos), siendo las lesiones discordantes un 53% tumores primarios BRAFWT con metástasis BRAFM y un 47% tumores primarios BRAFM con metástasis BRAFWT.
Nuestro grupo50, en un estudio multicéntrico con un tamaño muestral mayor que incluye 140 melanomas primarios y 171 metástasis emparejadas, obtiene una tasa mayor de concordancia. Dicha tasa es del 83,6% cuando se determina la mutación con la plataforma Cobas® y asciende hasta el 100% de concordancia cuando se combinan la RT-qPCR con la secuenciación y la inmunohistoquímica VE1.
Otros autores, con un tamaño muestral menor, obtienen también elevadas tasas de concordancia. Omholt et al.18 estudian BRAF en 71 melanomas primarios de los que en 51 casos pueden estudiarse metástasis emparejadas (aunque sin especificar en el estudio el tipo de metástasis). Solo 2 casos presentan discordancia, siendo tumores primarios BRAFWT con metástasis BRAFM. En 17 casos estudian además metástasis consecutivas, encontrando solo un caso discordante de un paciente con primario BRAFM que desarrolló posteriormente una metástasis BRAFM y otra BRAFWT. Saroufim et al.51 estudian 40 muestras de tumores primarios y metástasis emparejadas, de las cuales solo se dispone de tejido suficiente en 33. En 6 casos obtienen resultados no valorables con RT-qPCR, por lo que recurren a la inmunohistoquímica. Objetivan una concordancia en 26 casos (79%), siendo los casos discordantes 5 tumores primarios BRAFM con metástasis BRAFWT y 2 primarios BRAFWT con metástasis BRAFM. Akslen et al.52 estudian 18 casos, de ellos en 17 obtienen resultados mostrando solo 2 casos discordantes, siendo ambos casos tumores primarios BRAFWT. Busam et al.53 realizan un estudio con muestras de pacientes con estado mutacional ya conocido por secuenciación en las que valoran los resultados de la tinción inmunohistoquímica VE1. Entre los casos se encuentra un tumor primario BRAFM en el que se valora su correspondiente metástasis, que muestra concordancia.
Estudios con un bajo tamaño muestral evidencian en cambio una mayor discordancia. Houben et al.54 estudian NRAS y BRAF en una muestra de 24 metástasis emparejadas, encontrando discordancia en 7 casos. En 3 casos se trata de tumores primarios BRAFWT que presentan metástasis BRAFM (V600E, V600R, V600K). Otros 2 casos son tumores inicialmente mutados (BRAFV600E) cuyas metástasis son BRAFWT, pero adquieren mutaciones en NRAS que no estaban presentes en el tumor primario. El resto de los casos muestran discordancia mutacional exclusivamente en NRAS. Yancovitz et al.21 estudian la concordancia de BRAF en 18 tumores y sus correspondientes metástasis. De los 8 casos discordantes, 6 son tumores BRAFWT con metástasis BRAFM, mientras que 2 son tumores BRAFM con metástasis BRAFWT. Además, objetivan en 9 de los tumores primarios la presencia de heterogeneidad en el estado mutacional de las poblaciones celulares dentro del mismo tumor. Este fenómeno ha sido descrito también por otros autores55,56. Shinozaki et al.19 encuentran discordancia en 8 casos de 13 estudiados, siendo todos los casos tumores primarios BRAFWT que presentan metástasis BRAFM. Los autores indican que la presencia de la mutación podría adquirirse durante la progresión de la enfermedad. Lin et al.20 objetivan discordancia en muestras de 3 pacientes en los que las poblaciones celulares BRAFM en tumores primarios inicialmente heterogéneos se seleccionan positivamente. Una de ellas se trataba de una recurrencia mutada en un paciente con un tumor primario originariamente no portador de la mutación. En otra de las muestras se objetiva heterogeneidad tumoral en el tumor primario (BRAFWT +BRAFV600K) y una predominancia de la mutación BRAFV600K en 7 de las 9 metástasis viscerales y subcutáneas. Finalmente, un tercer paciente con tumor primario portador de la mutación BRAFV600K presenta un mayor número de alelos mutados en la metástasis ganglionar. Apuntan dichos autores que incluso en melanomas acrales y mucosos pueden hallarse pequeñas subpoblaciones minoritarias con mutación en BRAF en el tumor primario que posteriormente predominen en las metástasis.
Concordancia en metástasis subsecuentesSon varios los estudios en los que no se dispone del tumor primario pero sí de varias metástasis de un mismo paciente para analizar la concordancia. Un estudio interesante es el de Sigalotti et al.57 que analiza metástasis iniciales (n=15) y subsecuentes (n=19) de 15 pacientes. Encuentran que en todos los casos se mantenía el estado mutacional de BRAF (3 BRAFWT y 12 BRAFM), siendo la única variación objetivada la adquisición en 2 casos de un estatus homozigoto en las metástasis subsecuentes originadas por lesiones primarias heterozigotas. Este estudio sugiere la estabilidad del estado mutacional del melanoma tras haber alcanzado el estado metastásico, independientemente de la localización o intervalo de tiempo transcurrido57. Siguiendo esta línea, Saroufim et al.58 con metástasis subsecuentes y Niessner et al.59 con muestras de metástasis cerebrales y extracerebrales emparejadas, objetivan un patrón idéntico en BRAF, NRAS y KIT. En contraposición, Chang et al.56 analizan en su estudio 3 casos con metástasis múltiples en tejido criopreservado mediante secuenciación, encontrando concordancia completa en uno de ellos, mientras que en los otros 2 casos encuentran metástasis discordantes.
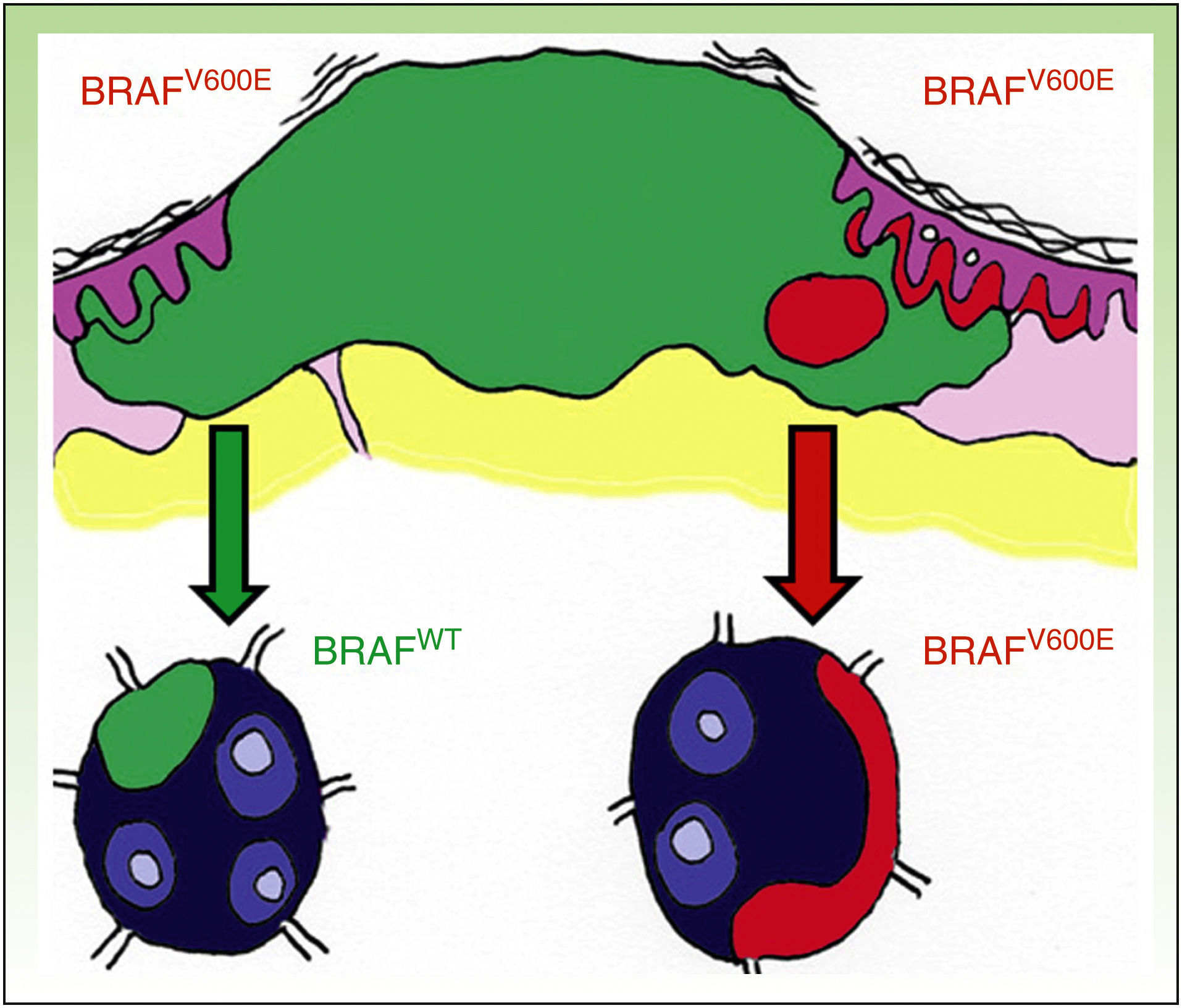
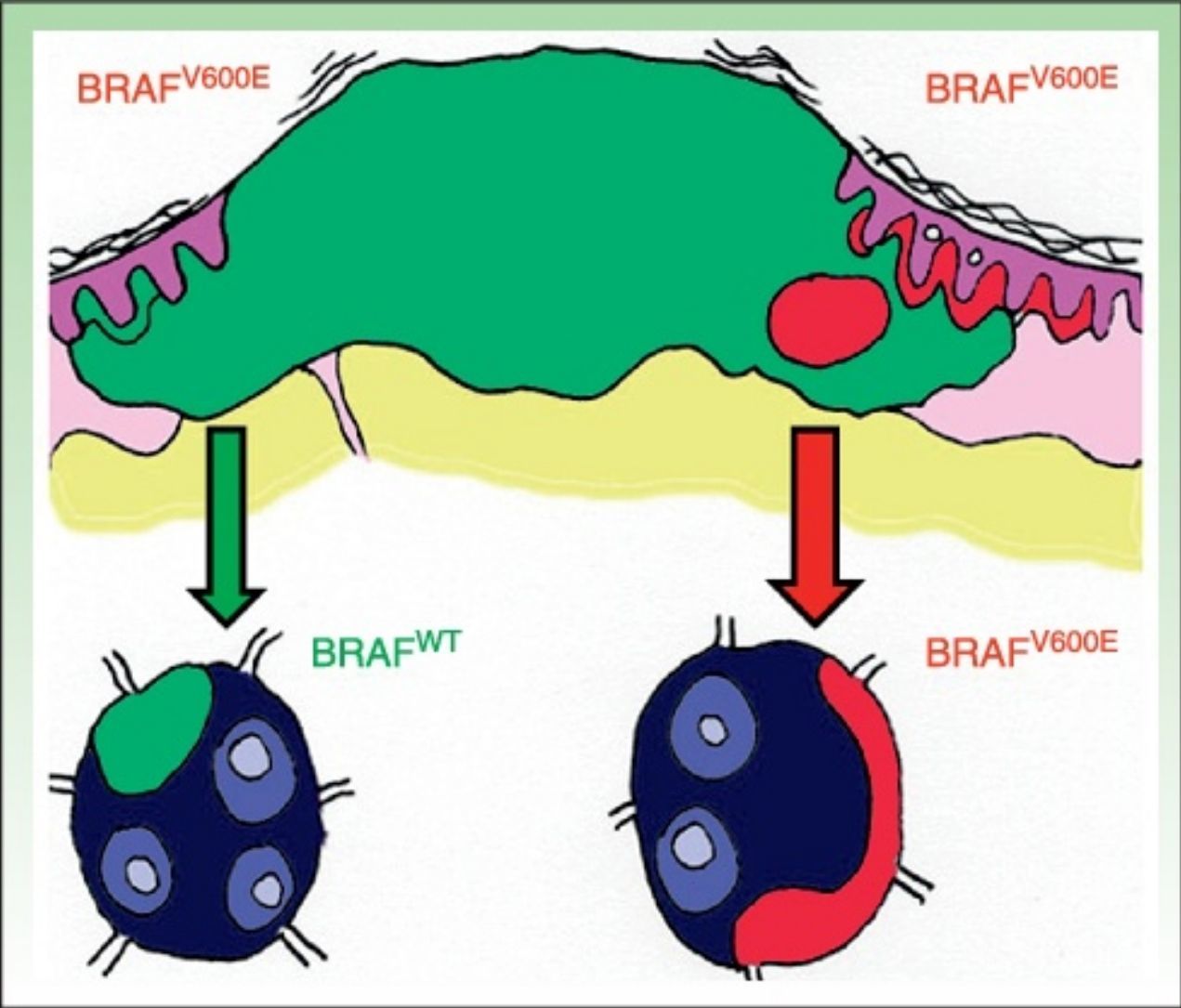
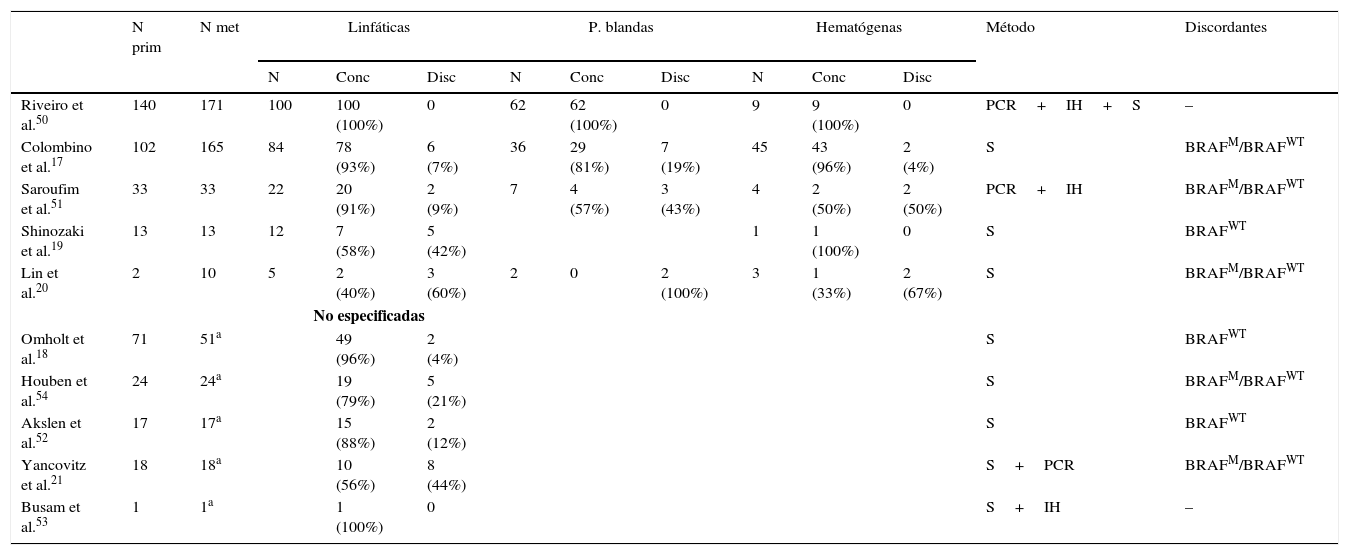
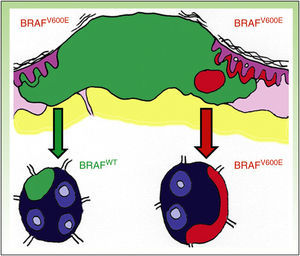
DiscusiónLa existencia de discordancia entre tumores primarios y sus correspondientes metástasis podría explicarse basándose en una reciente teoría propuesta por Yancovitz et al.21 según la cual en el melanoma existen subclones de distintas poblaciones dentro del mismo tumor (fig. 3), la llamada heterogeneidad intratumoral. La presencia de estas distintas poblaciones celulares, unas portadoras de la mutación y otras no, permitiría el desarrollo tanto de metástasis BRAFM como BRAFWT. Del mismo modo, la presencia de heterogeneidad intratumoral (subclones distintos en un mismo tumor) e intertumoral (entre lesiones primarias y sus metástasis) podría explicar la resistencia a las terapias dirigidas y la progresión tras una buena respuesta inicial al tratamiento con BRAFi en algunos pacientes por selección clonal.
Si seleccionamos los estudios con un mayor tamaño muestral, podemos afirmar que la discordancia en el melanoma cutáneo es baja o casi ausente. La existencia de mutaciones distintas de V600E, así como la utilización de un solo método de determinación de la mutación, en ocasiones con baja sensibilidad, podría explicar gran parte de la discordancia objetivada en algunos estudios. El hecho que el estudio con mayor número de muestras y mayor número de técnicas de detección presente un 100% de concordancia apoya la teoría de una elevada estabilidad en el estado mutacional durante la progresión del melanoma.
En cualquier caso, aunque dicho porcentaje discordante sea bajo, no debe despreciarse teniendo en cuenta que todos los casos discordantes pueden tratarse de pacientes candidatos a beneficiarse del tratamiento con inhibidores de BRAF (BRAFi) y la no detección de la mutación supondría negarles dicha opción terapéutica.
Parece por tanto lógico proponer que el tejido idóneo para el análisis de la mutación sea el tejido metastásico disponible más reciente, siempre que se disponga de una cantidad adecuada. Cuando no se disponga de acceso a dicho tejido metastásico, la elevada concordancia de los estudios con mayor tamaño muestral nos indica que sería correcto el estudio del tumor primario en su lugar. Del mismo modo, ante una progresión durante tratamiento con BRAFi deberían analizarse las nuevas metástasis valorando la posible progresión por parte de clones no portadores de la mutación. La utilización además de técnicas combinadas, como la RT-qPCR y la inmunohistoquímica, permitiría además aumentar la sensibilidad en la detección de la mutación.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.