INTRODUCCION
En los últimos años han aumentado los conocimientos sobre la glándula sudorípara ecrina y su implicación en diversos procesos cutáneos. La implicación de la glándula sudorípara ecrina en la reparación cutánea (1, 2) y la demostración de la excreción de diversos fármacos a través del sudor (3-8) pueden tener consecuencias clínicas y/o terapéuticas significativas. Un especial interés ha despertado la siringometaplasia escamosa ecrina (SEE), una afectación patológica de esta glándula cuya relevancia se ve reflejada en la posibilidad de servir como marcador de algunas reacciones cutáneas y aportar nuevas ideas sobre la patogenia de ellas.
La metaplasia se conoce como la transformación de un tipo celular normal, diferenciado (epitelial o mesenquimal), por otro que es inapropiado para el sitio anatómico (9). Las células metaplásicas suelen soportar mejor las condiciones adversas, pero se pierde la capacidad funcional del epitelio especializado. Aunque diversos autores habían referido cambios de metaplasia escamosa en las glándulas ecrinas, tanto en trabajos sobre el carcinoma epidermoide (10-12) como en la hiperplasia seudoepiteliomatosa (13, 14), no fue hasta 1979 cuando King y Barr (15) definen por primera vez el concepto de siringometaplasia escamosa o siringometaplasia escamosa ecrina (SEE), como la metaplasia de las células epiteliales cuboides de los conductos ecrinos en células escamosas. Estos autores consideran además la posibilidad de que la SEE sea una entidad histológica propia y establecen criterios histológicos para diferenciar la SEE del carcinoma epidermoide.
La SEE se ha asociado a diversos procesos cutáneos, que se dividen principalmente en dos grupos: los que están relacionados con la quimioterapia y los que no están.
Entre los procesos cutáneos no relacionados con la quimioterapia figuran el carcinoma epidermoide (10, 11), la hiperplasia seudoepiteliomatosa (13, 14) y el queratoacantoma (16). Ocasionalmente la SEE se ha asociado a los siguientes procesos infecciosos o inflamatorios: la HEN infecciosa por Enterobacter cloacae en un caso (17), piodermia gangrenosa en dos (18), paniculitis en tres (18), granuloma anular elastolítico en uno (19) y siringitis herpética en tres casos (20). Además de SEE, se observó necrosis del epitelio de los conductos y/o glándula ecrina y un infiltrado inflamatorio intenso en dermis y tejido subcutáneo compuesto por neutrófilos, linfocitos o macrófagos.
La presencia de SEE se ha descrito en pacientes diagnosticados de enfermedad injerto contra huésped (EICH) crónica (21, 22). Sin embargo, no se podía descartar la implicación de la quimioterapia en estos casos. Otras asociaciones descritas de forma aislada constituyen una reacción de fototoxicidad probablemente inducida por el benoxaprofeno (23), algunas lesiones de acné en niños expuestos a 2,3,7,8-tetraclorodibenceno-p-dioxín (24), una dermatitis artefacta por inyectar posibles sustancias tóxicas (25) y tres casos de lesiones necróticas por quemaduras (26).
La única revisión amplia de SEE que se ha publicado hasta el momento actual pertenece a Serrano y cols. (27). Estos autores observaron SEE en 21 de un total de 7.500 biopsias cutáneas recibidas durante 2 años, lo que representa el 0,28%. Resalta que los autores no encontraron ningún caso asociado a la quimioterapia, más que por extravasación de la misma en dos casos. Probablemente esto se deba a la población de referencia del hospital, aunque los autores no aportan datos sobre ello.
Desde que en 1982 Santa Cruz y cols. (28) describieron por primera vez la presencia de SEE en el eritema acral inducida por la quimioterapia, el mayor número de los trabajos sobre la SEE se ha concentrado en su asociación con la quimioterapia (28-41). Además de haberse encontrado en una erupción relacionada con la quimioterapia sistémica, la SEE se ha observado en la piel de voluntarios sanos después de inyecciones intradérmicas de bleomicina (40), en lesiones ulceradas después de una extravasación por doxorubicina (41) y en el fenómeno de recall (37).
En cuatro casos la SEE relacionada con la quimioterapia está acompañaba una hidradenitis ecrina neutrofílica (HEN) (29-32). Cabe resaltar que un caso no cumplió en realidad uno de los dos criterios establecidos para el diagnóstico de HEN, que es la presencia de un infiltrado neutrofílico periglandular (29, 30, 42-44). La falta de infiltrado neutrofílico en algunos casos por lo demás similares a la HEN (31, 45, 46) fue motivo para algunos autores de ampliar la definición de la HEN a «hidradenitis ecrina asociada a la quimioterapia» (45). En 1990, Hurt y cols. (33) introdujeron la idea de un espectro histológico de la hidradenitis ecrina asociada a la quimioterapia con un extremo inflamatorio y otro no inflamatorio. No obstante, parece más que la SEE y la HEN son dos reacciones diferentes que pueden coexistir como se ha observado recientemente en la piel de voluntarios sanos después de inyecciones intradérmicas de bleomicina (40).
Aunque algunos autores (36) piensan que las lesiones clínicas asociadas a la SEE inducida por quimioterapia no muestran preferencia alguna para una localización en particular, el número de casos con una manifestación clínica característica ha aumentado (28, 34, 35, 38, 39). Santa Cruz y cols. (28) observaron la presencia de SEE en una serie de 10 pacientes con eritema acral después de quimioterapia a altas dosis. Mientras Rongioletti y cols. (35) describieron otro caso de SEE con eritema acral, uno de los cuatro casos que publicaron Bhawan y cols. (34) presentó áreas de eritema con pequeñas vesículas afectando predominantemente las ingles. Por último, nosotros (38, 39) describimos recientemente SEE en una serie de 10 pacientes con una erupción clínicamente característica que apareció durante o después de un tratamiento de acondicionamiento con altas dosis de quimioterapia previo al trasplante de médula ósea o trasplante autólogo de células progenitoras de sangre periférica (TASPE). La erupción afectó principalmente las axilas, ingles y palmas y/o plantas. La SEE se asociaba a una dermatitis de interfase vacuolar. En el mismo año, Prussick y cols. (48) describieron tres pacientes con una erupción parecida después de recibir quimioterapia a altas dosis previa a un TASPE.
La erupción peculiar que se asocia a la SEE inducida por la quimioterapia sistémica podría facilitar el diagnóstico en algunos pacientes tratados con quimioterapia que presentan erupciones. Sin embargo, para ello debemos ser capaces de diferenciar la SEE inducida por la quimioterapia no solamente de las erupciones sin SEE, pero también de las erupciones con SEE no asociada a la quimioterapia. De este modo propusimos los siguientes objetivos para esta tesis:
-- Establecer parámetros clínicos e histológicos que permitan diferenciar la SEE de otras erupciones.
-- Establecer parámetros clínicos e histológicos que permitan diferenciar los casos de SEE asociada a quimioterapia de aquellos no asociados a quimioterapia.
-- Valorar posibles relaciones entre datos clínicos y histológicos y entre ellos que pudieran tener una relevancia especial.
MATERIAL Y MÉTODOS
Pacientes y biopsias
Fueron seleccionadas todas las biopsias del Servicio de Dermatología del Hospital Universitario de La Princesa, codificadas como SEE entre junio de 1986 y marzo de 1998. Se incluyeron un total de 59 biopsias procedentes de 46 pacientes. Un paciente tenía tres biopsias, 11 pacientes tenían dos biopsias cada uno y 34 pacientes tenían una biopsia cada uno.
La SEE fue definida como la transformación del epitelio cilíndrico o cuboideo del ovillo secretor y/o del conducto excretor de la glándula ecrina en células escamosas con amplio citoplasma eosinófilo y puentes intercelulares, similares a las células del estrato espinoso de la epidermis.
Valoración clínica
En todos los pacientes incluidos se evaluaron los siguientes parámetros generales: si habían recibido quimioterapia, sexo, edad, enfermedad de base, número de leucocitos totales en sangre (valorados en el inicio de la erupción y en el momento de la biopsia).
Se analizó la clínica cutánea con los siguientes parámetros: localización, patrón, morfología y evolución de las lesiones. En este análisis se distinguieron tres patrones:
-- Patrón A. Erupción con afectación exclusiva o predominante de axilas y/o ingles y/o palmas y/o plantas.
-- Patrón B. Erupción con afectación de axilas y/o ingles y/o palmas y/o plantas, pero no predominante.
-- Patrón C. Erupción sin afectación de axilas, ingles, palmas o plantas.
En los casos de SEE asociada a la quimioterapia se analizaron además la quimioterapia administrada, los días transcurridos desde el inicio o cese de la quimioterapia y la aparición de la erupción y la relación entre el patrón clínico y la quimioterapia en la cual se valoró la droga en particular y el tipo de quimioterapia (acondicionamiento pretrasplante frente a los tipos restantes).
Valoración histológica
En todas las biopsias incluidas se valoraron los hallazgos histológicos fuera y dentro de la glándula ecrina con una tinción de hematoxilina-eosina en un microscopio de luz marca Nikon, modelo eclipse E400.
Dentro de la glándula ecrina se analizó la localización, extensión y maduración de la SEE. La SEE se consideró extensa si había más de un conducto ecrino afectado en una longitud epidérmica de corte de 2-6 mm y más de dos en una longitud mayor de 6 mm. La SEE fue clasificada focal si había un menor número de conductos afectados que lo establecido para cumplir el criterio de extensa. La SEE fue clasificada madura cuando se apreciaba queratinización intraductal e inmadura cuando no había signos de ella.
Además se valoró la presencia de los siguientes parámetros: queratogranulomas, atipia celular, apoptosis, necrosis, infiltrado inflamatorio periglandular (tipo e intensidad) y fibroedema periductal.
Fuera de la glándula ecrina se valoró la afectación de la epidermis y de la dermis. En la epidermis se analizaron los siguientes parámetros: apoptosis, degeneración hidrópica de la capa basal y cambios madurativos, entendiendo por tales desorganización de queratinocitos, pérdida de polaridad, anisocitosis, anisocariosis, multinucleación, nucléolos prominentes, mitosis suprabasales. En la dermis se valoraron los siguientes parámetros: infiltrado inflamatorio (tipo e intensidad), edema y vasodilatación del plexo vascular superficial.
Valoración de relaciones entre clínica e histología
Se valoraron las siguientes relaciones entre clínica e histología: 1) la relación entre madurez de la SEE y el tiempo de evolución de la lesión biopsiada, y 2) la relación entre el valor de los leucocitos totales en sangre y la presencia o no de un infiltrado periglandular.
Análisis estadístico
En primer lugar se realizó un análisis descriptivo de la muestra calculándose proporciones de las variables cualitativas y medias y desviación estándar en las variables cuantitativas. Para estudiar la relación simple entre las variables cualitativas se empleó el test exacto de Fisher cuando ambas variables eran dicotómicas y el test de Chi cuadrado si no lo eran. Para estudiar la relación entre una variable dicotómica con una variable cuantitativa se empleó la prueba «t» de Student.
En todos los casos se rechazaron las hipótesis nulas cuyo valor de p era menor de 0,05. Los análisis se realizaron con la ayuda de los programas EPI INFO v 6.04 (CDC Software) y SPSS v 6.01 (SPSS Inc. Chicago Ill).
RESULTADOS CLINICOS
Dieciséis de los 46 pacientes no habían recibido quimioterapia (grupo 1) y 30 pacientes sí (grupo 2).
Sexo y edad
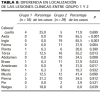
En el grupo 1 había cuatro mujeres (25%) y 12 varones (75%) y en el grupo 2 había 16 mujeres (53,3%) y 14 varones (46,7%). La diferencia entre el número de hombres y mujeres en ambos grupos no fue estadísticamente significativa (p = 0,0719). La edad parece también similar en ambos grupos. En el grupo 1 la edad media era de 43,6 ± 16,2 años y en el grupo 2 de 40,2 ± 13,8 años con un valor de t = 0,73 (p = 0,47). La edad era también similar en hombres y mujeres. La edad media en hombres era 40,9 ± 15,0 años y en mujeres 42,1 ± 14,4 años con un valor de t = 0,27 (p = 0,79).
Enfermedad de base
La enfermedad de base fue variable tanto en el grupo 1 como en el grupo 2 (tabla I). Las cicatrices recientes en grupo 1 representan ampliaciones quirúrgicas de distintos procesos. En la pieza quirúrgica de la primera intervención de estos cuatro procesos no se había apreciado SEE en ningún caso.
Clínica cutánea
Se analizó la clínica cutánea con los parámetros definidos en el material y métodos. En el análisis de la localización y patrón de las lesiones se excluyó un paciente dado que las lesiones cutáneas representaron una manifestación de un fenómeno de recall.
Localización de las lesiones
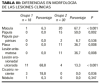
En el grupo 1 la localización de las lesiones era muy variable y estaba limitada a una región anatómica en 14 de los 16 pacientes. En los otros dos pacientes diagnosticados de infección herpética las lesiones estaban diseminadas. En el grupo 2 las lesiones afectaban al menos a dos localizaciones diferentes en 28 de los 29 pacientes, siendo las axilas e ingles las afectadas con mayor frecuencia. Cabe destacar que la afectación de las axilas era siempre simétrica.
Encontramos diferencias estadísticamente significativas en la afectación de axilas (p < 0,0001), ingles (p < 0,0001), palmas (p = 0,004), tórax (p = 0,013), abdomen (p = 0,008), brazo (p = 0,033), antebrazo (p = 0,017) y nalgas (p = 0,018). Todas estas localizaciones menos las nalgas fueron afectadas con mayor frecuencia o exclusivamente en el grupo 2 (tabla II).
Patrón de las lesiones
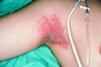
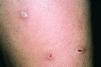
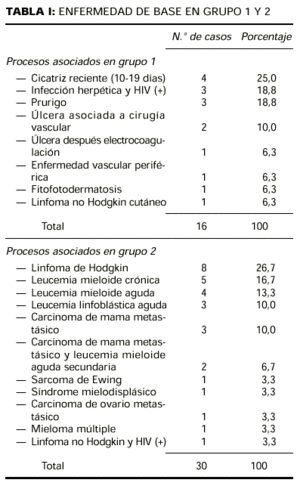
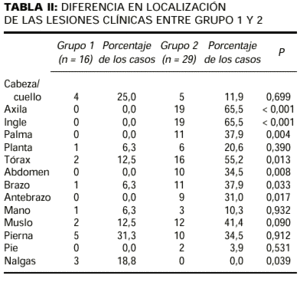
El patrón A (Fig. 1) fue observado exclusivamente en 13 pacientes del grupo 2 (44,8%). El patrón B (Fig. 2) fue también visto con más frecuencia en el grupo 2 (11 pacientes, 37,9%) que en el grupo 1 (un paciente, 6,2%). En cambio, el patrón C fue más frecuente en el grupo 1 (15 pacientes, 93,8%) que en el grupo 2 (cinco pacientes, 17,3%). Las diferencias en frecuencia de cada patrón entre los casos del grupo 1 y del grupo 2 eran estadísticamente significativas (p < 0,001). En todos los pacientes con patrón A y en siete de los 12 casos con patrón B estaban afectadas al menos dos de las localizaciones establecidas como criterios en Material y métodos (axilas, ingles, palmas, plantas).
FIG. 1.--Placa eritematosa exclusivamente en axila derecha (patrón A).
FIG. 2.--Afectación de axila derecha pero no predominante (patrón B).
Morfología de las lesiones
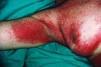
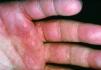
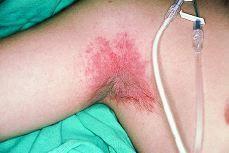
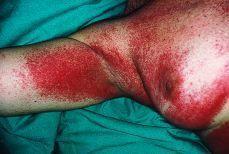
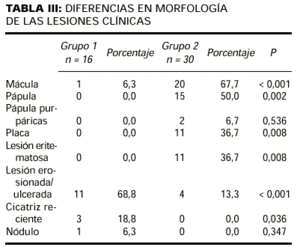
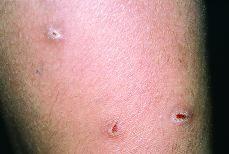
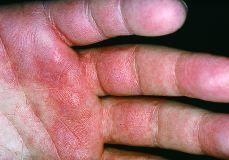
Mientras que las lesiones de cada paciente en el grupo 1 tenían sólo una morfología, 25 de los 30 pacientes en grupo 2 tenían lesiones con al menos dos morfologías diferentes. En la comparación entre grupo 1 y 2 encontramos diferencias significativas en seis tipos morfológicos (tabla III). En el grupo 2 se observaron con mayor frecuencia placas (36,7%) frente al 0,0% (p = 0,008); máculas, 67,7% frente al 6,3% (p < 0,001); pápulas, 50% frente al 0,0% (p = 0,002), y lesiones eritematoedematosas (Fig. 3), 36,7% frente al 0,0% (p = 0,003). En cambio, en el grupo 1 se observaron con mayor frecuencia lesiones erosionadas o ulceradas (Fig. 4), 68,8% frente al 13,3% (p < 0,001), y cicatrices recientes, 18,8% frente al 0,0% (p = 0,036).
FIG. 3.--Pápulas con centro erosivoulcerado diagnosticado de prurigo.
FIG. 4.--Lesiones eritematoedematosas en la palma de la mano.
Evolución
En el grupo 1 el tiempo entre la aparición de la lesión y la biopsia oscilaba entre 2 y 45 días, con un promedio de 17 días. Las lesiones desaparecieron entre 10 días y 4 meses según la enfermedad de base. En el grupo 2 las lesiones se desarrollaron en 2-7 días en 27 pacientes. Posteriormente, las lesiones evolucionaron a una hiperpigmentación postinflamatoria y se resolvieron en 5-20 días. La evolución fue espontánea en 18 pacientes y se emplearon corticoides sistémicos o tópicos en nueve. En dos pacientes la evolución fue distinta. En un paciente la erupción fue progresiva durante 12 días y en el otro paciente la hiperpigmentación postinflamatoria duró más de 40 días.
Quimioterapia administrada
De los 30 pacientes con quimioterapia, 29 habían recibido por lo menos dos fármacos distintos antes del comienzo de la erupción. Los fármacos que formaban parte de la quimioterapia incluían: ciclofosfamida en 22 casos, metotrexate en 15, ciclosporina A en 12, busulfán en 10, etopósido en 10, carmustina en seis, tiotepa en cinco, melfalán, citarabina y carboplatino en tres y doxorubicina, daunoblastina, vinblastina, bleomicina, dacarbazina, cisplatino, mitoxantrone y paclitaxel en un caso.
Relación temporal entre quimioterapia y erupción
En total 21 de 30 pacientes estaban recibiendo quimioterapia en el momento de la aparición de la erupción. Todos ellos llevaban entre 2 y 22 días (promedio: 13,4 días) con quimioterapia. En los otros nueve pacientes se había suspendido toda la quimioterapia entre 1 y 9 días (promedio: 4,7 días) antes del inicio de la erupción.
Relación entre patrón clínico y quimioterapia
Encontramos una relación estadísticamente significativa entre el patrón clínico y la quimioterapia en tres fármacos: ciclofosfamida (p = 0,016), busulfán (p = 0,017) y citarabina (p = 0,034). La ciclofosfamida fue administrada con mayor frecuencia en los casos con patrón A y B que en los casos con patrón C (p = 0,013). Aunque el busulfán fue administrado tanto en patrón A como B, la droga fue administrada con mayor frecuencia en los casos con patrón A (p = 0,016). Por otra parte, la citarabina fue administrada exclusivamente en los casos con patrón C (p = 0,034).
También encontramos una relación estadísticamente significativa entre el patrón A y el B y la quimioterapia como acondicionamiento pretrasplante y entre el patrón C con otros tipos de quimioterapia (p < 0,001). Mientras los patrones A y B fueron observados exclusivamente (56,5% frente al 0,0%) o con mayor frecuencia (39,1% frente al 33,3%) en los pacientes tratados con el acondicionamiento pretrasplante, el patrón C fue mucho más frecuente (66,7% frente al 4,3%) en los pacientes tratados con otros tipos de quimioterapia.
RESULTADOS HISTOLOGICOS
Se estudiaron un total de 16 biopsias con SEE procedentes de los 16 pacientes del grupo 1 y un total de 43 biopsias con SEE procedentes de los 30 pacientes del grupo 2.
Hallazgos de la glándula ecrina
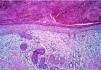
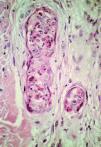
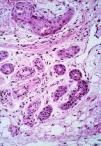
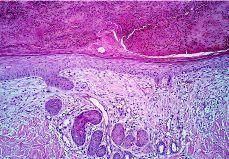
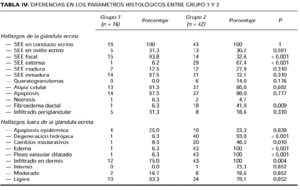
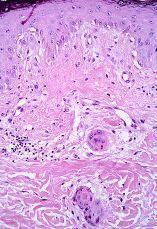
En el grupo 1 se observaba una relación morfológica directa entre un proceso patológico local y la SEE en 15 de las 16 biopsias (93,8%). La relación más frecuente fue con una úlcera no infecciosa en ocho casos. En estos casos la SEE se encontraba justamente debajo de la úlcera en cuatro casos (reepitelizado en dos) (Fig. 5), dentro de una úlcera en uno y en el borde de la úlcera en dos. En tres casos la SEE se encontraba justamente en la incisión de una cirugía previa. En dos de ellos el tejido alrededor de las glándulas afectadas era fibroso y en el otro caso se observó alrededor de las glándulas afectadas tejido de granulación y hemorragia abundante (Fig. 6). Por otra parte, en un caso la SEE se encontraba en la vecindad de un linfoma cutáneo en tejido subcutáneo. En los tres casos de infección herpética la SEE se asociaba a una siringitis herpética y además estaba en la vecindad de una úlcera herpética en dos de ellos. Sólo en un caso diagnosticado de fitofotodermatosis la relación parecía menos directa.
FIG. 5.--Ovillo ecrino con imágenes de SEE debajo de una úlcera reepitelizada.
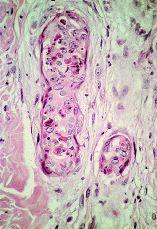
FIG. 6.--Conductos con SEE localizados en tejido de granulación justamente en la incisión de la cirugía previa.
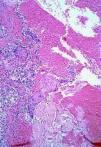
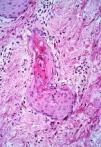
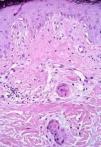
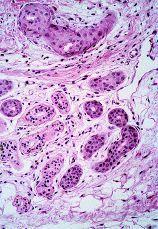
En la comparación entre el grupo 1 y el grupo 2 dos parámetros mostraron diferencias estadísticamente significativas (tabla IV). Tanto la SEE extensa --67,4% frente al 6,2% (p < 0,001)-- como la presencia de fibroedema periductal (Fig. 7) --41,9% frente al 6,2% (p = 0,009)-- fueron observados con mayor frecuencia en el grupo 2. Aunque queratogranulomas fueron observadas exclusivamente en el grupo 2, la diferencia no era estadísticamente significativa (p = 0,176). Tampoco hubo diferencias significativas en la frecuencia de SEE madura e inmadura (Fig. 8). En los casos con queratogranulomas la SEE era siempre madura (Fig. 9). Por otra parte, la SEE madura fue acompañada de edema fibroductal en el 91,7% de los casos y la SEE inmadura en el 22,6%.
FIG. 7.--Conducto ecrino con apoptosis, atipia celular intensa y fibroedema periductal.
FIG. 8.--Conductos ecrinos normales y conductos con siringometaplasia escamosa ecrina inmadura.
FIG. 9.--Conducto ecrino con siringometaplasia escamosa ecrinamadura (cornificación intraductal) y queratogranuloma.
Hallazgos fuera de la glándula ecrina
En la comparación entre grupo 1 y grupo 2, cinco parámetros mostraron diferencias significativas (tabla IV). En los casos del grupo 2 había una mayor frecuencia de degeneración hidrópica --93,0% frente al 6,3% (p = < 0,0001)--, cambios madurativos --46,5% frente al 6,3% (p = 0,010)-- (Fig. 10), edema en dermis papilar --100% frente al 6,3% (p < 0,001)-- y un plexo vascular dilatado en dermis papilar --100% frente al 6,3% (p < 0,001)--. La presencia de un infiltrado inflamatorio en dermis fue observado también con mayor frecuencia en grupo 2 --100% frente al 75% (p = 0,004)--. Sin embargo, no había diferencia significativa en intensidad del infiltrado entre ambos grupos.
FIG. 10.--Epidermis con cambios madurativos y degeneración hidrópica de la capa basal.
En grupo 1 el infiltrado era mixto en siete casos y monocelular en cinco. El infiltrado estaba compuesto de linfocitos en 11 casos (91,7%), neutrófilos en siete (58,3%) y eosinófilos en dos (16,7%). En grupo 2 el infiltrado era mixto en 13 casos (30,2%) y monocelular en 30 (69,8%). Los linfocitos fueron observados en todos los casos (100%), eosinófilos en nueve (20,9%), neutrófilos en ocho (18,6%) y macrófagos en siete (16,3%). Por otra parte cabe destacar que en 24 casos (55,8%) sólo había un mínimo infiltrado de linfocitos.
RELACIONES ENTRE CLINICA E HISTOLOGIA
Maduración de SEE y tiempo de evolución de la lesión biopsiada
La media del tiempo de evolución de la lesión biopsiada en los casos de SEE madura (8,6 ± 6,6 días) y SEE inmadura (8,3 ± 9,3 días) era similar t = 0,10 (p = 0,923). Sin embargo, mientras no se ha observado SEE madura en lesiones con menos de 3 días de evolución, SEE inmadura fue hallada en 19 de estas lesiones. Esta diferencia fue estadísticamente significativa (p = 0,002).
Relación entre leucocitos en sangre e infiltrado periglandular
La relación entre el valor máximo de los leucocitos totales en sangre y el número de casos con infiltrado periglandular era estadísticamente significativa (p = 0,033) (tabla V). Un caso diagnosticado de LMA subtipo 5 tenía una leucopenia severa y HEN. Se excluyeron cuatro casos sin análisis.
DISCUSION
En los casos de SEE no relacionada a la quimioterapia, la clínica que presentaban los pacientes era la del proceso de base y, aunque no se ha estudiado tal parámetro, no parece que la presencia o no de SEE vaya a modificar la morfología o distribución clínica de las lesiones. En la mayoría de estos casos la SEE se asociaba a lesiones erosivas, ulceradas o cicatrices recientes. Las lesiones afectaban con mayor frecuencia las extremidades y no afectaban las axilas, ingles o región palmoplantar, excepto en un caso. Estas observaciones coinciden con la mayoría de los casos de SEE publicados en los que los pacientes no fueron tratados con quimioterapia (14, 15, 18, 20, 25-27).
La SEE en los casos tratados con quimioterapia se asociaba en el 82,7% de los casos a una erupción con patrón A o B y en el 44,8% de los casos a patrón A. La preferencia de las lesiones clínicas para axilas, ingles y región palmoplantar habla en favor de que el sudor estaría implicado en la patogenia del proceso. Estas áreas anatómicas tienen un abundante número de glándulas ecrinas por cm2 y/o son áreas donde el sudor queda habitualmente ocluido. Diversos autores han sugerido que la excreción de la quimioterapia a través del sudor podría inducir la SEE por medio de un efecto tóxico directo (32-35, 38, 39). La excreción de quimioterapia a través del sudor se ha demostrado solamente en el caso del tiotepa (7). Curiosamente los pacientes de aquel estudio presentaron lesiones clínicas en áreas ocluidas por vendajes o parches y biopsias de estas lesiones mostraron alteraciones histológicas compatibles con un efecto por quimioterapia (7).
Encontramos una relación estadísticamente significativa entre el busulfán y el patrón A y entre la ciclofosfamida y el patrón A y B. Es la primera vez que se establece una relación significativa entre una droga en particular y un patrón clínico asociado a la SEE. Si bien hasta el momento actual no se habían publicado series con más de 10 casos de SEE inducida por quimioterapia (28, 39). Por otra parte, todos los pacientes recibieron combinaciones de dos o varias drogas a la vez y en la mayoría de los casos con patrón A; estos tratamientos incluían una combinación de busulfán y ciclofosfamida. De este modo existe también la posibilidad de que los efectos tóxicos de los fármacos que se excretarían a través del sudor se potencien mutuamente. Por último, el busulfán fue siempre administrado como tratamiento de acondicionamiento pretrasplante y ciclofosfamida en el 90,9% de los casos. Aunque no se ha cuantificado la dosis de los fármacos, es importante recordar que el uso de trasplante permite emplear dosis mucho más altas que sin ello serían demasiado tóxicas. La relación entre el patrón clínico y el acondicionamiento pretrasplante fue estadísticamente significativa (p < 0,001). Por tanto, el número de glándulas ecrinas por cm2, la oclusión del sudor, las propias características del fármaco, la dosis del fármaco y la suma de efectos tóxicos de distintos fármacos podrían ser factores implicados en la patogenia de las lesiones.
La distribución característica observada en los casos de SEE inducida por quimioterapia coincide con los 10 pacientes con eritema acral descritos por Santa Cruz y cols. (281), el paciente con eritema acral descrito por Rongioletti y cols. (35) y uno de los cuatro pacientes que publicaron Bhawan y cols. (34), que presentó áreas de eritema con pequeñas vesículas predominantemente en ingles. Sin embargo, contrasta con la opinión expresada por algunos autores (36), que piensan que las lesiones clínicas asociadas a la SEE inducida por quimioterapia no muestran preferencia alguna para una localización en particular. Si bien las conclusiones de estos autores se basaron en casos clínicos aislados. No obstante, el hecho de que no todos los casos de SEE tratados con quimioterapia presentan lesiones en axilas, ingles o región palmoplantar, sugiere que el efecto tóxico directo causado por la quimioterapia en el sudor no sea (siempre) el único factor implicado en la patogenia de las lesiones y por tanto deba(n) existir otro(s) factor(es).
Histológicamente la SEE no relacionada a la quimioterapia era focal en el 93,8% de los casos y mostró una relación morfológica directa con una patología previa local. Aunque la etiopatogenia de la SEE se desconoce, diversos estímulos han sido implicados. En las úlceras y en las incisiones quirúrgicas se ha sugerido la SEE como un fenómeno de regeneración (1, 2, 26) o como un efecto secundario a la isquemia (15, 25, 27). En los casos de siringitis herpética la propia infección herpética de la glándula ecrina podría haber inducido directamente la SEE o indirectamente por medio de sus efectos destructivos en forma de necrosis y apoptosis del epitelio. En cambio otros autores sugirieron la SEE como una respuesta a la necrosis del epitelio ecrino supuestamente provocado por un infiltrado inflamatorio intenso en casos de paniculitis, pioderma gangrenoso y granuloma anular elastolítico (18, 19). Sin embargo, la presencia de una úlcera en los casos de pioderma gangrenoso (18) e infección herpética (20) podía haber actuado por lo menos como un factor etiopatogénico adicional en estos casos. Por último, la SEE en el caso de fitofotodermatosis de esta tesis, que fue publicado recientemente (49), se podría explicar como una reacción fototóxica del conducto ecrino similar al caso de la SEE después de la ingesta de benoxaprofen (23).
La SEE en los casos tratados con quimioterapia se asociaba en la mayoría de los casos a una dermatitis de interfase vacuolar con poco componente celular, lo que constituye el patrón histológico más frecuente en reacciones inducidas por quimioterapia (50, 51). En menor frecuencia se observaban también cambios madurativos de la epidermis. Una dermatitis de interfase con poco componente celular asociada a cambios madurativos es casi diagnóstica de una reacción inducida por quimioterapia (50, 51). Sin embargo, los cambios madurativos no se expresan siempre clínicamente (52). Por tanto, en ausencia de un infiltrado inflamatorio significativo, las lesiones clínicas se explicarían principalmente por el edema y la vasodilatación en la dermis.
La presencia de un infiltrado inflamatorio periglandular se relacionaba con el valor máximo de los leucocitos en sangre (p = 0,033). Sin embargo, un caso diagnosticado de HEN y LMA subtipo 5 según la clasificación francesa-americana-británica tenía una leucopenia severa. Esto coincide con las conclusiones de otros autores (47), que explican la HEN en pacientes neutropénicos con LMA subtipos 4 y 5 por un tropismo cutáneo especial de ciertos precursores leucémicos que estimulara la quimioterapia hasta neutrófilos clonales.
Fenómenos de queratinización de la glándula ecrina se han observado solamente en lesiones con más de 72 horas de evolución. Esto sugiere que estos fenómenos de queratinización requieren un cierto tiempo para desarrollarse. La SEE inmadura, por otra parte, se puede observar en cualquier lesión de más de 24 horas de evolución. Aunque la SEE madura se observó con mayor frecuencia y los queratogranulomas exclusivamente en los casos tratados con quimioterapia, las diferencias entre los dos grupos no eran estadísticamente significativas.
Otro fenómeno asociado a la SEE fue el fibroedema periductal, que se observó con mayor frecuencia en los casos tratados con quimioterapia y se asociaba en el 91,7% de los casos a SEE madura. Estos datos indican que el fibroedema periductal forma parte del espectro lesional de la glándula ecrina, especialmente en casos severos inducidos por quimioterapia. El fibroedema periductal fue observado previamente en otros dos casos de SEE inducida por quimioterapia (34).
Se podría argüir que en los casos tratados con quimioterapia la mera presencia de SEE no condiciona una clínica peculiar. No obstante, la SEE parece un marcador específico del mismo. Esta clínica peculiar que se asocia a la SEE inducida por quimioterapia nos podría ser de gran utilidad para diferenciarla de otras erupciones que pueden aparecer en estos pacientes. El diagnóstico diferencial de la SEE inducida por quimioterapia debe establecerse con EICH aguda, exantema por recuperación linfocitaria, con enfermedades infecciosas, erupción asociada a factores estimulantes de colonias (G-CSF y GM-CSF) y otras toxicodermias.
Placas eritematosas elevadas y áreas maculosas confluentes en axilas o ingles que presentaron nuestros pacientes no son manifestaciones propias de la EICH aguda, la erupción por recuperación linfocitaria, los exantemas virales o la erupción asociada a factores estimulantes de colonias. La afectación de palmas y plantas se observa en la EICH aguda, pero generalmente aparece como un eritema maculopapuloso que puede llegar a confluir, a diferencia de las áreas de eritema y edema intenso bien definidas que presentan desde el principio nuestros pacientes. Cabe destacar que la presencia de SEE no ha sido descrito en el contexto de la EICH aguda, ni en la erupción por recuperación linfocitaria o en los exantemas virales y solamente en una ocasión después de un tratamiento con G-CSF a dosis altas (52). En este caso el tratamiento indujo una foliculitis necrotizante profunda y la SEE fue observado en relación con la necrosis focal del epitelio ductal y un infiltrado inflamatorio denso y mixto, compuesto de linfocitos, neutrófilos y macrófagos. Aunque no se puede excluir la existencia de otras toxicodermias, la SEE ha sido relacionada solamente en una ocasión con un fármaco no citostático (23). En aquel caso aparecieron lesiones en áreas fotoexpuestas tras la ingesta de benoxaprofén y se implicaron mecanismos fototóxicos.
Agradecimientos
Quiero agradecer especialmente al profesor Amaro García Díez y al doctor Jesús Fernández Herrera, por su gran ayuda desde el inicio del presente estudio, que han enriquecido con valiosas aportaciones, y al doctor Javier Fraga Fernández, por su decisiva y valiosa colaboración en el estudio histológico del presente trabajo. Agradezco también a mis compañeros del Servicio de Dermatología del Hospital de La Princesa su constante apoyo y su estrecha colaboración en todo momento.