El síndrome de descamación de la piel acral (acral peeling skin syndrome [APSS]) es un síndrome de herencia autosómica dominante, causado por la alteración del gen TG5, responsable de la producción de la transglutaminasa 5 (TG5)1. Se presenta desde el nacimiento o la primera infancia, con la formación de ampollas y ulterior descamación localizadas a nivel de las palmas y las plantas. La mayoría de las veces cursa con una clínica poco o nada limitante lo que, unido a su baja incidencia, hace que esté infradiagnosticado o mal diagnosticado como epidermólisis ampollosa simple, con la que comparte algunas características2.
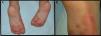
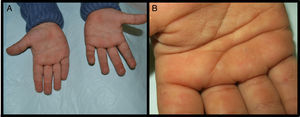
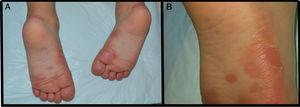
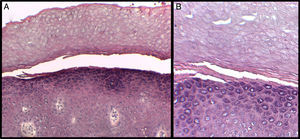
Se presenta el caso de un niño de 3 años de edad con un cuadro consistente en la formación de ampollas y ulterior descamación de palmas y plantas y, en menor medida, de dorso de manos y pies desde los 6 meses de edad. Los episodios eran asintomáticos y se repetían con una frecuencia de una o 2 veces al mes, empeorando con la humedad. En el examen físico, el paciente presentaba ampollas tensas y fláccidas en zonas de presión, junto con descamación de las palmas y de las plantas (figs. 1 y 2), y áreas eritematosas en resolución. El resto de la piel y las mucosas eran normales. La biopsia cutánea demostró una discreta separación entre las capas granulosa y córnea, sin inflamación (fig. 3). En el estrato córneo, las capas celulares intermedias localizadas por encima del punto de clivaje presentaban un aspecto desestructurado, con células grandes y redondeadas. Los datos clínicos y anatomopatológicos eran compatibles con el diagnóstico de APSS. El estudio genético confirmó esta hipótesis al presentar el paciente 2 mutaciones del gen TG5, ambas en homocigosis: una patogénica (p.G113C) y un polimorfismo (p.T109H) frecuentemente asociado a la anterior.
El APSS pertenece al grupo de los síndromes de descamación cutánea (PSS), dentro de los cuales se puede diferenciar una forma acral localizada (APSS) y otra generalizada3–5. La primera vez que se acuñó el APSS como una entidad propia fue en 1982, en la descripción de Levy y Goldsmith6. Desde entonces han sido varias las descripciones de casos clínicos y series de casos clínicos de este síndrome (tabla 1), que se caracteriza por la formación de ampollas y por la descamación superficial de la piel de las plantas y las palmas, dejando un eritema residual indoloro y posterior curación sin cicatrices. Los síntomas empeoran con la humedad y con factores físicos como traumatismos o fricciones. En general, es asintomático o causa síntomas leves. El APSS presenta, además, varias características histopatológicas. La fundamental es la separación entre la capa granulosa y la córnea. Otro dato frecuente es la existencia, dentro del estrato córneo por encima del punto de separación con la granulosa, de varias capas celulares de aspecto atípico, con células grandes, redondeadas, más claras, de aspecto edematoso, y menos compactadas. Con microscopía electrónica puede apreciarse mejor la separación entre los corneocitos a estos niveles, con fragmentación de los filamentos de queratina7,8.
Resumen de los datos más relevantes de los casos de APSS publicados hasta la fecha
| Nacionalidades descritas | Alemania, Reino Unido, Países Bajos, Polonia, Italia, España, Rusia, Hungría, Eslovaquia, Finlandia, Suecia, este de África, Túnez, Oriente Medio, Marruecos y Jordania |
| Edad de inicio de los síntomas | Desde el nacimiento hasta los 11 años |
| Edad en el momento del diagnóstico | Desde uno a 47 años |
| Signos más frecuentes | Ampollas y descamación de palmas y plantas, y dorso de manos y pies |
| Factores agravantes | Humedad, sudor, calor, fricción y traumatismos |
| Mutaciones más frecuentemente descritas | p.[Gly113Cys];[Gly113Cys] p.[Gly113Cys] en heterocigosis p.[Met1Thr];[Met1Thr] p.[Lys445Asn];[Lys445Asn] p.[Val273Met];[Val273Met] p.[Thr109His];[Thr109His] |
APSS: acral peeling skin syndrome.
El mecanismo genético subyacente fue elucidado por Cassidy et al. en 20051 al identificar la mutación responsable del síndrome en el gen TG5, localizado en el 15q15. Este gen codifica una proteína, la TG5, cuya función está alterada en los pacientes que padecen este síndrome.
La TG5 se expresa en la capa córnea y es responsable de la formación de enlaces cruzados entre proteínas clave en el proceso de cornificación (loricrina, involucrina, filagrina, entre otras), siendo así indispensable para el mantenimiento de una capa córnea íntegra1,4,8. Cuando se analiza la piel sana de individuos afectos de APSS, se comprueba que la mutación no es exclusiva de la piel acral, pero se postula que el resto de transglutaminasas presentes en la piel en diferentes proporciones según la localización son suficientes para llevar a cabo el proceso de cornificación. Esta acción abolida de la TG5 no estaría compensada en las palmas y las plantas, donde la capa córnea es mayor y está sometida a mayores presiones9.
Se describen 2 mutaciones que, en homocigosis, se relacionan con el síndrome. La primera de ellas es la mutación G113C, que da lugar a una abolición completa de la función de la TG5. La otra es la T109M, que no es patogénica en sí, sino que se trata de un polimorfismo localizado en el mismo alelo, y que con frecuencia se encuentra asociada a la primera. Esta combinación se ha descrito en varios pacientes del norte y centro de Europa, y se postula que es el resultado de un fenómeno fundador en la población europea. Recientemente se han descrito 59 casos con 15 mutaciones nuevas que afectan a la TG510, así como una mutación a nivel de la proteína cistatina A, cuya alteración también daría lugar a una clínica de APSS.
El tratamiento es sintomático, con emolientes y medidas destinadas a disminuir la maceración y los traumatismos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Javier Cañueto Álvarez del Departamento de Dermatología de la Universidad de Salamanca, a Rogelio González Sarmiento y a Elena Bueno Martínez del Departamento de Medicina Molecular de la Universidad de Salamanca y a Luis Carlos Sáez Martín del Departamento de Dermatología del Hospital General Universitario Gregorio Marañón de Madrid.