Las nuevas terapias inmunológicas dirigidas contra el cáncer han supuesto un cambio radical en el tratamiento y el pronóstico de muchas neoplasias. Estos medicamentos se dirigen de manera mucho más específica contra los mecanismos fisiopatogénicos del cáncer, por lo que adquieren el sobrenombre de «terapias diana». Este cambio de paradigma ha supuesto la aparición de nuevos efectos adversos dermatológicos, que afectan tanto la piel como sus anejos. Los efectos adversos en el pelo pueden manifestarse en alteraciones de su ciclo, forma, color o inmunología. Debido a que son tratamientos nuevos en su mayoría y no existe un documento que englobe todos estos efectos adversos, hemos realizado una exhaustiva revisión bibliográfica para caracterizar de manera concreta cuáles son los efectos adversos tricológicos que pueden inducir cada uno de estos fármacos.
The advent of immune targeted therapies for cancer has radically changed the treatment and prognosis of many cancers. These drugs are called targeted therapies because they target specific pathophysiological mechanisms of cancer. This paradigm shift in cancer treatment, however, has resulted in new adverse dermatologic effects involving both the skin and its appendages. In the case of hair, targeted drugs can cause immune alterations and changes in hair growth, color, and shape. Because most targeted therapies are new, there is no single document describing all these adverse effects. We performed an exhaustive review of the literature to characterize adverse hair effects associated with the use of targeted therapies.
Las terapias diana han supuesto desde su introducción una auténtica revolución en la lucha contra el cáncer. Son fármacos diseñados para interferir con moléculas específicas necesarias para el crecimiento y la progresión tumoral (tabla 1). Suponen un cambio en el paradigma de la lucha contra el cáncer, con tratamientos que actúan de forma más específica que los citotóxicos clásicos. Este proceso ha supuesto también un cambio en el manejo de estos pacientes y de los efectos adversos que presentan estas terapias. Aunque de forma general las nuevas terapias diana presentan una menor toxicidad directa contra el pelo, también presentan efectos que pueden alterarlo, ya sea en su ciclo, forma y color o provocando trastornos inmunológicos que provoquen su caída.
Principales dianas en terapia dirigida antineoplásica con sus principales fármacos
| Diana | Principales fármacos |
|---|---|
| EGFR | Afatinib, cetuximab, erlotinib, gefitinib, necitumumab, osimertinib, panitumumab, vandetanib |
| HER-2 | Trastuzumab, lapatinib, neratinib |
| PD-1/PD-L1/CTLA-4 | Nivolumab, pembrolizumab/atezolizumab, avelumab, durvalumab/ipilimumab |
| BRAF | Dabrafenib, vemurafenib |
| MEK | Trametinib, cobimetinib, binimetinib, selumetinib |
| KIT/BCR-ABL | Axitinib, imatinib, regorafenib/bosutinib, dasatinib, nilotinib, ponatinib |
| VEGF/VEGFR | Bevacizumab, pazopanib, sorafenib, sunitinib/lenvatinib, ramucirumab |
| Hedgehog | Vismodegib, sonidegib |
| Proteasoma | Bortezomib, carfilzomib, ixazomib |
| mTOR | Everolimus, temsirolimus, sirolimus |
| CD52 | Alemtuzumab |
| ALK | Alectinib, ceritinib, crizotinib |
| HDAC | Belinostat, panobinostat, romidepsina, vorinostat |
| RANKL | Denosumab |
| PARP | Olaparib, rucaparib, veliparib, talazoparib, iniparib |
| CD30 | Brentuximab |
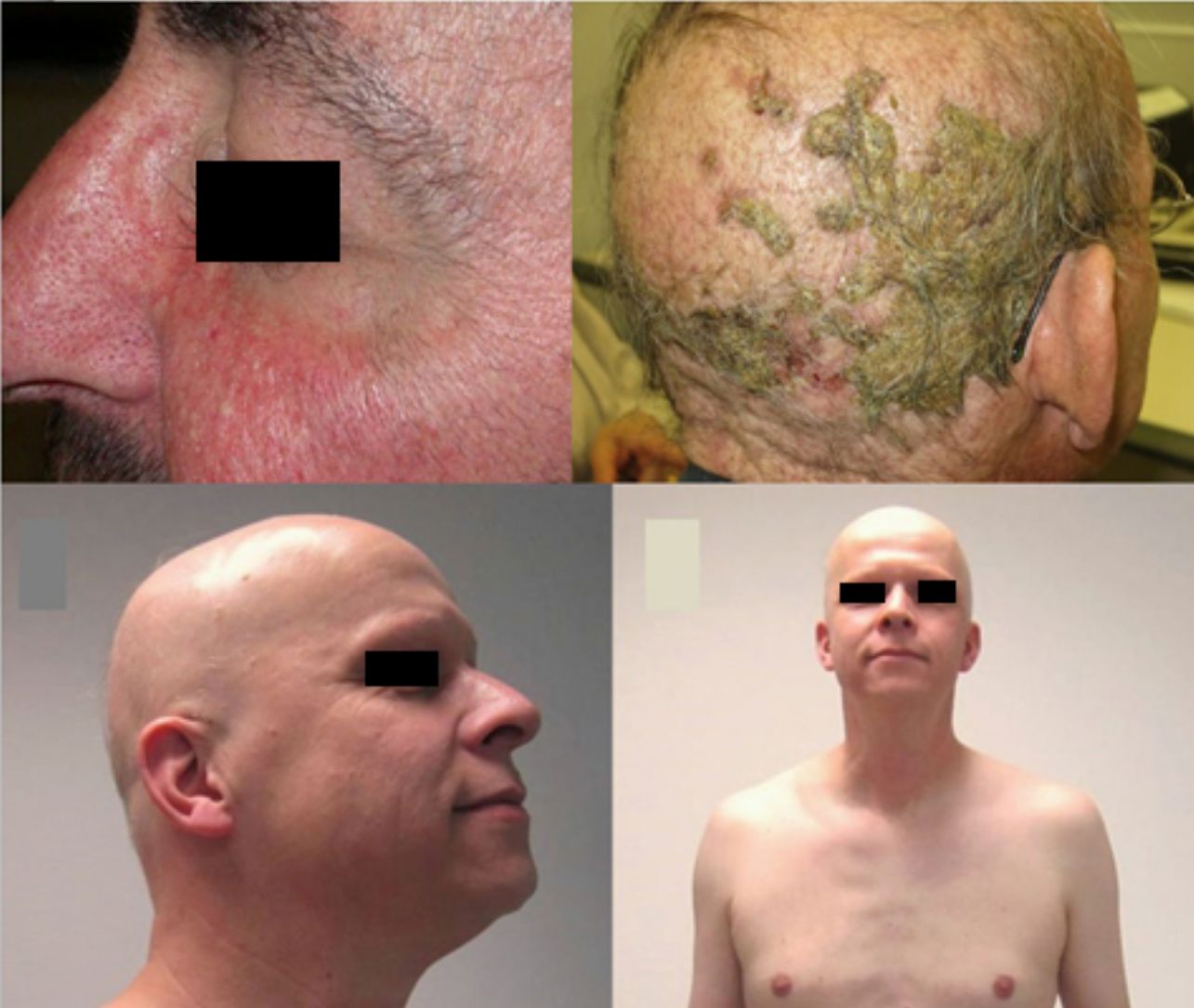
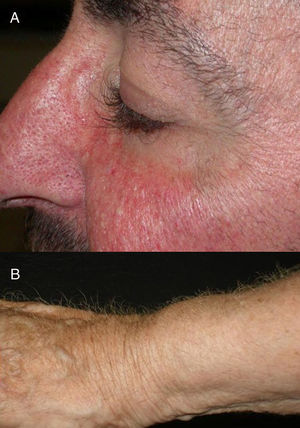
El papel que juega el epidermal growth factor receptor (EGFR, «receptor del factor de crecimiento epidérmico») en la formación tumoral y en el correcto desarrollo de la piel y sus anejos está bien establecido. Además, sabemos que juega un papel importante en el equilibrio del ciclo folicular1. Por eso, los principales efectos adversos que presentan estos tratamientos son dermatológicos. Estos se dividen básicamente en los que afectan a la piel (reacción folicular o acneiforme, xerosis y prurito), que suelen ser precoces, y los que afectan a los anejos (paroniquia y cambios del pelo), que aparecen de forma más tardía2–4. Los cambios en el pelo afectan a prácticamente un 80% de los pacientes tras 6 meses de tratamiento. Están descritos diversos cambios del pelo: alopecia o crecimiento de pelo, cambios en la velocidad del crecimiento, grosor del pelo o, incluso, de la forma, adquiriendo forma rizada o lisa2. Más raros son los cambios en la pigmentación del pelo, de los que hay descritos 2 casos: como poliosis5 y como repigmentación de pelo canoso6. Uno de los efectos más característicos es sin duda el crecimiento persistente o acelerado del pelo, lo que se ha llamado tricomegalia7. Es muy llamativa y característica la tricomegalia de las pestañas5,7,8, que suele ocurrir entre los meses 2 y 5 de tratamiento (fig. 1). Este crecimiento anómalo, además del compromiso cosmético, condiciona una forma aberrante de las pestañas, pudiendo en algunos casos graves traumatizar la córnea. Por este motivo se recomienda siempre recortarlas con cuidado4.
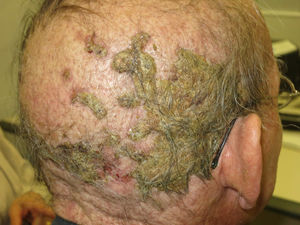
La alopecia relacionada con estos fármacos se puede ver en un porcentaje variable según el fármaco: afatinib 11,9%, cetuximab y erlotinib 8,9%9. Además, de forma más infrecuente, los inhibidores del EGFR pueden inducir la aparición de una alopecia inflamatoria. Esta puede presentarse como alopecia inflamatoria no cicatricial10 o mediante pústulas foliculares en el cuero cabelludo, pudiendo dejar una alopecia cicatricial4,11. Esta última forma podría corresponder a la afectación del cuero cabelludo de la reacción folicular típica (fig. 2). Sin embargo, algunos autores defienden que se trata de una forma de dermatosis pustulosa erosiva del cuero cabelludo debido a los hallazgos tricoscópicos encontrados, característicos de este proceso12. En cualquier caso, el tratamiento debe realizarse con corticoides tópicos, siendo en ocasiones útil la asociación de antibióticos antiestafilocócicos, ya que en algunos casos se ha reportado el hallazgo de Staphylococcus aureus11.
Inhibidores HER-2: trastuzumab, lapatinib, neratinibTrastuzumab es el fármaco con mayor experiencia de este subgrupo para el tratamiento adyuvante del cáncer de mama positivo para HER-2. La alopecia por este fármaco no parece ser un efecto adverso frecuente13. Lapatinib, en cambio, al ser un inhibidor de HER-2 pero también de EGFR, puede presentar los efectos característicos de este grupo14. Con los ensayos clínicos realizados con neratinib hasta el momento no existen reportes sobre efectos en el pelo15.
Además, de forma anecdótica, están reportados 2 casos de foliculitis en penacho inducidos por inhibidores de HER-2: uno con trastuzumab16 y otro con lapatinib17.
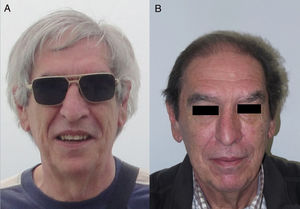
Anti-PD-1/PD-L1/CTLA-4: nivolumab, pembrolizumab/atezolizumab, durvalumab/ipilimumabLos inhibidores de PD-1, PD-L1 y CTLA-4 son un grupo heterogéneo de fármacos familiares para el dermatólogo porque se utilizan en el melanoma metastásico. Con relación al uso de ipilimumab, es frecuente la aparición de hipopigmentaciones cutáneas tipo vitíligo (sobre todo en pacientes con melanoma), y en estudios iniciales hasta un 14% de los pacientes presentaban hipopigmentaciones en el pelo del cuero cabelludo, las cejas o las pestañas18,19. Posteriormente, 2 reportes hablan de poliosis por este grupo de fármacos: una con ipilimumab20 y otra con pembrolizumab21. Sin embargo, el caso inverso parece más frecuente en los PD-1/PD-L1, ya que recientemente ha sido publicada una serie de 14 casos de repigmentación de cabello en pacientes que habían recibido tratamiento con alguno de estos fármacos PD-1/PD-L1 para una neoplasia de pulmón no microcítica (fig. 3)22. Destaca que 13 de los 14 eran hombres.
Aunque la alopecia producida por los anti-PD-1 se supone entre un 1-2%, no existe ningún estudio que la caracterice de manera adecuada23. Con ipilimumab la proporción de alopecia está alrededor del 5,1% (desde 1,3 hasta 18,3% según las series)9. Recientemente se ha reportado una serie de 4 casos de pacientes que durante el tratamiento combinado PD-1/PD-L1+ipilimumab desarrollaron cuadros indicativos de alopecia areata (AA); 3 de ellos en placas y uno universal con afectación ungueal23. Están descritos otros 2 casos de AA relacionados con el uso de ipilimumab24,25. En uno de ellos la AA se asociaba a vitíligo extenso y los autores defienden que esta presencia de fenómenos autoinmunes podría ser indicadora de una mayor supervivencia.
Otro caso anecdótico relaciona el cambio a pelo rizado de forma persistente en un paciente en tratamiento con nivolumab26.
Inhibidores BRAF: vemurafenib, dabrafenibLos inhibidores de BRAF fueron pioneros en el tratamiento dirigido para el melanoma metastásico. Son tratamientos con un perfil de seguridad complejo, que se han visto beneficiados mediante la combinación de los inhibidores de MEK27. Los inhibidores de BRAF presentan múltiples y frecuentes efectos adversos sobre el pelo. La alopecia, habitualmente de carácter difuso, no cicatricial y en grados leves (i-ii), es un efecto secundario frecuente, presentándose en un 8% en los primeros ensayos clínicos de vemurafenib y hasta en un 100% en un estudio prospectivo de 11 pacientes28. Sin embargo, datos más fiables probablemente los podamos obtener de una cohorte de 3.219 pacientes con vemurafenib en los que hasta un 25% de los casos presentaron algún grado de alopecia29, datos similares a los del metaanálisis (23,7%)9. Menos datos tenemos sobre la proporción de alopecia por dabrafenib. Una serie de 119 pacientes mostraba una incidencia del 14%30, que según el metaanálisis aumentaría hasta el 18,9%9. Además, cabe destacar que este cuadro de alopecia se acompaña habitualmente de cambios en la morfología (hacia pelo rizado), el grosor o el color del pelo (típicamente aparece pelo canoso o se repigmenta en algunos casos)27,31. Este hecho se produciría en un 16,7% de los pacientes con vemurafenib y en un 13-60% de aquellos con dabrafenib (de forma leve mayormente), dependiendo de las series30,32. Estos conjuntos de hallazgos son lo que algunos autores han denominado alopecia RASopática31. Además, es característica la aparición de puntos amarillos interfoliculares en el cuero cabelludo asociada a estos cambios32. En la mayoría de los casos estos efectos se producen al inicio del tratamiento, aunque recientemente se ha descrito un caso de aparición tardía33.
Por último, no es infrecuente la aparición de dermatitis seborreica en el cuero cabelludo, que puede ser de difícil manejo34, llegando en algunos casos más graves a formas tipo pitiriasis amiantácea35.
Inhibidores MEK: trametinib, cobimetinib, binimetinib, selumetinibComo ya hemos comentado, los inhibidores de MEK se utilizan habitualmente en combinación con los inhibidores de BRAF (vemurafenib y dabrafenib), no solo para aumentar la supervivencia, sino también para disminuir sus efectos secundarios26,27. Por eso, no existen demasiados reportes específicos acerca de los efectos secundarios sobre el pelo de estos tratamientos en monoterapia. En uno de los ensayos clínicos fase iii con 323 pacientes con trametinib, se objetivó un 19% de alopecia, siendo en su práctica totalidad de grado i36. Según un metaanálisis, la proporción global con trametinib se acercaría a un 13,3%9. En otra pequeña serie de 11 pacientes podemos observar que selumetinib provocó alopecia en un 9% de los casos37.
Sin embargo, lo más trascendente de estos fármacos es, sin duda, la capacidad de mejorar el perfil de seguridad de los inhibidores de BRAF, de los cuales van casi siempre acompañados. Los estudios comparativos entre inhibidores de BRAF en solitario y la combinación de inhibidores de BRAF y MEK muestran como la mayoría de los efectos secundarios habituales se producen con menor frecuencia en la terapia combinada26,30,37. No ocurre así con la fotosensibilidad y la queratosis pilar, que incluso pueden aumentar con la terapia combinada27. En cuanto al pelo, la combinación sí parece mejorar el perfil de seguridad, como muestra un estudio comparativo donde se comparaba la incidencia de alopecia en pacientes con dabrafenib (14%) frente a aquellos con la combinación dabrafenib+trametinib (3,3%), así como la aparición de pelo rizado o canoso (12,6 vs. 3,3%, respectivamente)30.
Recientemente ha sido presentado un caso de tricorrexis nudosa en una niña de 14 meses de edad, relacionada con el tratamiento con trametinib38.
Inhibidores KIT/BCR-ABL: axitinib, imatinib, regorafenib/bosutinib, dasatinib, nilotinib, ponatinibEste grupo heterogéneo de fármacos tiene propiedades inhibitorias de las tirosina cinasas producidas por c-kit, por los receptores de los factores de crecimiento plaquetarios y por la fusión de BCR-ABL. Se utilizan mayoritariamente para neoplasias de estirpe hematológica, como la leucemia mieloide crónica, aunque presentan otras múltiples indicaciones13. Los efectos secundarios cutáneos más característicos de este grupo se relacionan con trastornos de la pigmentación19, debido al rol de c-kit en la fisiología del melanocito13. Múltiples patrones de hipo/despigmentación cutánea se han descrito con imatinib19, pudiendo afectar al pelo39,40 (a veces en forma de pelo canoso)41,42. Estos cambios son más frecuentes en pacientes de fototipos altos y suelen responder al descenso de dosis o remitir al suspender el fármaco43. También se han descrito varios casos de leucotriquia por dasatinib, asociados o no a hipopigmentación cutánea44?46, y por regorafenib47. El caso inverso (repigmentación), aunque no es tan frecuente, también está descrito tanto en piel, mucosas y uñas19,43 como en pelo, en 2 series diferentes con imatinib: una de 9 casos sobre 133 pacientes tratados (mediana a los 5,7 meses de tratamiento)48 y la otra de 8 casos más (sobre 58)49.
Otro efecto adverso tricológico que podemos observar de forma frecuente es la alopecia, sobre todo en mujeres. Regorafenib es el fármaco con mayor tasa de alopecia del grupo (23,7%)9. Aunque nilotinib también presenta tasas altas de alopecia (un 6-8% según los principales estudios, aunque puede aumentar hasta un 15,9% según el metaanálisis)43,50, esta no está bien caracterizada13. En un caso sí se describe de manera exhaustiva la aparición de un cuadro de alopecia inflamatoria difusa total (afectando el cuero cabelludo y las cejas, pero respetando las pestañas, el pelo del cuerpo y las uñas) en una paciente, asociada a una erupción de múltiples pápulas foliculares color carne en el tronco, varias semanas después de iniciar nilotinib51. Además, coincidía también con un posparto reciente. Al ser un cuadro de alopecia que no se ajusta a los cuadros habituales, los autores proponen el término de alopecia inducida por nilotinib. De momento no existen más reportes sobre este tipo concreto de alopecia. Imatinib también puede producir alopecia en un 6,6%9, aunque la alopecia total es rara52. En un estudio comparativo de axitinib con sorafenib (ambos están indicados en el cáncer renal metastásico), axitinib presentó un 4% de alopecia53. Dasatinib presenta una tasa de alopecia del 7,8% aproximadamente, aunque puede variar del 3 al 19,1% según las series9.
Además de alopecia y trastornos de la pigmentación, se pueden observar otro tipo de efectos secundarios tricológicos. La queratosis pilar por nilotinib es frecuente54, pudiendo ser atrófica, y está descrita asociada a AA en placas55. Hay que destacar también que las reacciones liquenoides son habituales con este grupo de fármacos y que en algunas ocasiones pueden afectar al pelo en forma de liquen plano pilar56. Además, con algunos de estos fármacos (nilotinib, dasatinib y ponatinib) se han reportado casos donde esta clínica podría ser mixta, combinando hallazgos típicos de liquen plano pilar con erupción cutánea tipo queratosis pilar, recordando al síndrome de Graham-Little57. Además, de forma anecdótica, imatinib ha sido relacionado con un caso de madarosis en un paciente pediátrico58 y nilotinib, con un caso de foliculitis perforante59.
Inhibidores VEGF/VEGFR: bevacizumab, pazopanib, sorafenib, sunitinib/lenvatinib, ramucirumabLos fármacos que pertenecen a este grupo también son llamados inhibidores multicinasas porque, aparte de inhibir la actividad de la porción intracelular del receptor de VEGF, actúan sobre otras muchas tirosinas cinasas de manera directa e indirecta13. Es por esto que presentan múltiples efectos adversos y que muchos de ellos coinciden con efectos adversos característicos de otros grupos farmacológicos.
El efecto adverso tricológico más frecuente es la alopecia13. Numerosos estudios avalan estos datos: diferentes metaanálisis cifran la proporción de alopecia en un 6% (5-21%) con sunitinib60, un 10% (3,3-26,8%) con bevacizumab9, un 12,3% (9-16%) con pazopanib9 y un 25,5-29% con sorafenib61, el fármaco con porcentajes más elevados. Además, la alopecia asociada a sorafenib presenta algunas características propias. Suele aparecer entre la semana 3 y 15 de tratamiento y en algunas ocasiones puede acompañarse de un lento crecimiento de la barba62. En otro estudio se objetivó que hasta un 19% de los pacientes presentaron pérdida de vello corporal, no siempre asociada a alopecia del cuero cabelludo63. El manejo es complejo, ya que no existe un tratamiento específico, pero el trastorno habitualmente es temporal y el paciente recupera la densidad capilar al completar el tratamiento (en algunos casos incluso antes de finalizarlo). Al recuperarse, el pelo puede crecer quebradizo y rizado64. Otros autores defienden que algunos casos podrían tener características superponibles a la AA65. En cuanto a los inhibidores VEGFR, lenvatinib y ramucirumab, son fármacos con pocos datos hasta el momento. Ramucirumab, según un metaanálisis sobre 6 ensayos clínicos aleatorizados, no presenta un aumento en la proporción de alopecia respecto a placebo66, mientras que lenvatinib presenta un 11% de alopecia en un ensayo clínico fase iii con 261 pacientes67.
Por la actividad directa e indirecta que tienen sobre c-kit, estos fármacos también presentan con cierta asiduidad trastornos de la pigmentación tanto sobre la piel como sobre el pelo13. En este caso, sunitinib es el fármaco más típicamente implicado62, llegando a producir despigmentación del pelo, las cejas o las pestañas hasta en un 8-14% de los casos42,68–70. Este efecto suele aparecer sobre las 5-6 semanas de tratamiento, adquiriendo un color grisáceo de aspecto canoso. Esto suele revertirse a las 2-3 semanas de haber finalizado el tratamiento, con lo que se pueden dar casos de despigmentación «intermitente» según la periodicidad del tratamiento (por una inhibición transitoria de c-kit)62,69. Aunque este efecto se atribuye clásicamente a sunitinib, según algunas series la proporción de despigmentación de pelo de pazopanib sería incluso más alta, llegando hasta un 38%71 a dosis altas, pudiéndose desarrollar de forma rápida72 y con un riesgo relativo de 4,5473.
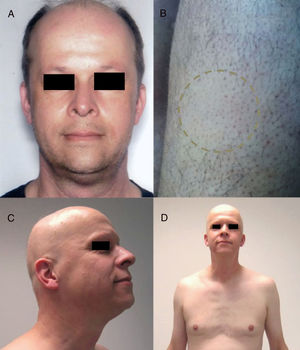
Inhibidores de la vía Hedgehog: vismodegib, sonidegib, erismodegibEstán principalmente indicados en el carcinoma basocelular avanzado y metastásico31. En este caso la alopecia es, sin duda, el efecto adverso más frecuente sobre el pelo (fig. 4). Las tasas son muy altas, hasta del 63% en los primeros ensayos clínicos de vismodegib74. De hecho, vismodegib aparece como el fármaco diana antineoplásico con mayor índice de alopecia según un metaanálisis comparativo9. Además, cabe destacar que un porcentaje del 10-14% presentaba alopecia en grado ii (>50% de pérdida de cabello)74. En otro importante estudio recientemente publicado de 694 pacientes con carcinoma basocelular avanzado y metastásico tratados con vismodegib la proporción de alopecia fue del 62%, sucediendo casi de forma constante en los primeros 12 meses de tratamiento y siendo causa de abandono del tratamiento en un 3% de los casos75. Es de destacar que aunque esta alopecia se recupera de manera espontánea al cesar el tratamiento (habitualmente durante el primer año)75, han sido descritos 4 casos de alopecia persistente (seguimiento medio de 15 meses)76. Además, algunos autores exponen 2 casos donde la mejoría espontánea de este proceso durante el tratamiento se acompañaba de un fallo de este, y se cuestionan si este hecho podría ser un marcador precoz de fracaso terapéutico y progresión de la neoplasia77. La alopecia asociada a sonidegib, aunque no es tan frecuente, se presenta en más del 10% de los casos78. La vía Hedgehog muestra niveles altos de señalización en los folículos en crecimiento, lo que explicaría las altas tasas de alopecia al inhibir esta vía79. De hecho, agonistas de la vía Hedgehog habían sido estudiados como potenciales tratamientos de la alopecia androgenética (siendo descartados por sus numerosos efectos adversos)80. Un estudio reciente caracteriza de manera exhaustiva el patrón de alopecia que se presenta asociada a estos fármacos en 5 pacientes (4 con vismodegib y uno con sonidegib/erismodegib)81. Los autores la describen en todos los casos como una alopecia de patrón difuso (sin patrón androgénico), no inflamatoria, que se presenta de manera lenta y gradual, volviéndose el cabello cada vez más fino y débil. Este proceso se desarrolló entre los 2 y 9 meses (mediana de 3,1) y afectó de forma frecuente al pelo del cuerpo y las cejas (en 4 de los 5 casos), y a las uñas (3/5). En ningún caso se observaron signos de AA. Los hallazgos histopatológicos solo objetivaron un aumento en la ratio telógeno/anágeno, siendo compatibles con efluvio telogénico.
Alopecia difusa por vismodegib (inhibidor de la vía Hedgehog) en pacientes incluidos en el estudio STEVIE. A) Paciente varón antes de empezar el tratamiento. B) A los 8 meses de tratamiento. C) A los 3 meses de la suspensión del tratamiento. D) Paciente mujer antes de empezar el tratamiento. E) A los 9 meses de tratamiento. F) A los 3 meses de finalizar el tratamiento. Cortesía de la Dra. V. Ruiz-Salas.
Otro efecto curioso asociado al tratamiento con vismodegib de manera anecdótica es la tricodisplasia espinulosa, de la cual hay un caso reportado82.
Inhibidores del proteasoma: bortezomib, carfilzomib, ixazomibRepresentan fármacos utilizados principalmente para el tratamiento de neoplasias hematológicas. La alopecia por bortezomib está catalogada como rara9, con datos que varían entre 0,4 y 10,9%83,84.
Inhibidores mTOR: everolimus, temsirolimus, sirolimusLos inhibidores del mTOR son fármacos con múltiples y diversas indicaciones que generalmente suponen pocos efectos sobre el pelo31,85. Están clasificados como infrecuentes causantes de alopecia9. La proporción de alopecia es del 5,3% (1,9-14,3%) con everolimus y del 5,2% (0,9-25,9%) con temsirolimus9. Con sirolimus la prevalencia de alopecia, habitualmente leve y de patrón difuso, es del 9%, y en algunos casos puede afectar también el pelo del cuerpo86. Con sirolimus también están reportados: hipertricosis (cara y cuerpo), 2 casos de AA y foliculitis de cuero cabelludo hasta en un 25%86.
Inhibidores de la PI3K: idelalisib, copanlisib, dactolisibEs una prometedora vía para las neoplasias hematológicas y los tumores cerebrales, con datos escasos sobre reacciones capilares. La presencia de una alta actividad de PI3K en las células del folículo piloso parecía indicar que la inhibición de esta vía podía relacionarse con un alto porcentaje de alopecia87. De hecho, en modelos murinos con dactolisib, la alopecia ha sido el efecto adverso más frecuentemente observado88. Sin embargo, los datos de que disponemos hasta la fecha con idelalisib (fármaco con mayor experiencia) indican una baja proporción de alopecia89.
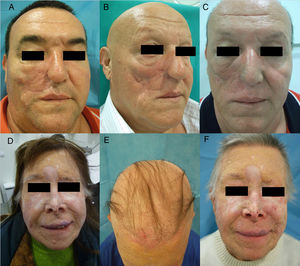
Anti-CD52: alemtuzumabAlemtuzumab es un fármaco anti-CD52 con indicaciones muy diversas. Característicamente presenta múltiples efectos adversos autoinmunológicos90. En este contexto, existen reportes de AA asociada a alemtuzumab, tanto en placas como universal, que pueden ir acompañadas de otros eventos autoinmunes (fig. 5)91. Además, la tasa de alopecia es del 5,3% (0,7-29,4%)9.
Alopecia areata (AA) universal por alemtuzumab (anti-CD52). A) Aspecto antes del tratamiento. B) Placas iniciales de AA en piernas. C y D) Fase final de AA universal.
Fuente: Van der Zwan et al.91.
Los inhibidores de ALK están indicados principalmente en el cáncer de pulmón no microcítico. La tasa de alopecia por crizotinib es del 8% (4,9-13,2%)9,92. Los datos con el resto de los fármacos son escasos, aunque está descrito un caso de alopecia difusa por alectinib en un paciente que ya había recibido crizotinib sin presentar alopecia93.
Inhibidores de la HDAC: belinostat, panobinostat, romidepsina, vorinostatExisten pocos datos sobre los inhibidores de la HDAC hasta el momento. Un estudio de 6 pacientes con linfoma T cutáneo avanzado tratados con vorinostat reveló 2 casos de alopecia leve y uno moderado, sin otros efectos relevantes sobre el pelo94.
Inhibidores RANKL: denosumabDenosumab es el fármaco principal de este grupo y está indicado para el tratamiento de la osteoporosis y de tumores o metástasis relacionados con el hueso. La alopecia no está registrada entre los efectos adversos frecuentes tras 10 años de uso95. Se ha comunicado un caso de AA universal relacionado con el uso de denosumab, tras solo 2 semanas de tratamiento96. Los autores discuten si el hecho de que RANKL sea una molécula de la familia del TNF-α podría tener relación con la aparición de este fenómeno, ya que los anti-TNF-α sí están relacionados de forma frecuente con la aparición de AA paradójica.
Inhibidores de PARP: olaparib, rucaparib, veliparib, talazoparib, iniparibEstán en fase de investigación clínica principalmente para el cáncer de ovario metastásico. En un ensayo clínico de 306 pacientes se demostró que no existía un aumento en la proporción de alopecia con veliparib respecto a placebo97. Otro ensayo demostraba también una disminución estadísticamente significativa de la proporción de alopecia en los pacientes que recibían veliparib/temozolomida en lugar del régimen de quimioterapia clásica con carboplatino/paclitaxel98. Olaparib también demostró ser capaz de reducir la tasa de alopecia cuando se combina con quimioterapia clásica respecto al tratamiento exclusivo con esta99.
Anti-CD30: brentuximabBrentuximab es un tratamiento anti-CD30 indicado principalmente para el linfoma de Hodgkin refractario100. La proporción de alopecia en los pacientes que reciben brentuximab es del 14% (9,9-19,6%)9. Además, de manera anecdótica existe el reporte de un caso de repigmentación completa del cabello en un varón de 72 años a los 6 meses de tratamiento con brentuximab101.
ConclusionesLos efectos secundarios relacionados con el pelo son frecuentes en las nuevas terapias diana dirigidas contra el cáncer (tabla 2). Todo dermatólogo debe conocer los efectos más importantes para el correcto manejo de estos pacientes, cada día más frecuentes en nuestras consultas (tabla 3). Existen múltiples reacciones capilares diferentes dependiendo de la familia de los fármacos implicados. Estas reacciones pueden afectar a la morfología del pelo, como la característica tricomegalia por inhibidores del EGFR. Los cambios pigmentarios también son frecuentes, y van desde la despigmentación típica de los inhibidores de c-kit o VEGF/VEGFR hasta la sorprendente repigmentación relacionada con los inhibidores de PD-1/PDL-1. Incluso las reacciones más típicas, como la alopecia que podemos encontrar especialmente con los inhibidores de la vía Hedgehog, presentan características peculiares y diferenciadas según la terapia responsable. Otros efectos reportados menos frecuentes incluyen cuadros que semejan enfermedades tricológicas «clásicas», como la AA, el liquen plano pilar o la dermatosis pustulosa erosiva del cuero cabelludo. Aunque la trepidante evolución del mundo de las terapias diana no nos permite descanso, esta revisión puede servir como una primera guía de consulta y estudio acerca de los efectos tricológicos relacionados con estos fármacos hasta el momento.
Los 10 fármacos con mayor incidencia de alopecia y su mecanismo de acción
| Posición | Fármaco | Proporción de alopecia | Mecanismo de acción |
|---|---|---|---|
| 1 | Vismodegib | 56,9 (5,6-63,1) | Inhibición Hedgehog |
| 2 | Sorafenib | 29 (23,9-34,7) | Inhibición VEGFR |
| 3 | Vemurafenib | 23,7 (9,6-47,5) | Inhibición BRAF |
| 4 | Regorafenib | 23,5 (9,7-46,7) | Inhibición KIT |
| 5 | Dabrafenib | 18,9 (10,5-31,5) | Inhibición BRAF |
| 6 | Nilotinib | 15,9 (12,4-20,1) | Inhibición KIT |
| 7 | Brentuximab | 14 (9,9-19,4) | Anti-CD30 |
| 8 | Trametinib | 13,3 (6,2-26,4) | Inhibición MEK |
| 9 | Pazopanib | 12,3 (9-16,6) | Inhibición VEGFR |
| 10 | Afatinib | 11,9 (9,1-15,4) | Inhibición EGFR |
Resumen de las reacciones capilares principales y secundarias de las terapias diana antineoplásicas clasificadas por grupos
| Diana | Reacciones capilares principales | Reacciones capilares secundarias |
|---|---|---|
| EGFR | Cambios morfológicos, tricomegalia, alopecia, alopecia inflamatoria, reacción folicular del cuero cabelludo | Cambios de pigmentación |
| HER-2 | Foliculitis en penacho | |
| PD-1/PD-L1/CTLA-4 | Cambios de pigmentación | Cambios morfológicos, AA |
| BRAF | Alopecia RASopática | Dermatitis seborreica |
| MEK | Reducción efectos adversos de los inhibidores de BRAF | Alopecia, tricorrexis nudosa |
| KIT/BCR-ABL | Cambios de pigmentación, alopecia inducida por nilotinib | Queratosis pilar, reacciones liquenoides, AA, madarosis, foliculitis perforante |
| VEGF/VEGFR | Alopecia, despigmentación del pelo | Todos los efectos de los inhibidores EGFR |
| Hedgehog | Alopecia | Tricodisplasia espinulosa |
| Proteasoma | ||
| mTOR | Alopecia (cuero cabelludo y cuerpo), hipertricosis, AA, foliculitis | |
| CD52 | AA | |
| ALK | Alopecia | |
| HDAC | ||
| RANKL | AA | |
| PARP | ||
| CD30 | Alopecia | Repigmentación del pelo |
Los autores declaran no tener ningún conflicto de intereses.