La dermatoscopia nos permite apreciar en una lesión pigmentada estructuras y colores no patentes a simple vista. Comparando imágenes dermatoscópicas sucesivas de un lunar podemos apreciar cambios mucho antes de que esa inestabilidad sea evidente si solo trabajáramos con imágenes macroscópicas convencionales de ese lunar. Uno de los objetivos básicos de la dermatoscopia digital es facilitar el archivo y la comparación de las imágenes sucesivas de los lunares atípicos1, en los que la inestabilidad con ganancia de atipia puede hacernos sospechar que estamos ante un melanoma incipiente o ante un lunar en camino de progresión a melanoma.
En relación con el diagnóstico del melanoma, el uso de la dermatoscopia nos sitúa ante 4 escenarios básicos posibles. El primero se da cuando queremos efectuar el diagnóstico diferencial morfológico entre un posible melanoma y una lesión no melanocítica, como una queratosis seborreica o un epitelioma basocelular2. En este caso el diagnóstico diferencial es estrictamente morfológico. La mayor precisión diagnóstica de la dermatoscopia frente al ojo desnudo evitará bastantes biopsias o extirpaciones innecesarias o innecesariamente urgentes. Y lo más importante, evitará el tratamiento inadecuado o tardío de algún melanoma.
El segundo escenario se da cuando observamos con dermatoscopia una lesión pigmentada con diagnóstico clínicamente muy obvio de melanoma o, alternativamente, de lunar convencional y benigno2. En estos casos el interés diagnóstico de la dermatoscopia es marginal, pero su interés didáctico es muy elevado. Cuando alguien se inicia en el uso de la dermatoscopia es muy importante que se habitúe a apreciar las características morfológicas presentes en lunares y melanomas de diagnóstico obvio. Más adelante deberá buscar esas estructuras y esos colores en lunares atípicos y melanomas incipientes, donde su presencia puede ser mucho más sutil y su valor diagnóstico mucho mayor.
Este segundo escenario nos permite introducir una reflexión muy relevante para la idea central de este trabajo: ¿qué es lo que hace tan sencillo el diagnóstico a simple vista de un gran melanoma de extensión superficial? ¿Cómo y por qué ha adquirido un gran melanoma de extensión superficial esos rasgos morfológicos (ABCDE) tan característicos? El aspecto clínico de cualquier gran melanoma no es casual ni arbitrario. Está condicionado por las alteraciones genéticas subyacentes en las células tumorales, así como por las características anatómicas y microambientales de la región cutánea donde se desarrolla. En nuestra opinión hay 3 procesos biológicos básicos a considerar aquí, ya esbozados en algunos trabajos previos3–6, que condicionan muy directamente la morfología que encontramos en la mayoría de los melanomas de extensión superficial de gran tamaño: crecimiento incontrolado/pérdida de senescencia, inestabilidad genética y regresión.
Los lunares benignos adquiridos no alcanzan el tamaño que observamos en grandes melanomas de diagnóstico tardío. Lo que define el crecimiento de estos melanomas no es su rapidez, que es muy variable, sino que no se autolimita en el espacio y el tiempo, como ocurre con los lunares benignos. Se ha propuesto que un mecanismo de senescencia celular puede ser responsable, al menos en parte, del crecimiento autolimitado en los lunares7. En el melanoma, este mecanismo no se alcanzaría nunca (melanoma de novo) o se perdería tras haberlo alcanzado antes (melanoma asociado a un nevo melanocítico).
La inestabilidad genética es uno de los principales mecanismos responsables de la heterogeneidad intratumoral, implicado en la progresión de muchas neoplasias malignas8. Puede facilitar la presencia de asimetría morfológica en grandes melanomas9, con variedad de colores y texturas en su interior, incluyendo la posibilidad de zonas sobreelevadas y/o ulceradas. El diagnóstico clínico en casos así suele ser muy fácil. La inestabilidad genética también facilita que aparezcan subpoblaciones de células tumorales con distinta eficiencia metastásica y distinta respuesta a los tratamientos disponibles, lo que supone un reto terapéutico8.
Muchos melanomas grandes presentan focos de regresión. Está bien establecido que el melanoma es un tumor bastante inmunogénico10. Con frecuencia el sistema inmune ataca y destruye parcialmente al melanoma y en grandes melanomas esto es fácilmente apreciable a simple vista y facilita su diagnóstico. En ocasiones la destrucción del melanoma primario es completa, aunque durante ese proceso pueden seleccionarse subclones menos inmunogénicos capaces de producir metástasis.
Muchos otros procesos biológicos característicos del fenotipo tumoral maligno condicionan con seguridad el aspecto y/o la evolución del melanoma y muchos otros tumores11, pero los 3 aquí comentados tienen una traducción morfológica inmediata e incuestionable en el melanoma, y de ahí la utilidad diagnóstica de poder detectarlos muy precozmente en un tumor melanocítico. Si apreciamos indicios de su presencia debemos evaluar esa lesión con especial cautela. La ventaja de la dermatoscopia frente al ojo desnudo es obvia, como más adelante veremos. Lo que a simple vista es muy evidente en un gran melanoma, no suele serlo en un melanoma incipiente o en un nevo displásico e inestable. Y esto tiene importantes consecuencias para la prevención y el diagnóstico precoz del melanoma.
El tercer escenario al que nos avoca el uso de la dermatoscopia para el diagnóstico del melanoma empieza a plantearnos más dificultades. Consiste en la distinción entre un lunar atípico y un melanoma incipiente, conscientes de que a simple vista algunos lunares atípicos resultan aparentemente más atípicos que algunos melanomas incipientes12. La dificultad aumenta en los pacientes con muchos lunares atípicos. La dermatoscopia ha demostrado aumentar nuestra precisión diagnóstica en estos casos, pero no nos ofrece una precisión del 100%. Este es el escenario para el que se han ideado múltiples algoritmos para el diagnóstico del melanoma con dermatoscopia, así como el análisis de patrones2. Los algoritmos suelen evaluar la presencia o ausencia de diferentes datos morfológicos concretos en la lesión. El resultado de aplicar un algoritmo nos orienta sobre las posibilidades de que esa lesión sea un melanoma y nos ayuda a decidir: ¿vigilamos o extirpamos? Ningún algoritmo tiene una sensibilidad del 100%, y el hecho de que se hayan desarrollado múltiples algoritmos es en sí mismo indicativo de que ninguno resulta completamente satisfactorio. Todos dejan algún melanoma sin diagnosticar y todos nos pueden inducir a extirpar algunos lunares benignos atípicos. Aunque algún algoritmo considera la información que el paciente pueda aportar sobre la evolución de la lesión13,14, la mayoría de estos algoritmos trabajan solo sobre la morfología (estructuras y colores) que apreciamos con dermatoscopia2. Los utilizamos sobre una foto fija de la lesión. Lo que cuenta al emplear el algoritmo es la presencia o ausencia de determinados datos morfológicos apreciables con dermatoscopia, y no el significado evolutivo que podamos suponer para esos datos morfológicos ni la evolución en sí.
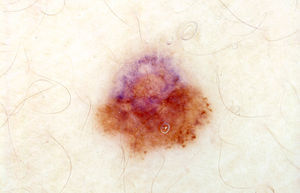
La dificultad para catalogar correctamente como benignas o malignas con dermatoscopia manual algunas lesiones dudosas nos introduce en el cuarto escenario, en el que la decisión de mantener en vigilancia o extirpar un lunar atípico y de naturaleza dudosa vendrá condicionada fundamentalmente por su evolución. Este es el escenario propio de la dermatoscopia digital1. Sabemos que algunos melanomas sin hallazgos morfológicos evidentes de malignidad solo son sospechados como tales ante la presencia de cambios no esperados tras un seguimiento de pocos meses. Y muchos melanomas incipientes se diagnostican con facilidad ante los cambios observados con dermatoscopia digital en periodos más largos de seguimiento, cuando estos cambios pueden no ser aún evidentes a simple vista. En cualquier caso, la información que aporta la dermatoscopia manual no es necesariamente ajena a este escenario. Los procesos biológicos antes mencionados (crecimiento incontrolado/pérdida de senescencia, inestabilidad genética y regresión) tienen un correlato dermatoscópico muy bien definido en muchos casos3. Así, una correcta interpretación de estos datos morfológicos nos puede revelar la dinámica evolutiva de muchos lunares atípicos y melanomas incipientes, aunque ante nuestros ojos solo tengamos la foto fija del momento en que miramos con el dermatoscopio esa lesión. El tercer y el cuarto escenario se solapan si somos capaces de captar la información evolutiva que podemos deducir de una única imagen de dermatoscopia (fig. 1).
Hemos mencionado 3 procesos biológicos (crecimiento incontrolado/pérdida de senescencia, inestabilidad genética y regresión) como responsables principales de la morfología propia de los grandes melanomas de extensión superficial. ¿Tienen estos procesos un correlato dermatoscópico obvio en melanomas muy incipientes y en lunares atípicos e inestables con ganancia de atipia? En nuestra opinión, claramente sí.
En dermatoscopia hay un marcador característico de crecimiento: la presencia de glóbulos periféricos, a veces en forma de maza o pseudópodo, y en ocasiones con morfología lineal (proyecciones radiales). Un anillo de glóbulos periféricos con distribución regular es característico de muchos nevos melanocíticos compuestos en crecimiento15. En nevos de Spitz-Reed puede generar un patrón en estallido. Pero algunos datos deben hacernos considerar la posibilidad de malignidad o de evolución hacia la malignidad, por ejemplo cuando el tamaño, coloración y distribución de los glóbulos periféricos son irregulares, cuando su ubicación es focal (fig. 1) o cuando su pigmentación es anormalmente intensa. Es inquietante la presencia de glóbulos periféricos en lesiones que por su tamaño ya no deberían tenerlos (o en pacientes que por su edad ya no deberían tener lunares en crecimiento) y hay que ser cauto ante su reaparición en un lunar que previamente ya los había perdido, o ante su aparición en una lesión que nunca los tuvo.
La dermatoscopia nos ofrece muchos indicios de inestabilidad genética en lesiones melanocíticas, y la mayoría de algoritmos conceden gran valor a la asimetría estructural (fig. 1), así como a la abundancia de estructuras y colores en la lesión examinada2. Es razonable pensar que la asimetría marcada y/o la presencia de un patrón multicomponente vengan condicionados por la emergencia de subclones de melanocitos que interaccionan de manera desigual con el microambiente cutáneo. La dermatoscopia manual ya nos pone sobre la pista de este fenómeno. En lunares atípicos inestables con ganancia de atipia y en muchos melanomas incipientes el seguimiento con dermatoscopia digital lo puede hacer más evidente ante nuestros ojos. Y si este proceso es muy evidente y progresivo, la vigilancia de esa lesión debe concluir.
La regresión es también fácilmente apreciable con dermatoscopia, como punteado gris en pimienta (fig. 1) o como despigmentación blanca de aspecto pseudocicatricial. La presencia de velo azul-blanquecino en lesiones aplanadas suele asociarse también con áreas de regresión. La regresión no debe confundirse con la involución fisiológica que lleva a muchos lunares a perder pigmentación con el paso del tiempo. La regresión es la consecuencia del ataque del sistema inmune hacia una neoplasia melanocítica, benigna o maligna, en la que el sistema inmune probablemente reconoce cambios premalignos o malignos10. En los nevos melanocíticos convencionales con halo (nevos de Sutton) el problema lo tiene el sistema inmune, y en general no hay por qué extirpar el lunar. En un lunar atípico con regresión el problema lo tiene el lunar. La regresión es, por su propia naturaleza, un fenómeno dinámico y progresivo (hasta que el sistema inmune haya eliminado lo que motiva su ataque o hasta que su ataque sea neutralizado por mecanismos de evasión del sistema inmune puestos en marcha por el propio tumor)10. Las lesiones con regresión dermatoscópica obvia son infrecuentes. Nuestro criterio es favorecer su extirpación.
Hay un cuarto proceso que suele permanecer oculto a nuestros ojos en melanomas incipientes, pero es fácil de reconocer con dermatoscopia: la angiogénesis tumoral patológica. La visualización de vasos en el seno de un tumor melanocítico no es sinónimo de malignidad. Los nevos dérmicos muestran vasos en coma, a veces muy abundantes y prominentes. Sin embargo, algunos patrones vasculares (vasos puntiformes, vasos en sacacorchos y vasos polimorfos, entre otros) son muy sugestivos de malignidad16. La presencia de una reacción inflamatoria en el microambiente tumoral (otro de los procesos biológicos básicos implicados en la progresión tumoral11) también puede generar eritema y aumento de vascularización. Con frecuencia el aumento patológico de vascularización en un melanoma es focal o muestra distribución irregular. En algunos melanomas hipomelanóticos o amelanóticos puede darnos la única clave diagnóstica.
Los 4 procesos ya esbozados (crecimiento incontrolado/pérdida de senescencia, inestabilidad genética, regresión y angiogénesis tumoral patológica) son por definición procesos dinámicos, con un correlato dermatoscópico bien definido en muchos casos. La presencia de los datos dermatoscópicos asociados habitualmente a dichos procesos biológicos en un tumor melanocítico nos ayuda a reconocer de dónde viene y hacia dónde va esa lesión, aunque solo dispongamos de una única imagen dermatoscópica de la misma. La dermatoscopia digital es muy útil cuando queremos valorar la estabilidad de un lunar atípico y asegurarnos de que no gana atipia en el tiempo1. Pero su indicación puede ser cuestionada cuando la imagen de una lesión melanocítica atípica ya contiene elementos que hacen muy probable que esté cambiando y ganando atipia. ¿Vigilamos o extirpamos? En este último caso nuestra propuesta es extirpar. Como han señalado previamente otros autores, lo importante en estos casos no es acertar en el diagnóstico, sino acertar en la actitud17.
La inmensa mayoría de los lunares atípicos son estables, o cambian sin ganar atipia. Su seguimiento con dermatoscopia digital corrobora este hecho y evita extirpaciones innecesarias1. Pero algunos lunares, con o sin atipia clínica de partida, pueden cambiar, ganar atipia y generar un melanoma. La interpretación con un enfoque biológico de algunos hallazgos dermatoscópicos nos pone fácilmente en la pista de lesiones que están sufriendo cambios característicos de la progresión tumoral hacia la malignidad, o de la malignidad misma. La extirpación de estas lesiones, con certeza inestables, puede contribuir no solo a diagnosticar más precozmente el melanoma, sino también a prevenirlo cuando actuamos sobre un lunar en proceso de transformación a melanoma. Nuestra actuación debe ser muy selectiva para no incrementar innecesariamente el número de lunares benignos extirpados. Y su eficacia debería reflejarse en una reducción en la incidencia de melanoma a largo plazo en nuestros pacientes en seguimiento18.
Con un sentido práctico, y desde esta perspectiva biológica, nuestra propuesta es valorar de entrada la presencia de asimetría estructural en los lunares atípicos. La asimetría en ausencia de cualquier otro dato problemático admitiría vigilancia (muchos lunares atípicos adquiridos y bastantes nevos melanocíticos de patrón congénito muestran asimetría en un eje y estabilidad a largo plazo). Si la asimetría estructural, que sugiere posible inestabilidad genética, se asocia en un lunar a signos de cualquiera de los otros 3 procesos (crecimiento incontrolado/pérdida de senescencia, regresión, angiogénesis patológica), nuestro criterio es favorecer siempre su extirpación, incluso aunque la imagen no sugiera aún que esa lesión es ya un melanoma. Algunos melanomas surgen a partir de nevos melanocíticos, y por lo tanto nos brindan la oportunidad de evitar su aparición cuando estamos vigilando a esos nevos melanocíticos y muestran signos de inestabilidad problemática. El potencial preventivo de la dermatoscopia no debería llevarnos a extirpar muchos más lunares atípicos, sino a extirpar preferentemente aquellos con signos obvios de inestabilidad con ganancia de atipia o de estar sufriendo procesos biológicos característicos de la progresión tumoral hacia la malignidad.
Nuestro planteamiento tiene algunas limitaciones. En el lentigo maligno facial y en el melanoma lentiginoso acral los hallazgos dermatoscópicos iniciales están preferentemente condicionados por la peculiar disposición de los melanocitos tumorales en relación con la microanatomía cutánea de esas zonas19. La precoz invasión folicular en el lentigo maligno genera imágenes de pigmentación perifolicular asimétrica. En pequeños melanomas lentiginosos acrales se identifica un patrón paralelo de la cresta debido a la acumulación de melanocitos tumorales alrededor de la cresta profunda intermedia, por donde discurren los acrosiringios. Estos hallazgos nos pueden dar la clave diagnóstica en casos incipientes de estos subtipos de melanoma, cuando aún no muestran los signos propios de los mecanismos biológicos esbozados en este trabajo.
Finalmente, los melanomas nodulares de rápido crecimiento plantean también limitaciones a nuestro enfoque. Su diagnóstico precoz es a la vez difícil y de importancia crítica para reducir la mortalidad asociada a este subtipo de melanoma. De la regla ABCDE muchos tan solo cumplirán la E. Para facilitar su diagnóstico precoz se ha propuesto la regla EFG, por las siglas en inglés de elevación, firmeza a la palpación y crecimiento continuado durante más de un mes20. La dermatoscopia de los melanomas nodulares incipientes es con frecuencia poco expresiva, aunque puede ofrecer algunos datos que orientan el diagnóstico, por ejemplo un patrón vascular atípico y prominente como reflejo de la neoangiogénesis característica de estos tumores, mucho más evidente en lesiones hipomelanóticas20. La detección de estos melanomas puede beneficiarse mucho del seguimiento de los pacientes de riesgo con imágenes panorámicas basales (útiles también para labores de autovigilancia), ya que es una de las formas más precisas de detectar pequeñas lesiones nuevas o inestables de crecimiento rápido, a veces amelanóticas. Estas lesiones siempre deberán ser evaluadas de forma inmediata y con mucha cautela. En caso de duda, mejor extirpar.