Las infecciones por virus herpes presentan una frecuencia no desdeñable en pacientes hematológicos. El primer caso corresponde a una paciente con leucemia linfática crónica con un herpes genital extenso refractario a aciclovir, con respuesta parcial a foscarnet que hubo que suspender por efectos secundarios sistémicos. El segundo caso es el de una paciente con un linfoma de Hodgkin folicular que presentaba un herpes hipertrófico refractario a tratamiento con aciclovir, que respondió a cidofovir intralesional e imiquimod tópico. Los pacientes hematológicos, al igual que otros enfermos inmunodeprimidos, pueden presentar manifestaciones atípicas de infección por virus herpes, así como resistencia a los tratamientos que actúan por medio de la timidina quinasa viral. Esto hace necesario tener una alta sospecha clínica para poder alcanzar un diagnóstico precoz, y conocer los diferentes tratamientos alternativos disponibles.
Herpesvirus infections are not uncommon in hematologic patients. Our first patient, diagnosed with chronic lymphatic leukemia, presented extensive genital herpes infection refractory to treatment with aciclovir and with a partial response to foscarnet, which had to be withdrawn due to systemic adverse effects. The second patient, diagnosed with follicular Hodgkin lymphoma, presented hypertrophic herpes infection refractory to treatment with aciclovir but that responded to intralesional cidofovir and topical imiquimod. As in other immunocompromised patients, herpesvirus infection in hematologic patients can present atypical manifestations, as well as resistance to treatments that are activated by the viral thymidine kinase. A high level of clinical suspicion is therefore needed to make an early diagnosis, together with extensive knowledge of the different treatments available.
Las infecciones por virus de la familia Herpesviridae son altamente frecuentes en pacientes con enfermedad hematológica. De ellos, las producidas por el subgrupo Alpha-herpesviridae, que incluye el virus herpes tipo i (VHS I), virus herpes tipo ii (VHS II) y virus varicela-zóster (VVZ) son hallazgos frecuentes en la práctica clínica habitual. Es común la presentación atípica y con resistencias a los fármacos habituales (aciclovir, valaciclovir y famciclovir), por lo que el diagnóstico y el tratamiento en estos casos puede suponer un reto. Presentamos 2 casos de infección por VHS II en pacientes hematológicos, de presentación inusual y con resistencias a los tratamientos habituales.
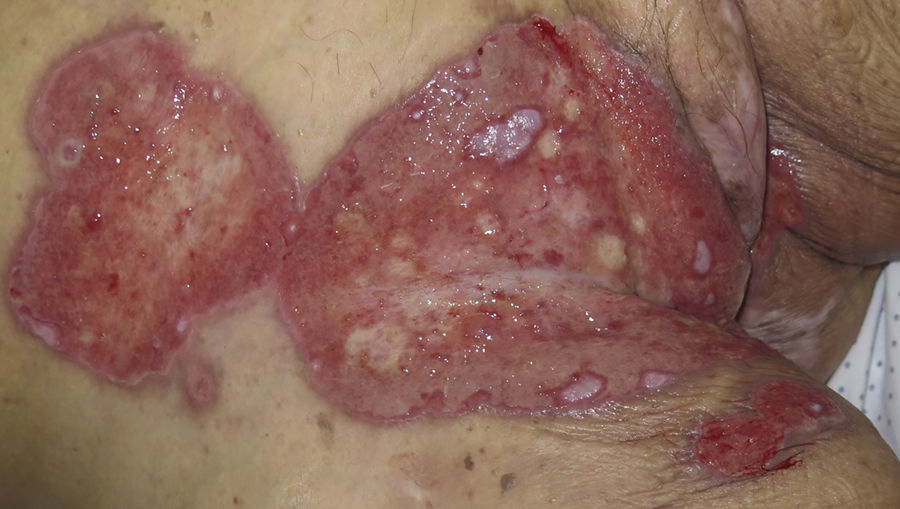
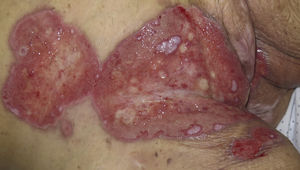
Caso 1Mujer de 84 años con antecedentes de hipertensión arterial, diabetes mellitus tipo 2, hipercolesterolemia y leucemia linfática crónica en seguimiento sin tratamiento por hematología. En el año 2015 recibe tratamiento con aciclovir iv por úlceras perianales y vulvares secundarias a infección por VHS II, con remisión parcial y pérdida de seguimiento al alta. En marzo de 2017 ingresa por nuevo brote de lesiones. A la exploración presentaba amplias úlceras malolientes, de fondo fibrinoso, con exudación y borde eritematoso, distribuidas en la región vulvar, perianal, inguinal bilateral, porción interna de los muslos e hipogastrio (fig. 1). Se recogió PCR de virus herpes, que resultó positiva para VHS tipo ii y se inició tratamiento con aciclovir iv a dosis de 10mg/kg cada 8horas y cidofovir en crema al 1%, una aplicación diaria. Tras 10 días de tratamiento, ante la ausencia de mejoría, y dado que la paciente presenta una hipogammaglobulinemia grave, se administró una dosis de inmunoglobulina iv a dosis de 0,4g/kg y se mantuvo el mismo tratamiento. Ante el empeoramiento progresivo del cuadro clínico se planteó la posibilidad de resistencia al tratamiento con aciclovir y se decidió iniciar tratamiento con foscarnet iv a dosis de 40mg/kg cada 8horas e imiquimod en crema al 5% 3 veces en semana. Las lesiones cutáneas comenzaron a mejorar de forma paulatina, pero teniendo en cuenta el estado basal de la paciente, las múltiples complicaciones derivadas del tratamiento con foscarnet (hipocalcemia, hipomagnesemia, hipofosfatemia e hipopotasemia refractarias a suplementos orales e intravenosos), 2 infecciones del tracto urinario (una producida por K. pneumoniae y otra por E. faecium) resueltas con tratamiento antibiótico, empeoramiento progresivo de la función renal y varios episodios de agudización de insuficiencia cardíaca se decidió suspender el tratamiento intensivo de la infección por VHS II y proceder al alta de la paciente manteniendo el tratamiento con imiquimod al 5% en crema y valaciclovir oral. Finalmente, 3 meses tras el alta, la paciente acudió a urgencias, donde falleció por un cuadro de sepsis de origen urinario.
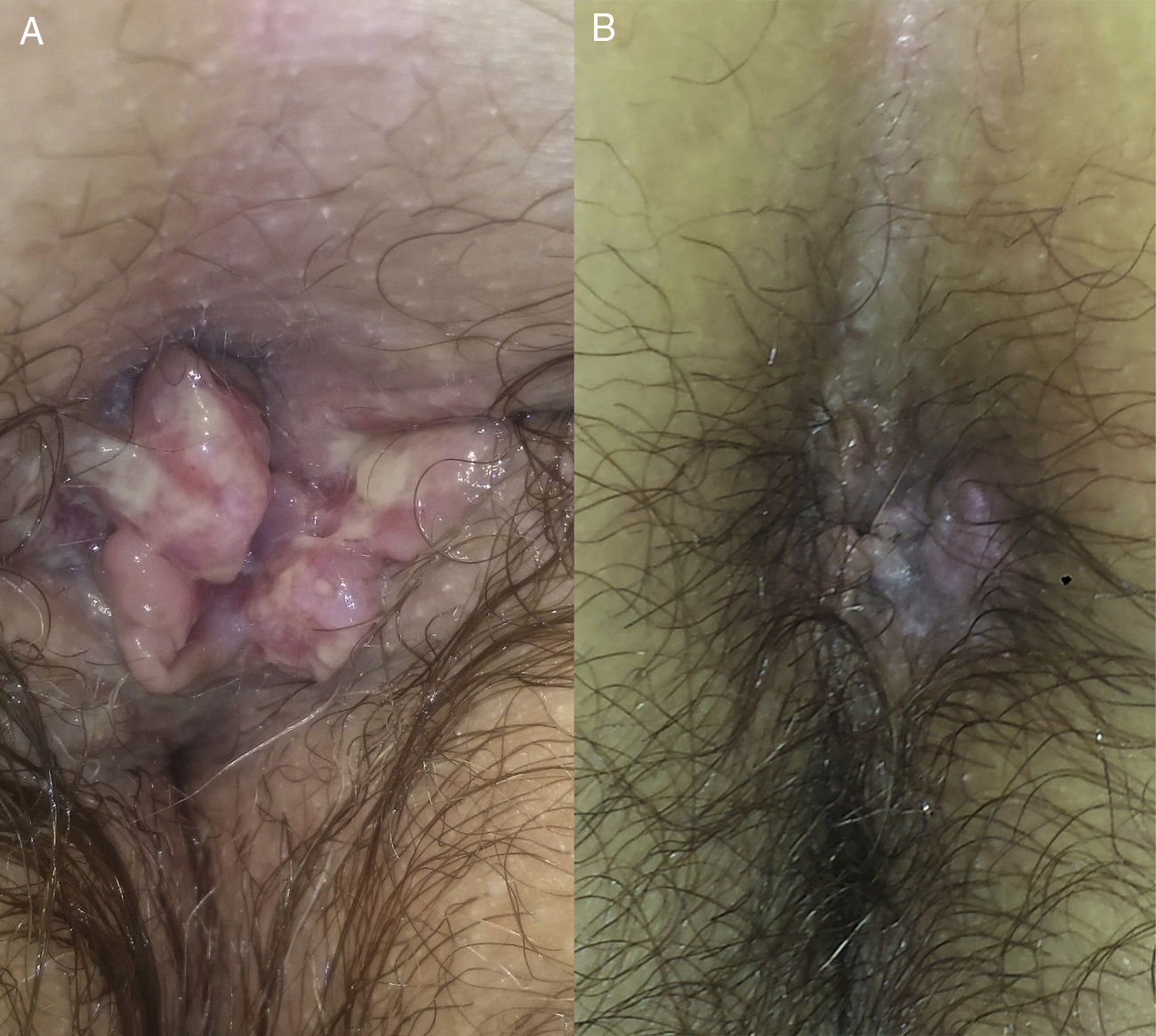
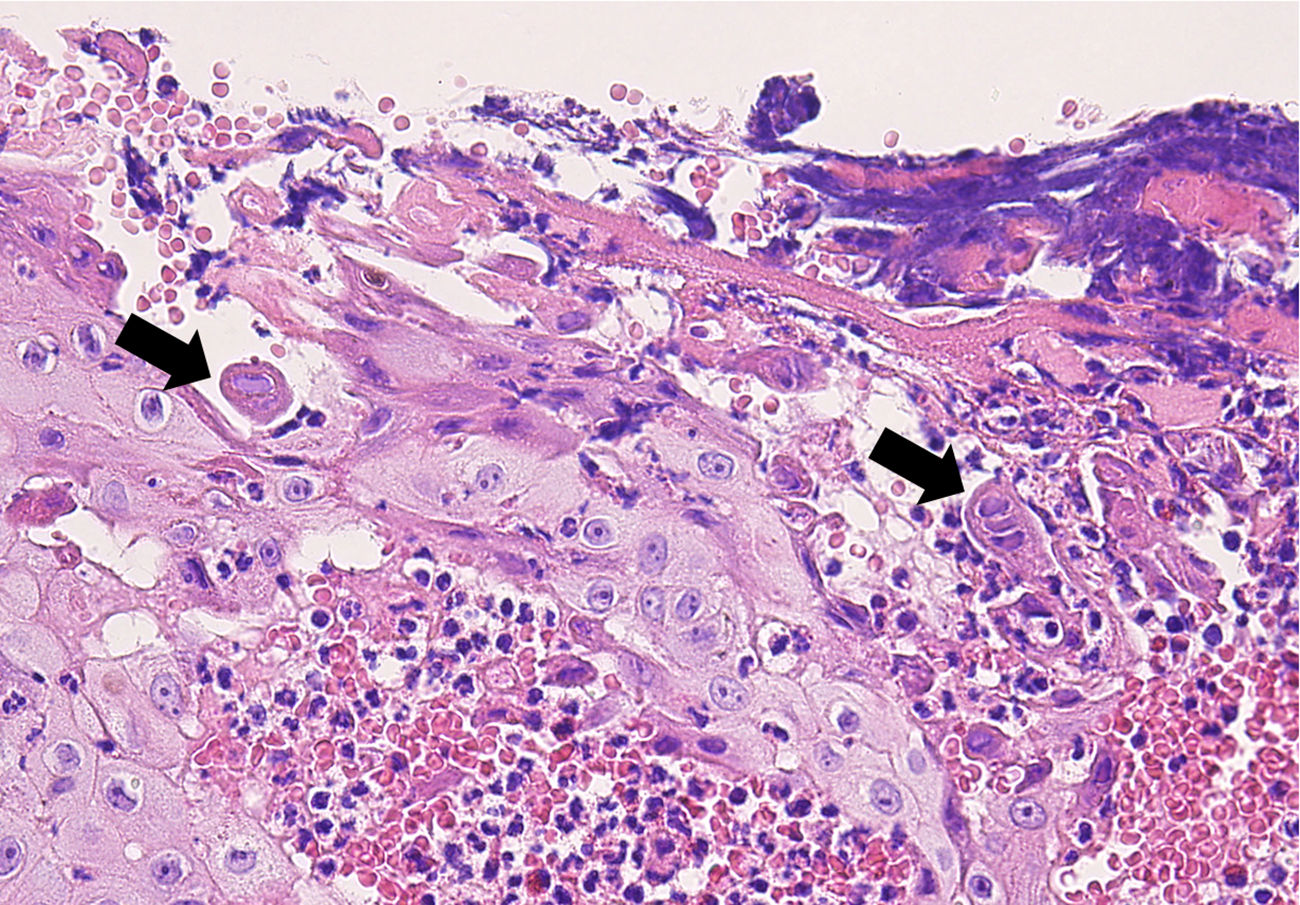
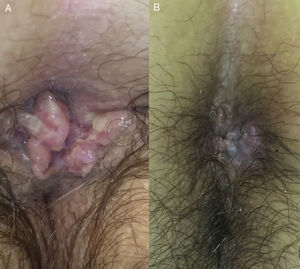
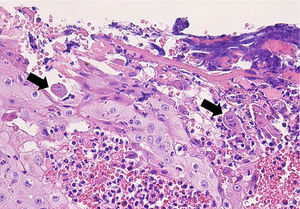
Caso 2Mujer de 64 años con antecedentes de linfoma de Hodgkin folicular, para el que había recibido trasplante de médula ósea (TMO), e infección por VHS II perianal. Acude en 2008 por presentar una lesión excrecente en la región perianal (fig. 2) que se biopsió para descartar carcinoma epidermoide perianal. La biopsia evidenciaba una hiperplasia epidérmica con células gigantes multinucleadas y células epiteliales de núcleo gris con cromatina marginada compatibles con infección por virus herpes (fig. 3), y la PCR para virus herpes resultó positiva para VHS II, por lo que la paciente fue finalmente diagnosticada de herpes simple perianal hipertrófico. A pesar del tratamiento con aciclovir oral a dosis de 400mg cada 4horas durante 7 días no se objetivó mejoría de la lesión, por lo que se administró una dosis de 0,3ml de cidofovir intralesional, con resolución completa del cuadro (fig. 2). Ante las frecuentes recidivas se decidió la aplicación de imiquimod 5% en crema 3 veces en semana, presentado una respuesta favorable mantenida en los últimos 3 meses desde el inicio de la aplicación.
Las infecciones por virus herpes simple son altamente frecuentes en el paciente hematológico, con una incidencia variable entre el 15% en pacientes con leucemia linfática crónica a un 90% en pacientes con diagnóstico de leucemia aguda o que han sido sometidos a TMO1. Las manifestaciones clínicas suelen ser el resultado de la reactivación de un virus latente, en forma de afectación oral (85-90%) o genital (10-15%), ya que la primoinfección en este tipo de pacientes es bastante inusual2.
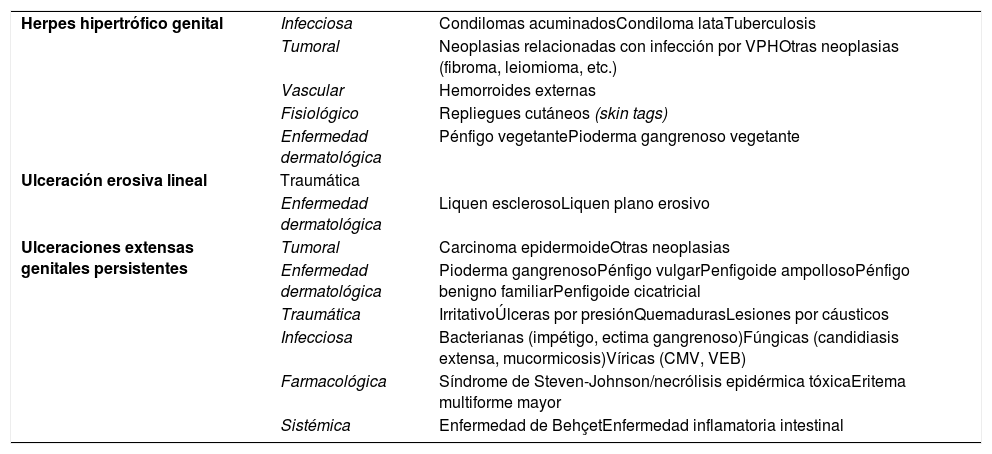
La presentación de la infección por VHS II en pacientes hematológicos puede ser crónica y atípica3 en forma de erupción papular generalizada, amplias ulceraciones de bordes geográficos, ulceración erosiva lineal, herpes simple vegetante4, lesiones de crecimiento verrucoso que pueden simular una neoplasia, o casos que presentan placas necróticas5, pudiendo plantearse el diagnóstico diferencial con múltiples entidades (tabla 1).
Diagnóstico diferencial de presentaciones atípicas de infección por VHS II
| Herpes hipertrófico genital | Infecciosa | Condilomas acuminadosCondiloma lataTuberculosis |
| Tumoral | Neoplasias relacionadas con infección por VPHOtras neoplasias (fibroma, leiomioma, etc.) | |
| Vascular | Hemorroides externas | |
| Fisiológico | Repliegues cutáneos (skin tags) | |
| Enfermedad dermatológica | Pénfigo vegetantePioderma gangrenoso vegetante | |
| Ulceración erosiva lineal | Traumática | |
| Enfermedad dermatológica | Liquen esclerosoLiquen plano erosivo | |
| Ulceraciones extensas genitales persistentes | Tumoral | Carcinoma epidermoideOtras neoplasias |
| Enfermedad dermatológica | Pioderma gangrenosoPénfigo vulgarPenfigoide ampollosoPénfigo benigno familiarPenfigoide cicatricial | |
| Traumática | IrritativoÚlceras por presiónQuemadurasLesiones por cáusticos | |
| Infecciosa | Bacterianas (impétigo, ectima gangrenoso)Fúngicas (candidiasis extensa, mucormicosis)Víricas (CMV, VEB) | |
| Farmacológica | Síndrome de Steven-Johnson/necrólisis epidérmica tóxicaEritema multiforme mayor | |
| Sistémica | Enfermedad de BehçetEnfermedad inflamatoria intestinal | |
En el caso del herpes simple hipertrófico se suele manifestar en forma de lesiones tumorales exofíticas y dolorosas, que pueden presentar de forma ocasional ulceración en su superficie, planteando el diagnóstico diferencial con lesiones por virus del papiloma humano, sífilis secundaria o lesiones tumorales (carcinoma epidermoide o linfoma)6. La biopsia suele mostrar un denso infiltrado inflamatorio de células plasmáticas, linfocitos y eosinófilos, asociado a un grado variable de hiperplasia epidérmica, con células gigantes multinucleadas mostrando los efectos citopáticos de la infección por VHS (células epiteliales de núcleo gris con cromatina marginada)7. El mecanismo de esta variante hipertrófica es desconocido, pero se plantea que se deba a una anormal respuesta inmune de tipo Th-2 que conduciría a una proliferación exagerada de queratinocitos y fibroblastos6,8.
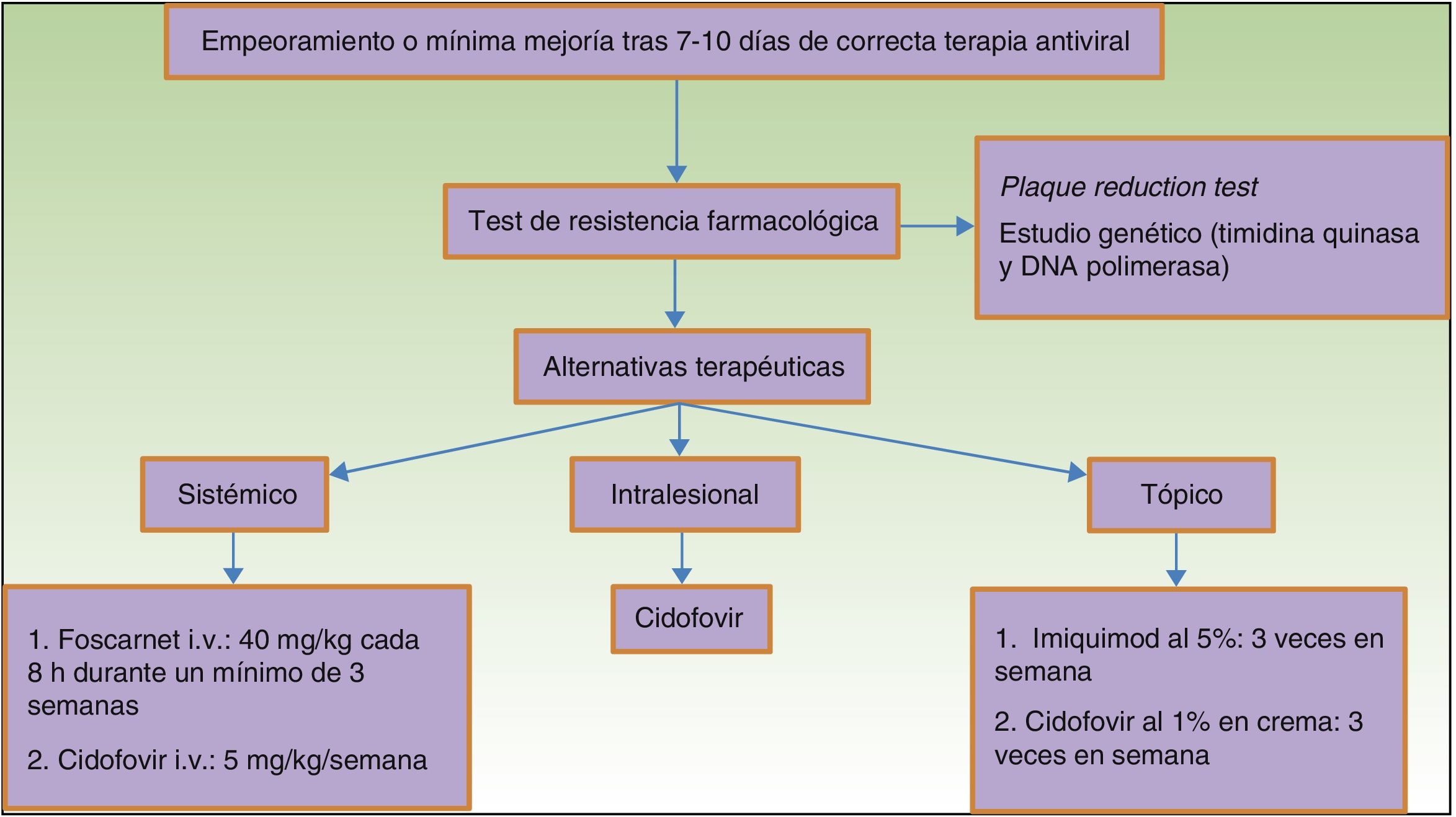
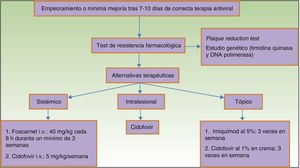
En cuanto a la resistencia de VHS a aciclovir es muy poco frecuente en pacientes inmunocompetentes (<1%), siendo más habitual en pacientes positivos para el VIH9 (5,3%) o hematológicos2. En el caso de pacientes hematológicos se ha observado que la resistencia es menor en trasplantados de médula ósea que reciben profilaxis prolongada10, pero es mayor si la reactivación tiene una larga duración. El mecanismo en el 95% se debe a una disminución en la timidina quinasa viral, reduciendo la activación del aciclovir en las células infectadas2. Todas las cepas resistentes a aciclovir son también resistentes a valaciclovir, ganciclovir y casi todas a famciclovir. En estos casos las alternativas terapéuticas incluyen foscarnet intravenoso o cidofovir intravenoso o tópico, ya que estos fármacos no requieren el uso de la timidina quinasa para su activación. Existen técnicas que pueden permitir detectar la resistencia de VHS a los tratamientos antivirales11, entre las que se encuentran técnicas fenotípicas y genotípicas, como son el análisis de los genes de la timidina quinasa y de la ADN-polimerasa viral12. Sin embargo, dichas técnicas son poco accesibles para la mayoría de los laboratorios, por lo que la sospecha de resistencia a fármacos habituales se basa en la evolución clínica y en la respuesta terapéutica observada (fig. 4).
En los pacientes con herpes simple hipertrófico se ha observado una mayor resistencia a los fármacos de primera línea, planteándose la hipótesis de que pueda ser debido bien al aumento de frecuencia de cepas resistentes en la lesión, bien a la disminución del depósito del fármaco en el tejido pseudotumoral6. El imiquimod es una molécula antagonista de los receptores Toll-like, sobre todo del receptor Toll-like 7, provocando la liberación de citoquinas proinflamatorias como el interferón alfa, la interleuquina 6 o el factor de necrosis tumoral alfa. Su uso tópico, en forma de crema al 5%, 3 veces en semana, ha demostrado ser útil en la mejoría clínica, pocas semanas después de su administración, y con escasos efectos secundarios locales6,13.
En conclusión, la inmunosupresión derivada de las neoplasias hematológicas supone una alta incidencia de infecciones cutáneas víricas, fúngicas y bacterianas, en muchas ocasiones de presentación atípica. Se hace necesario tener una alta sospecha clínica para poder alcanzar un diagnóstico precoz, y conocer los diferentes tratamientos disponibles, puesto que la resistencia a los fármacos de primera línea es relativamente frecuente en estos pacientes.
Responsabilidades éticasProtección de personas y animales.Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.