Tanto la pitiriasis liquenoide y varioliforme aguda como la pitiriasis liquenoide crónica representan 2 extremos de un espectro de enfermedad de etiología desconocida. En este trabajo se describen 2 casos de pitiriasis liquenoide y varioliforme aguda, en los que se detectó ADN de virus herpes humano tipo 7 en muestras de piel mediante la metodología de reacción en cadena de la polimerasa, una asociación no descrita previamente. Este manuscrito puede apoyar la participación de la infección viral en la etiopatogenia de esta enfermedad.
Pityriasis lichenoides et varioliformis acuta and pityriasis lichenoides chronica represent 2 ends of a disease spectrum of unknown etiology. Herein we describe 2 cases of pityriasis lichenoides et varioliformis acuta, in which human herpesvirus 7 DNA was detected in skin samples by polymerase chain reaction methodology, an association not previously described. This report may support the involvement of viral infection in the etiopathogeny of this disease.
Tanto la pitiriasis liquenoide y varioliforme aguda (PLEVA) como la pitiriasis liquenoide crónica representan 2 extremos de un espectro de enfermedad en el que coexisten ambas entidades y formas intermedias1. Las presentaciones clínicas van desde la aparición de erupciones cutáneas de pápulas inflamatorias y papulovesículos que desarrollan necrosis hemorrágicas y son de varias semanas de evolución, hasta la aparición de pápulas descamativas de color parduzco de meses de evolución en el caso de la pitiriasis liquenoide crónica2. El diagnóstico se basa en la presentación clínica y en la histopatología de las lesiones3. La fisiopatología no termina de entenderse del todo aunque algunos casos se han asociado a agentes infecciosos4,5.
A continuación, describimos 2 casos de PLEVA asociados al virus herpes humano tipo 7 (VHH-7).
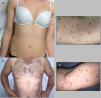
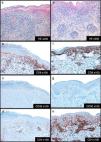
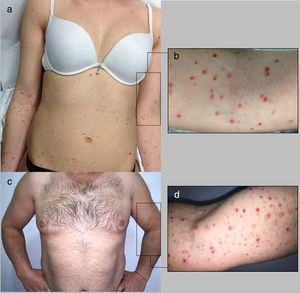
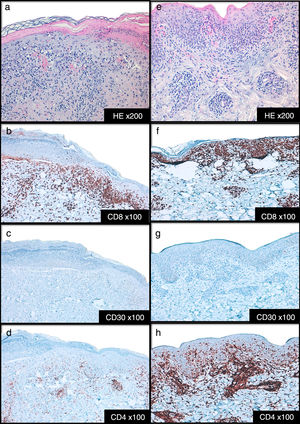
Descripción de casosCaso 1Mujer de 26 años de edad, previamente sana, que acude a nuestra unidad por presentar una erupción prurítica generalizada de 2 semanas de evolución. No se aprecian otros signos, síntomas, ni ingesta de fármacos. La exploración física revela múltiples pápulas eritematosas con propagación a extremidades y tronco, con algunas costras hemorrágicas y otras con una fina escamación (figs. 1a-b). No se detectan adenopatías palpables. Las pruebas que se realizan en laboratorio confirman la presencia de niveles altos de la proteína C reactiva (13mg/l; normal<3), un recuento normal de glóbulos rojos, una química hepática y renal normales, y resultado negativo a la prueba de los anticuerpos antinucleares. Las pruebas serológicas que se practican para descartar presencia de virus de la hepatitis B, virus de la hepatitis C, virus de la inmunodeficiencia humana y sífilis dan negativo. Sin embargo, las pruebas serológicas que se realizan para descartar presencia de citomegalovirus, virus del herpes símplex 1, parvovirus B19 y virus varicela zóster dan positivo para anticuerpos IgG, pero negativo para anticuerpos IgM lo cual indica una infección en el pasado. Las pruebas serológicas que se realizan para descartar presencia tanto del virus de Epstein-Barr como de virus del herpes símplex 2 dan, ambas, negativo, tanto para anticuerpos IgG como para anticuerpos IgM. La biopsia cutánea que se realiza revela presencia de acantosis epidérmica, hiperqueratosis ortoqueratósica y un infiltrado linfocítico perivascular en la dermis asociado a eritrocitos extravasados. (fig. 2a). La inmunohistoquímica revela una predominancia de células T CD8+, un descenso en el recuento de células Langerhans y ausencia de evidencias de células CD30+ (fig. 2b-d). La prueba de la reacción en cadena de la polimerasa a tiempo real (RCP-TR) confirma la presencia de ADN de VHH-7, aunque da negativa para presencia de ADN de virus herpes humano tipo 6 (VHH-6) y ADN de Treponema pallidum en el fragmento de piel. El diagnóstico de PLEVA se llevó a cabo en base a los hallazgos clínicos e histopatológicos. Se prescribe claritromicina oral (500mg 2 veces/día) y betametasona valerato tópica asociada a ácido fusídico, observándose una remisión total un mes después de la lesión. Tras 4 meses de seguimiento, no se observa recurrencia alguna.
Varón de 44 años de edad derivado a nuestra clínica tras presentar una erupción cutánea de 6 semanas de evolución consistente en pápulas costrosas y descamativas eritematosas, y pequeñas placas localizadas en tronco y extremidades (fig. 1c-d). El paciente niega la presencia de síntomas sistémicos asociados. No se aprecia nada especial en su historia clínica así como tampoco antecedentes de factores precipitantes, ni siquiera ingesta de fármacos o infección previa a la aparición del sarpullido. No se observan adenopatías palpables. El análisis de laboratorio, incluido el recuento completo de glóbulos rojos con químicas hepática y renal diferenciales y anticuerpos antinucleares está dentro de los rangos normales. Las pruebas serológicas que se realizan para descartar presencia de virus de la hepatitis B, virus de la hepatitis C, virus de la inmunodeficiencia humana y sífilis dan negativo. La exploración histopatológica revela presencia de hiperqueratosis epidérmica, infiltrado inflamatorio linfocítico en dermis y epidermis, asociado a la vacuolización de la capa basal y eritrocitos extravasados en dermis papilar (fig. 2e). La inmunohistoquímica revela una predominancia de células T CD8+ intraepidérmicas con células T CD4+ perivasculares, así como un descenso/ausencia de células Langerhans y células CD30+ (fig. 2f-h). Hallazgos consistentes con un diagnóstico de PLEVA. La prueba de la RCP-TR da positivo para ADN de VHH-7 y negativo para presencia de ADN de VHH-6 y Treponema pallidum en el fragmento de piel. La prueba de la RCP-TR cualitativa da negativo para presencia de ADN de VHH-6 y VHH-7. Se prescribe doxiciclina oral (100mg 2 veces/día) y betametasona valerato tópica asociada a ácido fusídico. Una semana después, el paciente advierte una mejoría e interrumpe el tratamiento espontáneamente. No se ha registrado recurrencia alguna de la lesión tras 2 meses de seguimiento.
DiscusiónLa patogénesis de la pitiriasis liquenoide (PL) no termina de estar clara y son varias las hipótesis que se han propuesto hasta la fecha4. La PL podría ser una reacción inflamatoria desencadenada por antígenos extrínsecos con la implicación de múltiples agentes. Agentes infecciosos como los virus (virus de la inmunodeficiencia humana, citomegalovirus, virus de Epstein-Barr, parvovirus B19, virus varicela zóster, adenovirus, virus de la hepatitis C, virus herpes humano tipo 8 y virus del herpes símplex)5–7, las bacterias (estreptococo betahemolítico y estafilococo coagulasa positivo)5, o los protozoos (Toxoplasma gondii)5 se han propuesto como posibles desencadenantes de la PLEVA. Los fármacos (tratamiento hormonal con estrógenos-progesterona, antibióticos, acetaminofeno, inmunoglobulinas, agentes biológicos, agentes citostáticos e inhibidores de la HMG-CoA reductasa)3,8–10 y las vacunas (vacuna del sarampión viva atenuada, la vacuna combinada sarampión-paperas-rubéola, la vacuna del tétanos, la vacuna de la hepatitis B) también se han asociado a la PLEVA3,5. Según esta teoría, la detección de clones de células T en la PL podría ser representativa de una respuesta inmunológica clonal a un antígeno extrínseco. No obstante, un estudio descubrió antecedentes infectivos en, solo, el 30% de los pacientes con PL11. Algunos informes ocasionales de PL que han evolucionado hacia linfomas cutáneos de células T, y la detección de clonalidad de células T, han hecho que algunos se atrevan a plantear la hipótesis de que la PL, aunque no sea un verdadero linfoma cutáneo de células T, sí represente una reacción inflamatoria de una discrasia de células T subyacente12. En cualquier caso, la monoclonalidad no se encuentra, de forma uniforme, en la PL y, además, la detección de monoclonalidad, por sí sola, no basta para designar un trastorno como enfermedad linfoproliferativa primaria12. Por último, algunos autores confirmaron la presencia de un componente de vasculitis mediada por inmunocomplejos en el desarrollo de la PL3.
Muchos casos de PL presentan una tendencia autoinvolutiva y no necesitan tratamiento. En los casos más severos, el tratamiento sí está indicado e incluye la administración de antibióticos sistémicos, fármacos antiinflamatorios tópicos, fármacos inmunosupresores sistémicos y fototerapia ultravioleta5. La razón de que estos tratamientos funcionen es todo un misterio.
En nuestros pacientes con PLEVA, se detectó ADN de VHH-7 en muestras cutáneas mediante el método cualitativo de la prueba de la RCP-TR, una asociación no descrita con anterioridad. Al igual que ocurre con otros virus herpes humanos, las infecciones por VHH-7 pueden manifestarse a través de compromiso cutáneo13. El VHH-7 está implicado en la etiopatogenia de trastornos cutáneos inflamatorios tales como la pitiriasis rosada y el liquen plano13,14. Existen, también, evidencias del papel que desempeña el VHH-7 en el desarrollo del exantema súbito (roséola infantil) y otros sarpullidos infantiles13,14. Además, el síndrome de hipersensibilidad inducida por fármacos se ha asociado a una reactivación de, solo, el VHH-7, o, también, del VHH-614. El papel que desempeña el VHH-7 en varias enfermedades sistémicas y trastornos cutáneos todavía está pendiente de definición.
A pesar de las similitudes de nuestros pacientes, incluido el cuadro clínico, la histopatología, la positividad por VHH-7 y la evolución, demostrar la presencia de etiología viral es un problema complejo. Métodos moleculares cualitativos como la prueba de la RCP-TR son altamente sensibles, pero no ofrecen evidencias concluyentes que nos permitan establecer un nexo etiológico15. La prueba de la RCP solo es capaz de valorar la mera presencia de ADN de VHH. No sirve para valorar la relativa importancia que tiene la contaminación por ADN vírico por células latentemente infectadas, y por si esto fuera poco, el VHH-7 es un virus linfotrópico que se replica en los linfocitos T CD4+15. La alta prevalencia de infección por VHH-7 en la población general es otro problema añadido15. El VHH-7 puede estar inducido por la latencia de las células T mediante activación celular. Esto explicaría la detección del virus en el fragmento de piel. Resulta interesante que el VHH-6, que es capaz de replicarse, muy eficazmente, en las células T primarias activadas, no se detectara en nuestros pacientes.
La habilidad que tiene el VHH-7 para inducir la producción de citocinas en células infectadas podría hacer que el VHH-7 fuese un importante cofactor patogénico tanto en los trastornos inflamatorios como en los neoplásicos13. La presencia de VHH-7 en la piel lesionada de los pacientes podría ser indicativa de que este virus desempeña un papel en la patogénesis de la PLEVA. Sea como fuere, no termina de estar claro si el VHH-7 actúa como un verdadero desencadenante antigénico de la PLEVA o si esta relación es una mera coincidencia.
ConclusiónEste informe permite inferir la posibilidad de que el VHH-7 tiene un papel importante en la patogénesis de la PLEVA, lo cual avalaría la implicación de una infección viral en esta enfermedad. No obstante, han de realizarse más estudios que nos ayuden a determinar cuál es el papel que desempeña, exactamente, el VHH-7 u otros agentes infecciosos en la etiopatogenia de la PLEVA.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.