La obesidad, en particular la abdominal, se considera en la actualidad como un proceso inflamatorio crónico de bajo grado que participa de forma activa en el desarrollo de los fenómenos fisiopatológicos responsables del síndrome metabólico y la morbilidad cardiovascular a través de la secreción de adipocinas y citocinas proinflamatorias. En los últimos años se ha establecido un vínculo firme entre psoriasis y obesidad que abarca aspectos genéticos, patogénicos y epidemiológicos, con importantes repercusiones en la salud del individuo. Es probable una relación bidireccional, en la que la obesidad predispone a la psoriasis, pero también la psoriasis favorece la obesidad.
La obesidad tiene también importantes implicaciones terapéuticas, como el mayor riesgo de efectos adversos en el caso de los fármacos sistémicos convencionales y la disminución de la eficacia y/o el incremento del coste en el caso de los fármacos biológicos, que hace recomendable ajustar la dosis al peso del paciente.
Obesity, particularly abdominal obesity, is currently considered a chronic low-grade inflammatory condition that plays an active role in the development of the pathophysiologic phenomena responsible for metabolic syndrome and cardiovascular disease through the secretion of proinflammatory adipokines and cytokines. In recent years clear genetic, pathogenic, and epidemiologic links have been established between psoriasis and obesity, with important implications for health. The relationship between the 2 conditions is probably bidirectional, with obesity predisposing to psoriasis and psoriasis favoring obesity.
Obesity also has important implications in the treatment of psoriasis, such as a greater risk of adverse effects with conventional systemic drugs and reduced efficacy and/or increased cost with biologic agents, for which dosage should be adjusted to the patient's weight.
Definimos obesidad como una enfermedad crónica, caracterizada por un exceso de peso debido a un aumento de los depósitos de energía en el cuerpo, que se almacenan en forma de masa grasa corporal. El defecto en la simbiosis y armonía de la ingesta asociada a una desregulación del gasto energético del organismo, ya sea por enfermedad inflamatoria asociada, enfermedad genética o provocada por exceso o alteraciones de la toma de alimentos, conducirá a un estado de obesidad o de delgadez1.
El diagnóstico de obesidad se establece por la medición del índice de masa corporal (IMC: peso en kilogramos dividido por altura en metros al cuadrado). Actualmente, la Organización Mundial de la Salud propone clasificar la población adulta según puntos de corte del IMC, que definen las siguientes categorías: entre 18,5 y 24,9 es normal, entre 25 y 29,9kg/m2 es sobrepeso y un IMC mayor a 30kg/m2 es diagnóstico de obesidad2,3.
En los últimos años se ha establecido un vínculo firme entre psoriasis y obesidad, que ha coincidido con la consideración de ambas dolencias como procesos inflamatorios crónicos y con importantes repercusiones en la salud del individuo, en gran medida a través del incremento del riesgo cardiovascular y de los elementos del síndrome metabólico. Aunque existe todavía mucha controversia al respecto, las evidencias apuntan hacia una relación bidireccional. De este modo, diversos estudios epidemiológicos han permitido concluir que la obesidad es un factor de riesgo independiente, que conlleva un alto riesgo de presentar psoriasis y que le confiere un mal pronóstico de esta dermatosis a largo plazo, mientras que, según las conclusiones de otros trabajos, la obesidad podría ser una consecuencia de la psoriasis más que un factor de riesgo de esta4-6.
La presente revisión pretende ofrecer un análisis general de la relación entre psoriasis y obesidad. A partir de la presentación de las propuestas actuales referidas a la naturaleza inflamatoria de la obesidad, se repasará la relación entre psoriasis y obesidad y sus fundamentos patogénicos. Finalmente, se profundizará en cuáles son los retos y las consecuencias que plantea para el clínico la asociación de psoriasis y obesidad en el manejo terapéutico de esta dermatosis.
Naturaleza inflamatoria de la obesidadHasta 1994, cuando se describió la primera adipocina, la leptina, el tejido adiposo (TA) era considerado solo un depósito de energía en forma de grasa; sin embargo, ahora está claro que es un órgano endocrino, autocrino y paracrino, que realiza otras funciones, además de servir como reservorio energético7.
El TA es el órgano más grande en el cuerpo humano adulto; está compuesto por adipocitos, que se encargan de almacenar energía en forma de triglicéridos. Evidencias recientes indican que el TA, en particular el abdominal, es un órgano endocrino activo que contribuye en la regulación de las funciones corporales, tales como los procesos mediados por insulina, el metabolismo lipídico y glucídico, cambios vasculares, en la coagulación y algunos aspectos de la inflamación8,9.
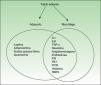
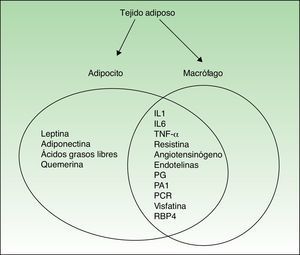
Como mediadores de todos estos efectos se citan distintas sustancias procedentes de los adipocitos (adipocinas) y una amplia variedad de citocinas proinflamatorias, como la proteínaC reactiva (PCR), factor de crecimiento β, activador del plasminógeno (PA-1), IL-1β, IL-6 y factor de necrosis tumoral alfa (TNF-α). Estas moléculas son las que, a través de sus efectos directos e indirectos, explican la naturaleza inflamatoria de la obesidad y su relación con otros procesos inflamatorios como la psoriasis.
En la obesidad, además, el TA varía su estructura y composición con respecto a su estado basal, lo que multiplica su efecto proinflamatorio. De este modo, la leptina y posiblemente otros factores que son producidos por los adipocitos, macrófagos o ambos regulan al alza o aumentan notablemente las moléculas de adhesión sobre las células endoteliales, como la ICAM-1 y la molécula de adhesión celular plaqueto-endotelial tipo 1.También es posible que la proteína recaptadora de monocitos (monocyte chemoattractant molecule 1 [MCP-1]), que se expresa en los adipocitos y puede correlacionarse con la adiposidad, contribuya al reclutamiento y la transmigración de monocitos derivados de la médula ósea, produciendo un aumento de macrófagos en el TA. Algunos macrófagos residentes se fusionarían y generarían células gigantes multinucleadas. Está acumulación de macrófagos aumentados en número y tamaño, que llegará hasta el 60% dependiendo de la masa grasa del paciente, será la responsable de provocar la expresión de moléculas proinflamatorias y contribuirá al estado inflamatorio permanente.
Otro hallazgo importante que se debe destacar es que los linfocitos, que no forman parte del tejido adiposo, a menudo están en proximidad con el tejido adiposo pericapsular de los ganglios linfáticos y pueden mantener interacciones paracrinas entre estos y los adipocitos, intercambiando información10,11.
En la figura 1se desarrolla la producción de citocinas a partir de los macrófagos activados y de los adipocitos del TA. De hecho, algunos autores han reconocido al TA como una parte del sistema inmunitario innato12.
Además de los elementos celulares antes citados, encontramos células endoteliales, leucocitos, fibroblastos y preadipocitos que conforman el tejido vascular estromal adiposo.
Este conglomerado de células forman el TA, y este está regulado por múltiples vías metabólicas mediadas por citocinas (ya sean del propio TA o a distancia) y las adipocitocinas, o adipocinas, que serán un producto bioactivo con funciones endocrinas, paracrinas y autocrinas producidas por el TA que representan los fundamentos del estado proinflamatorio de la obesidad13,14.
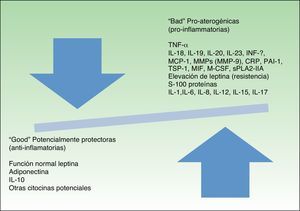
La presencia y la persistencia de un estado inflamatorio crónico de bajo grado en la obesidad conduce a una alteración de la función y de la estructura vascular, de la inmunidad y del metabolismo de los adipocitos, todo ello a través de una alteración del balance de las adipocinas y citocinas, que son claves en la patogénesis del síndrome metabólico y en el desarrollo del riesgo de morbimortalidad cardiovascular.
La figura 2 presenta una modificación del modelo de Fisman, incluyendo una clasificación de las moléculas asociadas a la inflamación que afectan al riesgo cardiovascular.
A continuación, se detalla el perfil de moléculas implicadas en la naturaleza inflamatoria de la obesidad.
AdipocinasEl TA, principalmente el visceral, es un órgano inmuno-metabólico-endocrino y, como tal, es capaz de secretar sustancias que tienen actividad endocrina, paracrina y autocrina conocidas como adipocinas15.
Estas adipocinas son capaces de inducir obesidad (leptina), resistencia insulínica (resistina), inflamación, dislipemia, hipercoagulabilidad y disfunción endotelial asociada a la arterioesclerosis, elementos todos ellos implicados en el inicio y progresión del síndrome metabólico. Sin embargo, algunas adipocinas, como la adiponectina, podían tener efectos protectores contra el síndrome metabólico.
AdiponectinaPrincipalmente producida por los adipocitos, el gen que la codifica está localizado en la región de susceptibilidad genética del síndrome metabólico, la diabetes tipo 2 y la enfermedad cardiovascular16. Hay una relación inversa entre los niveles de adiponectina y el IMC17. En la obesidad, la adiponectina está disminuida, debido en parte a un aumento de citocinas y adipocinas proinflamatorias, como el TNF-α y la IL-618. La adiponectina tiene un papel antiinflamatorio muy importante, al inducir la secreción de IL-10, el antagonista del receptor de la IL-1 en monocitos y macrófagos e inhibir la producción de TNF-α, IL-6 y ICAM-1. Se ha comprobado que los niveles de adiponectina en sangre son bajos cuando hay un exceso de tejido adiposo intraabdominal, en la dislipemia, en los pacientes con resistencia a la insulina, en la enfermedad cardiovascular y en la hipertensión arterial19.
En los procesos inflamatorios crónicos existe variabilidad con respecto a los niveles de adiponectina. De este modo, puede estar incrementada en procesos inflamatorios sin obesidad ni tejido adiposo visceral excesivo, como la artritis reumatoide, mientras que podría estar regulada en dirección opuesta en aquellas enfermedades crónicas en las que sí existe un exceso de tejido adiposo visceral y obesidad, como la psoriasis, la diabetes tipo 2 o el síndrome metabólico, donde los niveles de adiponectina están muy disminuidos20.
LeptinaPrincipalmente producida por los adipocitos, aunque también se expresa en tejidos como la placenta, los ovarios, el músculo esquelético, el estómago, la hipófisis y el hígado21,22.
La leptina indica si las reservas somáticas de depósitos de grasa son suficientes para el crecimiento y la reproducción. Los niveles bajos de leptina serían indicativos de reservas insuficientes de energía, lo que provocaría hiperfagia, bajo gasto energético e infertilidad, al no estar preparado el cuerpo para la gestación. Una concentración de leptina en suero más alta del umbral podría tener poco o ningún efecto fisiológico sobre la hipofagia, lo que demuestra que las adipocinas no actúan solas, sino que necesitan multitud de combinaciones entre ellas para provocar un efecto determinado sobre el peso, inflamación, etc.23.
Los pacientes con déficit de leptina son extremadamente obesos y los niños con déficit congénito permanecen prepúberes si no se les trata con leptina exógena24,25.
Niveles elevados de leptina se han asociado con alteraciones cardiovasculares y en algunos estudios se ha postulado como un factor predictivo independiente de estos eventos y de enfermedad coronaria. En estudios en ratones también se ha comprobado cómo acelera la formación de trombos arteriales sobre vasos dañados previamente por la inflamación26-30.
La leptina tiene un efecto inmunomodulador importante20. Se ha comprobado que si se incuban células mononucleares periféricas de suero humano con altas dosis de leptina, se produce una respuesta Th1, lo que va a favor de la hipótesis de que la leptina participa en la regulación de los procesos inflamatorios31,32.
Algunos autores señalan que la leptina en la psoriasis podría servir como un marcador de gravedad y cronicidad. La leptina puede estimular la angiogénesis y la proliferación de queratinocitos, además de, juntamente con la obesidad, predisponer a psoriasis9,33,34.
ResistinaEs una adipocina derivada del tejido adiposo vinculada principalmente a la inflamación, inmunidad, obesidad y resistencia a la insulina. Producida por monocitos y macrófagos del tejido adiposo y de la sangre periférica, la expresión aumentada de resistina y, por tanto de inflamación, podría ser un mediador en la disfunción endotelial y un signo temprano para arterioesclerosis35,36.
Citocinas proinflamatorias como el TNF-α, la IL-1-β, la IL-6 y los lipopolisacáridos pueden incrementar la expresión de la resistina y esta, por sí misma, puede incrementar la producción de TNF-α y IL-1236.
Aunque en humanos inicialmente la resistina se describió como un enlace entre la obesidad y la diabetes, no se ha podido demostrar del todo por las controversias surgidas entre diferentes estudios.
La resistina ha mostrado ser un factor predictivo positivo de enfermedad coronaria y un marcador de la gravedad del daño isquémico cardíaco37,38.
Proteína retinol-binding 4Es una proteína de transporte de la vitamina A producida y secretada por hepatocitos y principalmente por los adipocitos viscerales39. Se han relacionado niveles elevados de RBP4 con la obesidad y resistencia a la insulina. Una RBP4 elevada antes del inicio de la diabetes nos indicará un alto grado de resistencia a la insulina y la conveniencia de ajustar más el tratamiento40-42. Se ha relacionado directamente la RBP4 con la afección cardiovascular asociada a la obesidad, pero no con la psoriasis.
OmentinaEs una proteína producida principalmente por las células estromales y vasculares del tejido adiposo visceral. Se encarga de aumentar la sensibilidad a la insulina. Se ha involucrado en la patogénesis de la obesidad y las enfermedades relacionadas con esta. En un estudio de Souza et al. la omentina se correlacionó inversamente con la obesidad43,44.
Los autores concluyen que los niveles de omentina elevados podrían ser vistos como un marcador protector que se opone a la obesidad.
QuemerinaLa quemerina es una proteína que regula el desarrollo de los adipocitos y las funciones metabólicas, como el metabolismo de la glucosa hepático y musculoesquelético. Los niveles de quemerina están elevados en pacientes con obesidad y exhiben una correlación positiva con varios aspectos del síndrome metabólico. El doble papel de esta adipocina en la inflamación y el metabolismo enlazará la inflamación crónica y la obesidad, así como las enfermedades asociadas a ella, como la diabetes mellitus tipo 2 y la enfermedad cardiovascular45.
LipocalinaEl papel de la lipocalina en la obesidad aún no está del todo definido. Se ha correlacionado con otras adipocinas y, positivamente, con el TNF-α y la IL-6, y con el diámetro de los adipocitos viscerales46.
Hormona estimuladora de los melanocitos αLa hormona estimuladora de los melanocitos α es, juntamente con la grelina y la leptina, un pilar básico en la regulación del balance energético. Tiene efectos en el sistema nervioso central, la función inmunitaria y la inflamación. Inhibe la ingesta estimulando el receptor de la melanocortina ubicado en el cerebro. Variantes del gen de la melanocortina 4 receptor están relacionadas con el IMC de los pacientes, de forma que si hay una pérdida o disfunción del receptor de la melanocortina en el hipotálamo habrá una obesidad masiva. La mutación heterocigótica del gen ha mostrado ser la causa más importante de obesidad grave en niños. En algunos estudios se ha visto que la MSH-α modula más que la leptina en el aspecto de la ingesta y el gasto energético, pero no en aspectos relacionados con el crecimiento ni en los ejes endocrinos, donde influye y participa más la leptina.
En la obesidad, tanto la leptina como la MSH-α están elevadas, aunque respecto a la inflamación esta tiene efectos contrarios a la leptina, al reducir la secreción de prostaglandinas revirtiendo el efecto del TNF-α en los melanocitos47.
ApelinaEs un péptido bioactivo producido por los adipocitos, las células estromales, el corazón y el sistema cardiovascular. En humanos, la obesidad y los niveles de insulina elevan los niveles de apelina. Este péptido parece actuar como una hormona paracrina circulante; además, su receptor comparte características con el de la angiotensina. Asimismo, regula la resistencia a la insulina y altera los niveles de adiponectina. En ratas se ha descrito un efecto hemodinámico positivo actuando como inotrópico48,49.
VaspinaLa vaspina humana se expresa en el tejido adiposo visceral y subcutáneo; además, se ha observado que regula de manera específica los depósitos de grasa y se asocia a la obesidad y a la resistencia a la insulina. Los niveles elevados de vaspina se relacionan con la obesidad y con la sensibilidad a la insulina50-53.
Ácidos grasos libresLos ácidos grasos libres se han considerado un importante eslabón entre la inflamación crónica y la actividad del tejido adiposo, ya que estas moléculas son capaces de aumentar el estrés oxidativo y, por lo tanto, el ambiente inflamatorio y la actividad vascular reactiva54.
Activador del plasminógeno-1El factor inhibidor del PA-1 es secretado en parte por el tejido adiposo, junto al hígado y tejido endotelial. Los niveles de este están elevados en la obesidad y en la resistencia insulínica y se relacionan con la inducción del síndrome metabólico, además de predecir el riesgo de diabetes tipo 2 y problemas cardiovasculares. Así pues, el PAI-1 puede contribuir al desarrollo de obesidad y resistencia a la insulina y ser un enlace entre el desarrollo de obesidad y enfermedad cardiovascular55.
CitocinasFactor de necrosis tumoralEs una molécula proinflamatoria presente en la circulación como molécula soluble, producida por una variedad de células, como monocitos/macrófagos activados, linfocitos, mastocitos y células «natural killer». En la obesidad, la principal fuente de TNF-α son los macrófagos del sistema estromal y vascular del tejido adiposo.
Se ha comprobado que la expresión del ARNm del TNF-α se encuentra elevada en los adipocitos de ratones genéticamente obesos56 y en muestras de tejido adiposo humano en pacientes con un alto porcentaje de grasa corporal (r=0,46)57. El ARNm del TNF-α y la expresión de proteínas son 2 y 2,5 veces mayores, respectivamente, en los adipocitos de personas obesas en comparación con controles58. De igual modo, la expresión de TNF-α en los adipocitos de pacientes obesos se ve disminuida con la pérdida de peso. También parece demostrado que la obesidad está asociada a altos niveles circulantes de receptores de TNF-α humanos59. Cabe señalar, sin embargo, que la mayoría de los estudios no han demostrado niveles elevados de TNF-α en suero humano en pacientes obesos, por lo que la mayoría de los expertos creen que los efectos proadipogénicos del TNF-α son causados por acciones autocrinas o paracrinas directamente dentro del tejido adiposo58,59.
El TNF-α incrementa su propia producción y la de la IL-6, resistina, visfatina y proteína quimiotáctica de los macrófagos (MCP-1)60-62. Por el contrario, disminuye las concentraciones de la adiponectina y la leptina generadas por los adipocitos63.
Asimismo, el TNF-α contribuye a la resistencia de la insulina mediante la inducción de la fosforilación de la serina del sustrato 1 del receptor de insulina, lo que reduce la actividad de la tirosincinasa del receptor insulínico64-66. El tratamiento de ratas obesas con receptores solubles de TNF-α normaliza la expresión del propio TNF-α y aumenta la sensibilidad a la insulina56. Este hecho también se ha demostrado en pasiva, de forma que la administración exógena de TNF-α en animales sanos disminuye la sensibilidad a la insulina67. Todos estos hallazgos sugieren que el TNF-α podría tener una función «lipostática». Pero, paradójicamente, los datos obtenidos por Domínguez et al.68 en un estudio de 20 pacientes obesos con diabetes insulinorresistente demostraron que el bloqueo de TNF-α con etanercept no aumentó significativamente la sensibilidad de la insulina a pesar de la reducción de los niveles séricos de citocinas inflamatorias como IL-6 y PCR.
En un estudio in vitro con TNF y células del tejido adiposo se demostró que la formación de citocinas proinflamatorias se neutralizaba al inhibir el TNF-α. Así pues, los autores concluyeron que el TNF-α podía ser crucial en la regulación de las adipocinas en los adipocitos69-71.
Interleucina-6Es considerada como una de las mayores mediadoras de la inflamación con efectos pro y antiinflamatorios. También se ha visto que regula la hematopoyesis, la respuesta inmunitaria y la inhibición de mecanismos de defensa72.
La producen fibroblastos, células endoteliales, monocitos y adipocitos71.
El 30% de la IL-6 circulante se origina en el tejido estromal del tejido adiposo73. Además de encontrarse muy elevada en episodios de estrés grave, cirugía y sepsis, también se han encontrado niveles elevados de IL-6 en la obesidad73. En los pacientes obesos, la expresión y excreción de IL-6 derivada del tejido adiposo visceral se relaciona directamente con incrementos en el IMC y del tejido graso. La liberación de IL-6 en los vasos sanguíneos se ha relacionado con la resistencia a la insulina y como predictor de diabetes tipo 242.
En estudios en ratones se ha demostrado que una dieta rica en ácidos grasos libres induce un aumento de IL-6 secretada por el tejido adiposo y en el hígado induce una resistencia insulínica74.
Además, otras funciones de la IL-6 en los reactantes de fase aguda, como la PCR, el PAI y el fibrinógeno, son estimularlos al alza. Así pues, la IL-6 será otro vínculo importante entre el tejido graso y la inflamación75.
Otras citocinas implicadas son la IL-1, la IL- 5, la MCP-1 y el factor estimulador de colonias de macrófagos.
Naturaleza inflamatoria de la obesidad: conclusionesRecientemente, se ha demostrado que el tejido adiposo no es solo un reservorio pasivo de energía, sino que, por el contrario, se trata de un auténtico órgano endocrino y metabólico de gran actividad. También se sabe que la obesidad constituye en sí misma un proceso de inflamación crónica de bajo grado, donde uno de los principales protagonistas desde el punto de vista celular es el macrófago del tejido adiposo. Además, hoy en día se dispone de suficiente evidencia científica para afirmar que la inflamación inherente a la obesidad participa de forma activa en el desarrollo de los fenómenos fisiopatológicos responsables del síndrome metabólico, la morbilidad cardiovascular y la psoriasis. De ahí que algunos parámetros de inflamación crónica se hayan postulado, sobre la base de los resultados de estudios poblacionales, como marcadores de riesgo cardiovascular, siendo la elevación de los niveles séricos de la PCR, la IL-6, el TNF-α y la leptina, así como una disminución de los niveles de adiponectina e IL-10, los que representan una mayor correlación con las alteraciones que constituyen el síndrome metabólico, incluida la obesidad.
Psoriasis y obesidadLa asociación entre la obesidad y la psoriasis ha sido objeto de varias revisiones y es un tema de creciente interés76-79. La primera referencia se describió en un estudio sueco, que incluyó a 159.200 individuos seguidos durante un período de 10 años5. Esta asociación ha sido corroborada posteriormente en numerosas publicaciones recientes4,80-86. En un estudio italiano de casos-controles con 560 pacientes psoriásicos, se comprobó que la probabilidad de presentar psoriasis en una población con un IMC entre 26 y 29 o mayor de 30 fue superior (OR=1,6 y 1,9, respectivamente) que en los controles no obesos80. Otro estudio del Reino Unido incluyó a 127.706 pacientes con psoriasis leve (definidos como aquellos que no fueron tratados con terapias sistémicas o fototerapia) y a 3.854 pacientes con psoriasis severa (definida como los que fueron tratados con terapias sistémicas o fototerapias) y evidenció también una mayor probabilidad de obesidad en pacientes con psoriasis grave (OR=1,8) que en pacientes con psoriasis leve (OR=1,3) y que en pacientes sin psoriasis81. Esta misma tendencia se confirmó en otro estudio que incluyó a 16.851 pacientes con psoriasis, en el que además se constató que los pacientes psoriásicos menores de 35 años eran más propensos a presentar obesidad (OR=2,2) que los mayores de 65 años (OR=1,6) en comparación con los controles sanos82. En conjunto, estos estudios sugieren que existe una correlación positiva entre el peso corporal, la prevalencia y la gravedad de la psoriasis.
¿Qué es primero, la obesidad o la psoriasis?Toda la evidencia epidemiológica disponible no ha sido suficiente para responder a la siguiente cuestión: ¿qué es primero, la psoriasis o la obesidad?
Herron et al.83 realizaron un estudio con 557 pacientes psoriásicos a los que se les pidió que recordaran su tamaño corporal a los 18 años de edad (siempre antes de la aparición de la psoriasis) y evaluaron entonces el peso actual (después de la aparición de la misma). Por medio de este curioso —cuanto menos— método retrospectivo, los pacientes que reconocieron obesidad a los 18 años de edad no relacionaban un mayor riesgo de psoriasis. Por el contrario, los pacientes que posteriormente desarrollaron psoriasis sí fueron más propensos a ser obesos, lo que sugiere que la psoriasis precedió a la aparición de la obesidad. Mallbris et al.87 compararon a 200 pacientes en los 12 meses iniciales de la enfermedad, diferenciando entre IMC normal o en rango de obesidad, y no encontraron diferencias estadísticamente significativas en el IMC entre ambos grupos. De hecho, aunque en ambos grupos se apreció una tendencia hacia la obesidad, esta fue algo mayor en el grupo control (13%) que en el grupo de psoriasis (10%).
Se han propuesto varios mecanismos por los que la psoriasis podría conducir a la obesidad, como el aislamiento social progresivo, la adquisición de malos hábitos alimenticios, la depresión, el aumento del consumo de alcohol y la disminución de la actividad física (más acentuada en caso de coexistir una artritis psoriásica). En esta línea, Zamboni et al.88 observaron, en un estudio de caso-control, que tanto los hombres como las mujeres con psoriasis consumían significativamente más grasas totales, grasas saturadas y alcohol cuando se comparaban con los controles sanos. Por otro lado, solamente el 43% de los pacientes obesos con psoriasis, en el estudio de Herron et al.83 —ya comentado—, realizaban ejercicio durante 30 min o más al menos 2 o 3 veces por semana en comparación con el 59% de los pacientes no obesos con psoriasis. Comprobaron, además, que en más del doble de estos pacientes obesos era la artritis la que impedía el desarrollo de actividad física.
A pesar de los resultados de los estudios mencionados, existe otra conjetura, paradójica si se compara con la primera, como es la hipótesis de que la obesidad es la que predispone al desarrollo de psoriasis. Los primeros datos que apoyarían esta teoría se encuentran en informes sobre presos de guerra desnutridos durante la Segunda Guerra Mundial, que señalan que la psoriasis mejora con la pérdida de peso y la reducción de calorías ingeridas89. Más recientemente, Rucevic et al.90 demostraron, en un estudio de 82 pacientes con psoriasis, que aquellos asignados al azar para una dieta baja en calorías y grasas durante 4 semanas tuvieron una reducción mayor, significativa, de los niveles de colesterol total, triglicéridos y lipoproteínas de baja densidad, con una mejora concomitante en su psoriasis, en comparación con los pacientes aleatorizados para una dieta estándar de hospital. La mayor contribución en esta línea la realizan Setti et al.91, aportando datos recogidos de 78.626 mujeres (de las que 892 declaran tener psoriasis) en un estudio de salud realizado en enfermeras, en el que se encontró que el aumento de peso llevó a un mayor riesgo individual para el posterior desarrollo de psoriasis. Además, la incidencia de la psoriasis resultó estar linealmente asociada con el IMC, teniendo mayor riesgo (RR=2,69) los pacientes con un IMC de 35 o más en comparación con pacientes con un IMC entre 21 y 23.
Existen también casos aislados o series pequeñas que muestran una relación psoriasis-obesidad similar. Porres92 publicó el caso de una mujer de 44 años con psoriasis extensa que, tras perder 54kg después de un bypass yeyuno-ileal, fue capaz de retirar la medicación para su psoriasis. Otros 2 casos describen una remisión completa de psoriasis grave y generalizada sin medicación, al año de la realización de un bypass gástrico93,94.
Nexo patogénico entre la psoriasis y la obesidadComo se ha desarrollado en los párrafos anteriores, la relación entre psoriasis y obesidad parece clara desde un punto de vista epidemiológico, aunque debe establecerse si es coherente y, lo que es más importante, si hay pruebas de ello desde un punto de vista patogénico. Parece razonable pensar que el estado proinflamatorio crónico de bajo grado que hay en estos 2 procesos potencie el riesgo de sus consecuencias, tales como la probabilidad de desarrollar una diabetes, un síndrome metabólico y el aumento del riesgo cardiovascular53. En este punto, podemos preguntarnos también en qué medida existe una predisposición genética conjunta para el desarrollo de ambos en algunos individuos o a través de qué mecanismos la presencia de la psoriasis es capaz de favorecer la obesidad y viceversa.
Se ha demostrado que el HLA-Cw6, el mayor locus de susceptibilidad genética para la psoriasis, está también asociado a la obesidad; en un estudio se comprobó cómo la presencia de obesidad y HLA Cw6 incrementan 35 veces el riesgo de desarrollar psoriasis, comparado con pacientes de peso normal y HLA Cw6 negativo95.
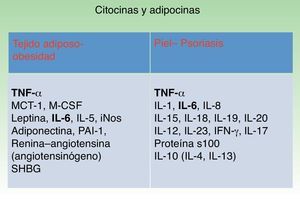
El hecho de que la obesidad y la psoriasis puedan ocurrir juntas podría conducir a la interacción de ambas enfermedades, en las cuales las adipocinas desempeñarían un papel moderador y, en ocasiones, común.
En la figura 3 se muestran las principales citocinas y adipocinas secretadas por el tejido adiposo visceral en el contexto de la obesidad y las secretadas por la piel en el contexto de la psoriasis. Ambos tejidos comparten la secreción de TNF-α e IL-6, lo que permite dilucidar una coincidencia —y probablemente sinergia— en el estado inflamatorio asociado a ambos procesos10,11.
Repercusión de la obesidad en el tratamiento de la psoriasisEl tratamiento de los pacientes obesos con psoriasis plantea numerosas dificultades. Por una parte, la obesidad se ha asociado con una disminución de la respuesta a los tratamientos sistémicos y biológicos, que puede estar relacionada con cuestiones farmacocinéticas, afectando más a los fármacos que se administran a dosis fijas, en comparación con los que se administran en función del peso. Por otra, la obesidad se puede asociar a condiciones como el síndrome metabólico o la esteatosis hepática, que pueden aumentar el riesgo de efectos adversos a los tratamientos sistémicos convencionales96.
Además de la posible disminución de la eficacia y el mayor riesgo de efectos adversos, la obesidad supone un aumento considerable del coste en el caso de los fármacos que se administran en función del peso del paciente.
Efecto de la obesidad en el tratamiento con fármacos sistémicos convencionalesTratamientos tópicos y fototerapiaLa evidencia para el uso de tratamientos tópicos, incluyendo corticoides, calcipotriol, la formulación conjunta de calcipotriol y dipropionato de betametasona, y tazaroteno en pacientes obesos con psoriasis es anecdótica83.
En relación con la fotoquimioterapia (psoraleno y radiación ultravioleta A [UVA]), debido a que la dosis de psoraleno se prescribe por peso, la eficacia no se ve afectada por el mismo83.
MetotrexatoLa obesidad puede complicar el tratamiento de la psoriasis con fármacos sistémicos convencionales como el metotrexato, dado que condiciones asociadas a la obesidad, como la esteatosis hepática no alcohólica, contribuyen a la hepatotoxicidad del metotrexato y suponen una contraindicación relativa97,98.
Diversos estudios han permitido demostrar que la obesidad es un factor de riesgo de hepatotoxicidad en pacientes con psoriasis tratados con metotrexato, aun mayor que el consumo de alcohol, los antecedentes de hepatitis vírica o la dosis acumulada, especialmente cuando se combina con otros factores de riesgo, como la diabetes mellitus. La esteatosis, muy prevalente en pacientes obesos y/o diabéticos, probablemente contribuye a este riesgo, por lo que la toxicidad hepática debe ser monitorizada más estrechamente99-101.
El posible riesgo de cirrosis hepática en los pacientes obesos que toman metotrexato crea cierta inquietud. Aunque clásicamente se ha recomendado la realización de una biopsia hepática después de una dosis acumulada de metotrexato de 1,5g, muchos autores sugieren que en pacientes obesos debe realizarse la biopsia tras acumular una dosis menor102-105. Berends et al.102 comprobaron que entre los pacientes en tratamiento con metotrexato, 4 de 38 pacientes obesos y 2 de 9 pacientes con diabetes mostraron un resultado en la biopsia hepática grado iiio iv con criterios de Roenigk, mientras que ninguno de los 34 pacientes sin factores de riesgo demostró grado alguno de enfermedad hepática. Weinstein et al.102 encontraron que la obesidad y la diabetes concomitantes se asociaron significativamente con el desarrollo de fibrosis (grado medio de 3,3) y cirrosis (grado medio de 1,7) en los pacientes antes de tomar metotrexato, pero, paradójicamente, después de la terapia, estas condiciones no se asociaron ni con fibrosis (1,8) ni con cirrosis (2,0), en comparación con el resto de los participantes del estudio. En general, el resultado de todos estos estudios parece indicar que el uso de metotrexato no se encuentra contraindicado en pacientes psoriásicos obesos, pero sí advierten de la necesidad de un seguimiento relativamente temprano por medio de biopsia hepática.
En un estudio realizado en 500 pacientes, la obesidad no influyó en la tolerancia ni en la respuesta al tratamiento con corticoides tópicos, metotrexato o PUVA. Sin embargo, en los pacientes obesos tratados con metotrexato, era más probable la pérdida de respuesta con el tiempo86.
Por otra parte, debido a su efecto sobre la inflamación crónica, el tratamiento con metotrexato se ha asociado con una disminución del riesgo de enfermedades cardiovasculares y de infarto de miocardio, especialmente cuando se administra a dosis bajas y en combinación con ácido fólico106.
Ciclosporina ALa farmacocinética de la ciclosporina está influenciada por la obesidad, puesto que es un fármaco muy lipofílico, que se distribuye en el tejido adiposo y se une a lipoproteínas, generalmente aumentadas en pacientes obesos. Sin embargo, en algunos estudios en pacientes con trasplantes renales y de médula ósea, la obesidad no parece alterar el aclaramiento, el volumen de distribución o los niveles en sangre107,108. Sin embargo, en pacientes trasplantados pueden existir diversos factores de confusión, como el estado del paciente, el uso de corticoides o las alteraciones en las proteínas sanguíneas y los lípidos, que pueden modificar el efecto de la obesidad en la farmacocinética de la ciclosporina.
Dado que en los pacientes con psoriasis es menos probable que se den estos factores, se ha investigado la relación entre la obesidad y la concentración sérica de ciclosporina en 16 pacientes con psoriasis, encontrando una fuerte correlación positiva entre la concentración mínima estandarizada (concentración en nanogramos por mililitro dividida por la dosis diaria en miligramos por kilo) y el índice de obesidad utilizado (% obesidad=100 [(peso (kg)/22 altura (m)2) – 1]). De este modo, para una misma dosis de ciclosporina, los pacientes obesos tienen mayor probabilidad de un aumento de los niveles séricos y, por lo tanto, de nefrotoxicidad. Estos resultados fueron independientes de los valores de hematocrito o lípidos plasmáticos, de modo que la obesidad ejerce un efecto independiente sobre los niveles de ciclosporina en pacientes con psoriasis109.
Otros estudios confirman que la obesidad es un factor de riesgo de efectos adversos en pacientes tratados con ciclosporina, especialmente cuando se combina con otros factores, como la edad avanzada, la hipertensión o el uso concomitante de fármacos nefrotóxicos. Por lo tanto, en estos casos, la dosis de ciclosporina debería adaptarse al peso ideal, en lugar del real, para disminuir el riesgo de nefrotoxicidad110.
Thaçi et al. estudiaron la efectividad y la seguridad de la ciclosporina durante 12 semanas con una nueva pauta independiente del peso (100-300mg/día), en comparación con la pauta convencional en función del peso (1,25-5mg/kg). El aumento de creatinina era mayor en el grupo en el que el fármaco se administraba en función del peso, en comparación con la pauta independiente del peso, que podría ser útil en pacientes obesos, con mayor riesgo de nefrotoxicidad, si la ciclosporina se administra sin tener en cuenta el peso corporal ideal111.
Por lo tanto, durante el tratamiento con ciclosporina A de pacientes obesos con psoriasis es necesaria una monitorización minuciosa de los niveles de fármaco en suero, hipertensión, nefrotoxicidad, diabetes y dislipemia.
Además del mayor riesgo de toxicidad, la eficacia de la ciclosporina parece estar influenciada por el peso corporal. Gisondi et al. demostraron que la pérdida moderada de peso (5-10% del peso corporal) aumentaba la respuesta terapéutica a dosis bajas de ciclosporina en pacientes obesos con psoriasis moderada-grave. La eficacia de la ciclosporina (2,5mg/kg/día) en combinación con una dieta baja en calorías se comparó con la eficacia de la ciclosporina en monoterapia en 61 pacientes obesos (IMC > 30kg/m2) con psoriasis moderada-grave. A las 24 semanas, la reducción media del peso (media±DT) fue de 7±3,5% en el primer grupo y del 0,2 ± 0,9% en el grupo control. El 66,7 y el 86,7% de los pacientes tratados con ciclosporina y dieta alcanzaron un PASI 75 y un PASI 50, respectivamente, frente al 29 y 48,3% de los pacientes tratados con ciclosporina solo (p<0,001)112.
AcitretinoEl desarrollo de hipercolesterolemia, con disminución de las lipoproteínas de alta densidad, es un efecto secundario frecuente en pacientes con psoriasis tratados con acitretino, sobre todo en pacientes diabéticos, obesos, alcohólicos y con hipertrigliceridemia113.
Corbetta et al. evaluaron el efecto de acitretino en el metabolismo lipídico y de la glucosa, al mes y a los 3 meses de tratamiento en 10 pacientes con psoriasis. La alteración de la tolerancia a la glucosa y del metabolismo lipídico fue transitoria y no relacionada con las variaciones en el IMC, los niveles de TNF-α ni las hormonas implicadas en la obesidad (resistina y adiponectina)114.
Efecto de la obesidad en el tratamiento con fármacos biológicosAunque los estudios en muchas ocasiones no son comparables entre sí, debido a los diferentes métodos utilizados para cuantificar el peso, los fármacos biológicos, en particular aquellos que no se ajustan en función del peso, podrían tener menor eficacia en pacientes con sobrepeso115,116.
El tejido adiposo, en especial el de localización abdominal, actúa como un órgano endocrino capaz de secretar ácidos grasos, citocinas proinflamatorias (TNF-α, IL-1, IL-6, IL-10), hormonas (leptina, adiponectina) y factores protrombóticos. Puesto que el papel de los fármacos inhibidores del TNF-α es el de eliminar su exceso en la circulación y en las placas de psoriasis, y que en los pacientes obesos está aumentada su producción, el efecto de estos fármacos podría ser menor en los pacientes con obesidad106,117.
Naldi et al., en un estudio basado en el proyecto Psocare, que incluye a pacientes con psoriasis de diversos centros italianos que inician un tratamiento sistémico (convencional o biológico), comprobaron que el IMC era un factor pronóstico en la respuesta al tratamiento para la psoriasis. La proporción de pacientes que alcanzan un PASI 75 disminuye conforme aumenta el IMC, del 41,7% en pacientes con un IMC<20 al 29,1% en aquellos con un IMC ≥ 30 a las 8 semanas, y del 59 al 42,2% a las 16 semanas. Los pacientes obesos tenían menos probabilidades de mejorar a las 8 y 16 semanas, en comparación con los pacientes de peso normal, independientemente de otras variables, como el sexo, la gravedad de la psoriasis o el tipo de tratamiento previo. La OR para alcanzar un PASI 75 en los pacientes obesos en comparación con los pacientes con normopeso era de 0,73 (IC del 95%, 0,58-0,93) a las 8 semanas y de 0,62 (IC del 95%, 0,49-0,79) a las 16 semanas118.
A continuación, se evaluará de forma detallada la evidencia acerca del impacto de la obesidad en los distintos fármacos biológicos.
InfliximabLa dosificación según peso de infliximab ofrece la posibilidad de obtener resultados similares en pacientes obesos y no obesos. Reich et al., en un análisis de 3 ensayos clínicos en 1.462 pacientes tratados con infliximab, encontraron una respuesta similar (PASI 75) a las 10 semanas de tratamiento en pacientes con sobrepeso u obesidad y en pacientes con peso normal (IMC < 25kg/m2). Un 78,3% de los pacientes con sobrepeso alcanzaban un PASI 75 a las 10 semanas, en comparación con el 74,4% de los pacientes obesos y el 77,5% de los pacientes con peso normal119.
En otro estudio realizado en 53 pacientes con psoriasis moderada-grave tratados con infliximab (5mg/kg en las semanas 0, 2, 6 y cada 8 semanas), la obesidad se asoció a un retraso en la respuesta y una menor eficacia120.
EtanerceptStrober et al. estudiaron el efecto de varios factores demográficos en la eficacia de etanercept. Los pacientes fueron aleatorizados a recibir etanercept 50mg o placebo durante 12 semanas, seguido de una fase abierta de etanercept 50mg durante 36 semanas. El 70% de los pacientes tenían sobrepeso y el 10%, obesidad mórbida. Los pacientes con IMC dentro de la normalidad tenían una respuesta superior a etanercept que los pacientes con sobrepeso u obesidad. Entre los pacientes con obesidad mórbida (IMC ≥ 40), un 15, un 25, un 32 y un 27%, respectivamente, alcanzan un PASI 90, PASI 75, PASI 50 o una respuesta inferior a las 12 semanas. Entre los pacientes con peso normal, la respuesta fue del 41, el 33, el 17 y el 9%, respectivamente121.
Gordon et al., en un subanálisis de 1.187 pacientes tratados con etanercept (50 o 100mg/semana) o placebo, encontraron mejor respuesta en los pacientes de menor peso y en los que recibían 100mg de etanercept a la semana. A la semana 12, un 41% de los pacientes que pesaba menos de 89,36kg y recibía 50mg de etanercept a la semana alcanzó un PASI 75, en comparación con el 25% de los pacientes de mayor peso que recibían la misma dosis de etanercept. En el grupo que recibía 50mg 2 veces a la semana, el 53% de pacientes con peso menor de 89,36kg alcanzó el PASI 75, frente al 43% de los pacientes con mayor peso122.
Sin embargo, en otro estudio realizado en 100 pacientes con psoriasis tratados con etanercept 100mg/semana durante 12 semanas, seguido de 50mg/semana, el IMC no se relacionó con la eficacia del etanercept a las 12 y 24 semanas123.
En otro estudio de 50 pacientes aleatorizados a recibir etanercept 25 o 50mg 2 veces a la semana, tampoco se demostró la influencia del peso corporal en la respuesta a etanercept. Aunque casi todos los pacientes que no alcanzaban un PASI 50 tenían un IMC elevado (25,8-30kg/m2), entre los que alcanzaban el PASI 75 también había un número significativo de pacientes con sobrepeso u obesidad124.
AdalimumabEn los subanálisis de los estudios REVEAL, BELIEVE y CHAMPION, la respuesta al tratamiento también disminuye en función del peso, aunque a menudo no de forma significativa125-128.
En el estudio REVEAL, los factores que más influían en la respuesta eran el tipo de tratamiento, el peso y la edad. En los pacientes tratados con adalimumab, el 74,1% de los pacientes que pesaban menos de 100kg alcanzó el PASI 75 en la semana 16, frente al 63,8% de los de mayor peso. Cuando se considera el IMC, el porcentaje de respuesta fue del 79,2, el 75,5 y el 65,1% de los pacientes con peso normal, sobrepeso y obesidad, respectivamente129,130.
En un subanálisis del estudio BELIEVE se evaluó la eficacia de adalimumab, solo o en combinación con calcipotriol y betametasona, en función de las características de la psoriasis y de las características demográficas de los pacientes. El porcentaje de pacientes que alcanzaban el PASI 75 a las 16 semanas era inferior en el grupo de peso ≥ 95kg131.
En el estudio CHAMPION se trató de determinar si las características demográficas y de la psoriasis influían en la eficacia de adalimumab, en comparación con metotrexato y placebo. La respuesta se determinó en función del número de pacientes que alcanzaban el PASI 75 a la semana 16 y el peso se dividió en cuartiles (≤ 68kg, > 68 y ≤ 82kg, > 82 y ≤ 92kg, > 92kg). La respuesta (≥ PASI 75) en cada cuartil fue del 85, el 86, el 86 y el 60%, sin diferencias significativas en la eficacia de adalimumab en función del peso128.
En pacientes con artritis reumatoide tratados con adalimumab se encontró un incremento del aclaramiento sérico del fármaco en los pacientes con mayor peso, que podría suponer una disminución de la eficacia132.
UstekinumabEn los estudios PHOENIX 1 y PHOENIX 2 se observó correlación entre el peso corporal, las concentraciones séricas de ustekinumab y la eficacia, sin diferencias en la seguridad. En la fase iii de ambos ensayos clínicos los pacientes fueron aleatorizados a recibir ustekinumab (45 o 90mg) cada 12 semanas o placebo, con cambio a ustekinumab en la semana 12. La eficacia y la concentración sérica de ustekinumab se evaluaron con cada 10kg de incremento en el peso, en la semana 28. En los pacientes que pesaban más de 100kg, la respuesta (PASI 75) era un 20% mayor en el grupo que recibía 90mg de ustekinumab, en comparación con el grupo que recibía 45mg (74,2% y 54,6%, respectivamente, p<0,0001). Sin embargo, en los pacientes de menos de 100kg, no había diferencias significativas en la respuesta al tratamiento, en función de la dosis (80,8% en el grupo de 90mg y 76,9% en el grupo de 45mg; p=0,1823).
Estas diferencias en la eficacia también se observaron cuando se medía la respuesta en función del porcentaje de pacientes que alcanzan un PASI 90 o del PGA (cero o mínimo).
Las concentraciones séricas de ustekinumab también estaban afectadas por el peso, con menores concentraciones en los pacientes de mayor peso. En paralelo con la eficacia clínica, la concentración sérica en los pacientes ≤ 100kg que recibían la dosis de 45mg era similar a la concentración en los pacientes de >100kg tratados con 90mg de ustekinumab. Es presumible que estos datos acabasen condicionando la ficha técnica del producto, con dosis recomendadas de 90mg por encima de 100kg y de 45 por debajo de este peso.
La incidencia y el tipo de efectos adversos fueron similares, independientemente de la dosis y el peso del paciente. El porcentaje de autoanticuerpos tendía a ser mayor en los pacientes de mayor peso tratados con la dosis de 45mg, lo que sugiere que su desarrollo podría estar relacionado con concentraciones de fármaco inferiores a los límites detectables133.
En el estudio ACCEPT, que compara la eficacia y seguridad de ustekinumab (45 o 90mg) con etanercept, se obtuvieron conclusiones similares, con mejor respuesta (PASI 75 a las 12 semanas) en los pacientes que pesaban menos de 100kg y en los tratados con ustekinumab129.
Efecto de los tratamientos biológicos en el peso del pacienteEn algunos trabajos se ha comprobado cómo el tratamiento de la psoriasis moderada y grave puede condicionar un incremento moderado del peso de los pacientes, que resulta significativo a partir de la semana 12 de tratamiento134. En base a estos resultados, se postula que el bloqueo de TNF-α, que normalmente induce la producción135 y liberación136 de leptina, podría conducir a un aumento del apetito, que explicaría el aumento de peso posteriormente observado. Sin embargo, la eficacia comprobada en estos pacientes inclina claramente la balanza en la valoración de riesgo/beneficio.
Papel de la obesidad en la elección del tratamiento biológicoDiversos estudios han señalado la importancia del ajuste de la dosis en función del peso en pacientes tratados con fármacos biológicos, de modo que se alcancen concentraciones que permitan una eficacia óptima y, al mismo tiempo, evitar la sobreexposición en los pacientes de menor peso.
Aunque no existe un protocolo de cómo realizar la transición de un biológico a otro, según algunos autores, el peso del paciente es un factor que puede influir en la elección del tratamiento. De este modo, en los pacientes con mayor peso sería razonable considerar como de primera elección aquellos fármacos biológicos en los que la dosis de administración tiene en cuenta el peso, como infliximab o ustekinumab. Sin embargo, también deberá tenerse en cuenta el incremento de coste que ello significa. Aunque en los ensayos clínicos de etanercept y adalimumab los pacientes que no responden a las dosis convencionales de fármaco sí pueden responder al doblar la dosis, esta pauta supone un notable incremento del coste y de la exposición al fármaco130,131. De forma reciente se han publicado recomendaciones prácticas para el diagnóstico, las implicaciones prácticas y el manejo terapéutico de los pacientes con obesidad y psoriasis137,138.
Conclusiones terapéuticasEl tratamiento de los pacientes con psoriasis y obesidad plantea dificultades, como el mayor riesgo de efectos adversos en el caso de los fármacos sistémicos convencionales, y la disminución de la eficacia y/o el incremento del coste en el caso de los fármacos biológicos.
Uno de los objetivos del manejo de los pacientes con psoriasis y obesidad debería ser el de reducir la obesidad y, por lo tanto, la inflamación asociada para conseguir una mejor eficacia y tolerancia, especialmente con aquellos fármacos que se administran a dosis fijas, y disminuir así el riesgo de toxicidad.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónMSD ha participado en la promoción de este artículo pero no han participado en su contenido, que ha sido libremente escogido y redactado por los autores
Conflicto de interesesEl Dr. José Manuel Carrascosa declara haber participado en trabajo de investigación, dictado conferencias patrocinadas por Pfizer, MSD, Johnson, y Abbott.
El Dr. Vicenç Rocamora declara haber participado en trabajos de investigación y dictado conferencias patrocinadas por laboratorios Pfizer, MSD, Johnson y Abbott.
El Dr. José C Moreno-Giménez declara haber participado en trabajos de investigación y dictado conferencias patrocinadas por laboratorios Janssen, MSD, Abbot, Leo-Farma, Galderma y Pfizer.
El resto de autores declaran no tener ningún conflicto de intereses.