La dermatomiositis es un tipo de miopatía inflamatoria idiopática que afecta al músculo esquelético y a la piel. Las miopatías inflamatorias idiopáticas se caracterizan por la producción de autoanticuerpos que se dirigen frente a diversas estructuras de la célula. Algunos de estos autoanticuerpos resultan específicos de las miopatías inflamatorias idiopáticas (anticuerpos específicos de miositis), mientras que otros se encuentran en diversos síndromes de solapamiento (anticuerpos asociados a miositis). Todos ellos determinan ciertas características clínicas y patofisiológicas de miositis, pero son principalmente los anticuerpos específicos de miositis los que constituyen marcadores muy útiles para el diagnóstico clínico, la clasificación y la predicción del pronóstico en las miopatías inflamatorias idiopáticas. En los últimos años se han identificado dos nuevos anticuerpos específicos de miositis, el anti-CADM-140 en la dermatomiositis amiopática y el anti-p155 y anti-p155/p140 en la dermatomiositis asociada a cáncer. Ello tiene una gran trascendencia ya que en estos subgrupos clínicos no se detectaban anticuerpos específicos de miositis. La identificación de los antígenos diana que reconocen estos anticuerpos resultará fundamental para comprender mejor la etiopatogenia de estas enfermedades.
Dermatomyositis is an idiopathic inflammatory myopathy that affects skeletal muscle and the skin. Idiopathic inflammatory myopathies are characterized by the production of autoantibodies directed against different cell structures. Some of these autoantibodies are specific to idiopathic inflammatory myopathies (myositis-specific antibodies) whereas others are found in a range of overlap syndromes (myositis-associated antibodies). Although they are all associated with certain clinical and physiopathological characteristics of myositis, myositis-specific antibodies are essentially the most useful markers for clinical diagnosis, classification, and prognosis in idiopathic inflammatory myopathies. In recent years, two new myositis-specific antibodies—in clinically amyopathic dermatomyositis (CADM), CADM-140 and, in cancer-associated dermatomyositis, anti-p155/p140— have been identified. This is of great importance as no myositis-specific antibodies had previously been detected in these clinical subgroups. The identification of target antigens that are recognized by these antibodies is essential for a better understanding of the pathogenesis of these diseases.
La dermatomiositis es una enfermedad inflamatoria que afecta a la piel y al músculo. Se incluye dentro de las miopatías inflamatorias idiopáticas o miositis idiopáticas, las cuales constituyen un grupo heterogéneo de enfermedades musculares, de etiología desconocida, caracterizadas por la aparición progresiva de debilidad muscular e inflamación1.
En un intento de ordenar estos procesos se han propuesto varias clasificaciones. Una es la clasificación clínica que distingue grupos específicos de miopatías inflamatorias que difieren en la clínica, la microscopia, el pronóstico y, probablemente, también en la etiopatogenia (tabla 1)2. En este sentido, las más actuales incluyen, además de las entidades ya propuestas por Bohan y Peter en 19753, otras miopatías descritas con posterioridad como la miopatía por cuerpos de inclusión, o situaciones clínicas que si bien eran reconocidas desde hace tiempo por los dermatólogos, no se contemplaban en estas clasificaciones hasta hace pocos años. Este es el caso de la dermatomiositis amiopática o sine miositis, un diagnóstico de gran interés para el clínico dada su repercusión en el pronóstico y la terapéutica.
Clasificación clínica de las miopatías inflamatorias idiopáticas
| Polimiositis |
| Dermatomiositis |
| Dermatomiositis sine miositis |
| Polimiositis y dermatomiositis de la infancia |
| Miopatía por cuerpos de inclusión |
| Miositis asociada a cáncer |
| Miositis asociada a conectivopatías |
| Miositis eosinofílica |
| Miositis granulomatosa |
| Miositis focal o nodular |
| Miositis ocular u orbital |
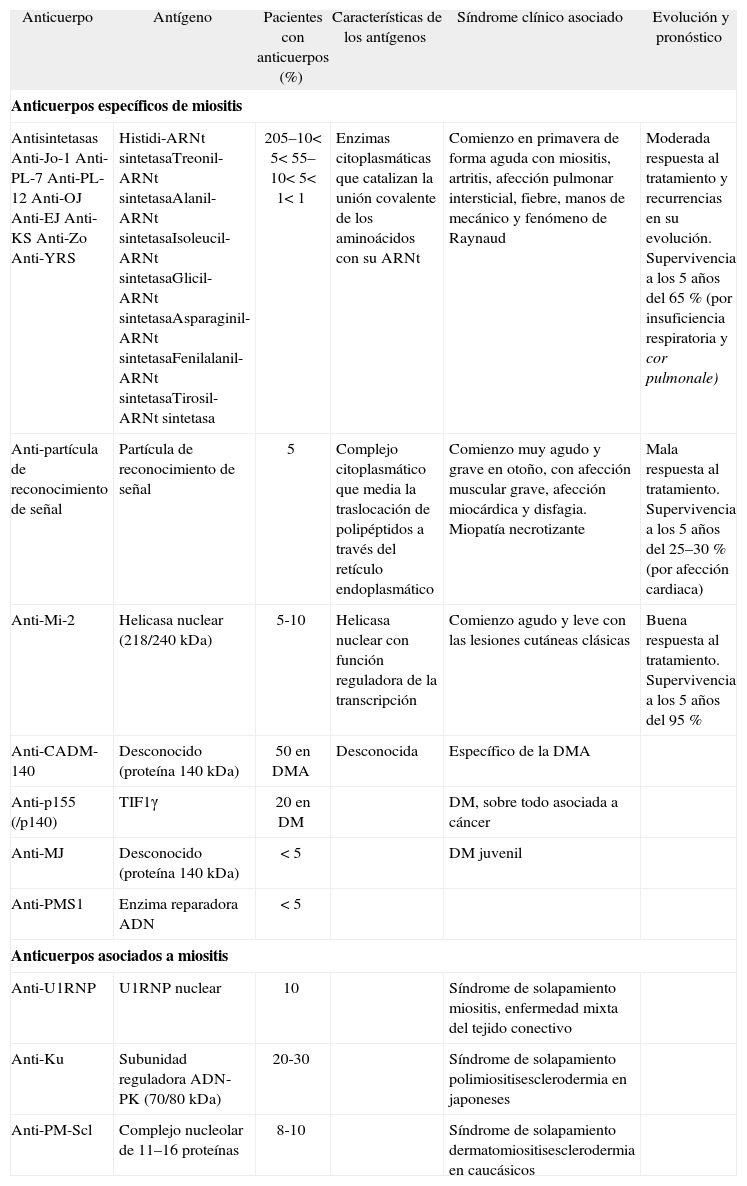
Una segunda clasificación contempla la presencia de unos anticuerpos dirigidos, en su mayor parte, frente a enzimas que participan en la síntesis de proteínas4,5. Estos anticuerpos parecen definir grupos de pacientes con unos hallazgos clínicos, epidemiológicos y pronósticos homogéneos, en especial aquellos que se asocian a los anticuerpos específicos de miositis (tabla 2). Su sensibilidad no es muy grande, por lo que su ausencia no puede excluir el diagnóstico de miopatía inflamatoria, pero su presencia sí que tiene un elevado valor predictivo. Dentro de los anticuerpos específicos de miositis los más importantes son los anticuerpos anti-sintetasa (anti-aminoacil-ARNt sintetasa) que van dirigidos frente a enzimas citoplasmáticas que catalizan la unión covalente de los aminoácidos con sus ARN de transferencia (ARNt). De ellos, el anticuerpo anti-histidil-ARNt o anti-Jo1 es el más frecuente6. A los 6 anticuerpos antisintetasa clásicos cabe añadir otros dos de reciente identificación en el suero de dos únicos pacientes: anti-Zo (fenilalanil-ARNt sintetasa) y anti-YRS (tirosil-ARNt sintetasa)7,8. Salvo excepciones, cada paciente presenta uno solo de estos anticuerpos antisintetasa y las manifestaciones clínicas son, a grandes rasgos, similares en todos ellos. Es característica la presencia de miositis, enfermedad pulmonar intersticial, artritis, fenómeno de Raynaud y las manos de mecánico. De aquí el término «síndrome antisintetasa», que se acuñó con el fin de identificar a los pacientes que cursaban con esta sintomatología9. Los anticuerpos antisintetasa tienen interés, ante todo, por su capacidad para predecir el desarrollo de enfermedad pulmonar intersticial en los pacientes con miositis y viceversa, el inicio tardío de una miositis en los pacientes que debutan con una enfermedad pulmonar intersticial10.
Anticuerpos en las miositis idiopáticas y características clínico-evolutivas de la miopatía inflamatoria asociada
| Anticuerpo | Antígeno | Pacientes con anticuerpos (%) | Características de los antígenos | Síndrome clínico asociado | Evolución y pronóstico |
| Anticuerpos específicos de miositis | |||||
| AntisintetasasAnti-Jo-1Anti-PL-7Anti-PL-12Anti-OJAnti-EJAnti-KSAnti-ZoAnti-YRS | Histidi-ARNt sintetasaTreonil-ARNt sintetasaAlanil-ARNt sintetasaIsoleucil-ARNt sintetasaGlicil-ARNt sintetasaAsparaginil-ARNt sintetasaFenilalanil-ARNt sintetasaTirosil-ARNt sintetasa | 205–10< 5< 55–10< 5< 1< 1 | Enzimas citoplasmáticas que catalizan la unión covalente de los aminoácidos con su ARNt | Comienzo en primavera de forma aguda con miositis, artritis, afección pulmonar intersticial, fiebre, manos de mecánico y fenómeno de Raynaud | Moderada respuesta al tratamiento y recurrencias en su evolución. Supervivencia a los 5 años del 65 % (por insuficiencia respiratoria y cor pulmonale) |
| Anti-partícula de reconocimiento de señal | Partícula de reconocimiento de señal | 5 | Complejo citoplasmático que media la traslocación de polipéptidos a través del retículo endoplasmático | Comienzo muy agudo y grave en otoño, con afección muscular grave, afección miocárdica y disfagia. Miopatía necrotizante | Mala respuesta al tratamiento. Supervivencia a los 5 años del 25–30 % (por afección cardiaca) |
| Anti-Mi-2 | Helicasa nuclear (218/240 kDa) | 5-10 | Helicasa nuclear con función reguladora de la transcripción | Comienzo agudo y leve con las lesiones cutáneas clásicas | Buena respuesta al tratamiento. Supervivencia a los 5 años del 95 % |
| Anti-CADM-140 | Desconocido (proteína 140 kDa) | 50 en DMA | Desconocida | Específico de la DMA | |
| Anti-p155 (/p140) | TIF1γ | 20 en DM | DM, sobre todo asociada a cáncer | ||
| Anti-MJ | Desconocido (proteína 140 kDa) | < 5 | DM juvenil | ||
| Anti-PMS1 | Enzima reparadora ADN | < 5 | |||
| Anticuerpos asociados a miositis | |||||
| Anti-U1RNP | U1RNP nuclear | 10 | Síndrome de solapamiento miositis, enfermedad mixta del tejido conectivo | ||
| Anti-Ku | Subunidad reguladora ADN-PK (70/80 kDa) | 20-30 | Síndrome de solapamiento polimiositisesclerodermia en japoneses | ||
| Anti-PM-Scl | Complejo nucleolar de 11–16 proteínas | 8-10 | Síndrome de solapamiento dermatomiositisesclerodermia en caucásicos | ||
Adaptada de Mimori T et al5.
ADN-PK: ADN dependiente de proteín-cinasa; DM: dermatomiositis; DMA: dermatomiositis amiopática; TIF1-γ: factor transcripcional intermediario 1γ.
Los cambios clínicos que definen las manos de mecánico son el engrosamiento, la hiperqueratosis y las fisuras en las caras laterales y palmar de las manos11,12. Sin embargo, posteriormente estos cambios cutáneos se han descrito junto a lesiones típicas de la dermatomiositis clásica, en pacientes con polimiositis13 o en síndromes de solapamiento como la escleromiositis14. Por todo ello, en la actualidad las manos de mecánico se tienden a considerar un marcador cutáneo de miositis con independencia del anticuerpo o la miopatía asociada.
Otros dos anticuerpos específicos de miositis bien conocidos son el anticuerpo anti-Mi-2 y el anti-partícula de reconocimiento de señal (anti-PRS). Anti-Mi-2 se asocia a dermatomiositis tanto juvenil como del adulto, con poco riesgo de enfermedad pulmonar intersticial, y a un pronóstico relativamente bueno15. Este anticuerpo reconoce dos antígenos, Mi-2α (240 kDa) y Mi-2β (218 kDa), los cuales probablemente pertenecen a la misma familia de proteínas, las helicasas nucleares, que tienen una función reguladora de la transcripción16–18. Es posible que en un futuro próximo se identifiquen diferencias clínicas entre los pacientes con distinta reactividad frente a las dos moléculas Mi-2 o determinados fragmentos de las mismas, como ya se ha apuntado en un artículo reciente19. La PRS es un complejo citoplasmático ARN-proteína que consiste en 7SL-ARN y 6 polipéptidos de 72, 68, 54, 19, 14 y 9 kDa. Este complejo media la traslocación de polipéptidos a través del retículo endoplasmático. Los pacientes que desarrollan anticuerpos frente a esta partícula suelen presentar una miositis de inicio agudo, en general resistente al tratamiento estándar con glucocorticoides y con frecuentes exacerbaciones, afectación miocárdica y disfagia20,21. Desde el punto de vista microscópico se ha observado que en esta miositis predomina la necrosis de las fibras musculares sin apenas existencia de infiltrados inflamatorios22. Por tanto, el anti-PRS puede ser el marcador de un síndrome de miopatía necrotizante diferente de la típica polimiositis que, si bien no suele responder al tratamiento convencional con glucocorticoides, sí puede responder a otros tratamientos como rituximab, un anticuerpo monoclonal anti-CD2023.
Recientemente se han identificado nuevos autoanticuerpos específicos de miositis que parecen relacionarse con situaciones clínicas de gran interés para el dermatólogo, como pueden ser la dermatomiositis amiopática y la dermatomiositis asociada a cáncer.
Dermatomiositis amiopáticaEn un porcentaje bajo de pacientes, que se ha descrito entre el 2 y el 18 %, puede observarse una erupción indistinguible de la dermatomiositis clásica pero con ausencia o mínima expresión de enfermedad muscular. A este grupo se le denomina dermatomiositis sine miositis o dermatomiositis amiopática o dermatomiositis clínicamente amiopática, como recientemente han propuesto Sontheimer et al24. Esta situación clínica es motivo de gran interés y controversia, ya que siguen sin definirse los criterios que deben regir su diagnóstico, se desconoce si existe el mismo riesgo que en la dermatomiositis clásica de desarrollar complicaciones graves como una neoplasia o una enfermedad pulmonar intersticial, ni hay acuerdo sobre cuál es el tratamiento más adecuado.
Respecto a su diagnóstico, se debe recordar que no existen diferencias en cuanto a la clínica y la microscopia de las lesiones cutáneas en la dermatomiositis amiopática con respecto a la dermatomiositis clásica y que en más del 50 % de los pacientes con una dermatomiositis clásica, las lesiones cutáneas preceden entre 3 y 6 meses a la afectación muscular25. Si esta ocurre durante los dos primeros años desde la aparición del exantema, debe considerarse como la progresión habitual de la dermatomiositis clásica. Pasado este tiempo, si el paciente sigue con enfermedad únicamente en la piel, puede hablarse de dermatomiositis sine miositis26,27.
Más controvertido resulta definir «la ausencia de enfermedad muscular» y hasta qué punto debe explorarse el músculo para decidir si este órgano está activo o no. Se ha observado que pacientes con lesiones cutáneas de dermatomiositis sin clínica de debilidad muscular y creatinín-fosfocinasa (CPK) dentro de la normalidad pueden tener alteraciones en el electromiograma (EMG), la resonancia magnética y en la biopsia muscular, lo que implica la existencia de una miositis clínicamente silente28,29. Sin embargo, como se demuestra en un estudio reciente donde se realiza una revisión sistemática de la literatura24, estos hallazgos no sirven para predecir el inicio posterior de enfermedad muscular franca y, por tanto, su presencia no necesariamente comporta un cambio en la actitud terapéutica. Se podría argumentar, por tanto, que más allá de la exploración de la clínica muscular y la determinación de la CPK, otras exploraciones musculares resultarían innecesarias con el fin de tomar una decisión terapéutica en ausencia de debilidad muscular. Sí que el inicio de la enfermedad muscular es con frecuencia anunciado por una elevación de la CPK, lo que subraya el interés de realizar determinaciones periódicas de esta enzima muscular en los pacientes con una dermatomiositis clínicamente amiopática, en especial durante los dos primeros años.
Es evidente que ante la dificultad de definir desde el punto de vista clínico la dermatomiositis amiopática, la caracterización de algún marcador serológico que permitiera identificar a estos pacientes tendría un gran interés clínico y pronóstico. En este sentido, en los pacientes con dermatomiositis clínicamente amiopática, y no en la dermatomiositis clásica, se han identificado algunos anticuerpos dirigidos frente a nuevos autoantígenos que podrían desempeñar este papel; entre ellos destaca el anticuerpo anti-CADM-140, que se dirige frente a un antígeno citoplasmático de 140 kDa y se asocia, al menos en la población japonesa, a la dermatomiositis amiopática y, dentro de este contexto, a la enfermedad pulmonar rápidamente progresiva30. Respecto a esta última complicación, tras la revisión de la literatura se puede afirmar que hasta el 15 % de las dermatomiositis clínicamente amiopáticas pueden desarrollar enfermedad pulmonar intersticial con una mortalidad de casi el 40 %24. Hasta la identificación de anti-CADM-140 también se había podido comprobar que en estos pacientes, a diferencia de lo que ocurre en la dermatomiositis clásica asociada a enfermedad pulmonar, no se identificaba ningún anticuerpo específico de miositis clásico como el anticuerpo anti-Jo-1. Quizá estudios futuros permitirán caracterizar nuevos anticuerpos que, como el anti-CADM-140, pudieran identificar pacientes con dermatomiositis amiopática asociada o no a enfermedad pulmonar.
En lo referente a la actitud terapéutica, Euwer y Sontheimer31 sugirieron en 1991 que una aproximación más agresiva en el tratamiento de la enfermedad cutánea, entendiendo como tal la que se plantearía en el caso de una dermatomiositis clásica, podría prevenir el desarrollo posterior de inflamación muscular. Sin embargo, la publicación posterior de varias series en las que los pacientes diagnosticados de dermatomiositis amiopática no desarrollaron enfermedad muscular a pesar de no recibir tratamiento inmunosupresor29,32,33, sugiere que los glucocorticoides orales u otro agente inmunosupresor sólo deberían administrarse en presencia de enfermedad muscular franca.
Dermatomiositis asociada a cáncerOtro aspecto de interés en relación con algunos de los nuevos autoanticuerpos identificados en la dermatomiositis es el mayor riesgo que estos pacientes tienen de desarrollar una neoplasia. La asociación entre dermatomiositis y neoplasia se sugirió por primera vez en 1916. En los primeros estudios epidemiológicos, diversos aspectos clínicos y metodológicos -como la dificultad en el diagnóstico de miositis y, sobre todo, en la distinción entre dermatomiositis y polimiositis, el sesgo en la referencia de los casos, los estudios con muestras pequeñas, la escasa duración del seguimiento o la ausencia de un grupo control apropiado, entre otros– impidieron la confirmación de este hecho34–41. Sin embargo, estudios de cohortes más recientes, bien diseñados, han demostrado una asociación significativa entre miositis y neoplasia, siendo el riesgo de esta asociación mayor para la dermatomiositis respecto a la polimiositis.
Uno de estos estudios fue publicado por un grupo australiano en el año 2001 y en él se incluyeron un total de 537 pacientes, todos ellos con biopsia probada de miopatía inflamatoria42. La razón de incidencia estandarizada que se obtuvo en el grupo de pacientes con dermatomiositis fue de 6,2, lo que indica que el riesgo de neoplasia es 6 veces mayor en estos pacientes respecto a la población general. También se observó que este riesgo fue 2,4 veces mayor en los pacientes con dermatomiositis respecto al grupo con polimiositis.
Hill et al43 también demostraron en un amplio grupo de pacientes con dermatomiositis y polimiositis que ambas se asociaban a un mayor riesgo de cáncer, pero este riesgo era mayor en los pacientes con dermatomiositis.
Por tanto, parece claro que existe una asociación entre dermatomiositis y cáncer. Sin embargo, sigue sin definirse cuál es la estrategia más adecuada en la búsqueda de esta neoplasia. En este sentido, tres cuestiones importantes no tienen aun una respuesta clara. Primero, ¿disponemos de algún factor predictivo o marcador de neoplasia en la dermatomiositis del adulto?; segundo, el estudio de la neoplasia, ¿debe realizarse con las mínimas exploraciones o, por el contrario, debe ser completo y exhaustivo?; y tercero, ¿durante cuánto tiempo debemos realizar el seguimiento del paciente en caso de que no se encuentre neoplasia alguna en la primera evaluación?
La primera cuestión es una de las más importantes para el clínico, ya que es obvio que la identificación de determinados hallazgos clínicos o parámetros biológicos que pudieran actuar como marcadores de neoplasia, permitiría realizar una investigación selectiva y meticulosa de la neoplasia sólo en aquellos pacientes que fueran portadores de estos marcadores. Lamentablemente existen pocos cambios clínicos que nos permitan sospechar la existencia de una neoplasia. El primer factor que podríamos considerar es la edad. Sabemos que la frecuencia de neoplasia en los pacientes con dermatomiositis se incrementa con la edad34,44–48, y que la presencia de neoplasia resulta excepcional en la dermatomiositis infantil49. Sin embargo, se ha demostrado que el riesgo de neoplasia se encuentra aumentado incluso en los pacientes con dermatomiositis por debajo de los 45 años. Por tanto, la edad no debería ser para el clínico un elemento disuasorio en la búsqueda meticulosa de la neoplasia.
Algunos autores han señalado en diversas publicaciones de la literatura francesa50–52 el interés de observar en los pacientes con dermatomiositis lesiones necróticas en la piel, ya que parece que pueden constituir un marcador de neoplasia. En uno de estos estudios el valor predictivo de la asociación de necrosis cutánea y neoplasia fue del 70 %52. Este parámetro clínico resulta fácil de evaluar por el dermatólogo y, probablemente, su observación podría justificar una investigación exhaustiva de la neoplasia.
Finalmente, se ha sugerido que la presencia de enfermedad pulmonar intersticial sola o acompañada de anticuerpos anti-sintetasa tiene una asociación negativa con el riesgo de cáncer4,53,54.
Con respecto a los parámetros biológicos, se puede distinguir entre algunas determinaciones de laboratorio de rutina, los marcadores de antígenos tumorales y los autoanticuerpos. Se ha descrito que los pacientes con dermatomiositis y neoplasia asociada tienen con mayor frecuencia unos niveles normales de CPK55–57, aunque para algunos autores sería lo contrario58,59, y una velocidad de sedimentación globular (VSG) incrementada58.
Es bien conocido que la determinación de una batería de marcadores de antígenos tumorales puede proporcionar una información útil antes de iniciar la búsqueda exhaustiva de la neoplasia. En los pacientes con miositis podrían resultar de especial interés los marcadores CA125 y CA19.9, ya que según Amoura et al54 la elevación en el suero de estos dos marcadores, así como la elevación de CA125 en determinaciones seriadas, se asocia a un mayor riesgo de desarrollar cáncer, no sólo de ovario, sino también de otros tipos.
Desde el punto de vista serológico, hasta hace muy pocos años no se había identificado ningún anticuerpo específico de miositis como marcador de neoplasia. Más aun, en la literatura se había señalado que la presencia de estos anticuerpos específicos de miositis disminuía la probabilidad de cáncer4,60. No obstante, en los últimos años se han identificado nuevos anticuerpos específicos en los pacientes con dermatomiositis30,61, y alguno de ellos parece que se asocia a la presencia de cáncer. Uno de estos anticuerpos es el anti-p155. Según Targoff et al62, el anti-p155 estuvo presente en el 75 % de los casos con miositis y neoplasia, y la neoplasia se desarrolló en el 37,5 % de los pacientes con dermatomiositis y un anti-p155 positivo. El antígeno diana de este anticuerpo es el factor transcripcional intermediario 1–γ (TIF1-γ)63. Otros autores, de forma casi simultánea, han descrito un anticuerpo similar que reacciona no sólo con una proteína de 155 kDa, sino también con otra de 140 kDa64,65. Esta doble banda de precipitación ya era mencionada en el estudio anterior62, por lo que probablemente estamos ante el mismo anticuerpo. En cualquier caso, estos dos grupos de trabajo64,65 identifican este anticuerpo como específico de dermatomiositis a la vez que se correlaciona bien con la presencia de neoplasia y la ausencia de enfermedad pulmonar. Así, un anti-p155/140 positivo proporciona una alta especificidad (96 %), una sensibilidad moderada (50 %) y un valor predictivo negativo elevado (97 %) para dermatomiositis asociada a cáncer. Más aun, la presencia de este anticuerpo junto a un panel negativo de anticuerpos específicos de miositis incrementa la sensibilidad (94 %) y el valor predictivo negativo (99 %)65. Es obvio que la aplicación clínica de todos estos resultados requiere su confirmación mediante estudios amplios con un seguimiento prospectivo, pero evidentemente abre la posibilidad de disponer en un futuro próximo de posibles marcadores serológicos de dermatomiositis asociada a neoplasia.
Respecto a la segunda cuestión planteada, diremos que sigue siendo motivo de discusión cómo debe realizarse el estudio de una neoplasia en el paciente con una dermatomiositis. Debemos partir de la certeza de que el tipo de cáncer que podemos encontrar es variado (los más frecuentes son los de ovario, pulmón, tracto gastrointestinal, páncreas y mama) y que la mayoría de ellos pueden estar ocultos43. Desde una perspectiva clínica parece razonable aconsejar al paciente asintomático la búsqueda de cualquier proceso cuya detección y tratamiento precoces conduzcan a mejorar la evolución del mismo. Por otro lado, es evidente que la presencia de una neoplasia constituye un indicador de mal pronóstico en el contexto de una dermatomiositis.
Tradicionalmente existen dos actitudes opuestas respecto al número y tipo de exploraciones que se deben realizar en la búsqueda de una neoplasia en los pacientes con esta enfermedad. Una de ellas se limita a realizar un interrogatorio completo, una exploración física minuciosa, unas determinaciones de laboratorio de rutina y unas exploraciones complementarias en función de los síntomas y signos que se desprendan de la historia clínica. La otra aproximación incluiría, además de los exámenes ya comentados, un amplio abanico de exploraciones como tomografía axial computarizada (TAC) tóraco-abdominal, endoscopias del tracto gastrointestinal, mamografía, biopsia de médula ósea e inmunoelectroforesis del suero, entre otras58,66. Pero, probablemente, todas estas recomendaciones no pueden verse como algo definitivo, sino que pueden variar en el tiempo de acuerdo con la introducción de nuevos conocimientos médicos y técnicas de exploración más sensibles y cómodas. Aquí podría plantearse, por ejemplo, el papel del escáner-PET (tomografía por emisión de positrones).
Hoy por hoy, y según un estudio reciente de Hill et al43, parece razonable que a un paciente varón, de origen caucásico con una dermatomiositis, se le realice, además de un examen clínico cuidadoso y unos análisis de rutina y marcadores de antígenos tumorales, una búsqueda de sangre en heces y una TAC de tórax y abdomen. En la mujer también estaría justificada la realización de una TAC y una ecografía pélvica, así como una mamografía. Los estudios endoscópicos del tracto intestinal superior e inferior podrían estar indicados de acuerdo con la edad del paciente46,47,58. Finalmente, en los pacientes asiáticos que residen en el sudeste de Asia el cáncer de nasofaringe es muy frecuente, por lo que en ellos sería además recomendable una cuidadosa evaluación del territorio otorrinolaringológico57,66.
Aunque se han descrito algunos casos aislados de cáncer asociados a dermatomiositis amiopática, no existen datos poblacionales que confirmen el aumento del riesgo de neoplasia en este subtipo de dermatomiositis24. No obstante, se recomienda la misma actitud vigilante respecto a la posibilidad de una neoplasia asociada.
Entre el 26 y el 70 % de los casos, el desarrollo de la neoplasia ocurre durante el primer año tras el diagnóstico de la miositis. Este dato confirma que la investigación meticulosa de una neoplasia debe realizarse sobre todo durante este periodo de tiempo. Sin embargo, diversos estudios han demostrado que el riesgo es más alto en los tres primeros años, pero sigue siendo alto a los 5 años tras el diagnóstico de la miositis. No se puede descartar que este riesgo tardío de neoplasia se deba a un efecto a largo plazo de la terapia inmunosupresora. En cualquier caso, es recomendable que el clínico al cuidado de pacientes con dermatomiositis realice una supervisión meticulosa anual en búsqueda de una posible neoplasia durante los 3 o 4 primeros años tras el inicio de la miositis42,43.
Conflicto de interesesDeclaro no tener ningún conflicto de intereses.