El mecanismo por el cual las radiaciones ionizantes producen muerte celular es el daño al ADN, que afecta más a las células tumorales de mayor actividad mitótica e indiferenciadas. La administración de radioterapia en dosis fraccionadas aumenta la eficacia y la tolerabilidad del tratamiento; esquemas más fraccionados en dosis bajas por sesión minimizan los efectos secundarios. La mayoría de los tumores irradiados en dosis radical no desaparecen de forma rápida al final del tratamiento. Una valoración de la respuesta definitiva antes de los tres meses es prematura. La radioterapia es un tratamiento importante en pacientes seleccionados con cáncer de piel. Se obtienen excelentes tasas de control tumoral, con buen resultado cosmético, preservación funcional e infrecuentes complicaciones con los modernos equipos y las técnicas de radioterapia. La elección de la técnica se determina por el tamaño, el espesor y la localización anatómica del tumor. Las técnicas actualmente más extendidas para el tratamiento del cáncer de piel son la radioterapia externa con electrones de acelerador lineal y la braquiterapia de alta tasa de dosis.
Ionizing radiation causes cell death through DNA damage and has a stronger effect on undifferentiated tumor cells with a high mitotic rate. The use of a fractionated radiotherapy regimen improves both efficacy and tolerance. In addition, greater fractionation, with lower doses per session, minimizes adverse effects. In the majority of tumors treated with radical radiotherapy, the tumor cells do not disappear immediately after treatment, and assessment of the final response to treatment before three months is premature. Radiotherapy is an important treatment modality in selected patients with skin cancer. Modern radiotherapy equipment and techniques achieve excellent rates of tumor control, associated with good cosmetic results, preserved function, and a low rate of complications. The choice of technique is determined by tumor size and site and the thickness. The techniques most widely used at the present time include external beam radiotherapy with linear accelerators and high-dose-rate brachytherapy.
En este trabajo vamos a revisar aspectos del cáncer de piel no melanoma tales como su historia natural y factores pronósticos, radiobiología, indicaciones y técnicas de tratamiento con radioterapia y localizaciones anatómicas específicas, valorando los resultados clínicos y efectos secundarios de dicho tratamiento. También describiremos las indicaciones del tratamiento con radioterapia de las lesiones cutáneas premalignas, del melanoma y del carcinoma de células de Merkel. Finalmente revisaremos el tratamiento con radioterapia de tumores poco frecuentes, como el dermatofibrosarcoma protuberans.
EpidemiologíaEl cáncer de piel no melanoma es el más común de todos los cánceres; su incidencia está aumentando debido al envejecimiento de la población y a la exposición a la radiación ultravioleta. El carcinoma basocelular es el más frecuente, representando el 80 % del cáncer de piel no melanoma, seguido del carcinoma epidermoide, que supone el 20 %1,2. El melanoma representa aproximadamente el 3 % del cáncer cutáneo, pero es responsable del 75 % de las muertes por cáncer de piel. Otras lesiones malignas cutáneas son menos frecuentes.
Historia natural y factores pronósticos del cáncer de piel no melanomaCáncer de piel no melanomaCarcinoma basocelularSe localiza con mayor frecuencia en regiones de cabeza y cuello3; puede presentar mayor capacidad infiltrativa en áreas anatómicas de planos de fusión embrionarios. Se asocia con mutaciones del gen supresor tumoral en el cromosoma 9q y p534. El carcinoma basocelular rara vez metastatiza (< 0,1 %) y no suele presentarse en las mucosas ni en las palmas de las manos o las plantas de los pies. Los subtipos más frecuentes de carcinoma basocelular son el nodular ulcerativo (45–60 %) y el superficial (15–35 %), menos frecuente es la forma pigmentada (1–2 %), y más agresivos pero con menor incidencia son los tipos esclerodermiforme o infiltrativo (4–17 %)5–8. Estos últimos presentan mayor tasa de recidiva tras el tratamiento inicial, posiblemente por la dificultad de definir adecuadamente los bordes o límites tumorales. El riesgo de recurrencia local del carcinoma basocelular se relaciona con el tamaño tumoral (> 6 mm), mayor infiltración en profundidad, subtipo histológico (infiltrativo, esclerodermiforme), localización (región centrofacial, zonas de fusión embriológicas), pobre definición de los bordes tumorales, recidiva tumoral, inmunosupresión, invasión perineural y multifocalidad9–12. La mayoría de las recidivas se presenta en los tres primeros años desde el tratamiento inicial.
Carcinoma epidermoideEs un tumor de células queratinizantes de la epidermis que invaden a través de la unión dermo-epidérmica, comúnmente asociado a mutaciones del gen supresor tumoral p53. A pesar de su presentación superficial, puede invadir a través de la hipodermis estructuras musculares, periostio, tejido perineural y vasos angiolinfáticos. El carcinoma epidermoide derivado de queratosis actínica suele presentar un crecimiento lento y rara vez metastatiza. Cuando aparece sobre áreas de escaras o de inflamación crónica, o los primarios que se presentan de novo, son más agresivos. Las metástasis ganglionares y a distancia ocurren aproximadamente en el 10 % de los casos. La mortalidad por cáncer de piel no melanoma es rara, la causa suele ser el carcinoma epidermoide con los siguientes factores de riesgo de mortalidad: tamaño tumoral ≥ 4 cm, invasión perineural e invasión a través de la hipodermis. Clayman et al presentan en su análisis de 210 carcinomas epidermoides resultados de supervivencia libre de enfermedad específica a los tres años del 100 % sin ningún factor de riesgo, y del 70 % con al menos un factor de riesgo13.
Los factores de riesgo de recurrencia del carcinoma epidermoide son: tamaño y localización tumoral, pobre definición de los bordes tumorales, tumor recidivado e inmunosupresión. Otros factores adicionales son: localizaciones sobre procesos inflamatorios crónicos, rápido crecimiento tumoral, síntomas neurológicos, histología moderada-pobremente diferenciada, adenoide (acantolítico), adenoescamoso (con producción de mucina) o desmoplásico, afectación de la dermis reticular o de la grasa subcutánea (niveles de Clark IV-V) o espesor ≥ 4 mm e invasión perineural o vascular10.
Estadificación del cáncer de piel no melanomaEl sistema de estadificación para el cáncer de piel no melanoma aparece en la tabla 1.
Estadificación del cáncer de piel no melanoma
| Tumor primario (T) | |
| TX | El tumor primario no se puede valorar |
| T0 | Sin evidencia de tumor primario |
| Tis | Carcinoma in situ |
| T1 | Tumor ≤ 2 cm |
| T2 | Tumor > 2 cm y ≤ 5 cm |
| T3 | Tumor > 5 cm |
| T4 | El tumor invade en profundidad estructuras extracutáneas |
| Ganglios linfáticos regionales (N) | |
| NX | Los ganglios linfáticos regionales no se pueden valorar |
| N0 | Sin metástasis ganglionares regionales |
| N1 | Metástasis ganglionares regionales |
| Metástasis a distancia (M) | |
| MX | Las metástasis a distancia no se pueden valorar |
| M0 | Sin metástasis a distancia |
| M1 | Metástasis a distancia |
| Estadio | |||
| 0 | Tis | N0 | M0 |
| I | T1 | N0 | M0 |
| II | T2-3 | N0 | M0 |
| III | T4 | N0 | M0 |
| IV | T | N1 | M0 |
| T | N | M1 | |
Tomada de: American Joint Committee Staging System (AJCC).
En: Green FL, Page DL, Fleming ID, et al, editors. AJCC Cancer Staging Manual. 6th ed. New York: Springer-Verlag; 2002.
Las lesiones tumorales extensas y recurrentes pueden resultar muy difíciles, si no imposibles, de erradicar debido a las vías de diseminación del cáncer de piel no melanoma14:
Infiltración subclínica (diseminación dérmica)Este patrón es frecuente en el carcinoma basocelular y se caracteriza por una infiltración irregular digitiforme. La infiltración en profundidad a través de la hipodermis es más común en el carcinoma epidermoide y en etapas más tempranas de su evolución. Ambos, basocelular y epidermoide, pueden invadir la dermis media a través de las unidades pilosebáceas. En lesiones tumorales más grandes pueden existir islas tumorales aisladas en la dermis profunda15.
Infiltración en profundidadInvasión por contigüidadLos carcinomas basocelular y epidermoide pueden invadir estructuras vitales como el ojo, el párpado o el conducto lacrimal en proximidad a la órbita en la cara. Otras alteraciones funcionales pueden resultar de una invasión tumoral similar en otras áreas anatómicas. El tumor puede desarrollarse a través de fascias y planos como periostio, pericondrio y fascia muscular.
Diseminación neurotrópicaLa diseminación perineural de los carcinomas basocelular y epidermoide se asocia con un pronóstico infausto que afortunadamente no es frecuente. El espacio perineural, entre el nervio y su vaina, se convierte en vía de diseminación para el cáncer de piel, proporcionando acceso directo al sistema nervioso central. Mohs observó invasión perineural en el 0,9 % de 2.488 carcinomas basocelulares16. El carcinoma basocelular con invasión perineural aparece en estadios localmente avanzados o en tumores recurrentes17,18. El carcinoma epidermoide presenta invasión perineural en el 2–14 % de los casos. Las ramas periféricas de los nervios trigémino y facial son las que se afectan con mayor frecuencia. En las muestras histopatológicas se pueden observar implantes tumorales discontinuos a lo largo del nervio. La manifestación clínica puede ser insidiosa, permaneciendo asintomáticos el 60–70 % de los pacientes. La compresión del nervio puede desarrollarse en periodos de tiempo prolongados, incluso años, y da lugar a la aparición de síntomas como hormigueo, quemazón seguido de dolor, parestesias y déficit motor, si no se trata adecuadamente19–24.
Metástasis ganglionar, cutánea y hematógenaLa afectación ganglionar del carcinoma basocelular es infrecuente, menor del 0,1 %, y se presenta en tumores de mayor tamaño y crecimiento en profundidad, ulcerativos y recurrentes tras varios tratamientos. La localización metastásica más frecuente es en los ganglios linfáticos regionales, aunque el pulmón, el hígado y el hueso pueden verse también afectados25.
La afectación ganglionar secundaria al carcinoma epidermoide con factores pronósticos desfavorables representa el 10–30 % de los casos. Los ganglios periparotídeos e intraparotídeos son los que se afectan con más frecuencia. La identificación de pacientes con carcinoma epidermoide de alto riesgo es fundamental para la elección consensuada de los tratamientos.
De acuerdo con Johnson et al, la diseminación hematógena del carcinoma epidermoide se puede manifestar en pulmón, hígado, cerebro, piel o hueso26.
Las tasas de supervivencia publicadas a los 5 años de pacientes con metástasis ganglionar regional y visceral son del 22 al 56 % y de 23 %, respectivamente27,28.
Tratamiento con radioterapia del cáncer de piel no melanomaRadiobiología tumoralRadiosensibilidadLa interacción de las radiaciones ionizantes con los seres vivos da lugar a un depósito de energía, que se traduce en la aparición de ionizaciones y radicales libres. Estos, de gran actividad química, son los responsables de los efectos biológicos subsiguientes.
El mecanismo primario por el cual las radiaciones ionizantes producen muerte celular es el daño al ADN, que da lugar a la pérdida o cambio de una base, rotura de los enlaces de hidrógeno que unen las dos cadenas de la molécula de ADN o rotura simple o doble de las cadenas de ADN. Todas estas alteraciones no conducirán siempre a una lesión celular, ya que gran parte de los cambios se reparan, y otros ocurren en zonas de la cadena de ADN que no se replican ni tienen importancia en la síntesis de proteínas. Finalmente, otros provocarán una lesión celular que afectará a la propia célula o a su descendencia y se traducirá en el control tumoral (respuesta completa, parcial o estabilización).
A pesar de que las lesiones radioinducidas más importantes ocurren a nivel del ADN y de los cromosomas, las radiaciones provocan también lesiones en otras partes celulares. Se produce alteración en la permeabilidad de la membrana celular, en la actividad de las enzimas, cambio en la estructura de las proteínas, etc. Las altas dosis de radiación causan la muerte inmediata por fallo mitocondrial y de la cadena de fosforilación oxidativa.
El empleo de las radiaciones ionizantes en la práctica médica se basa en la mayor destrucción de los tejidos neoplásicos que de los sanos. La radiación afecta más a las células con actividad mitótica, indiferenciadas y que tienen un gran porvenir cariocinético, es decir, muchas divisiones celulares (mayor radiosensibilidad).
El concepto de radiorresistencia es relativo, ya que no existe ninguna célula radiorresistente a dosis suficientemente altas.
Respuesta tumoralDentro de la compleja estructura tumoral podemos distinguir varios grupos celulares diferentes. Existen células hipóxicas y células bien oxigenadas, clonogénicas y no clonogénicas, proliferativas y no proliferativas. Todas estas fracciones celulares exhibirán patrones de radiosensibilidad diferentes. La histología del tumor y el grado de diferenciación celular son también factores de gran importancia. Finalmente, el volumen total de células es un punto fundamental en la radiocurabilidad.
La heterogeneidad tumoral es mayor que en los tejidos normales, y no sólo desde el punto de vista de la hipoxia. Es un concepto dinámico en el que se producen cambios con el tiempo y la administración de la radioterapia o de fármacos antineoplásicos. La radioterapia es poco efectiva administrada en dosis única, ya que no consigue destruir la totalidad de las células tumorales debido a su heterogénea radiosensibilidad. Así, la fracción tumoral hipóxica o en fase S del ciclo celular tendría una resistencia muy superior.
La administración de radioterapia en dosis fraccionadas permite aumentar el efecto mediante varios fenómenos:
- 1.
Reoxigenación: a medida que las células bien oxigenadas, más radiosensibles, son destruidas en cada fracción, el porcentaje de células mal oxigenadas va disminuyendo con cada sesión.
- 2.
Redistribución: las células en fases sensibles del ciclo celular (M y G2) son destruidas precozmente y en las sucesivas sesiones de tratamiento, las células en reposo intermitótico (G0), radiorresistentes, entrarán en ciclo celular y llegarán a las fases radiosensibles.
- 3.
Reparación intracelular: aunque teóricamente la lesión producida sea similar en el tumor y en el tejido sano después de la primera dosis de radioterapia, la mayor capacidad reparativa del daño subletal por el tejido sano introduce una ventaja clara que aumentará con las fracciones. También se produce la inactivación celular tumoral por la acumulación de daño subletal. Además, la capacidad de proliferación del tejido sano es superior y más precoz que la de las células neoplásicas.
- 4.
Repoblación: uno de los efectos más fácilmente detectables tras una dosis de radiación sobre un tejido es la disminución de su índice mitótico. Durante los primeros días este no se recupera, pero al cabo de 3 o 4 semanas se produce una repoblación acelerada en los tumores, con gran aumento del índice mitótico. Este hecho determina que a partir de este periodo la eficacia de cada dosis descienda progresivamente.
La mayoría de las neoplasias sometidas a radioterapia radical no desaparece de forma rápida al final del tratamiento. Una valoración de la respuesta definitiva obtenida antes de los tres meses es prematura. No debe olvidarse que la radiación afecta a muchas células impidiendo, de forma irreversible, su capacidad mitótica, a veces incluso tras dos o tres ciclos celulares, pero no provoca la muerte inmediata.
A esto se debe la discordancia clinicopatológica que se observa en un resto tumoral clínicamente estable, cuya biopsia revela células tumorales pero que no son viables ya que han perdido la capacidad de entrar en ciclo.
Un tumor es una estructura que posee un estroma vásculo-conjuntivo no neoplásico que no es destruido por la radiación. Por ello, pueden quedar restos tumorales inactivos que requieren meses e incluso años para reabsorberse totalmente. Este hecho ocurre también en tumores quimiosensibles, como los linfomas. Es por tanto aconsejable adoptar actitudes prudentes y no abusar de biopsias repetidas o cirugías prematuras29,30.
Indicaciones y técnicas de tratamiento con radioterapiaIndicacionesLa radioterapia es una opción importante en el manejo de pacientes seleccionados con cáncer de piel no melanoma. Ofrece la posibilidad de tratar lesiones tumorales más extensas y con infiltración de tejidos profundos. La radioterapia se utiliza sola o en combinación con cirugía en el tratamiento de tumores localizados a lo largo de planos de fusión embrionarios31 y en tumores faciales, en los que la obtención de márgenes quirúrgicos libres de tumor puede suponer resecciones y reconstrucciones extensas.
En las lesiones tumorales pequeñas, que se pueden extirpar fácilmente y con cierre directo, sin secuelas funcionales ni estéticas, se admite que la cirugía constituye el tratamiento de elección.
El cáncer de piel con invasión perineural es de difícil control y el rescate de la recidiva tras la cirugía es muy improbable. Diversas series muestran resultados de pacientes asintomáticos con invasión perineural microscópica incidental, a los que se administró radioterapia postoperatoria, y en los que se obtuvo un control local del 78 % frente al 50 % en los pacientes con síntomas neurológicos o afectación macroscópica32,33. La resonancia magnética facilita la planificación del tratamiento radioterápico, documentando la afectación tumoral macroscópica del nervio, para la delimitación de volúmenes subsidiarios de dosis más elevadas de radioterapia (60 Gy al lecho quirúrgico tumoral, 50 Gy a la zona proximal del nervio implicado y con márgenes quirúrgicos negativos, siguiendo el trayecto hasta la base del cráneo, y 66–70 Gy al volumen anatómico con márgenes quirúrgicos positivos y restos tumorales microscópicos o macroscópicos)34.
Los campos de radiación pueden tratar múltiples lesiones o los ganglios linfáticos regionales. Los ganglios del área parotídea son los más comúnmente afectados por cánceres cutáneos de cara, cuero cabelludo y pabellón auricular, y susceptibles de tratamiento radioterápico radical o postoperatorio e irradiación profiláctica de los ganglios cervicales ipsilaterales.
Contrariamente a lo publicado en etapas anteriores, respecto a que la afectación tumoral de hueso o cartílago suponía una contraindicación para el tratamiento radioterápico, con los modernos equipos y técnicas de radioterapia se obtienen unas excelentes tasas de control, con buen resultado cosmético, preservación funcional e infrecuentes complicaciones31,34.
La radioterapia postoperatoria puede indicarse tras resecciones quirúrgicas incompletas. En el carcinoma epidermoide el control local y la supervivencia mejoran cuando la radioterapia se administra tras la extirpación quirúrgica tumoral incompleta. Perez35, de la Universidad de St. Louis, publica resultados de 87 % de control tumoral y 10–15 % de metástasis ganglionares en pacientes que recibieron radioterapia inicialmente, frente a 65 % de control tumoral y 39 % de metástasis ganglionares en los que recibieron radioterapia de rescate tras la recidiva o progresión tumoral.
Con respecto a la reirradiación, debemos tener presente que el efecto cutáneo residual de la radioterapia previa se debe a un fenómeno dinámico relacionado con la dosis por sesión y la dosis total administrada. Nos podemos encontrar con localizaciones que no toleren una irradiación adicional, tras un curso de tratamiento radioterápico previo a dosis radical, y se recomienda la cirugía para persistencias o recidivas tumorales tras radioterapia. La reirradiación de un cáncer cutáneo sólo se plantea cuando la zona afecta presenta un aspecto saludable, con buena vascularización, y la cirugía está contraindicada. Parecen tener ventajas teóricas los esquemas de reirradiación con dosis más bajas por sesión. Chao et al consideran una alternativa factible la reirradiación para casos seleccionados de recurrencia de cáncer cutáneo. Su serie de 17 pacientes presenta buen control local tumoral con aceptables resultados estéticos, tras reirradiación facial a dosis plenas o radicales36.
Técnicas de radioterapiaExisten diversas técnicas especializadas de radioterapia para tratar el cáncer de piel. La elección de la técnica se determina por el tamaño, el espesor y la localización anatómica del tumor.
La elección cualitativa de la radiación se selecciona a partir de la relación entre las dosis administradas en superficie y en profundidad idóneas para el tratamiento específico.
El tamaño del campo de tratamiento se determina por la localización anatómica tumoral y su histopatología.
El esquema de tratamiento, la dosis total y el fraccionamiento (dosis por sesión y número de sesiones por semana) se indica tomando como base los resultados cosméticos, la tolerabilidad y los efectos secundarios del tratamiento, que se minimizan con esquemas más fraccionados y en dosis bajas por sesión, y a veces en contra de la carga asistencial del centro hospitalario.
Cualidad de la radiación- 1.
Radioterapia superficial-Dermopan (fotones de ortovoltaje): los tumores superficiales se pueden tratar con esta técnica, pero cada vez hay menos unidades de radioterapia superficial disponibles. Los equipos pueden contar con una o varias energías (50, 100, 150, 200, 250 y 300 KV). Debido a que la irradiación del tejido subcutáneo aumenta la probabilidad de cambios cicatriciales cutáneos visibles, la elección de la energía adecuada es importante. Debido a que la mayoría de los carcinomas basocelulares superficiales presentan un espesor de 2–5 mm, las unidades de Dermopan de 50 KV eran las que se recomendaban en la literatura dermatológica37. Como se muestra en la tabla 2, un haz de radiación típico de 50 KV deposita el 85 % de la dosis de superficie a 2 mm de profundidad y solo el 65 % de la dosis de superficie en una profundidad de 5 mm. Por lo tanto, las radiaciones de baja energía (RX 50 KV) solo deberían ser utilizadas para el tratamiento de lesiones muy superficiales38.
Entre las ventajas que presenta la radioterapia superficial-ortovoltaje está que requiere tratar menos margen de piel alrededor del tumor, ya que la zona de penumbra en los márgenes del campo de tratamiento es menor.
- 2.
Electrones de acelerador lineal: los aceleradores lineales modernos producen electrones de diversas energías, de 6 a 20 MeV, que ofrecen la ventaja de una caída rápida de la dosis en profundidad, capaz de preservar el tejido sano que no es necesario tratar. La tabla 3 presenta la dosis en profundidad administrada por la radiación de electrones de distintas energías, utilizados con mayor frecuencia para el tratamiento del cáncer de piel. No obstante, los perfiles de dosis son menos precisos para campos de tratamiento pequeños, siendo necesaria la medida directa de la dosis administrada en lesiones tumorales pequeñas.
La profundidad del tejido tratado o cubierto por el haz de electrones está en función de su energía. Los electrones no depositan su máxima energía en la superficie cutánea, sino por debajo, por lo tanto hay que realizar unas modificaciones para aumentar la dosis en superficie31,34,39. Lo más habitual es colocar un material equivalente al tejido humano (bolus) directamente sobre la superficie cutánea, con ello se logra que la dosis depositada por el haz de electrones en la zona de tratamiento tumoral sea la adecuada, aumentando así la dosis en la superficie cutánea y cubriendo hasta la profundidad estimada. El número de capas de bolus (espesor de bolus) que se coloca depende de la energía del haz de electrones aplicado40.
El haz de electrones pierde su precisión cuanto más oblicua sea la incidencia de entrada al área anatómica a tratar, viéndose afectada la dosis prescrita o necesaria para tratar el tumor en esa zona. El haz de radiación debe incidir lo más perpendicular posible sobre la zona tumoral delimitada, para minimizar un posible efecto de infradosificación en el campo de tratamiento. Sabemos que los tumores muchas veces no asientan en áreas anatómicas planas, ni son de forma homogénea, pero debemos tratar de conseguir, de la mejor forma posible, las condiciones más ideales y reproducibles de tratamiento.
- 3.
Fotones de megavoltaje de acelerador lineal: se utilizan para el tratamiento de tumores cutáneos localmente avanzados que invaden tejidos profundos, pudiendo afectar al hueso o al cartílago; el espesor a tratar suele ser de 5–6 cm. Se irradia con haz de fotones, generalmente de 6 MV, y como en el caso de los electrones, se coloca un bolus en la superficie cutánea tumoral de la zona de tratamiento para optimizar la dosis en superficie.
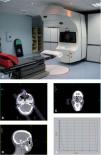
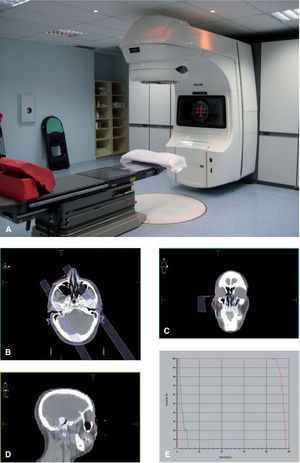
El tratamiento se planifica con tomografía computarizada (TC), que se realiza al paciente en la posición de tratamiento, con sistemas de inmovilización específicos para que dicha postura o posición del paciente se pueda reproducir cada día, en cada sesión, a lo largo del tratamiento. Sobre las imágenes de la TC se delimita el volumen blanco tumoral que se va a tratar. Se colocan unas marcas radioopacas sobre la piel del paciente delimitando el tumor, que facilitan su localización en la TC. En las imágenes de TC se definen también los llamados órganos críticos o de riesgo, que deberán recibir la menor dosis posible y no sobrepasar la dosis de tolerancia de cada uno de ellos, lo cual daría lugar a efectos secundarios graves y alteraciones funcionales. Posteriormente, sobre estas mismas imágenes de TC se planifica el tratamiento y se obtienen los histogramas dosis-volumen (fig. 1). Esta técnica de tratamiento se denomina radioterapia conformacional con planificación tridimensional. En muchos casos el tratamiento se planifica con haces de radiación combinados, fotones y electrones de alta energía de acelerador lineal.
Figura 1.Radioterapia conformacional tridimensional.
A) Acelerador lineal.
B, C y D) Sobre imágenes de tomografía computarizada se delimita el volumen tumoral (carcinoma epidermoide en el surco nasogeniano derecho) y los órganos de riesgo (ojo derecho: retina y cristalino).
E) Histograma dosis-volumen.
- 4.
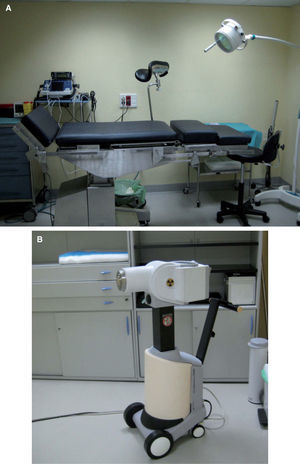
Braquiterapia de contacto de alta tasa de dosis (BTHDR): como técnica de contacto, utilizando aplicadores estándar (moldeable como el Freiburg Flap, aplicador para piel Valencia, entre otros) o aplicadores personalizados de implante temporal, permite el tratamiento de carcinomas basocelulares y epidermoides cutáneos, localizados en áreas anatómicas irregulares o zonas curvas, con una mayor adaptabilidad a la superficie a irradiar, y con el consiguiente beneficio clínico y dosimétrico. La fuente radiactiva que se utiliza es Iridio192 de alta tasa de dosis, que se encuentra alojada en el Microselectrón y a través de los tubos de transferencia se posiciona en los aplicadores colocados sobre la superficie cutánea del paciente en el volumen blanco tumoral a tratar. La carga de la fuente radiactiva es diferida, mediante control remoto, por lo que el personal sanitario no está directamente expuesto a la radiación. El paciente permanece solo, en una sala blindada, durante unos minutos, tiempo que dura cada sesión, y después se marcha a su domicilio (fig. 2).
La relación que ofrece la BT-HDR de contacto entre las dosis en superficie y en profundidad es idónea para el tratamiento de tumores cutáneos en estadios precoces: dosis máxima en la superficie cutánea (a 0 mm el 100 % de la dosis y en rango terapéutico hasta 3–5 mm de profundidad), con una caída exponencial de la dosis en zonas más profundas41–43.
Las indicaciones de esta técnica son: carcinoma basocelular y epidermoide cutáneo en estadios precoces T1-2 como tratamiento radical exclusivo; cáncer de piel no melanoma: tratamiento complementario después de radioterapia externa (acelerador lineal); cáncer de piel no melanoma: tratamiento complementario después de cirugía con márgenes afectos; reirradiación de recidivas tumorales; enfermedad de Bowen y lesiones premalignas cutáneas; queloides; lesiones malignas o premalignas intraorales y vaginales.
Las desventajas de esta técnica son: el tratamiento de los tumores localizados en los párpados o el bermellón de los labios conlleva menor toxicidad con la braquiterapia de baja tasa de dosis (BT-LDR) que con la BT-HDR.
Esta técnica está contraindicada en el tratamiento del melanoma y de los tumores del párpado superior.
La dosis y el fraccionamiento recomendados para el cáncer de piel no melanoma como tratamiento radical exclusivo es de 66–70 Gy, con un fraccionamiento de 2 Gy/sesión y 5 sesiones/semana. Así pues, el tratamiento tiene una duración de unas 7 semanas. En pacientes mayores con dificultad para los desplazamientos se pueden utilizar esquemas hipofraccionados, en detrimento del resultado estético y de la tolerancia39.
- 5.
Braquiterapia intersticial de baja tasa de dosis: con esta técnica se pueden tratar tumores cutáneos periorificiales de regiones de fusión embrionaria de la cara. Rio et al publican unos resultados que muestran buen control tumoral (92,5 %) y resultado estético. Las dosis administradas fueron de 55–65 Gy con tasa de dosis ≤ 2 Gy/h con bajo riesgo de complicaciones tardías44. El tratamiento dura horas o días de forma continua, por lo que se debe disponer de habitaciones de ingreso hospitalario blindadas, y medidas de control y seguridad para el personal sanitario que atiende a los pacientes. Las fuentes radiactivas que se aplican a cada paciente se preparan mediante manipulación manual, lo que supone también un mayor riesgo de exposición para los profesionales, a diferencia de la técnica de BT-HDR.
Al igual que está ocurriendo con la radioterapia superficial (Dermopan), cada vez hay menos unidades de BT-LDR disponibles y, por el contrario, van en aumento las unidades de BT-HDR; quizá en un futuro próximo esta técnica se convierta en el tratamiento radioterápico estándar del carcinoma cutáneo facial41.
Depende del tamaño del tumor, la localización y el tipo de radiación empleada. Choo et al valoraron los márgenes de resección en 71 pacientes con cáncer de piel no melanoma tratados mediante técnica de Mohs. La extensión microscópica tumoral variaba entre 1–15 mm (media 5,2 mm). Los autores determinaron un margen de 10 mm alrededor del tumor macroscópico, necesario para obtener una posibilidad del 95 % de margen negativo. Los tumores más grandes presentaban mayor extensión microscópica45.
El error de los márgenes estimados es la causa más frecuente de fracaso en el tratamiento del cáncer de piel no melanoma. Se deberían aplicar márgenes más generosos en el tamaño del campo de irradiación ante tumores de alto grado histológico, recidivantes, mal delimitados y en el caso del carcinoma basocelular esclerodermiforme39. En tratamientos para lesiones pequeñas, con la técnica de electrones de baja energía de acelerador lineal con campos de tratamiento pequeños, se requieren márgenes laterales de los campos mayores que para la técnica de radioterapia superficial (Dermopan), dadas las características dosimétricas de los electrones. Los tratamientos con fotones de megavoltaje de acelerador lineal requieren márgenes tumorales laterales, de los campos de tratamiento, menores que con los electrones. Los tumores de 2 cm de diámetro precisan tratarse con márgenes alrededor del tumor macroscópico de 0,5-1 cm para fotones y de 1–1,5 cm para electrones. Los tumores de 2–7 cm de diámetro precisan tratarse con márgenes alrededor del tumor macroscópico de 1,5-2 cm para fotones y de 2–2,5 cm para electrones34,39.
Al igual que los márgenes laterales, la extensión en profundidad del tumor a menudo está subestimada. La TC y la resonancia magnética pueden ayudarnos a calcular la invasión tisular del tumor en profundidad. En los tumores de párpado, pabellón auricular y ala nasal, donde el espesor tisular es fácilmente medible, se recomienda tratar todo el espesor. Para tumores de hasta 4 cm de diámetro, el tratamiento debe alcanzar en profundidad unos 5 mm más que el espesor estimado del tumor y aun se debe dejar más margen en profundidad para tumores más grandes, recurrentes, de alto grado histológico y especialmente los localizados en planos de fusión embrionarios por el mayor riesgo de afectación profunda oculta.
Fraccionamiento dosis-tiempoSe utilizan dosis y esquemas de fraccionamiento de radioterapia semejantes para tratar los carcinomas basocelular y epidermoide, de similar tamaño y espesor, aunque algunos autores defienden dosis más altas para el carcinoma epidermoide46. Diversos estudios han demostrado que los efectos tardíos de la radioterapia en la piel, como telangiectasias, atrofia, hipopigmentación y necrosis, se pueden minimizar con esquemas de tratamiento más fraccionados47–49. Petrovich et al publicaron unos resultados cosméticos y funcionales excelentes en 896 pacientes estudiados, tras tratamiento de carcinoma de piel con dosis diarias de ≤ 3 Gy50. La utilización de dosis más altas por sesión produce más efectos secundarios crónicos y debe considerarse, así como la edad y las comorbilidades de los pacientes, a la hora de prescribir el tratamiento radioterápico.
Las dosis de radioterapia recomendadas para el lecho tumoral son: 50–60 Gy en caso de enfermedad subclínica y márgenes quirúrgicos negativos, 60–66 Gy si los márgenes son positivos microscópicamente, y 66–70 Gy con tumor macroscópico. Para la irradiación ganglionar se emplean 46–50 Gy profilácticamente para la enfermedad subclínica y 56–60 Gy en caso de afectación ganglionar macroscópica (dosis administradas con fraccionamiento convencional de 2 Gy/fracción y 5 fracciones/semana).
El efecto biológico relativo es un 10–20 % menor para los tratamientos de megavoltaje (acelerador lineal) que para los de ortovoltaje (radioterapia superficial-Dermopan), por lo tanto, los tratamientos con electrones o fotones de acelerador lineal requieren incrementos de 10–20 % de la dosis para obtener el mismo efecto biológico antitumoral.
Cuando comparamos esquemas de tratamiento es útil tener en cuenta los valores tiempo-dosis-fracción (TDF) de isobioefecto. La dosis total administrada (que se obtiene al multiplicar la dosis por sesión por el número de sesiones) coincide con la dosis biológica efectiva solamente cuando el fraccionamiento empleado es de 2 Gy/sesión y 5 sesiones/semana (fraccionamiento estándar). Para cualquier otro esquema o fraccionamiento de un tratamiento es necesario realizar la conversión de la dosis total a la dosis equivalente biológica efectiva. Las fórmulas matemáticas del Modelo Lineal Cuadrático (MLC) permiten la determinación del cálculo de la dosis de control tumoral local y de las complicaciones en los tejidos normales.
Posición del paciente y proteccionesSe utilizan sistemas de inmovilización del paciente que permiten la localización tumoral con gran precisión y la reproducción diaria en cada sesión de tratamiento.
En los tratamientos con electrones, el acelerador lineal gira hasta conseguir el ángulo necesario para que el eje del haz de radiación incida perpendicularmente a la superficie cutánea tumoral a tratar. La protección del tejido sano adyacente y de los órganos con riesgo de irradiación es particularmente importante en el tratamiento del cáncer de piel localizado en las regiones de cabeza y cuello. Se colocan moldes de protección de materiales como plomo, bismuto o tungsteno directamente sobre la superficie cutánea y protegiendo las zonas específicamente determinadas. Se requieren protecciones específicas para el tratamiento de tumores localizados en las zonas de los ojos, la nariz, los labios y la oreja. Dosis del orden de 5–10 Gy pueden llegar a producir cataratas en el cristalino; para evitar este efecto secundario se suelen colocar lentillas de tungsteno debajo de los párpados, cada día antes de la sesión de tratamiento, para proteger las estructuras superficiales del ojo y las lentes oculares. Estas protecciones de tungsteno reducen la dosis ocular a < 5 % para electrones de energía de hasta 9 MeV51.
Se protegen también, blindando la salida del haz de radiación, estructuras como las encías, la mucosa oral, el conducto auditivo, el septo nasal y las áreas susceptibles de depilación como las cejas y el cuero cabelludo.
Práctica en Oncología RadioterápicaIndicación del tratamiento- 1.
Radioterapia radical: a) finalidad curativa como método exclusivo, sola o asociada a otros tratamientos; b) conservación del órgano, la función y la estética, y c) permite el rescate quirúrgico de la recidiva.
- 2.
Radioterapia adyuvante postoperatoria: a) tras la cirugía; b) mejora el control local disminuyendo la aparición de recidiva local; c) erradica restos tumorales microscópicos, y d) conserva la anatomía y la estética, evitando cirugías extensas y mutilantes.
- 3.
Radioterapia neoadyuvante preoperatoria: a) esquemas preoperatorios; b) en tumores localmente avanzados donde la cirugía no es factible inicialmente o sería muy extensa; c) mejora la supervivencia, y d) conserva la anatomía y la funcionalidad de los órganos.
- 4.
Radioterapia paliativa: a) trata síntomas producidos por el tumor (dolor, hemorragia, compresión vascular o nerviosa, etc.); b) administración rápida, precisa, sin añadir síntomas, y c) mejora la calidad de vida del paciente.
- 1.
Evaluación clínica inicial.
- 2.
Decisión terapéutica.
- 3.
Localización tumoral: mediante la exploración clínica directa y, si es posible, con soporte de imagen fotográfica inicial, así como con pruebas de imagen diagnósticas en el caso de tumores más avanzados (TC, resonancia magnética, ecografía, tomografía por emisión de positrones [PET]) que nos ayudan a delimitar de forma precisa la localización, la extensión tumoral y el área a irradiar.
- 4.
Delimitación del volumen tumoral y los órganos de riesgo (fig. 3): directamente en el paciente o sobre imágenes de TC de planificación, que se realiza al paciente en la posición de tratamiento y con los sistemas de inmovilización colocados. En los cortes axiales, coronales y sagitales de dicha TC de planificación se delimita tridimensionalmente el tumor y los denominados órganos de riesgo que deberán recibir la menor irradiación posible (ojos, oído medio e interno, etc.).
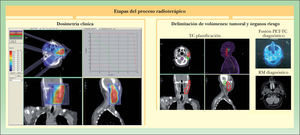
Figura 3.Etapas del proceso radioterápico. Irradiación ganglionar cervical-parotídea metastásica de carcinoma epidermoide cutáneo. Localización tumoral con ayuda de tomografía por emisión de positrones-tomografía computarizada (PET-TC) y resonancia magnética (RM). Delimitación de volúmenes y dosimetría clínica sobre tomografía computarizada de planificación.
- 5.
Dosimetría clínica: sobre la TC de planificación, con los volúmenes delimitados, se determina la configuración del haz o haces de radiación.
- 6.
Simulación: en el simulador de Rx se reproduce el tratamiento planificado antes de su administración definitiva en el acelerador lineal.
- 7.
Puesta en marcha del tratamiento-primera sesión: verificación del tratamiento.
- 8.
Desarrollo del tratamiento-sesiones sucesivas.
- 9.
Evaluación clínica del tratamiento: se presta especial atención a la respuesta tumoral y a los efectos secundarios.
- 10.
Seguimiento del paciente.
Podemos diferenciar los efectos adversos del tratamiento en tempranos o agudos (hasta 6 meses después de concluida la irradiación) y tardíos o crónicos (a partir de los 6 meses tras finalizar el tratamiento radioterápico).
Efectos agudosLa piel es un tejido de recambio rápido; la epidermis está formada por dos zonas bien definidas: las capas superiores, compuestas por células maduras en vías de queratinización, y la capa basal, donde se encuentran las células inmaduras, progenitoras de las anteriores, encargadas de la producción de células que sustituyen a las que se pierden de forma natural y mantienen la integridad funcional.
Generalmente, un 2 % de las células de la piel se renueva diariamente; el tiempo que tarda una célula progenitora en dar lugar a una célula madura que alcance la superficie de la epidermis es de 14–17 días.
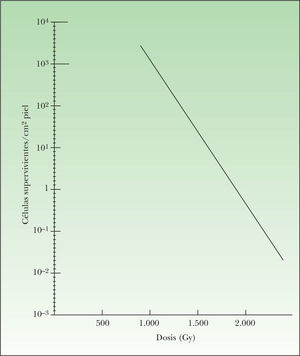
Cuando la piel recibe una dosis de 8 Gy, tras un periodo de latencia de 1–2 días aparece eritema debido a la vasodilatación capilar y al edema. Al mismo tiempo, el examen histológico pone de manifiesto la desaparición de las mitosis propias de la capa basal. Clínicamente, el eritema se sigue de descamación seca (dosis moderadas de irradiación) o dermatitis húmeda (dosis alta de irradiación). En cualquier caso, las células basales indemnes aceleran la producción de nuevas células para recuperar la integridad de la piel. Este fenómeno puede ser cuantificado mediante el recuento de colonias de células epiteliales originadas a partir de una célula basal superviviente (nódulos de regeneración), que crecen hasta cubrir por completo la dermis. Como puede verse en la figura 4, el número de colonias de regeneración que pueden contarse al cabo de unos días de la administración de dosis diferentes de radioterapia proporciona una típica curva de supervivencia celular.
Efectos tardíosLos efectos locales como consecuencia de irradiaciones localizadas, generalmente con dosis altas, son debidos a la reparación del tejido irradiado por proliferación del tejido conjuntivo, que reemplaza las células «nobles», especializadas, dando lugar a cambios morfológicos y funcionales. En la piel puede aparecer atrofia, cambios de pigmentación, pérdida del pelo, telangiectasias, ulceración o necrosis52.
Los efectos somáticos sistémicos se producen como consecuencia del efecto aleatorio de la radiación, en dosis bajas, y tras periodos de latencia prolongados. Pueden ser consecuencia de la depleción de células progenitoras, dando lugar a envejecimiento o acortamiento de la vida por agotamiento de la capacidad regenerativa de los tejidos, o a carcinogénesis por mutaciones genéticas que propicien la proliferación de células anormales.
Existen dos hipótesis para explicar la aparición de los efectos secundarios crónicos. Una teoría sostiene que los efectos crónicos derivan de un daño sobre el estroma del tejido conectivo. Dado que este está distribuido por todo el cuerpo, esto sugiere que existe un mecanismo común para la producción de los efectos crónicos en cualquier órgano53. Una variante de esta hipótesis es que el daño que se produce sobre las células endoteliales, omnipresentes en todo el organismo, es lo que da lugar a los efectos crónicos54. La hipótesis alternativa sugiere que los efectos agudos y crónicos de la radiación y de la quimioterapia citotóxica se deben a la depleción celular de los tejidos de renovación afectados. Los efectos agudos dependen del equilibrio entre la muerte celular y la replicación compensadora de las células madre. El desarrollo de los efectos crónicos requiere que las células madre tengan una capacidad de proliferación limitada55,56. La compensación de una muerte celular repetida o muy extensa puede agotar esta capacidad de proliferación, dando lugar a un posible fallo tisular57.
Para la cuantificación de la morbilidad del tratamiento se utiliza la escala SOMA-LENT (Subjetive/Objetive/Management/Analytic-Late Effects of Normal Tissue), establecida en 1995 por los principales grupos de investigación en Oncología y Radioterapia, la European Organization for Research and Treatment of Cancer (EORTC) y el Radiation Therapy Oncology Group (RTOG).
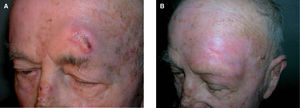
Resultados del tratamiento con radioterapia del cáncer de piel no melanomaLocke et al46 publican una actualización de los resultados del tratamiento de 339 carcinomas epidermoides y basocelulares cutáneos. Al contrario que en trabajos previos, encuentran tasas similares de control con electrones y radioterapia superficial. El estudio presenta el tipo histológico como factor de recidiva. Los resultados de control local tumoral son de 92 % para el carcinoma basocelular y 80 % para el carcinoma epidermoide. Como en series anteriores, las tasas de control fueron mejores para las lesiones que no habían recibido ningún tratamiento previo a la radioterapia (94 % para el carcinoma basocelular y 89 % para el carcinoma epidermoide), y remarca la importancia del tratamiento temprano para maximizar el control tumoral y los resultados cosméticos (fig. 5).
Lesiones cutáneas premalignasEnfermedad de BowenLa progresión a carcinoma epidermoide puede ocurrir en el 5–20 % de los casos. El tratamiento elegido generalmente es la escisión quirúrgica, aunque la radioterapia se puede considerar como una alternativa. Se requiere una dosis de 56 Gy a 2 Gy/fracción para controlar estas lesiones y con dicho fraccionamiento se obtiene un buen resultado cosmético, importante en las localizaciones faciales. Se pueden aplicar otros esquemas de tratamiento más cortos en tiempo, y con dosis biológica equivalente, pero con peores resultados cosméticos. La radioterapia debe evitarse en lesiones de extremidades inferiores, en pacientes de edad avanzada con comorbilidades vasculares, diabetes, etc., ya que se han publicado casos de aparición de úlceras crónicas con dificultad para cicatrizar58. La recidiva local tras radioterapia es poco frecuente, según los resultados de las series recientes publicadas59.
QueratoacantomaEs generalmente benigno y puede involucionar espontáneamente, pero en algunos casos puede tener un potencial destructivo sobre extensos volúmenes de tejido. Algunos autores lo consideran una variante de carcinoma epidermoide, y otros describen progresión y asociación de ambas lesiones60. En los casos en que la biopsia revela la coexistencia con un carcinoma epidermoide puede tratarse con radioterapia. Se pueden utilizar diversos esquemas de tratamiento. La dosis equivalente biológica necesaria para su tratamiento es del orden de 56 Gy.
Lentigo malignoEsta lesión puede progresar a melanoma invasivo. Se suele tratar mediante cirugía. La radioterapia se puede emplear como tratamiento primario o adyuvante tras la cirugía, con diversos esquemas de tratamiento61. La dosis equivalente biológica necesaria para su tratamiento es del orden de 56 Gy.
MelanomaLa radioterapia tiene diversos lugares de actuación en el tratamiento del melanoma: adyuvante tras la resección quirúrgica del tumor primario o de metástasis ganglionares regionales, tratamiento de ganglios regionales con alto riesgo de afectación subclínica, tratamiento paliativo de metástasis a distancia o de recidivas locales y rara vez como tratamiento radical del tumor primario.
Estudios recientes estiman la indicación de tratamiento con radioterapia en el 23 % de los pacientes con melanoma, siendo la tasa de utilización actual de tan solo 1–15 %62.
La idea sostenida de radiorresistencia de este tumor se resolvió con estudios in vitro, sugiriéndose una gran capacidad reparadora de las líneas celulares de este tumor, del daño subletal producido por la radiación y la posible ventaja terapéutica de esquemas de tratamiento hipofraccionados, con dosis altas por sesión. Se emplean diversos esquemas con dosis/sesión de 3–8 Gy generalmente.
Radioterapia adyuvante de la lesión primaria y de los ganglios regionalesSe han publicado diversos factores que aumentan el riesgo de recidiva. Un espesor tumoral ≥ 4 mm se asocia a un 6–14 % de recurrencia, esta es del 5 al 17 % para lesiones de localización primaria en cabeza y cuello, del 10–17 % con presencia de ulceración, del 14–16 % con lesiones satélites y del 23–48 % para la variante histológica desmoplásica63–65. Con estos resultados, las indicaciones establecidas de radioterapia adyuvante tras la cirugía del tumor primario son: histología desmoplásica, espesor tumoral > 4 mm con ulceración o lesiones satélites, márgenes quirúrgicos de resección positivos y, en caso de recidiva local, el tratamiento con radioterapia se puede aplicar de forma primaria o adyuvante tras la cirugía de la recidiva64.
La linfadenectomía terapéutica de la afectación clínica ganglionar tiene unos resultados de 85 % de control64. La afectación ganglionar extracapsular se asocia a 30–50 % de riesgo de recidiva ganglionar, así como 4 o más ganglios afectados, tamaño ganglionar > 3 cm, localización ganglionar cervical y recidiva ganglionar tras linfadenectomía inicial64,66,67.
Stevens et al65 aplican radioterapia hipofraccionada adyuvante en la localización del tumor primario a 35 pacientes e irradiación ganglionar a 139 pacientes con factores de riesgo. Se presenta recurrencia local tras la radioterapia en el 11 % de los pacientes (frente al 50 % en las series de cirugía solamente). Los resultados del MD Anderson Cancer Center de tasa de control local en la axila tras radioterapia adyuvante en pacientes con uno o más factores de riesgo son del 87 %68. La incidencia global a los 5 años de edema en el miembro superior de grado medio-moderado fue del 43 %. En el caso de linfadenectomía inguinal se recomienda cautela a la hora de indicar radioterapia adyuvante, proponiéndose cuando existan dos o más factores de riesgo69. Esquemas con fraccionamientos más conservadores (50 Gy a 2–2,5 Gy/fracción) pueden ser apropiados para irradiaciones inguinales o axilares, reduciendo el riesgo de linfedema y neuropatía70.
Radioterapia electiva de ganglios linfáticos regionales clínicamente negativosEl riesgo de afectación subclínica de los ganglios regionales se relaciona directamente con el espesor de la lesión primaria: será menor del 5 % para lesiones menores de 0,75 mm, 10 % para lesiones de 0,76 a 1,50 mm, 20 % para lesiones de 1,51 a 4 mm y 30–50 % para lesiones mayores de 4 mm62. Bonnen et al71 publican resultados de 89 % de control local a los 5 y 10 años tras la irradiación ganglionar electiva en melanomas de cabeza y cuello de ≥ 1,50 mm. Otros estudios presentan igualmente beneficio en el control locorregional del 82–95 % con radioterapia adyuvante en pacientes de alto riesgo (frente a un 50 % con cirugía sola)66.
Radioterapia primaria radicalEs una opción de tratamiento en pacientes inoperables.
Radioterapia paliativaIndicada en el tratamiento de melanoma con afectación locorregional irresecable y en enfermedad metastásica (cerebral, ósea, metástasis cutáneas o subcutáneas, compresión medular metastásica, etc.).
Carcinoma de células de MerkelLa tasa de recurrencia locorregional superior al 50 % tras la cirugía ha llevado a muchos investigadores a indicar de forma rutinaria el tratamiento con radioterapia adyuvante postquirúrgica72,73. Se delimitan amplios márgenes en el campo de tratamiento, de 3 a 5 cm por su propensión a presentar metástasis en tránsito y recidiva marginal. Tras la cirugía se irradia la localización del tumor primario (lecho quirúrgico tumoral y cicatriz) y los ganglios linfáticos de drenaje. Las dosis de radioterapia recomendadas son similares a las del carcinoma epidermoide cutáneo: para la localización del tumor primario se emplean 50–60 Gy en caso de enfermedad subclínica y márgenes quirúrgicos negativos, 60–66 Gy si los márgenes son positivos microscópicamente y 66–70 Gy con tumor macroscópico. Para la irradiación ganglionar se emplean 46–50 Gy profilácticamente para la enfermedad subclínica y 56–60 Gy en caso de afectación ganglionar macroscópica72,74 (dosis administradas en caso de fraccionamiento convencional de 2 Gy/fracción y 5 fracciones/semana).
La reciente publicación de Allen et al75 cambia el uso rutinario de la radioterapia adyuvante tras la cirugía del carcinoma de células de Merkel. Los autores revisan 251 casos tratados en el Memorial Sloan-Kettering Cancer Center durante un periodo de 32 años. Solo el 8 % de los pacientes tratados quirúrgicamente con márgenes negativos recidiva localmente y solo el 14 % de los pacientes con linfadenectomía recidiva, incluso sin radioterapia adyuvante. La supervivencia específica a los 5 años es del 64 %, siendo el estadio tumoral al diagnóstico el factor predictor de supervivencia y no la radioterapia adyuvante. Recomiendan radioterapia adyuvante tras la cirugía sólo en pacientes con alto riesgo de recidiva locorregional como los que presentan márgenes quirúrgicos positivos, afectación ganglionar múltiple o afectación ganglionar extracapsular. En pacientes médica o quirúrgicamente inoperables la radioterapia está indicada como tratamiento radical.
Boyer et al76 publican los resultados sobre control local, de una serie de 45 pacientes con carcinoma de células de Merkel en estadio I, tratados mediante cirugía de Mohs. Veinte pacientes recibieron radioterapia local adyuvante tras la cirugía con bordes libres (histológica y clínicamente) y a los 25 restantes no se les administró radioterapia postoperatoria. No encontraron diferencias significativas en la supervivencia global, la supervivencia libre de recidiva ni en la supervivencia libre de enfermedad entre ambos grupos. Recomiendan radioterapia adyuvante tras la cirugía de Mohs en los casos en que no se puedan llevar a cabo resecciones completas y no se pueda tener un control histológico completo de los márgenes. Se debe considerar la administración de radioterapia adyuvante en tumores extensos y en recidivas.
Dermatofibrosarcoma protuberansSe recomienda la administración de radioterapia postoperatoria tras la cirugía con márgenes próximos o positivos, debido al riesgo de recidiva mayor del 50 %. La dosis de radioterapia para enfermedad microscópica es de 60–66 Gy con dosis diarias de 2 Gy77. En casos de enfermedad macroscópica residual, la dosis será de 66–74 Gy.
Se indica radioterapia adyuvante en lesiones de alto grado histológico, independientemente del estado de los márgenes quirúrgicos.
Se indica radioterapia preoperatoria en los casos en los que la cirugía inicial debe ser muy extensa, con compromiso funcional y cosmético, con dosis de 50 Gy al tumor y márgenes de 3–5 cm, seguida de cirugía a las 4–6 semanas.
Conflicto de interesesDeclaramos no tener ningún conflicto de intereses.