Los nevus epidérmicos son hamartomas originados en la epidermis y/o en las estructuras anexiales de la piel que se han clasificado clásicamente partiendo de la morfología. En los últimos años se han descrito variantes nuevas y se han producido avances en el campo de la genética que han permitido caracterizar mejor estas lesiones y comprender su relación con algunas de las manifestaciones extracutáneas a las que se han asociado. En esta primera parte revisaremos los nevus derivados de la epidermis y los síndromes que se han descrito asociados a ellos.
Epidermal nevi are hamartomatous lesions derived from the epidermis and/or adnexal structures of the skin; they have traditionally been classified according to their morphology. New variants have been described in recent years and advances in genetics have contributed to better characterization of these lesions and an improved understanding of their relationship with certain extracutaneous manifestations. In the first part of this review article, we will look at nevi derived specifically from the epidermis and associated syndromes.
Un hamartoma es una malformación generalmente congénita de aspecto tumoral debida a una mezcla anormal en la distribución o bien en la proporción de elementos tisulares constitutivos maduros. No es una neoplasia porque los tejidos no tienen crecimiento autónomo. Los hamartomas en la piel se han venido llamando nevus o nevos. Existe cierta confusión respecto a la definición del término «nevus epidérmico». La mayor parte de la literatura actual se refiere al grupo de los nevos epidérmicos agrupando los que derivan de la epidermis y también los de las células epiteliales de los anejos. En cambio algunos textos de dermatopatología definen el nevus epidérmico como el nevus derivado de los queratinocitos (que aquí llamaremos nevus queratinocítico) excluyendo los nevus derivados de estructuras anexiales1,2. En este trabajo haremos referencia a los nevus derivados tanto de la epidermis como a los que derivan de las estructuras anexiales, que se revisarán en dos partes. La tabla 1 resume y clasifica los nevus que se revisarán tanto en la parte 1 (nevus queratinocíticos) como en la parte 2 (nevus derivados de estructuras anexiales) y podrá usarse a modo de índice.
Nevus epidérmicos clasificados según criterios morfológicos y genes implicados en su desarrollo
| Gen afecto | Locus | |||
|---|---|---|---|---|
| Nevos queratinocíticos | Nevus queratinocítico común | FGFR3 | 4p16.3 | |
| PIK3CA | 3q26.32 | |||
| HRAS | 11p15.5 | |||
| NRAS | 1p13.2 | |||
| KRAS | 12p12.1 | |||
| FGFR2 | 10q26.13 | |||
| Nevus PENS | Desconocido | Desconocido | ||
| Nevus epidérmico en el síndrome de Proteus | AKT1 | 14q32.33 | ||
| Enfermedad de Cowden tipo 2 sementaria (nevus PTEN) | PTEN | 10q23.31 | ||
| Nevus CHILD | NSDHL | Xq28 | ||
| NEVIL | Desconocido | Desconocido | ||
| Nevus epidérmico epidermolítico | KRT1 | 12.q13.13 | ||
| KRT10 | 17q21.2 | |||
| Nevus epidérmico acantolítico y disqueratótico | ATPA2A | 12q24.11 | ||
| Nevos derivados de estructuras anexiales | Nevus sebáceo | HRAS | 11p15.5 | |
| NRAS | 1p13.2 | |||
| KRAS | 12p12.1 | |||
| FGFR2* | 10q26.13 | |||
| Nevos foliculares | Nevus del folículo piloso (hamartoma velloso congénito) | Desconocido | Desconocido | |
| Nevus comedónico, Nevus de Munro | NEK9, FGFR2 | 14q24.3, 10q26.13 | ||
| Hamartoma folicular basaloide | Desconocido | Desconocido | ||
| Nevus de quistes tricolémicos | Desconocido | Desconocido | ||
| Nevos apocrinos | Nevus apocrino | Desconocido | Desconocido | |
| Siringocistoadenoma papilífero | BRAF | 7q34 | ||
| Nevos ecrinos | Nevus ecrino | Desconocido | Desconocido | |
| Hamartoma angiomatoso ecrino | Desconocido | Desconocido | ||
| Nevus ostial anexial poroqueratósico | GJB2 | 13q12.11 | ||
| Nevus de Becker | ACTB | 7p22.1 |
CHILD: Congenital Hemidysplasia, Ichthyosiform erythroderma and Limb Defects; NEVIL: nevus epidérmico verrugoso inflamatorio lineal; PENS: Papular Epidermal Nevus with Skyline basal cell layer; PTEN: en este contexto, Papillomatous, Thick, Epidermal, Non-organoid nevus.
Los nevus epidérmicos muestran con frecuencia organicidad. Este concepto, en anatomía patológica, define el crecimiento simultáneo de varios componentes celulares en un mismo hamartoma, fenómeno que se ve con frecuencia en los hamartomas derivados de estructuras anexiales, y no debe confundirse con el concepto, más frecuentemente usado en medicina, que define un síntoma originado por una alteración orgánica o física (en oposición a una causa psíquica). Algunos textos clasifican los nevus epidérmicos en organoides y no organoides (en la práctica, queratinocíticos). Las estructuras anexiales, por otra parte, pueden ser el origen de algunas lesiones definidas en algunos textos de dermatopatología como hamartomas3, que sin embargo no se consideran «nevus» en la mayoría de los textos de dermatología clínica (por ejemplo, el esteatocistoma, el fibrofoliculoma o el tricofoliculoma) y no las vamos a revisar.
Bases fisiopatológicasLa aparición de estas lesiones se debe a mutaciones genéticas o bien cambios epigenéticos que cambian la expresión en un clon celular durante el desarrollo embrionario, originado un mosaico, es decir la presencia de dos o más poblaciones celulares genéticamente distintas en el mismo individuo4. Se han descrito cuatro mecanismos genéticos que explican la mayoría de los mosaicos en la piel:
1) Mutaciones somáticas en genes autosómicos (dominantes) que son letales cuando se producen en el zigoto pero que persisten en forma de mosaico. Estas mutaciones afectan solo a un grupo de células, que sobreviven al estar cerca de células normales5. La mayoría de los nevus epidérmicos se producen por mutaciones de este tipo en dos vías de señalización implicadas en la supervivencia y la proliferación celular que se encuentran imbricadas: la vía de la fosfatidil inositol 3 kinasa (PI3K) y la vía de las Mitogen-Activated Protein Kinases o MAP-Kinasas6.
2) Mutaciones no letales en genes autosómicos que son la causa de enfermedades cutáneas extensas cuando se dan en el zigoto, pero que también se pueden manifestar en forma de mosaico si son el resultado de una mutación poszigótica. Estas pueden producirse en un individuo por lo demás sano, constituyendo una afectación en mosaico exclusiva (mosaicismo tipo 1 de Happle) o bien en un paciente que ya presenta una forma generalizada de la enfermedad, a la que se superpone un área de mayor afectación, que generalmente se debe a una mutación adicional que provoca una pérdida de heterozigosidad (mosaicismo tipo 2).
3) Mutaciones en mosaico o cambios epigenéticos en genes ligados a enfermedades inflamatorias poligénicas.
4) Mosaicismo funcional ligado a la inactivación aleatoria de uno de los cromosomas X en las mujeres o lyonización.
La tabla 1 enumera los genes cuya mutación se ha implicado en la fisiopatogenia de los nevus epidérmicos. Como se puede ver en la tabla, los recientes descubrimientos en el campo de la genética han demostrado que, de la misma forma que existe solapamiento morfológico en el grupo de los nevus epidérmicos, relacionar el genotipo con el fenotipo resulta más complejo de lo que uno podía imaginar7. La aparición de un nevus queratinocítico puede deberse a mutaciones en hasta 6 genes distintos, sin que se haya encontrado una relación con hallazgos morfológicos específicos. Por otro lado, la misma mutación en el mismo gen puede dar lugar a lesiones morfológicamente distintas, como ocurre con las mutaciones en genes RAS, que se han descrito en la fisiopatogenia de nevus queratinocíticos y sebáceos, incluso en un mismo paciente.
Los hamartomas cutáneos siguen un patrón de distribución que depende del tipo de célula que los origina8,9. La mayoría de los nevus epidérmicos siguen las líneas de Blaschko (patrón arquetípico A y B de Happle), con algunas excepciones. Por otra parte, el tiempo en el que se produce la mutación y se inicia el mosaico determina la localización y el tamaño del nevus. Cuando el mosaico se inicia al final del desarrollo las lesiones son más limitadas, y adoptan lo que se ha llamado formas9. Una forma oval o triangular es lo más habitual en los nevus epidérmicos. Lesiones más extensas resultan de mosaicos originados más precozmente y se asocian a la afectación extracutánea con mayor frecuencia. El síndrome del nevus epidérmico o síndrome de Solomon fue acuñado para algunos pacientes que asociaban a un nevus epidérmico defectos del sistema nervioso central, los ojos y/o en los huesos10. Esta denominación no se adecua a las diferentes entidades que se han ido describiendo en los últimos años, que son genética y clínicamente muy heterogéneas11–14. La tabla 2 resume los síndromes de nevus queratinocíticos más relevantes descritos hasta la fecha.
Algunos de los síndromes asociados a nevus queratinocíticos mejor caracterizados
| Síndrome | Tipo de nevus | Otras manifestaciones | Gen afecto (herencia) | Referencia |
|---|---|---|---|---|
| Síndrome del nevus epidérmico FGFR3 (García-Happle) | Nevus queratinocítico | Retraso mental, epilepsia | FGFR3 (esporádica) | 29,30 |
| Síndrome CLOVES | Nevus queratinocítico | Sobrecrecimiento lipomatoso, vascular, alteraciones esqueléticas | PIK3CA (esporádica) | 32 |
| Síndrome PENS | Nevus queratinocítico (nevus PENS) | Retraso mental y psicomotor leves que tienden a mejorar con la edad, acortamiento del tendón de Aquiles, hipospadias, pene curvado | Desconocida (la mayoría, esporádicos, algunos casos familiares con un patrón de herencia paradominante) | 46-48 |
| Síndrome de Proteus | Nevus queratinocítico | Hipertrofia de extremidades, macrodactilia, malformaciones vasculares, lipomas, aplasia cutis y nevus de tejido conectivo, enfermedad pulmonar, adenoma de parótida, cistadenoma ovárico y cáncer de mama, de endometrio y testicular | AKT1 (esporádica) | 50,51 |
| Enfermedad de Cowden tipo 2 segmentaria | Nevus queratinocítico (nevus PTEN) | Triquilemomas, papilomas orales, fibromas, neuromas mucocutáneos, queratosis acrales, lentiginosis genital, malformaciones y tumores vasculares y lipomas. Cáncer de mama, endometrio, tiroides y colon | PTEN (autosómica dominante) | 53,55,56 |
| Síndrome CHILD | Nevus queratinocítico (nevus CHILD) | Aplasia o hipoplasia esquelética ipsilateral, calcificaciones puntiformes en las epífisis de los huesos, defectos ipsilaterales en cerebro, pulmón, corazón o riñón | NSDHL (dominante ligada al X, aunque la mayoría de los casos son esporádicos) | 58 |
CHILD: Congenital Hemidysplasia, Ichthyosiform erythroderma and Limb Defects; CLOVES: Congenital Lipomatous Overgrowth with Vascular, Epidermal and Skeletal anomalies; PENS: Papular Epidermal Nevus with Skyline basal cell layer; PTEN: en este contexto, Papillomatous, Thick, Epidermal, Non-organoid nevus.
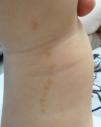
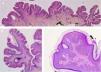
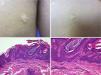
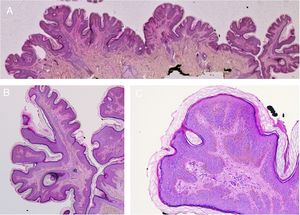
Se trata de placas de superficie verrucosa o aterciopelada, color marrón o gris, a menudo siguiendo las líneas de Blaschko (fig. 1). Tienen una prevalencia del 0,1 al 0,5%. Las lesiones localizadas en flexuras pueden macerarse y volverse malolientes, mientras que las que se localizan en superficies extensoras adquieren con frecuencia un aspecto seco y agrietado. Algunas lesiones presentan un aspecto francamente papilomatoso (fig. 2). Con frecuencia nos referimos a ellas como nevus verrugoso. El término nevus unius lateris se refiere a un nevus queratinocítico lineal largo, generalmente afectando una extremidad. Son raros en cuero cabelludo y en la frente, donde los nevus sebáceos son mucho más frecuentes. Algunos nevus epidérmicos asocian nevus de pelo lanoso en el cuero cabelludo15. Histológicamente el nevus queratinocítico común presenta acantosis, papilomatosis e hiperqueratosis, engrosamiento de la granulosa y aumento de la melanina en la capa basal (fig. 3). Se han descrito algunas variantes histopatológicas16,17.
Nevus verrugoso de la nuca. Imagen histológica. A) Hematoxilina-eosina, HE, 2x: la epidermis muestra acantosis, papilomatosis e hiperqueratosis. B) HE, 4x: detalle de la epidermis papilomatosa. C) HE, 10x: mayor detalle de la acantosis, la presencia de hiperpigmentación de la basal y la hiperqueratosis ortoqueratósica laxa, en «cesta de mimbre».
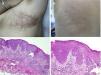
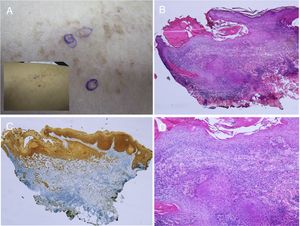
La aparición de tumores malignos sobre los nevus queratinocíticos es rara, aunque existen casos publicados (fig. 4)18–24. Suele producirse en la edad adulta. Lo más frecuente es el desarrollo de un carcinoma de células escamosas. Además, existen casos descritos de carcinoma basocelular y porocarcinoma.
Carcinoma de células escamosas desarrollado sobre nevus epidérmico, previamente tratado con electrocoagulación. A) Foto clínica panorámica y detalle. B) HE, 4x: dos de las tres lesiones que se biopsiaron mostraban una proliferación epidérmica y formación de cordones que invadían la dermis reticular. C) Inmunohistoquímica con citoqueratina AE1/AE3, 4x: estos cordones de células epiteliales invadían la dermis. D) GE, 10x detalle de la proliferación neoplásica compuesta por queratinocitos atípicos que forman queratina y perlas córneas. Imágenes clínicas cedidas por la Dra M. Concepción Sánchez Bermejo y la Dra María José González, del Hospital de Manacor.
El nevus queratinocítico común es el resultado de alteraciones de hasta seis genes diferentes, lo que no se traduce necesariamente en hallazgos morfológicos específicos. Todos ellos son protooncogenes implicados asimismo en algunos tipos de cáncer, así como en otras lesiones adquiridas benignas como las queratosis seborreicas25. Revisaremos a continuación los síndromes asociados al nevus queratinocítico basándonos en su clasificación genética.
Clasificación genética del nevus queratinocítico y síndromes asociadosEn aproximadamente un tercio de los nevus queratinocíticos «comunes» se encuentra la misma mutación R248C en heterozigosis en el oncogén FGFR325,26. Las mutaciones de FGFR3 son responsables de una lista relativamente larga de síndromes y también neoplasias, entra las que se encuentran el cáncer de vejiga urinaria, cérvix uterino, colorrectal y el seminoma espermatocítico. A pesar de que existen casos descritos de cáncer del tracto urinario en pacientes con nevus queratinocíticos27,28, no existe hasta la fecha ningún paciente en el que se haya demostrado que el nevus y la neoplasia compartan la misma mutación. En dos pacientes con nevus epidérmico y cáncer urotelial en los que se estudió el gen FGFR3, tanto el hamartoma como la neoplasia resultaron «wild-type»29. Mutaciones en mosaico en FGFR3 se han descrito en algunos pacientes que asociaban retraso mental y epilepsia, lo que se conoce como síndrome del nevus epidérmico FGFR3 o síndrome de García-Hafner-Happle30,31.
Otro gen afecto con frecuencia es PIK3CA. La misma mutación E545G de PIK3CA en mosaico se ha encontrado implicada en nevus queratinocíticos, queratosis seborreicas y cáncer colorrectal32. Por otra parte, las mutaciones en PIK3CA se han asociado a crecimiento lipomatoso y anomalías vasculares y esqueléticas, agrupadas en el congenital lipomatous overgrowth with vascular, epidermal and skeletal anomalies (CLOVES) OMIM #61291833. Este síndrome fue descrito a partir de una serie de siete pacientes diagnosticados previamente de síndrome de Proteus que presentaban algunas características diferenciales: malformaciones vasculares complejas, progresivas y mixtas en tronco, alteraciones del tejido adiposo, escoliosis en grado variable, huesos alargados sin presentar sobrecrecimiento progresivo y sin la distorsión ósea característica del síndrome de Proteus34. Posteriormente se describieron pacientes con malformaciones del sistema nervioso central y epilepsia35. Al contrario que los pacientes con síndrome de Proteus, no desarrollan nevus de tejido conectivo (elastoma, colagenoma)36. El nevus queratinocítico lineal es en cambio una lesión característica en el síndrome CLOVES. Las lesiones tienden a crecer y volverse más verrucosas hasta la adolescencia, manteniéndose estables posteriormente.
Aproximadamente el 40% de nevus queratinocíticos son el resultado de mutaciones en genes RAS. En un estudio con 72 lesiones, el gen HRAS fue el más frecuentemente afecto, seguido por NRAS y KRAS37. Los genes RAS son importantes oncogenes, que se encuentran mutados hasta en el 30% de las neoplasias en el ser humano y en múltiples síndromes (rasopatías). En el grupo de los nevus epidérmicos, las mutaciones en mosaico en este grupo de genes pueden dar lugar tanto a un nevus queratinocítico como a un nevus organoide y son un ejemplo de la discordancia entre genotipo y fenotipo. El nevus marginado, que presenta una zona central rica en glándulas sebáceas y una zona periférica más papular con acantosis y papilomatosis más parecida a un nevus queratinocítico, se debe a mutaciones en genes RAS que se encuentran en ambos componentes38. Recientemente se ha descrito el caso de una niña que presentaba múltiples lesiones nevoides, algunas compatibles con nevus queratinocítico en el tronco y otras con nevus sebáceo en la zona cráneo-facial. La paciente presentaba además dentición retardada, quiste aracnoideo cerebral y atrofia óptica. En ambos tipos de nevus se encontró la misma mutación en KRAS, que no estaba presente en piel sana ni tampoco en sangre periférica de sus progenitores39. Las formas sindrómicas asociadas a mutaciones en genes RAS se verán con mayor detalle al revisar los nevus sebáceos.
Algunos nevos queratinocíticos con mutaciones en RAS se han asociado al desarrollo de neoplasias malignas que albergaban la misma mutación. Es el caso de una niña que presentaba un nevus queratinocítico y desarrolló un rabdomiosarcoma útero-vaginal a la edad de 6 meses. Tanto en el hamartoma como en la neoplasia se demostró la misma mutación en KRAS, que no se encontraba en otros tejidos de la misma paciente40. Otro caso es el de un varón de 49 años con un nevus queratinocítico congénito extenso que desarrolló un cáncer urotelial en el que se demostró la misma mutación en HRAS en mosaico, en ambas lesiones41.
Muy recientemente se han descrito alteraciones en el oncogén FGFR2, cuya mutación explicaría el 5-10% de los nevos queratinocíticos42. La reciente descripción de dos fetos con nevus sebáceos que albergaban mutaciones en este gen ha sido causa de polémica, ya que algunos autores consideran que se trata de nevos queratinocíticos43,44.
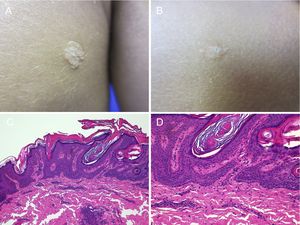
Otros nevus epidérmicos queratinocíticosPapular Epidermal Nevus with Skyline basal cell layer (PENS) y síndrome PENSAntonio Torrelo et al. describieron en 2011 una nueva forma de nevus epidérmico con características clínicas e histológicas específicas45. Son lesiones congénitas o que aparecen al poco tiempo de nacer, únicas o múltiples, de aspecto papular y superficie lisa o papilomatosa, formando placas redondeadas o en coma que miden de 0,3 a 1,5cm y siguen una distribución aleatoria. Solamente se ha descrito un caso en el que las lesiones seguían una distribución blaschkoide46. Histológicamente presentan una acantosis epidérmica regular con crestas epidérmicas engrosadas y rectangulares, con hiperqueratosis ortoqueratósica. El hallazgo más característico es que en la capa basal las células se disponen en empalizada, incluso llegando a verse una zona eosinófila «vacía» entre los núcleos de la basal y los primeros queratinocitos del estrato espinoso (fig. 5).
Dos nevus PENS en el mismo paciente. A y B) Dos placas de 8mm y 5mm respectivamente, de forma redondeada en el primer caso y poligonal, algo lineal en el segundo. C) HE, 4x: la biopsia mostraba una hiperplasia epidérmica con cretas engrosadas y fusionadas, con papilomatosis e hiperqueratosis compacta. D) HE, 10x: a mayor detalle se observa cómo la capa basal de células en la epidermis tiene un aspecto en empalizada.
El síndrome PENS se manifiesta en forma de retraso mental o psicomotor leve y epilepsia en el primer año de vida, que suele mejorar e incluso remitir con la edad47. Otros hallazgos incluyen facies característica, acortamiento del tendón de Aquiles, hipospadias y pene curvado48,49.
Se desconoce la alteración genética que causa este trastorno, así como su herencia. En la descripción original se descartaron mutaciones en FGFR3 y en PIK3CA45. Se trata generalmente de lesiones esporádicas, aunque se han descrito dos familias con más de un miembro afecto47,50.
Nevus epidérmico en el síndrome de ProteusEl síndrome de Proteus (OMIM #176920) se caracteriza por el sobrecrecimiento asimétrico de los tejidos debido a mutaciones letales, no hereditarias, que sobreviven en mosaico del gen AKT151. Lo más característico es la macrodactilia y la hipertrofia de extremidades. Asocia malformaciones vasculares, lipomas, aplasia cutis y nevus de tejido conectivo, enfermedad pulmonar, adenoma de parótida, cistadenoma ovárico y cáncer de mama, de endometrio y testicular. Hasta un 50% presenta nevus epidérmicos. Se trata de placas aplanadas, únicas o múltiples, de superficie aterciopelada, siguiendo las líneas de Blaschko. Histológicamente se observa acantosis e hiperqueratosis. Al contrario que otros tumores asociados al síndrome de Proteus, el nevus epidérmico no crece a lo largo del tiempo52.
En los años previos al descubrimiento de las mutaciones en AKT1, el síndrome «Proteus-like», por mutaciones del gen PTEN de herencia autosómica dominante, ha creado cierta confusión. Hoy en día se cree que todos estos pacientes presentan una enfermedad de Cowden y un nevus epidérmico asociado (ver apartado siguiente)53,54. Todos los casos de síndrome de Proteus son esporádicos.
Enfermedad de Cowden tipo 2 segmentaria (nevus PTEN)El síndrome de Cowden (OMIM #158350) es un trastorno multisistémico caracterizado por la aparición de múltiples hamartomas y tumores, entre ellos cáncer de mama, endometrio, tiroides y colon. En la piel se incluyen triquilemomas, papilomas orales, fibromas (incluido el fibroma esclerótico o colagenoma estoriforme, que parece ser bastante específico), neuromas mucocutáneos, queratosis acrales, lentiginosis genital, malformaciones y tumores vasculares y lipomas. Se produce por una mutación en el gen PTEN, un gen supresor de tumores, que se heredan de forma autosómica dominante, aunque se han descrito mutaciones en otros genes55.
Se ha ha llamado nevus de Cowden o nevus PTEN (usado aquí como acrónimo de Papillomatous, Thick, Epidermal, Non-organoid nevus) a la aparición de pápulas eritematosas, hiperqueratósicas y papilomatosas que confluyen formando placas lineales siguiendo las líneas de Blaschko en un paciente afecto de síndrome de Cowden, que se debe a una pérdida de heterocigosidad en mosaico en el gen PTEN (mosaicismo tipo 2 de Happle)54,56. También se ha llamado enfermedad de Cowden segmentaria tipo 254 y síndrome Segmental Overgrowth, Lipomatosis, Arteriovenous Malformation and Epidermal Nevus57. La lesión se distingue del nevus epidérmico característico del síndrome de Proteus por presentar un aspecto más querátosico y papilomatoso y asociarse a otras manifestaciones del síndrome de Cowden.
Nevus CHILD y síndrome CHILDEl síndrome Congenital Hemidysplasia, Ichthyosiform erythroderma and Limb Defects –CHILD– (OMIM #308050) se caracteriza por un nevus epidérmico que asocia aplasia o hipoplasia esquelética, ipsilateral, calcificaciones puntiformes en las epífisis de los huesos, defectos ipsilaterales en cerebro, pulmón, corazón o riñón. Se hereda con un patrón dominante ligado al X, aunque la mayoría de los casos son esporádicos. La expresividad clínica es muy variable, incluso dentro de una misma familia, en la que puede haber miembros con lesiones muy sutiles, lo que dificulta el diagnóstico58. Se produce a consecuencia de la mutación del gen NSDHL59, que participa en el metabolismo del colesterol. La mutación es muy frecuentemente letal en embriones masculinos, aunque existen casos descritos en varones60.
El nevus CHILD se confunde a veces con una enfermedad inflamatoria, sobre todo psoriasis, en los casos de afectación más limitada61. Se presenta como placas lineales eritematosas o amarillentas, descamativas, psoriasiformes o ictiosiformes, siguiendo un trayecto blaschkoide. Lesiones más extensas tienen un límite muy bien definido en la línea media. Curiosamente, la gran mayoría de los pacientes descritos presentan afectación del hemicuerpo derecho. Tiene especial predilección por las flexuras (pticotropismo)62. Histológicamente se caracteriza por una dermatitis psoriasiforme con exocitosis de neutrófilos. Se ha apuntado que en la paraqueratosis los núcleos que persisten son más redondeados en comparación con los que se ven en la psoriasis61. Con frecuencia veremos acúmulos de histiocitos cargados con vacuolas lipídicas que expresan CD68 y adipofilina en la dermis papilar, lo que bajo una epidermis papilomatosa puede hacer sospechar el diagnóstico de un xantoma verruciforme. Estos hallazgos, en el contexto de una lesión congénita blaschkoide, lateralizada, con pticotropismo, deberían hacer sospechar un síndrome CHILD.
Nevus epidérmico verrugoso inflamatorio linealSe trata de una placa lineal de aspecto inflamatorio, con eritema y descamación, especialmente frecuente en las extremidades inferiores. Un 25% están presentes al nacimiento, un 50% se presentan en los 6 primeros meses de vida y el resto se pueden presentar hasta los 4 años de edad. Histológicamente veremos una dermatitis psoriasiforme, con hiperplasia epidérmica con áreas de paraqueratosis sobre una epidermis sin granulosa, alternando con ortoqueratosis sobre hipergranulosis. Se han descrito áreas de aspecto más espongiótico con exocitosis de linfocitos. Se puede presentar en forma de mosaicismo de tipo 1 o bien de tipo 2 en un paciente con psoriasis generalizada63. Se han comunicado múltiples casos con buena respuesta a los tratamientos para la psoriasis (tópicos, fototerapia, sistémicos y biológicos). A parte de una anecdótica asociación con artropatía64, no se han descrito manifestaciones extracutáneas en pacientes con nevus epidérmico verrugoso inflamatorio lineal. Se desconoce la alteración genética responsables del mosaicismo que origina este nevus, y se cree que podría ser, como la psoriasis, una enfermedad poligénica.
Nevus queratinocítico epidermolíticoCorresponde a la forma en mosaico de la hiperqueratosis o ictiosis epidermolítica (OMIM #113800), y se debe a mutaciones dominantes en la queratina 1 o 10 (KRT 1 o KRT10)65,66. Se trata de lesiones verrugosas algo pigmentadas, siguiendo un trayecto lineal blaschkoide. Se pueden presentar al nacer, como lesión única o múltiple, pueden aparecer en cualquier parte del cuerpo y es frecuente que las lesiones flexurales se maceren y produzcan mal olor. Histológicamente presentan hiperqueratosis, acantosis, papilomatosis y acantólisis en la capa granulosa, hallazgos compatibles con una ictiosis epidermolítica. Existen casos en los que se muestra un mosaicismo de tipo 2, con áreas lineales de mayor afectación sobre un individuo con esta enfermedad67. Se han descrito varias familias con padres afectos de la forma nevoide e hijos que presentaban una forma completa de ictiosis epidermolítica68–70. Se sospecha que la transmisión se produce por mosaicismo gonadal. En los pacientes en los que se diagnostica este nevus se debería descartar afectación germinal y facilitar consejo genético.
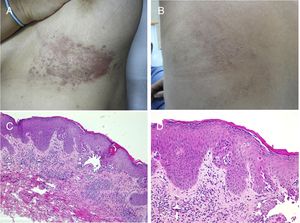
Nevus epidérmico acantolítico y disqueratósicoComo la anterior, representa para la mayoría de los autores una forma en mosaico de enfermedad monogénica, aunque existe controversia al respecto. En este caso correspondería a formas nevoides de una enfermedad de Darier (OMIM #124200) o más raramente una enfermedad de Hailey-Hailey (OMIM #169600). Existen numerosos casos descritos como enfermedad de Darier segmentaria o lineal descritos en la literatura71–75. Clínicamente se trata de lesiones lineales queratocostrosas que aparecen en la pubertad o posteriormente (fig. 6). Son características las exacerbaciones que con frecuencia se asocian a la sudoración y a la exposición solar. Las manifestaciones en mucosas y en extremidades, incluyendo palmas, plantas y uñas, características de la enfermedad de Darier, no se suelen ver en la forma nevoide. Tampoco encontraremos antecedentes familiares.
Enfermedad de Darier segmentaria. A y B) Imágenes clínicas de la lesión submamaria y dorsal izquierdas en una paciente sin más lesiones cutáneas. C) HE, 4x: la biopsia mostraba una acantosis epidérmica con mínima hiperqueratosis ortoqueratósica, acantólisis suprabasal y formación de una ampolla intraepidérmica. D) HE 10x: a mayor aumento se apreciaban mejor los cambios disqueratósicos con la presencia de cuerpos redondos y granos. La paciente fue diagnosticada de enfermedad de Darier segmentaria.
Histológicamente veremos la presencia de una epidermis hiperqueratósica y paraqueratósica en la que se observan hendiduras intraepidérmicas que contienen queratinocitos acantolíticos y disqueratósicos, con presencia de cuerpos redondos y granos (fig. 6). En algunos casos de nevus epidérmico acantolítico y disqueratósico se ha demostrado la mutación en ATP2A2 característica de la enfermedad76,77.
Algunos autores sostienen, no obstante, que el nevus epidérmico acantolítico y disqueratósico y la enfermedad de Darier segmentaria no son la misma enfermedad78–80. Los ejemplos que se presentan son lesiones congénitas (en vez de desarrollarse en la pubertad), en las que no se demuestra la mutación del gen ATP2A2 o bien se puede comprobar la expresión de SERCA2 (producto de la expresión de ATP2A2) por inmunohistoquímica.
Las formas nevoides de enfermedad de Hailey-Hailey son más raras. Se han publicado un caso de afectación segmentaria de tipo 181 y otro caso que debutó a los tres meses de edad con una lesión lineal recidivante que posteriormente desarrolló lesiones simétricas características de la enfermedad82. En esta paciente se demostró la pérdida de heterozigosidad en la zona de afectación más precoz (mosaicismo tipo 2)83. Histológicamente se observa acantólisis suprabasal con linfocitos y eosinófilos. La disqueratosis puede verse, aunque no suele ser tan evidente como en la enfermedad de Darier y no suelen verse cuerpos redondos ni granos. Para el diagnóstico de una enfermedad de Hailey-Hailey suele requerirse la inmunofluorescencia para descartar una enfermedad ampollosa autoinmune, sobre todo un pénfigo vulgar.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.