Los nevus epidérmicos son hamartomas originados en la epidermis y/o en las estructuras anexiales de la piel que se han clasificado clásicamente partiendo de la morfología. En los últimos años se han descrito variantes nuevas y se han producido avances en el campo de la genética que han permitido caracterizar mejor estas lesiones y comprender su relación con algunas de las manifestaciones extracutáneas a las que se han asociado. En esta segunda parte revisaremos los nevus derivados de estructuras anexiales de la piel y los síndromes que se asocian.
Epidermal nevi are hamartomatous lesions derived from the epidermis and/or adnexal structures of the skin; they have traditionally been classified according to their morphology. New variants have been described in recent years and advances in genetics have contributed to better characterization of these lesions and an improved understanding of their relationship with certain extracutaneous manifestations. In the second part of this review article, we will look at nevi derived from the adnexal structures of the skin and associated syndromes.
En esta segunda parte revisaremos los hamartomas derivados de las glándulas sebáceas, el folículo piloso y las glándulas sudoríparas apocrinas y ecrinas. Por último, haremos referencia al nevus de Becker. La tabla 1 resume los síndromes asociados a los nevus anexiales mejor caracterizados hasta la fecha.
Algunos de los síndromes asociados a nevus derivados de estructuras anexiales (organoides) mejor caracterizados
| Síndrome | Tipo de nevus | Otras manifestaciones | Gen afecto (herencia) | Referencia |
|---|---|---|---|---|
| Síndrome de Schimmelpenning | Nevus sebáceo (posiblemente también queratinocítico) | Retraso mental, epilepsia, osteopenia, cifoescoliosis, talla baja, alteraciones de los dedos de los pies y/o las manos, lipodermoide del párpado, coloboma y otras alteraciones | HRAS, KRAS y NRAS (esporádica) | 3-5, 32, 34 |
| Facomatosis pigmentoqueratósica | Nevus sebáceo y nevus spilus | Retraso mental, epilepsia, hemiparesia, alteraciones locales asociadas al nevus spilus: hiperhidrosis, disestesia, debilidad muscular y neuropatía sensitiva o motora | HRAS (esporádica) | 35, 36 |
| Síndrome cutáneo-esquelético con hipofosfatemia | Nevus queratinocítico y nevus sebáceo | Hipofosfatemia, displasia ósea y osteomalacia, manifestaciones cerebrales, cardiacas y oftalmológicas del síndrome del nevus sebáceo o la facomatosis pigmentoqueratótica | HRAS, NRAS (esporádica) | 37, 41, 42 |
| Didimosis aplasticosebácea y síndrome SCALPa | Nevus sebáceo, aplasia cutis | Dermoide del limbo corneal, un nevus melanocítico congénito grande o gigante y alteraciones neurológicas similares al síndrome de Schimmelpenning | Se desconoce (esporádica) | 46-48 |
| Síndrome del nevus comedónico | Nevus comedónico | Catarata ipsilateral, microcefalia, retraso mental, epilepsia, alteraciones vertebrales, sindactilia, clinodactilia, polidactilia y oligodontia | Posiblemente FGFR2 como formas en mosaico del síndrome de Apert en algunos casos (esporádica) | 56, 61 |
| Síndrome del nevus de Becker | Nevus de Becker | Hipoplasia mamaria ipsilateral, hipoplasia de la musculatura subyacente, lipoatrofia y alteraciones esqueléticas | ACTB (esporádica) | 98, 99 |
Se trata de lesiones organoides que contienen componentes epidérmicos, foliculares, sebáceos, apocrinos y ecrinos. Tienen una prevalencia del 0,3%. Existen algunas formas familiares1,2. Se producen a consecuencia de mutaciones somáticas poszigóticas en HRAS (95%) y KRAS (5%)3,4. Mutaciones en NRAS se han descrito más recientemente en un caso de nevus sebáceo con manifestaciones extracutáneas5. Algunos autores se refieren al grupo de las «rasopatías en mosaico», en el que incluyen los nevus sebáceos, y también algunos nevus queratinocíticos, nevus melanocíticos y formas sindrómicas asociadas6,7.
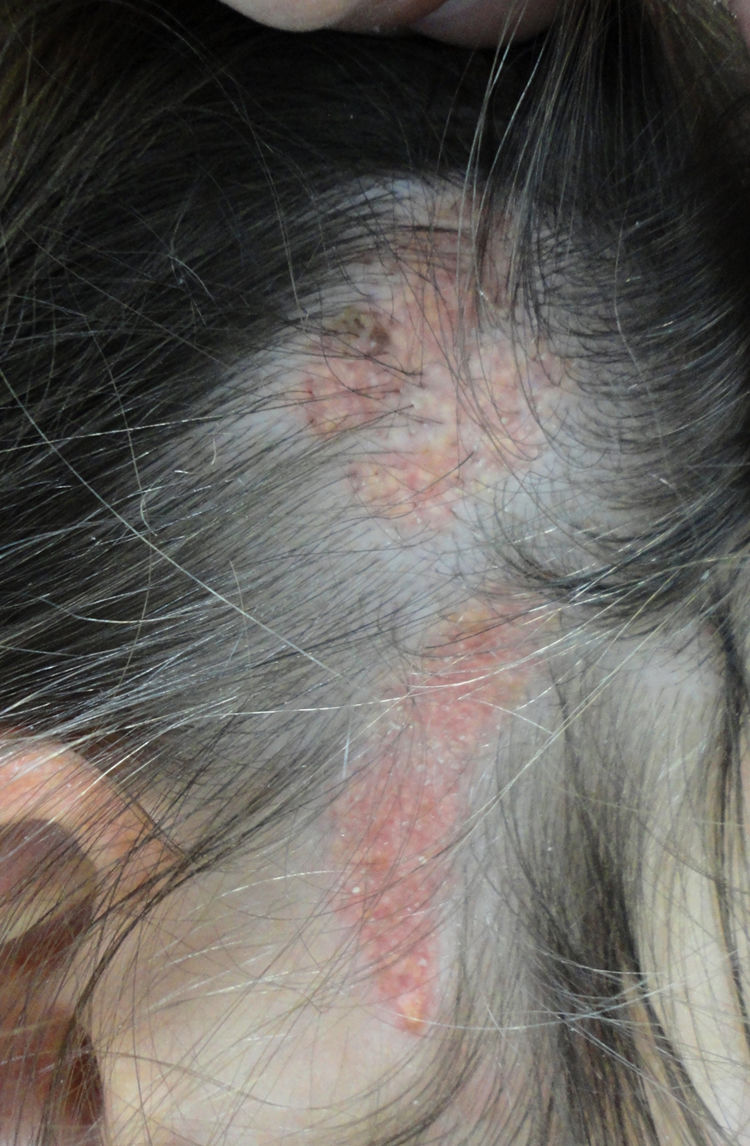
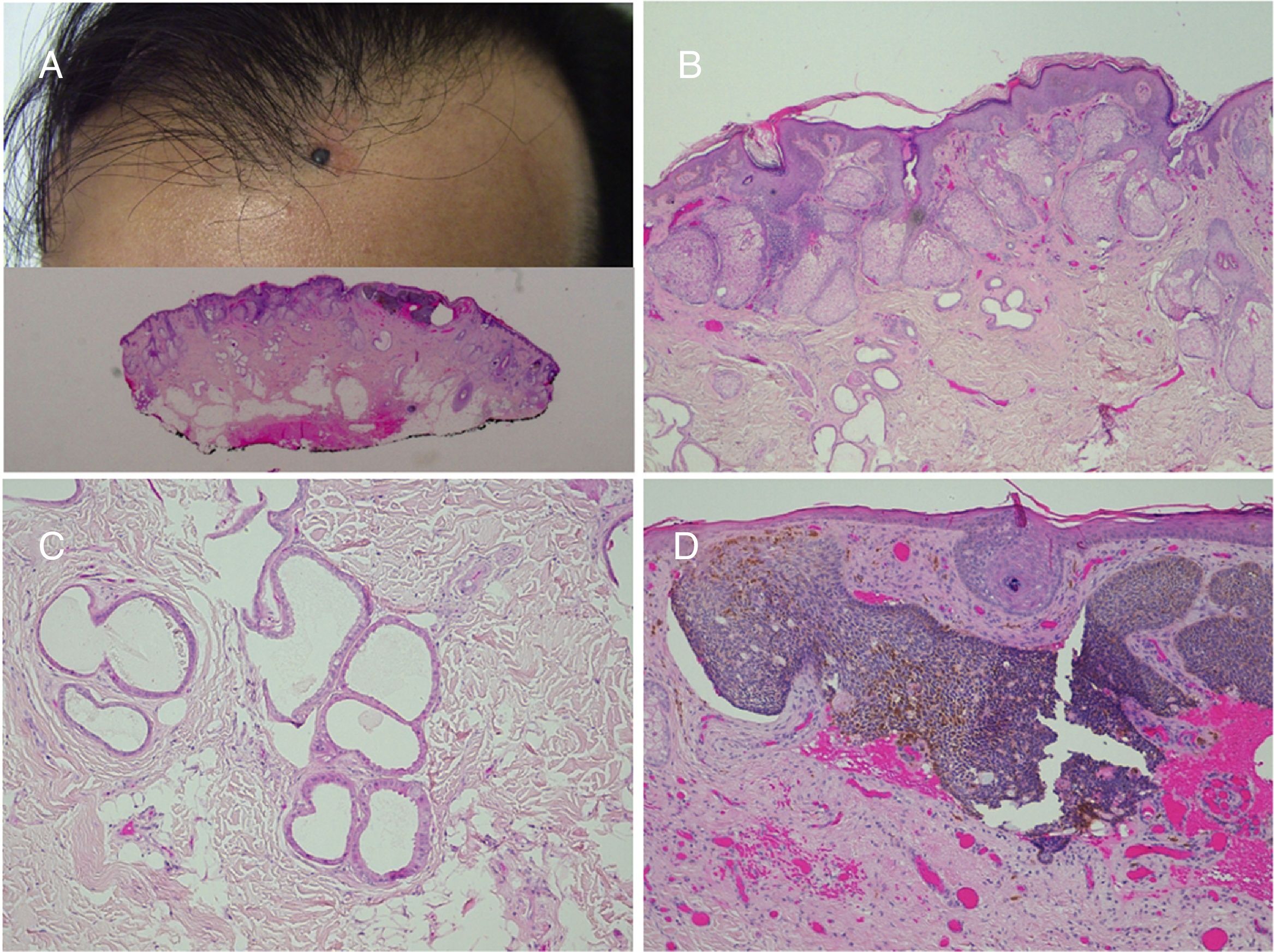
Más de la mitad de las lesiones se encuentran en el cuero cabelludo, un tercio se desarrollan en la cara, rara vez se ven en el cuello y excepcionalmente en el tronco o en las extremidades8,9. Se trata de lesiones congénitas en la mayoría de los casos, aunque pueden aparecer en los primeros años de vida. Siguen característicamente las líneas de Blaschko, adoptando una forma ovalada o en coma. El aspecto clínico varía con la edad, probablemente por un número aumentado de receptores de andrógenos en todos sus componentes, que se ven estimulados durante la pubertad10. En niños, se manifiesta como una placa alopécica de superficie lisa, coloración amarillento-anaranjada y se puede confundir con una aplasia cutis o bien una cicatriz. A partir de la adolescencia adquiere un aspecto más verrugoso y un color más amarillento (fig. 1).
Lógicamente, los cambios histológicos también varían con la edad del paciente8,9. En la edad pediátrica se suele observar una leve acantosis epidérmica y la presencia de pequeños folículos pilosos mal formados. A partir de la pubertad, la acantosis se hace más evidente y aumentan en número y en tamaño las glándulas sebáceas, que se encuentran más arriba en la dermis reticular o incluso papilar (fig. 2). La disgenesia folicular se mantiene en la edad adulta. Generalmente, la presencia de pelos terminales bien formados marca los límites de la lesión.
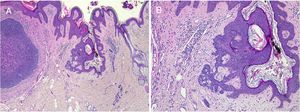
Nevus sebáceo en región temporal izquierda de un paciente joven. A)Imagen clínica. B(HE, 4×): imagen histológica que muestra la presencia de acantosis epidérmica y múltiples glándulas sebáceas de gran tamaño que se encuentran anormalmente altas en la dermis reticular. C(HE, 10×): detalle de las glándulas sebáceas. D(HE, 10×): la acantosis adquiere en algunas áreas un aspecto reticulado que recuerda a la queratosis seborreica adenoide.
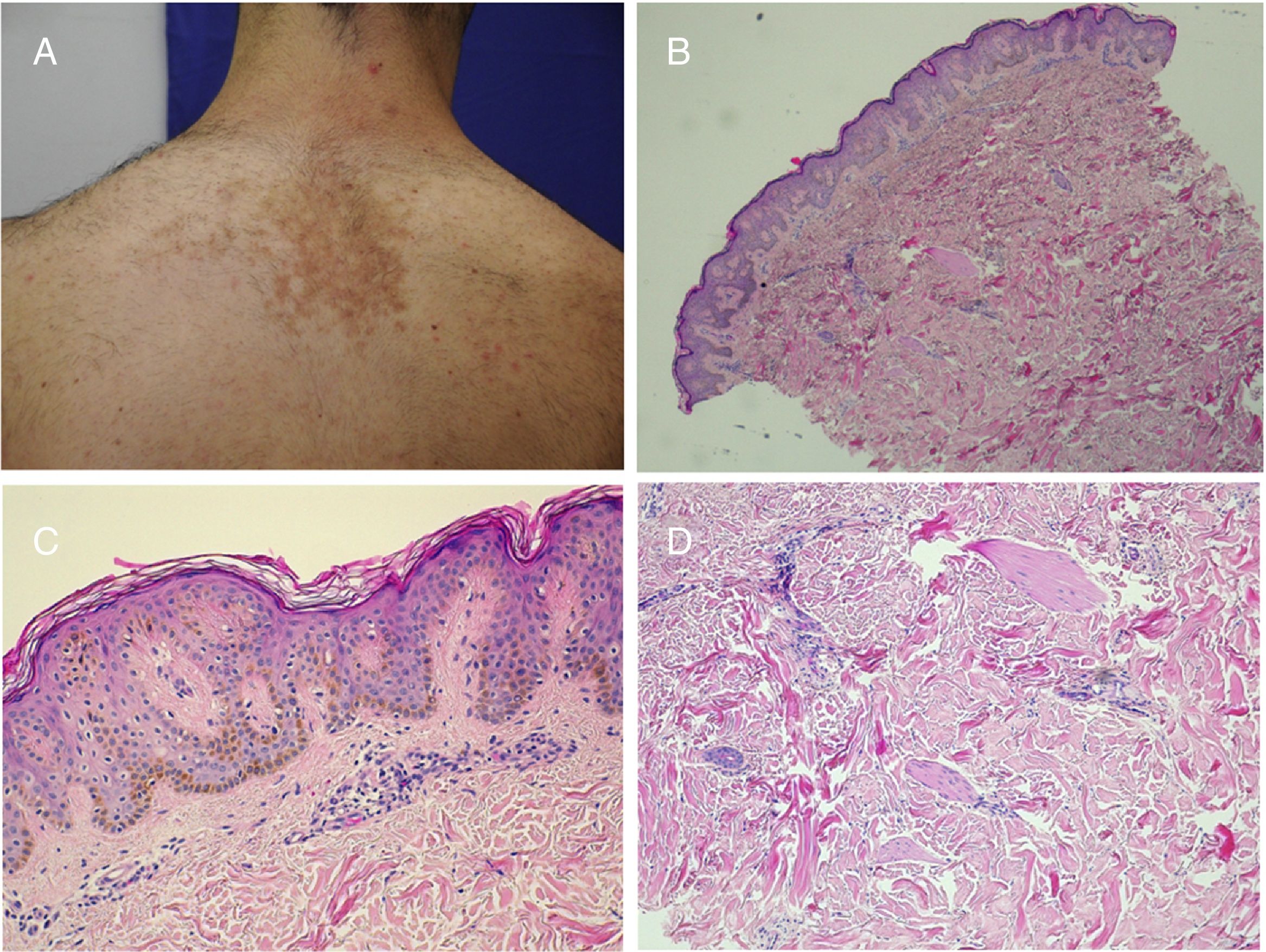
Un cambio epidérmico que se observa con cierta frecuencia en las lesiones en adultos es la inducción folicular. Se trata de un fenómeno reactivo que se puede ver en mútliples procesos y que se cree que se debe a la influencia del estroma sobre el epitelio11. Los cambios van desde la proliferación de células basaloides con empalizada periférica que hay que diferenciar de un carcinoma basocelular superficial (fig. 3), hasta bulbos foliculares en fase anagen con papilas foliculares visibles en su porción inferior.
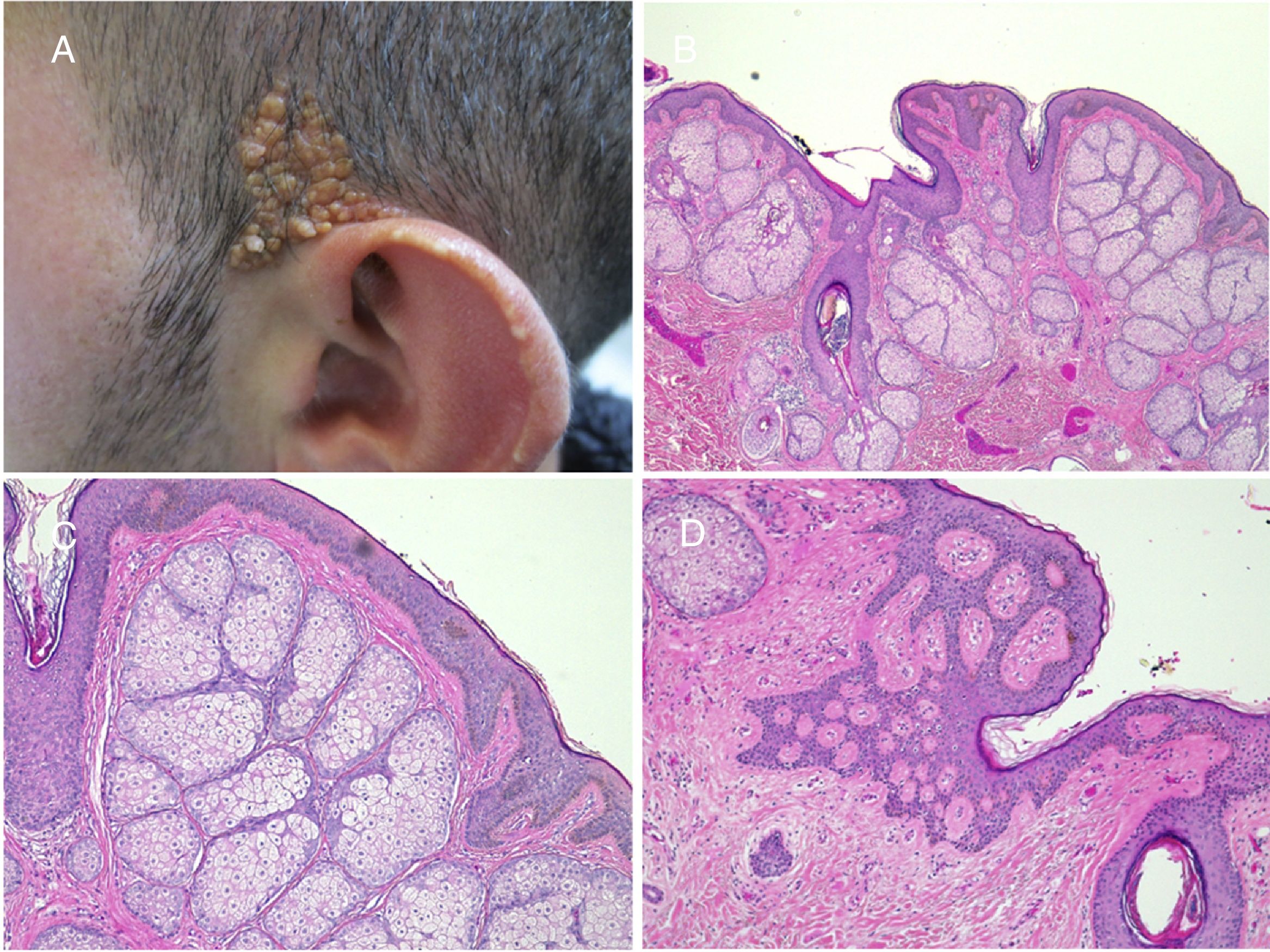
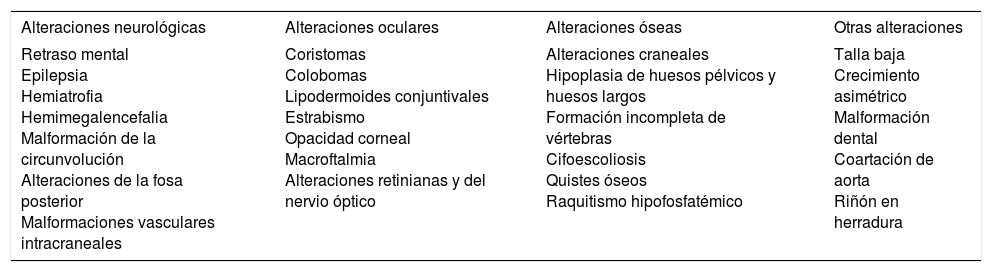
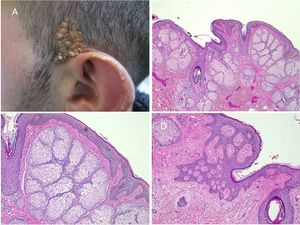
La prevalencia de tumores secundarios, la mayoría benignos, oscila entre el 2 y el 39%9. En las series más largas predominan el tricoblastoma y el siringocistoadenoma papilífero (fig. 4)8,9,12-15. Otros tumores benignos que se han descrito son el tricolemoma, tumores sebáceos, apocrinos y ecrinos. También se han asociado leiomiomas16 y nevus melanocíticos17. Con frecuencia se desarrolla más de un tumor en el mismo nevus, como puede verse en la paciente de la figura 418,19.
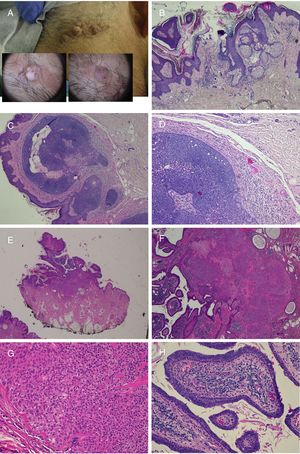
Nevus sebáceo que asocia un tricoblastoma, un siringocistoadenoma papilífero y un triquilemoma. A)Imagen clínica y dermatoscópica del hamartoma y las lesiones asociadas. B(HE, 4×): imagen histológica del nevus sebáceo, correspondiente a la parte más aplanada de la lesión. C(HE, 4×): imagen histológica de un tricoblastoma, que corresponde a la zona papular más oscura. D(HE, 10×): detalle del tricoblastoma. E(HE, 2×): imagen histológica panorámica correspondiente a la pápula menos pigmentada, que fue diagnosticada de un triquilemoma bajo un siringocistoadenoma papilífero. F(HE, 4×): detalle del triquilemoma. G(HE, 10×): detalle de triquilemoma a mayor aumento. H(HE, 10×): detalle del siringocistoadenoma papilífero.
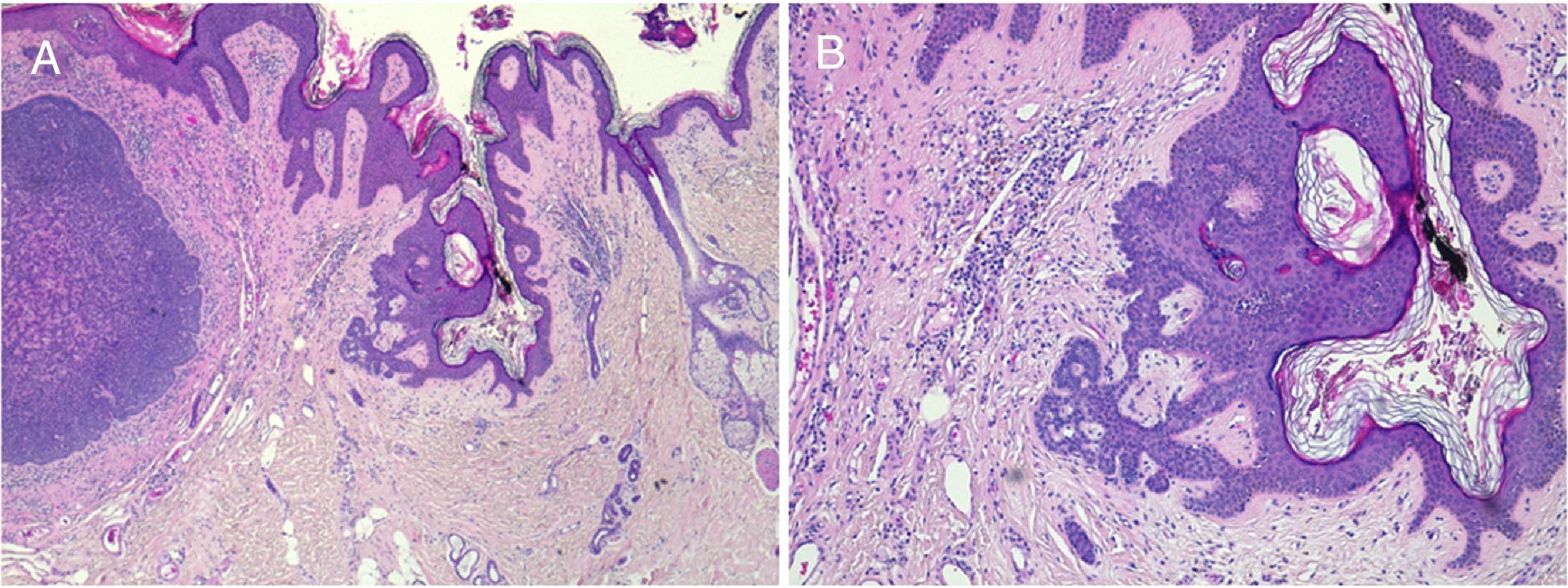
El carcinoma basocelular es el cáncer más frecuentemente asociado (fig. 5). Se han descrito casos aislados de carcinoma apocrino, carcinoma tricolemal, carcinoma sebáceo, carcinoma anexial microquístico, porocarcinoma y carcinoma escamoso. También se ha descrito un caso de leiomiosarcoma20 y otro de melanoma21 asociados. La frecuente confusión entre el tricoblastoma y el carcinoma basocelular ha llevado a una magnificación del potencial de desarrollo de malignidad en el nevus sebáceo en el pasado22. En las series de los últimos años la incidencia de carcinoma basocelular es menor del 1%12-15,23, de ahí que muchos autores aboguen por la vigilancia frente a la exéresis profiláctica en la mayoría de los casos23,24.
Carcinoma de células nasales sobre nevus sebáceo. A)Imagen clínica y visión histológica panorámica (HE, 2×). B(HE, 4×): imagen histológica que muestra la hiperplasia de las glándulas sebáceas y apocrinas. C(HE, 10×): detalle de la secreción por decapitación característica de las glándulas apocrinas. D(HE, 10×): detalle del carcinoma basocelular.
Nevus sebáceo papilomatoso pedunculado. Consiste en placas de aspecto tumoral, superficie papilomatosa, color eritemato-amarillento, que presentan desde el nacimiento un aspecto tumoral. En los 7 casos descritos25-27, todas las lesiones se localizaban en cabeza, cuello y tronco superior. Ningún paciente presentó manifestaciones extracutáneas. Se han descrito mutaciones en el gen FGFR2 en dos fetos que presentaban lesiones similares al nevus sebáceo papilomatoso pedunculado, aunque se ha puesto en duda el diagnóstico clínico e histológico28,29. En el caso de que se confirmara este hallazgo, se trataría de una llamativa excepción, puesto que todos los nevus sebáceos analizados hasta la fecha presentan mutaciones en genes RAS.
Nevus sebáceo cerebriforme. Se trata de una variante morfológica rara de la que existen pocos casos publicados30,31. Todos los casos descritos se encuentran en el cuero cabelludo. Las lesiones presentan un aspecto cerebriforme desde el nacimiento, lo que obliga a realizar el diagnóstico diferencial con otras lesiones, como nevus melanocíticos o colagenomas.
Síndromes asociados al nevus sebáceoEl síndrome de Schimmelpenning, síndrome de Schimmelpenning-Feuerstein-Mims o síndrome del nevus sebáceo lineal (OMIM #163200) asocia alteraciones neurológicas, oculares y óseas (tabla 2). En una serie de 196 pacientes con nevus sebáceo, 14 asociaban manifestaciones neurológicas y 4 presentaron además coloboma o coristoma. Lesiones extensas y la localización centrofacial se correlacionaron con la presencia de alteraciones extracutáneas. Las manifestaciones neurológicas más frecuentes fueron retraso mental (79%) y epilepsia (57%)32. Se han detectado alteraciones en HRAS, KRAS y NRAS en la piel afecta3-5. Recientemente se ha descrito el caso de una niña con nevus sebáceos, nevus queratinocíticos, dentición retardada, quiste aracnoideo cerebral y atrofia óptica. En ambos nevus se detectó la misma mutación en KRAS33. Aparece de forma esporádica y probablemente por mutaciones somáticas poszigóticas letales que sobreviven en forma de mosaico34.
Alteraciones extracutáneas descritas en el síndrome de Schimmelpenning
| Alteraciones neurológicas | Alteraciones oculares | Alteraciones óseas | Otras alteraciones |
|---|---|---|---|
| Retraso mental Epilepsia Hemiatrofia Hemimegalencefalia Malformación de la circunvolución Alteraciones de la fosa posterior Malformaciones vasculares intracraneales | Coristomas Colobomas Lipodermoides conjuntivales Estrabismo Opacidad corneal Macroftalmia Alteraciones retinianas y del nervio óptico | Alteraciones craneales Hipoplasia de huesos pélvicos y huesos largos Formación incompleta de vértebras Cifoescoliosis Quistes óseos Raquitismo hipofosfatémico | Talla baja Crecimiento asimétrico Malformación dental Coartación de aorta Riñón en herradura |
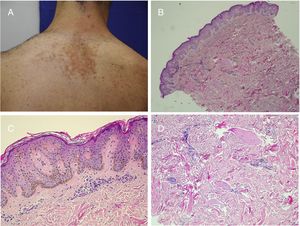
La facomatosis pigmentoqueratósica es una didimosis, es decir, la presencia concurrente, en una misma región, de dos áreas de tejido mutante, diferentes entre sí y del tejido circundante. También llamada didimosis spilosebácea, se caracteriza por la aparición de un nevus sebáceo y un nevus spilus en el mismo paciente, asociado con frecuencia a alteraciones óseas y anomalías neurológicas como retraso mental, epilepsia o hemiparesia. Además, se pueden observar manifestaciones locales asociadas al nevus spilus, como hiperhidrosis, disestesia, debilidad muscular y neuropatía sensitiva o motora. Así como el nevus sebáceo sigue las líneas de Blaschko, el componente melanocítico sigue un patrón en tablero de ajedrez, más típico de los hamartomas que provienen de esta línea celular35. En el año 2013, Groesser et al.36 establecieron que ambos hamartomas cutáneos albergan la misma mutación en HRAS, por lo que no se puede decir que sean una verdadera didimosis.
En el síndrome cutáneo-esquelético con hipofosfatemia los pacientes presentan hipofosfatemia, displasia ósea y osteomalacia (descrita en ocasiones como raquitismo), junto a manifestaciones cerebrales, cardiacas y oftalmológicas37-40. Recientemente se ha demostrado que las manifestaciones clínicas se deben a mutaciones en HRAS y NRAS que se encuentran tanto en el hueso como en las lesiones cutáneas (mosaico somático multilinaje)37,41,42. Las manifestaciones óseas y la hipofosfatemia se atribuyen a un aumento de factor de crecimiento fibrobástico23 (FGF23), una proteína sintetizada por los osteocitos en condiciones normales, que induce la excreción renal de fosfato. Se desconoce la causa de este aumento en los niveles de FGF23. Se han publicado casos de mejoría en los niveles de fosfato en sangre tras la exéresis de los nevus40,43,44, pero estos hallazgos no son constantes y en general no se recomienda la exéresis de las lesiones cutáneas con este objetivo37.
La didimosis aplasticosebácea consiste en la coexistencia de aplasia cutis y un nevus sebáceo. Algunos pacientes descritos presentaban además manifestaciones oculares características del síndrome de Schimmelpenning45-47. El síndrome SCALP (acrónimo de Sebaceous nevus, Central nervous system malformations, Aplasia cutis congenita, Limbal dermoid y Pigmented nevus) fue acuñado en 2008 para describir tres pacientes con didimosis aplasticosebácea que presentaban además tumor dermoide límbico, un nevus melanocítico congénito grande o gigante y alteraciones neurológicas47. Desde entonces se ha descrito un cuarto caso adicional48.
Nevus folicularesNevus del folículo piloso (hamartoma velloso congénito)Se presenta al nacer o en los primeros años de vida como una pápula, placa o nódulo, del color de la piel, localizado en la cara49. Se han descrito casos con lesiones múltiples siguiendo las líneas de Blaschko50,51. Histológicamente se caracteriza por la proliferación de folículos vellosos de pequeño tamaño en la dermis alta, con engrosamiento fibroso perifolicular, rodeados de un estroma altamente celular. En ocasiones se pueden acompañar de glándulas sebáceas, ecrinas o fibras musculares. Se han descrito de forma anecdótica asociaciones con alopecia ipsilateral, angiomatosis leptomeníngea y displasia frontonasal52,53.
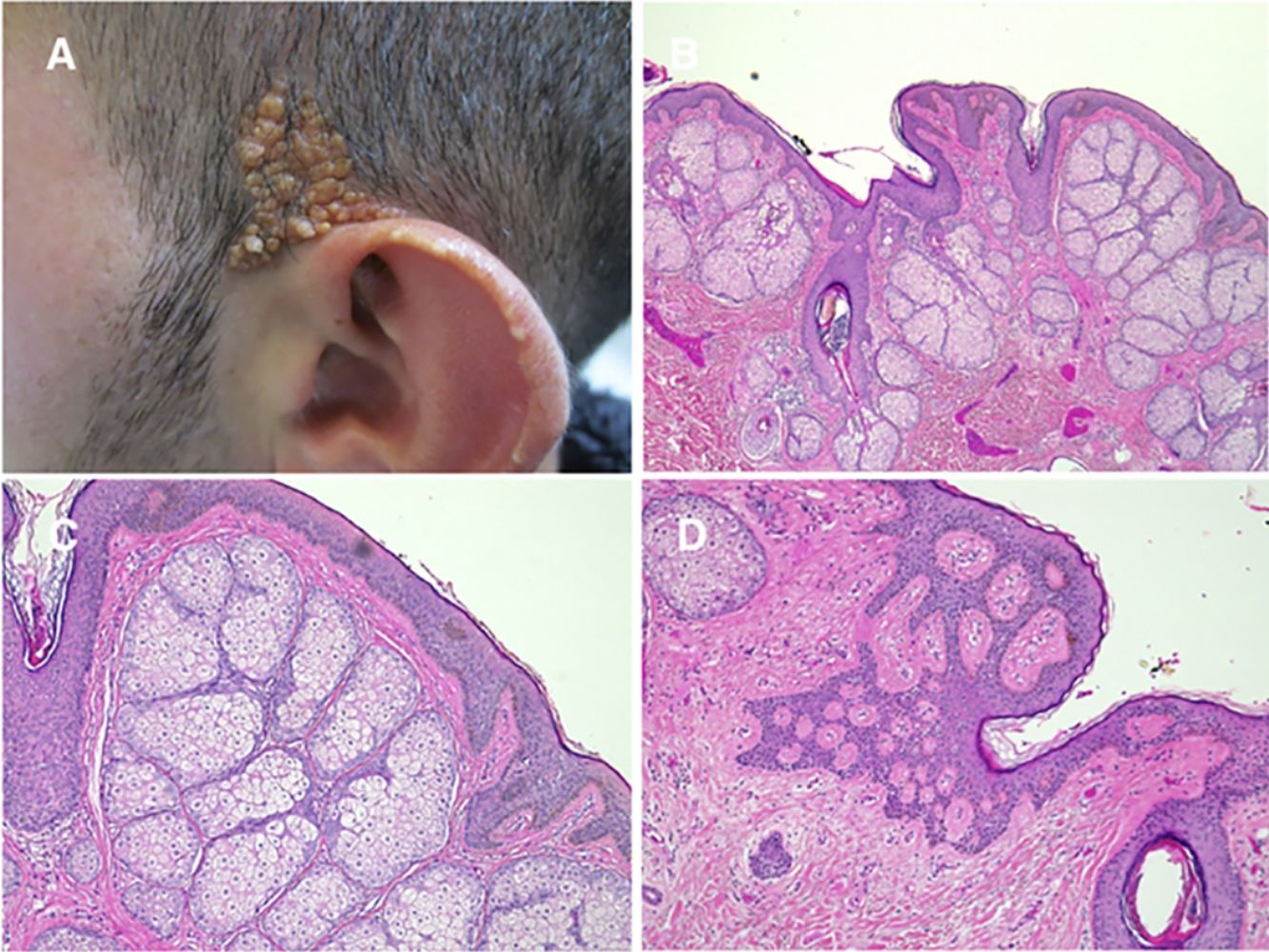
Nevus comedónico y nevus de MunroSe trata de una placa lineal con múltiples orificios foliculares dilatados siguiendo las líneas de Blaschko. Tiene una prevalencia de 1/45.000 a 1/100.00054. Suele aparecer al nacimiento y localizarse, por orden de frecuencia, en la cara, el cuello, el miembro superior y el tronco, incluyendo genitales. El «nevus del poro dilatado» sería una variante55. Algunos textos distinguen una forma no piogénica y otra caracterizada por la formación de quistes, pápulas, pústulas y abscesos, que se ha llamado nevus de Munro. Algunas formas piogénicas se producen por mutaciones en mosaico en el gen FGFR256,57. Este gen es el causante del síndrome de Apert (OMIM #101200), una enfermedad autosómica dominante caracterizada por craneosinostosis, sindactilia, hidrocefalia, retraso mental, hiperhidrosis y formas graves de acné en la cara y tronco. Recientemente se han descrito asimismo mutaciones en mosaico en el gen NEK9 en el nevus comedónico58. No está claro si las mutaciones en estos dos genes producen fenotipos diferentes.
El estudio histológico de la lesión muestra una epidermis acantótica con la presencia de invaginaciones que contienen lamelas de queratina concéntrica y que se corresponden con ostia foliculares, como se demuestra por la presencia de rudimentos de folículos, así como de pequeñas glándulas sebáceas y en ocasiones músculo erector. En algunas lesiones veremos la presencia de inflamación y cambios cicatriciales.
El desarrollo de tumores como carcinoma basocelular y queratoacantoma se ha descrito en algún caso aislado59,60. El síndrome del nevus comedónico asocia catarata ipsilateral, microcefalia, retraso mental, epilepsia, disgenesia del cuerpo calloso, alteraciones vertebrales como escoliosis, vértebras fusionadas, espina bífida, sindactilia, clinodactilia, polidactilia y oligodontia61, manifestaciones que ciertamente remedan a las del síndrome de Apert.
Hamartoma folicular basaloideEl hamartoma folicular basaloide es una lesión infrecuente. Clínicamente se manifiesta como pequeñas pápulas o placas del color de la piel. Es característica la alopecia en las zonas afectas. Se han descrito cinco variantes. En tres de ellas se producen lesiones generalizadas; una adquirida, asociada a enfermedades autoinmunes62-64, otra hereditaria asociada a otras lesiones cutáneas y manifestaciones extracutáneas65-68, y otra forma hereditaria sin ninguna asociación69. De las localizadas, existe una forma solitaria en forma de placa alopécica70, y otra forma lineal con una distribución blaschkoide. Muy recientemente se ha publicado una revisión de esta última variante71, en la que se describen tres pacientes que desarrollaron carcinoma basocelular en el hamartoma y un tricoblastoma. En relación con esta forma lineal, el síndrome de Happle-Tinschert se caracteriza por hamartomas foliculares basaloides distribuidos de forma segmentaria, junto a alteraciones óseas, dentales y cerebrales ipsilaterales72.
Los hallazgos histopatológicos son independientes de la variante clínica. Los folículos afectos se ven reemplazados por cordones epiteliales de dos o tres hileras de espesor que emergen radicalmente del eje folicular en forma de candelabro invertido. En algunas áreas se observan pequeños quistes infundibulares. El estroma es escaso y consiste en algunas fibras de colágeno entre algunos fibrocitos rodeando los cordones de células basaloides. Hay que hacer el diagnóstico diferencial con el tricoepitelioma y con el carcinoma basocelular infundíbulo-quístico.
Se desconoce la alteración molecular que puede provocar la aparición de estos hamartomas y las manifestaciones extracutáneas asociadas. Se ha demostrado que la expresión de PTCH1 está aumentada en el hamartoma folicular basaloide, pero es menor que en el carcinoma basocelular73.
Nevus de quistes tricolémicosLos quistes tricolémicos se presentan como nódulos en el cuero cabelludo, suelen ser múltiples y asocian antecedentes familiares. Histológicamente se caracteriza por una formación quística cuya pared está compuesta por varias capas de células y carece de capa granulosa. A diferencia del quiste infundibular, no se suele observar conexión con la superficie. Las células de la hilera periférica tienen un aspecto basaloide y se recubren de células que se van queratinizando y tornando más eosinófilas hacia la luz del quiste, dando lugar a una queratina compacta, ortoqueratósica, que contiene en ocasiones áreas de calcificación y cristales de colesterol.
Se ha descrito la aparición de quistes tricolémicos con una distribución blaschkoide, lo que se ha llamado nevus de quistes tricolémicos74, nevus comedónico con quistes tricolémicos75 y nevus epidérmico con quistes tricolémicos76. También se ha descrito en asociación con un nevus sebáceo77. El síndrome tricolemocístico se ha descrito en una paciente de 31años con placas lineales con múltiples quistes tricolémicos generalizadas, hiperqueratosis filiformes, comedones, osteomalacia grave y múltiples fracturas desde los 17años de edad74.
Nevus apocrinosNevus apocrino (hiperplasia glandular apocrina hamartomatosa)Se trata de lesiones nodulares o pediculadas cuya localización más frecuente es la axila. También se han descrito en la cara, el cuero cabelludo, el tórax o la región inguinal. La mayoría de las lesiones se diagnostican en adultos. En los casos pediátricos, las lesiones aumentaron de tamaño en la pubertad78.
Histológicamente veremos glándulas apocrinas maduras y estructuras ductales imbuidas en un estroma fibroso que se extienden desde la dermis superior hasta el tejido subcutáneo. Las luces glandulares están revestidas por un epitelio de células cuboidales o columnares rodeadas de una capa de células mioepiteliales. Las células secretoras muestran la característica secreción por decapitación. Se han descrito casos de transformación maligna79,80.
Siringocistadenoma papilíferoSe trata de una lesión nodular solitaria o bien de un grupo de pápulas o nódulos alineados siguiendo un trayecto blaschkoide. Se localiza preferentemente en la cabeza, aunque también puede encontrarse en la cara, el cuello, el tronco y las extremidades. En la mitad de los casos está presente al nacer y en un 15-30% se diagnostica antes de la adolescencia. En la pubertad o en el embarazo la lesión crece y la superficie se torna papilomatosa. El aspecto histológico es característico. A pequeño aumento se pueden ver invaginaciones con proyecciones papilares que conectan con la superficie de la epidermis mediante epitelio infundibular. La epidermis que recubre la parte más superficial puede verse acantótica, incluso con paraqueratosis. El epitelio que rodea las cavidades quísticas está formado de dos capas: células columnares que se orientan hacia la luz, en la que a veces podemos ver secreción por decapitación, y células basales cuboidales en contacto con un estroma rico en células plasmáticas.
Además del nevus sebáceo, se ha descrito en asociación con otros nevus o tumores benignos apocrinos. Respecto a su patogenia, hace unos años se encontraron deleciones del gen PTCH y p1681. Más recientemente se ha descrito la mutación V600E del gen BRAF en la mitad de los siringocistoadenomas papilíferos esporádicos82,83. Se ha descrito recientemente el caso de un niño con un astrocitoma anaplásico congénito, un siringocistoadenoma papilífero lineal y alteraciones oculares en el que se detectó la mutación tanto en el tumor como en la lesión cutánea, no detectándose en sangre periférica ni en la piel no lesional. En este caso, el paciente se benefició del tratamiento con vemurafenib84.
Nevus ecrinosNevus ecrinoSe han descrito como lesiones nodulares, en placa o siguiendo una distribución lineal. Es característica la hiperhidrosis. En algunos casos no se aprecia lesión en la piel y se manifiesta únicamente como una hiperhidrosis localizada85. La mitad de las lesiones descritas se localizaban en el antebrazo. Histológicamente, veremos un aumento de las glándulas ecrinas en zonas anatómicas donde no deberían ser tan numerosas. Algunos casos presentan una leve acantosis e hiperqueratosis en la epidermis suprayacente86. El nevus ecrino mucinoso muestra un estroma rico en mucina como única característica diferencial. En general, el nevus ecrino no se asocia a manifestaciones sistémicas, si bien en un único caso asociaba con otras manifestaciones cutáneas y oftalmológicas87.
Hamartoma angiomatoso ecrinoSe trata de una lesión caracterizada por el crecimiento hamartomatoso de elementos ecrinos y vasculares intermezclados. Se manifiesta como una lesión nodular o en placa única de coloración azulada, en ocasiones con telangiectasias88. Se han descrito casos de aspecto verrugoso, planteando el diagnóstico diferencial de un hemangioma verrugoso89. Se localiza frecuentemente en las extremidades de niños y asocia a veces dolor e hiperhidrosis. La mayoría se presentan al nacer o poco después, aunque hasta un tercio de los casos se diagnosticaron en la edad adulta en alguna serie90.
Histológicamente veremos una hiperplasia de glándulas ecrinas normales o dilatadas, con la presencia de focos de angiomatosis capilar y presencia variable de estructuras foliculares, lipomatosas, mucinosas, apocrinas y/o linfáticas90. Muchos autores piensan que se trata de una malformación primariamente vascular91. A favor de esta teoría, numerosas lesiones se han descrito acompañando tumores o malformaciones vasculares89,90.
Nevus ostial anexial poroqueratósicoEl término nevus ostial anexial poroqueratósico ha sido propuesto para englobar dos entidades que se solapan clínica e histológicamente: el nevus ecrino poroqueratósico y el nevus ecrino y del folículo piloso poroqueratósico92. Se trata de pápulas queratósicas o verrucosas en las que se observan pequeñas cavidades que se rellenan con queratina, parecidas a los comedones. Se distribuyen de forma lineal siguiendo las líneas de Blaschko. Se han descrito formas bilaterales e incluso generalizadas. Tienden a la distribución acral, y se pueden afectar las uñas. Solo cuando se trata de lesiones extensas se afectan el tronco, la cabeza y el cuello. Se puede asociar a anhidrosis y alopecia. Histológicamente se observan lamelas cornoides centradas en los acrosiringios o en los infundíbulos foliculares, que aparecen dilatados y sin capa granulosa. La epidermis muestra acantosis, hiperqueratosis y papilomatosis. Se han descrito casos de carcinoma de células escamosas y enfermedad de Bowen asociados92,93.
Recientemente se han descrito mutaciones en el gen GJB2 que codifica para la conexina26 en el nevus ecrino poroqueratósico94. Hoy en día se considera que este nevus es una forma en mosaico del síndrome KID (OMIM #148210), una enfermedad autosómica dominante caracterizada por eritroqueratodermia congénita, ictiosis lamelar, hiperqueratosis palmoplantar, hipotricosis, hipohidrosis, infecciones cutáneas de repetición, sordera y alteraciones oculares y musculoesqueléticas. Las lesiones en la piel comparten hallazgos clínicos e histopatológicos con el nevus ecrino poroqueratósico. El caso de niña con síndrome KID cuya madre presentaba nevus ecrino poroqueratósico apoya esta hipótesis95.
Nevus de BeckerSe trata de una mancha color marrón claro, de bordes geográficos, localizada en el tronco o en el hombro, que suele manifestarse en la segunda década de la vida. En los varones, más de la mitad de las lesiones desarrollan pelo grueso y oscuro a partir de la pubertad. Tiene una prevalencia del 0,5%. Se han descrito casos familiares. La creencia de que es más frecuente en varones ha sido desmentida recientemente y se cree que es fruto de una menor visibilidad de la lesión en las mujeres por ser dependiente de andrógenos96.
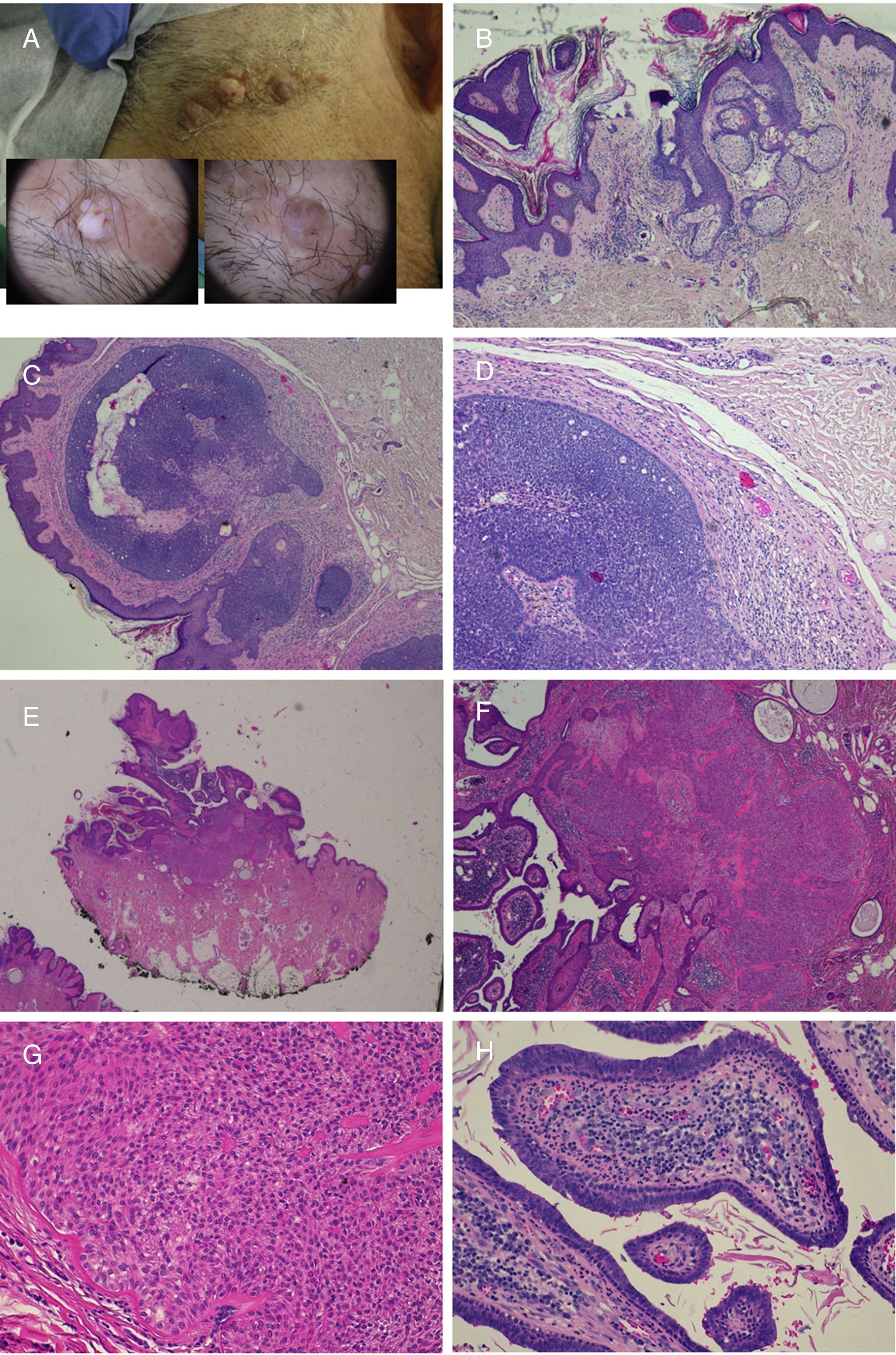
Se trata de un hamartoma organoide incluido en el grupo de los nevus epidérmicos61 y que presenta muchas características singulares. Se distribuye con un patrón arquetípico en parches o en tablero de ajedrez. Histológicamente se caracteriza por una acantosis con prolongación de las crestas interpapilares, en la que se ha demostrado una hiperplasia melanocítica. En la dermis reticular, además de un incremento en el número de folículos pilosos, se observa con frecuencia un aumento de las fibras de músculo liso que recuerdan al hamartoma de músculo liso, con el que para algunos constituye un espectro de lesiones (fig. 6)97. El reciente descubrimiento de mutaciones en el gen ACTB —letales si se dan en el zigoto— que se encuentran exclusivamente en las fibras musculares de biopsias de nevus de Becker ha dado lugar a la teoría de que su origen está en una alteración en el linaje mesenquimal98.
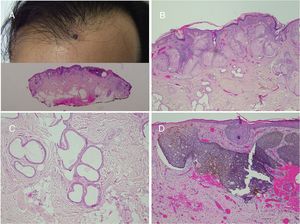
Nevus de Becker. A)Imagen clínica. B(HE, 4×): imagen panorámica que muestra la presencia de acantosis, hiperpigmentación de la basal y la presencia de fibras de músculo liso en la dermis reticular. C(HE, 10×): detalle de los cambios epidérmicos. D(HE, 10×): detalle de la presencia de fibras de músculo liso en la dermis reticular.
En menos del 5% de los casos asocia hipoplasia mamaria ipsilateral, hipoplasia de la musculatura subyacente, lipoatrofia y alteraciones esqueléticas como escoliosis, hemivértebras, costillas fusionaras o accesorias, pectus excavatum o carinatum y torsión tibial interna (síndrome del nevus de Becker)96,99.
ConclusiónLos últimos descubrimientos en el campo de la genética están cambiando la clásica concepción morfológica de los nevus epidérmicos. Desde esta perspectiva, puede que en un futuro próximo clasifiquemos a nuestros pacientes con nevus epidérmicos desde un punto de vista genético y podamos proporcionarles mucha más información en relación con la asociación a manifestaciones extracutáneas, desarrollo secundario de tumores o incluso consejo genético reproductivo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Esta revisión se ha elaborado como trabajo final del I Master Internacional en Dermatopatología y Correlación Clínica, dirigido por los doctores Jesús Cuevas y Pedro Jaén. Agradecemos su interés docente y su ánimo para dar difusión al trabajo.
Agradecemos a la doctora Gabriela Corte, jefa de servicio de Anatomía Patológica del Hospital de Manacor, por su colaboración en la recolección de casos para ilustrar este trabajo.