Entre el 10 al 15% de los pacientes medicados desarrollan reacciones adversas a medicamentos (RAM). A pesar de la alta prevalencia de RAM, la identificación del agente causal es un desafío diagnóstico y terapéutico, principalmente en pacientes que reciben múltiples medicamentos. Nuestro objetivo es actualizar los métodos de diagnóstico para identificar el fármaco desencadenante de RAM de tipo B que comprometa piel y/o mucosas, a fin de optimizar el seguimiento y la calidad de vida del paciente. Desarrollamos la revisión en dos etapas: I- repasamos los mecanismos fisiopatológicos de las RAM; II- desarrollamos el abordaje clínico para la identificación del desencadenante.
It is estimated that 10% to 15% of medicated patients develop adverse drug reactions (ADR). Despite the high prevalence of ADR, the identification of the trigger drugs remains a medical challenge, mainly in polymedicated patients. Our goal is to update the diagnostic tools to identify enhancer drugs of type B-ADR that compromise the skin and /or mucous membranes, in order to optimize patients’ follow-up and improve their quality of life. We develop the review in two stages: I- we review the pathophysiological mechanisms of the ADR; II- we developed the clinical approach for the identification of the triggering drug.
La OMS define una reacción adversa a medicamento (RAM) como una respuesta nociva y no intencionada, que se produce a dosis normalmente utilizadas en seres humanos para profilaxis, diagnóstico o tratamiento de una enfermedad o para modificar una función fisiológica.
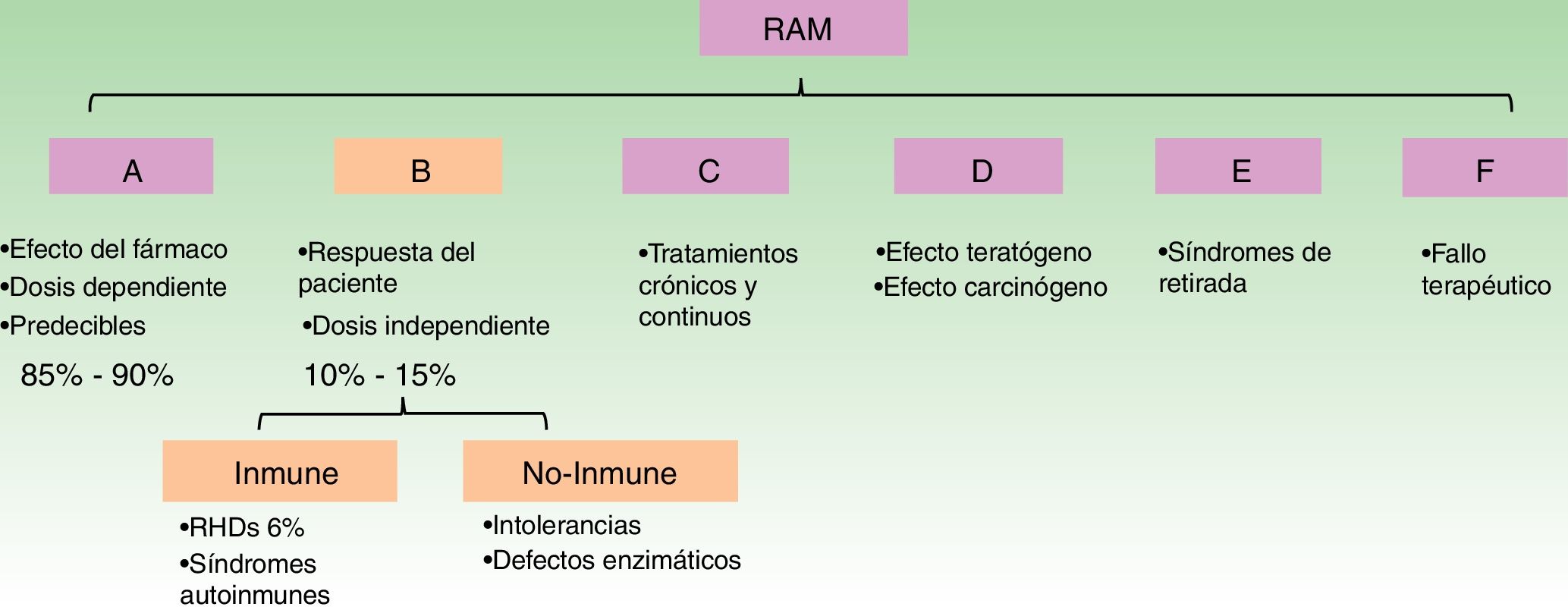
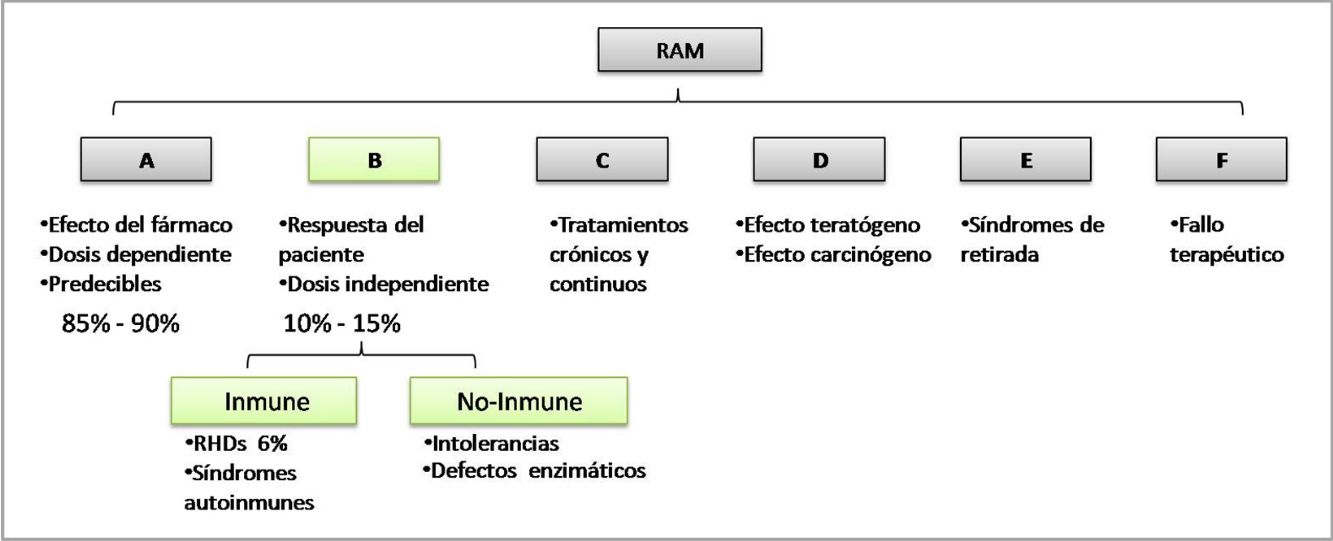
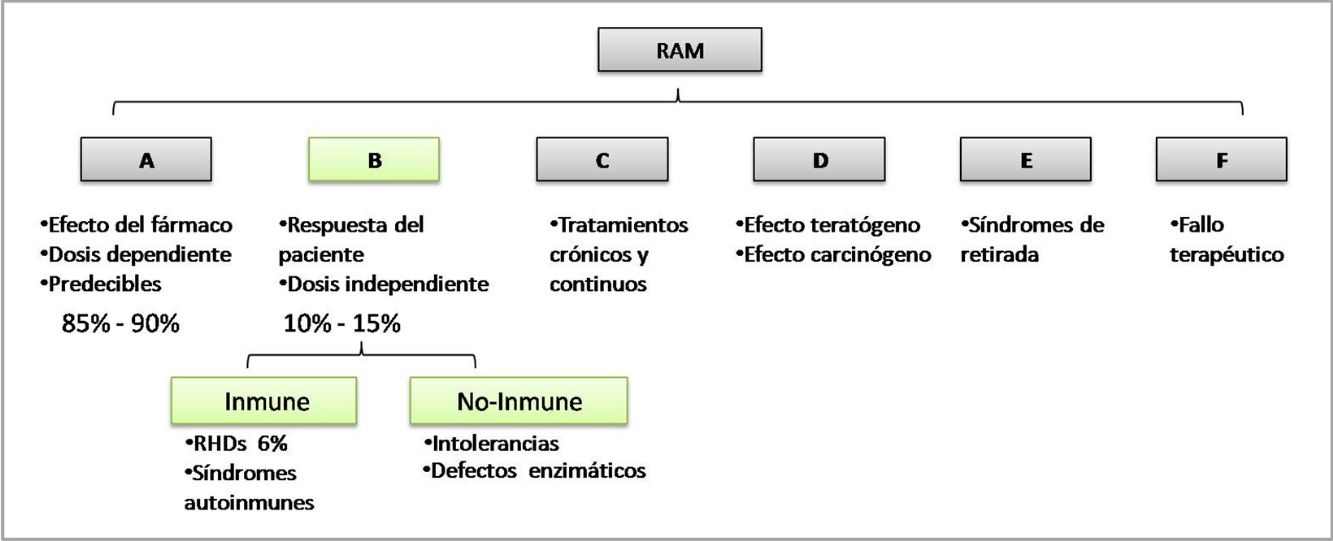
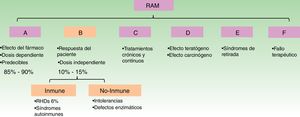
La OMS clasifica a las RAM según el mecanismo fisiopatológico de la «A» a la «F». Las reacciones de tipo B no son predecibles por el mecanismo de acción del fármaco, y dependen de la susceptibilidad del paciente, se las conoce como reacciones idiosincráticas, pueden ser de causa inmunológica o no inmunológicas (fig. 1)1.
Las RAM tienen manifestaciones muy variadas, dentro de ellas el compromiso cutáneo es el más frecuente. Se define RAM de compromiso cutáneo (RAMc) cuando afecta a la piel y/o a las mucosas o anejos2. Las RAMc se clasifican de distintas formas; recordamos las entidades acorde a la gravedad clínica (fig. 2).
Se estima que un 10% a un 15% de los pacientes medicados desarrollan RAM3. Representan el 3,5% de las causas de ingreso en Europa4, y en Estados Unidos se calculan 197.000 muertes anuales a causa de ellas. A pesar de la alta prevalencia la identificación del agente causal continúa siendo un desafío diagnóstico5.
Nuestro objetivo es actualizar las herramientas para identificar el fármaco desencadenante de RAMc de tipo B que comprometa la piel y/o las mucosas, con el fin de optimizar el seguimiento y la calidad de vida del paciente (ver material adicional en el anexo 1).
Fisiopatogenia de las reacciones adversas a medicamentos: aspectos inmunológicosAlgunos mecanismos fisiopatológicos, como las reacciones de hipersensibilidad a fármacos (RHF), se encuentran bien descritas6. Otros, como la inducción de síndromes autoinmunes por fármacos (lupus eritematoso, el penfigoide ampollar o la dermatitis ampollar IgA), el eritema fijo pigmentario o la anafilaxia no inmune no se conocen en detalle.
Actualmente a las RAM tipo B de causa inmunológica, según el mecanismo fisiopatológico, se las clasifica en 3 grupos6: RHF o alergias, reacciones tipo P-I (independientes de presentación antigénica), pseudoalergias (reacciones tipo anafilaxia no mediadas por IgE).
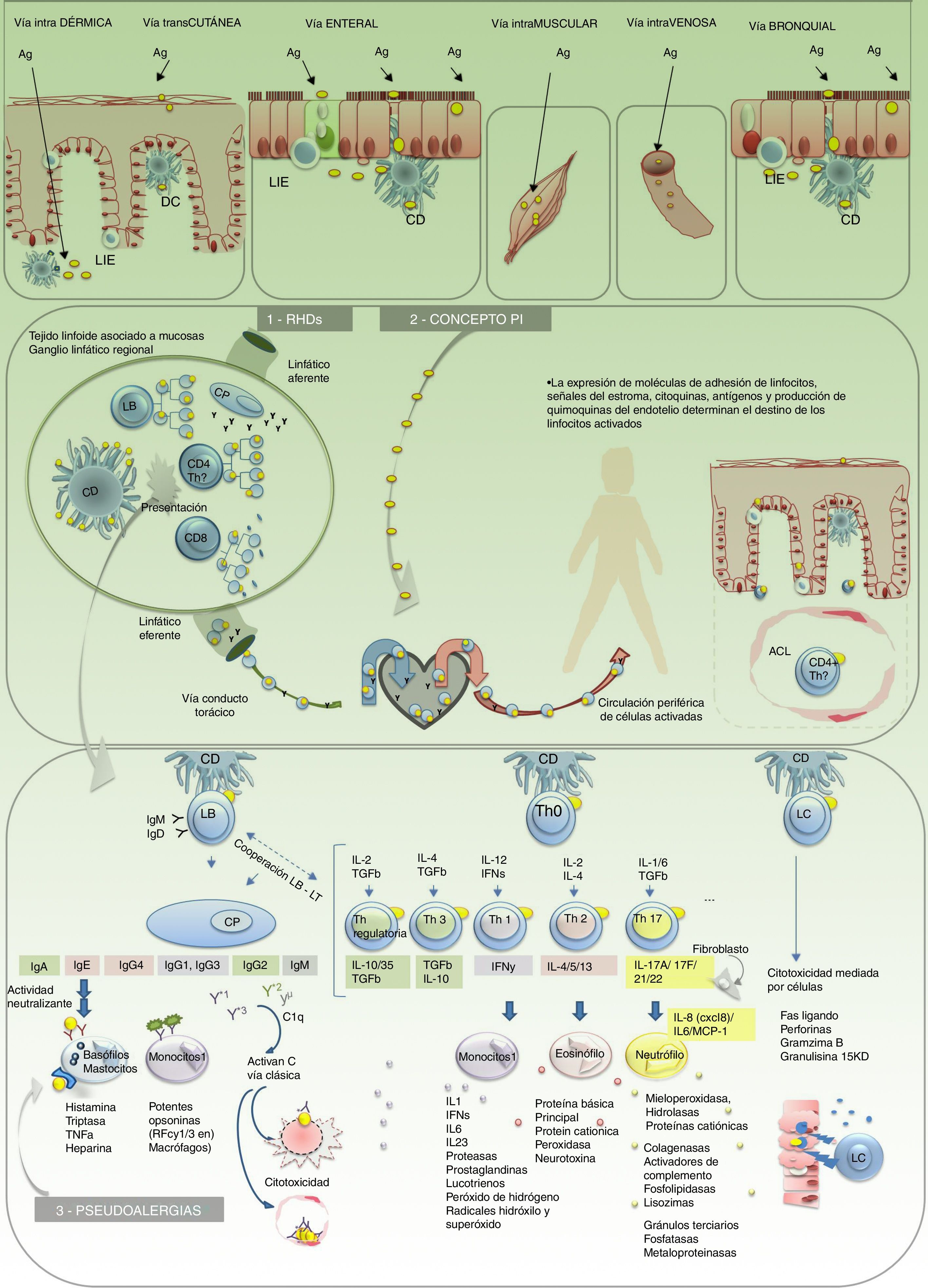
Reacciones de hipersensibilidad a fármacos (fig. 3)Las RHF afectan a más del 6% de la población5.
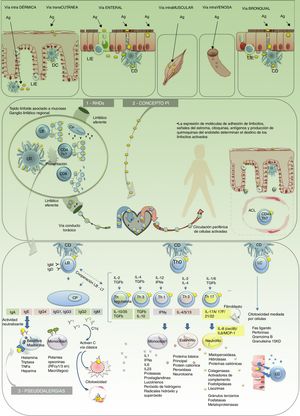
Modelo fisiopatológico de las reacciones adversas a fármacos. 1. Reacción de hipersensibilidad a fármacos (RHF). 2. Concepto P-i. 3. Pseudoalergias. Ag: antígeno; CD: célula dendrítica; CLA: antígeno linfocitario cutáneo; CP: plasmocito; LB: linfocito B; LC: linfocito citotóxico; LIE: linfocito intraepitelial.
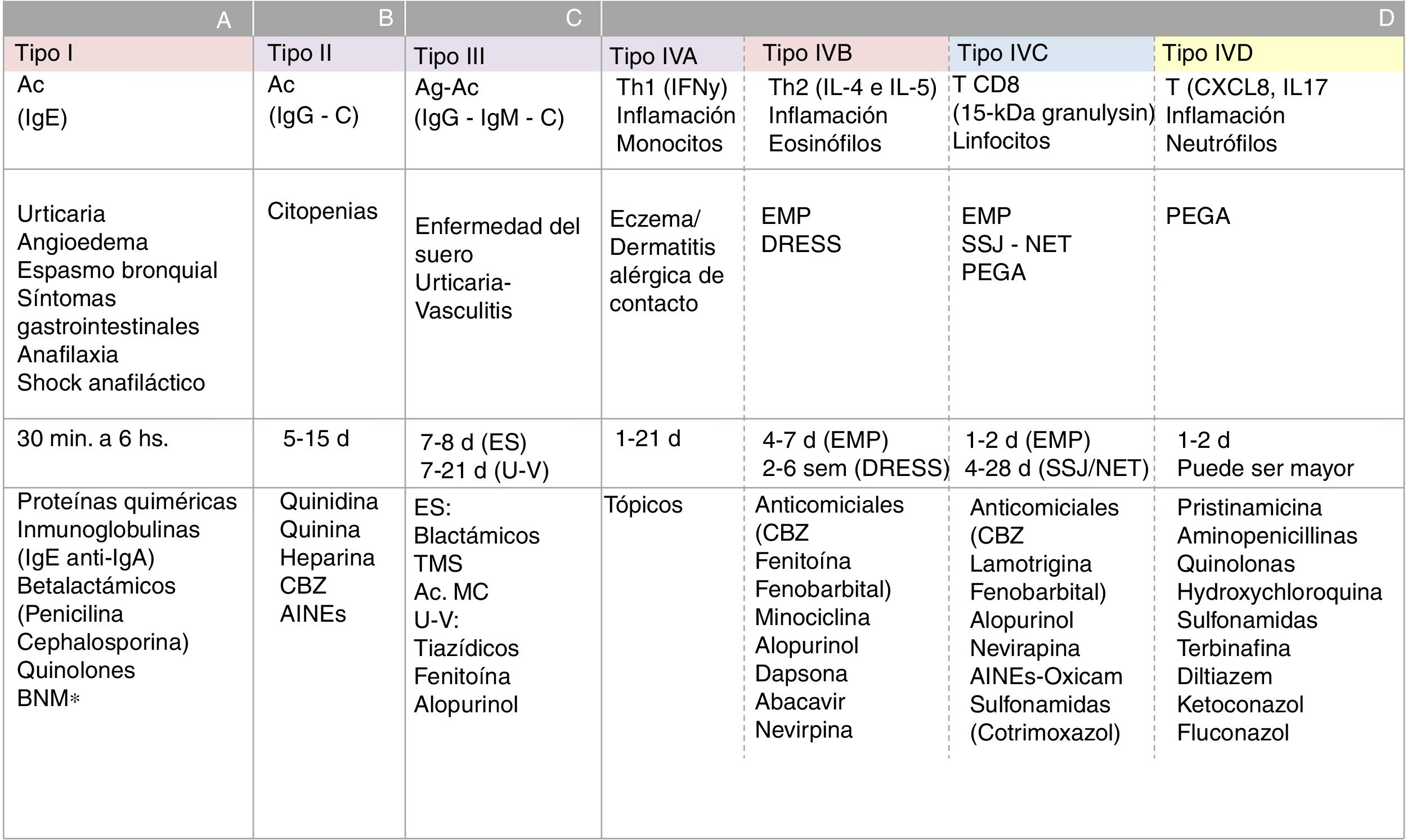
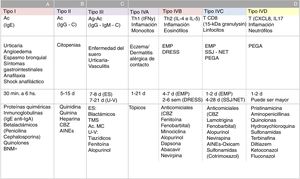
Todas las reacciones de hipersensibilidad se inician en una etapa de sensibilización, en la que intervienen el antígeno, la célula que lo procesa y presenta en su HLA (célula presentadora) y el linfocito T que lo reconoce a través del TCR (receptor de célula T). La vinculación inicial de estos 3 elementos conforma un complejo trimolecular (HLA-antígeno-TCR), que se conoce como «primera señal». Esta interacción genera una serie de cambios moleculares llamados «segunda señal», los cuales determinan la ejecución de una respuesta efectora celular o humoral (mediada por linfocitos T y B) y la generación de memoria inmunológica antígeno específica. Cuando los fármacos se comportan como antígenos (o haptenos) pueden desencadenar RHF. Existen distintos tipos de reacciones de hipersensibilidad. La clasificación de las reacciones de hipersensibilidad por Gell y Coombs, modificada por Pichler, sintetiza los mecanismos fisiopatológicos de las RHF (fig. 4)7. El tipo de reacción que se desencadena está determinada principalmente por la naturaleza del antígeno y el entorno de citoquinas. Este último varía según el perfil funcional del órgano involucrado en la reacción, la vía de administración del fármaco y el estado de activación inmunológico del individuo. Por ejemplo, los fármacos con propiedades antigénicas que se administran por vía cutánea o mucosa, en ambas situaciones se encuentran con tejidos de interfaz o frontera muy ricos en células inmunes, pero fisiológicamente adaptados para cumplir distintas funciones (distinto perfil funcional). En la piel, la activación de los linfocitos intraepiteliales se vinculan a perfiles inflamatorios de defensa y opsonización. Mientras que la mucosa del tracto digestivo se vincula al desarrollo de respuestas de tolerancia y neutralización, por activación del perfil Th3, T regulatolarias y abundante IgA (globulina neutralizante). Sin embargo, cuando la barrera mucosa se altera y se vuelve inflamatoria (estado de activación inmunológico del individuo) o fallan los mecanismos moduladores el paciente es propenso a perder tolerancia periférica y desarrollar respuestas de hipersensibilidad. Es así como un antígeno que ha ingresado por vía digestiva puede convertirse en un alérgeno y da síntomas localmente o a distancia. Lo mismo puede ocurrir en la piel, cuando se altera la barrera cutánea, como ocurre en la dermatitis atópica, y se torna más susceptible de padecer dermatitis alérgicas de contacto (reacción de hipersensibilidad tipo IV-A)8.
Clasificación de las reacciones de hipersensibilidad en relación con la fisiopatogenia de reacciones adversas a medicamentos. A: reacciones de hipersensibilidad tipo i; B: reacciones de hipersensibilidad tipo ii; C: reacciones de hipersensibilidad tipo iii; D: reacciones de hipersensibilidad IVA, IVB, IVC y IVD; BNM: bloqueantes neuromusculares; d: días.
Bajo este concepto se explican RAM tipo B sin existir una etapa de sensibilización. En estos casos se postula que la primera señal está dada por la interacción directa del HLA-fármaco o TCR-fármaco, independiente de procesamiento y presentación por parte de una célula presentadora, conformando así un complejo bimolecular y reversible, a diferencia de la presentación clásica trimolecular de las RHF. En las reacciones P-i, a falta de la influencia de la célula presentadora para el desarrollo de la segunda señal, se proponen distintas teorías: 1) que las reacciones P-i solo se dan en células T estimuladas por otro antígeno (infecciones crónicas o quienes padecen enfermedades autoinmunes); 2) que el fármaco se una al HLA y provoca un cambio en la conformación, generando un nuevo HLA para el cual el individuo no presenta tolerancia (como sucede en la respuesta a aloantígenos en trasplante de órganos)9; y 3) que la segunda señal esté dada por la interacción propia del fármaco y receptor blanco, cuando este tenga actividad sobre células presentadoras10. Por cualquiera de estos 3 mecanismos sería posible que se llegue a la activación de la célula efectora. A diferencia de las reacciones de hipersensibilidad, las reacciones p-i activarían respuestas únicamente celulares mediadas por linfocitos T y no humorales. Clínicamente se pueden presentar como cualquiera de las RAM mediadas por inmunidad celular como el exantema maculopapular, el síndrome de Steven Johnson (SSJ), la necrólisis epidérmica tóxica (NET), el síndrome de reacción por fármacos con eosinofilia y síntomas sistémicos6.
Pseudoalergias (fig. 3)Son similares a las RHF tipo-i, provocadas por degranulación de mastocitos y basófilos, pero por mecanismos independientes de IgE. Dentro de estas reacciones se encuentra el síndrome de hombros rojos por la infusión rápida de vancomicina. Están asociadas a fármacos catalogados liberadores de histamina tales como los expansores plasmáticos, antiinflamatorios no esteroideos y pirazolonas. Se conoce poco de la fisiopatogenia y no hay test específicos para estudiarlas.
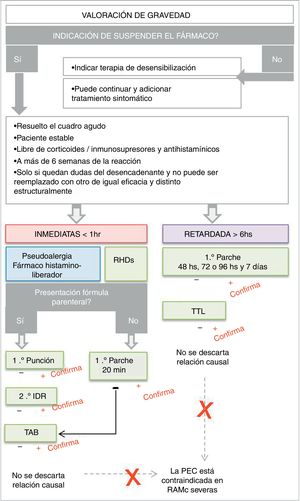
Abordaje clínico de las reacciones adversas a medicamentosSi bien este no es un artículo que pretende abordar el tratamiento de las RAMc, es importante destacar que las RAMc graves obligan a actuar ante la sospecha clínica, y se debe suspender la administración del fármaco sospechoso de inmediato y no esperar la confirmación del mismo.
Historia clínica adecuadaLa historia clínica debe orientarse hacia la identificación del fármaco5. Los objetivos principales a incluir son:
- •
Información exhaustiva del evento.
- •
Posible/s desencadenante/s. Fármaco, hierba o formulación homeopática, químicos por exposición laboral o pasatiempo.
- •
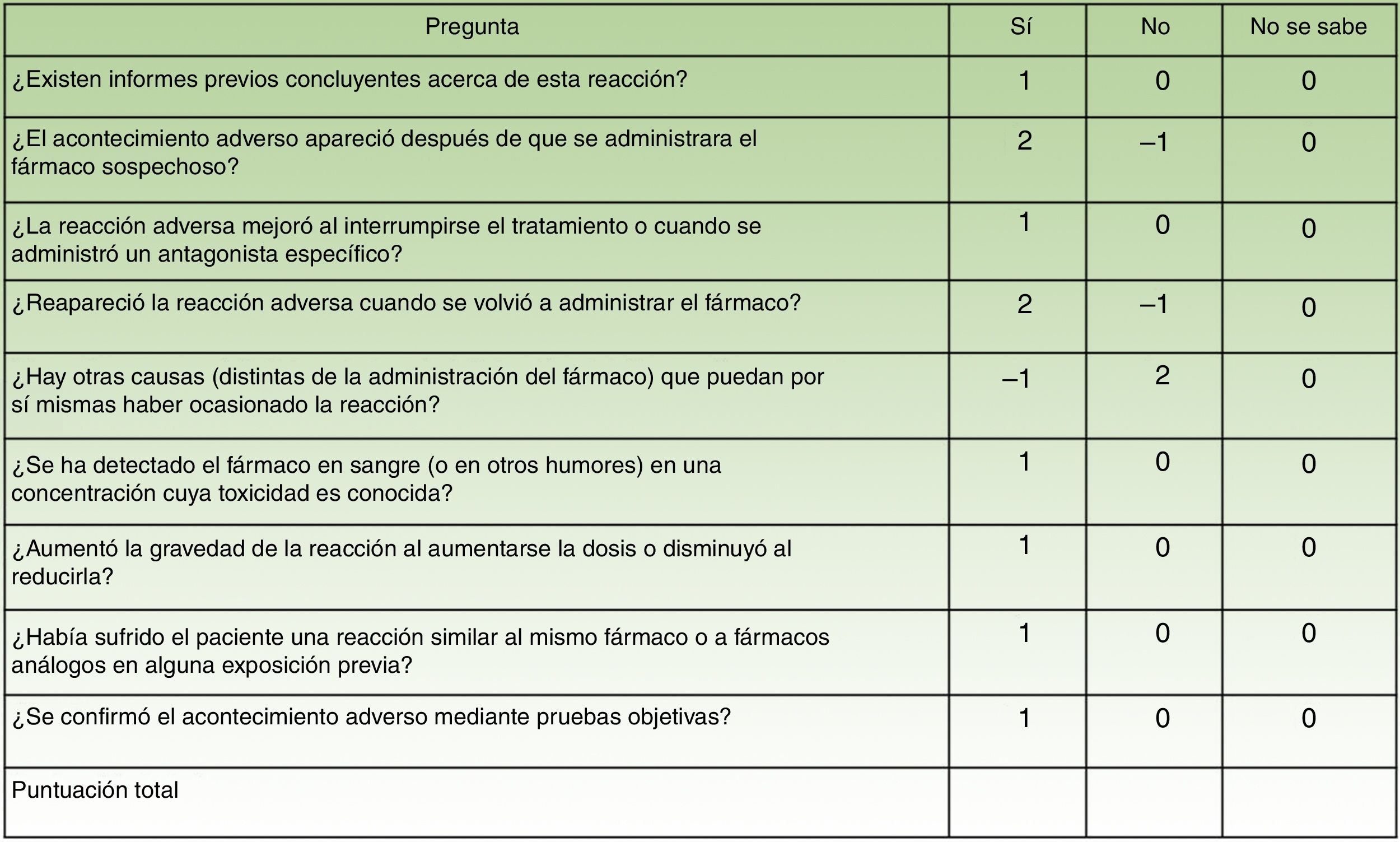
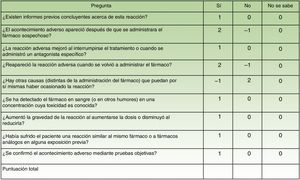
De cada fármaco sospechoso es indispensable establecer la relación causal con la reacción (Escala de Naranjo [fig. 5])11.
- •
Acorde a la presentación clínica del episodio y la vinculación temporal con el fármaco sospechoso se puede presumir el mecanismo patogénico implicado.
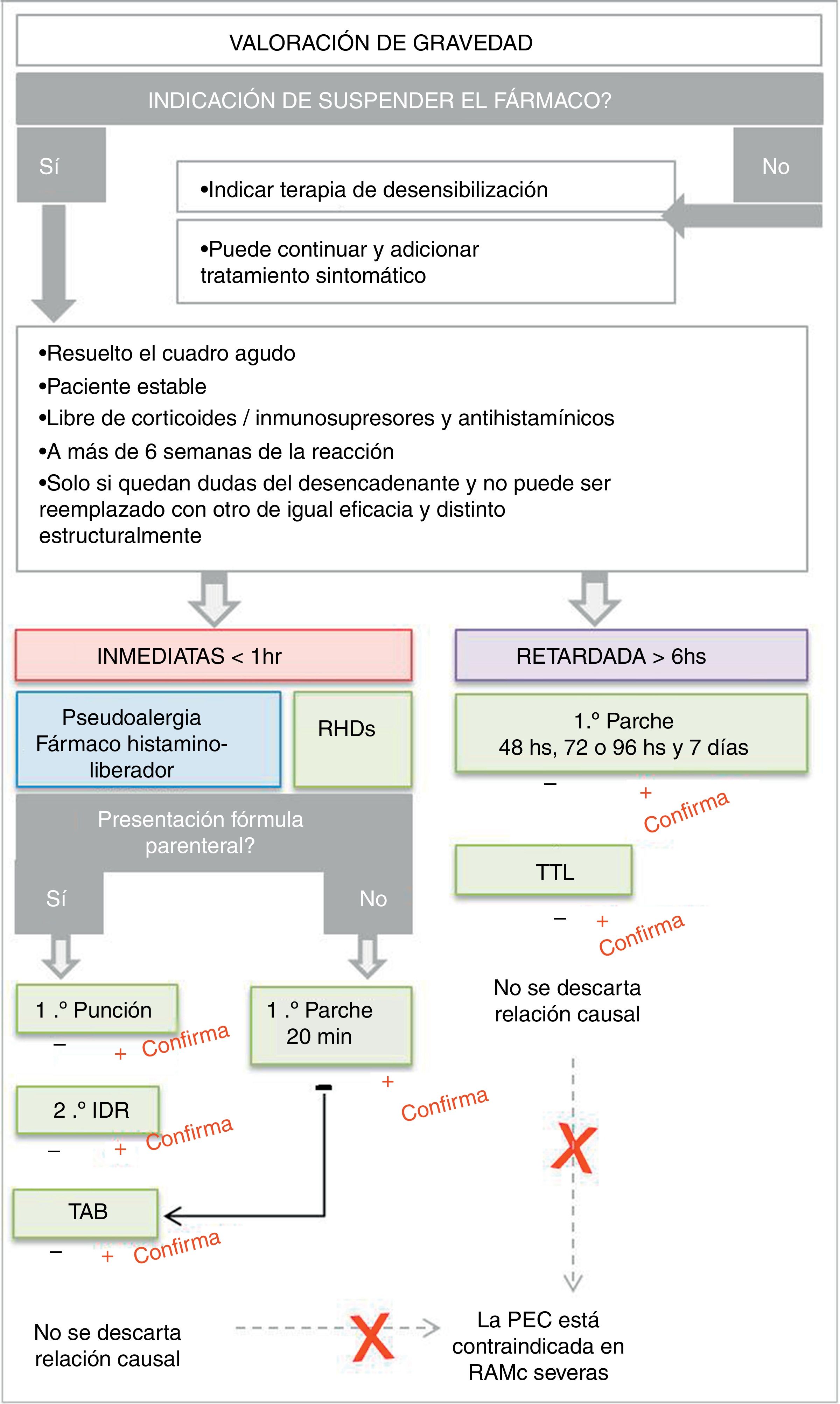
Si del análisis de causalidad quedan dudas de la identificación del fármaco provocador podremos recurrir a pruebas diagnósticas. Únicamente se someterán a pruebas de diagnóstico cuando no exista una alternativa terapéutica igual de efectiva para reemplazar el fármaco y la relación beneficio/riesgo sea favorable. Se deben esperar 4 a 6 semanas de la resolución completa y el paciente debe encontrarse totalmente estable y libre de medicación inmunosupresora o modificadores cardiovasculares (bloqueadores beta) para reacciones inmediatas. No se someterán a estudio: a) error en el establecimiento de una relación causal o etiológica (de cronología, con tolerancia posreacción, reacción sin exposición); b) cuando existe un diagnóstico alternativo que explique la reacción (erupción viral); y c) ante una posible reacción grave no controlable y potencialmente mortal; d) nunca se realizan pruebas de RHF preexposición.
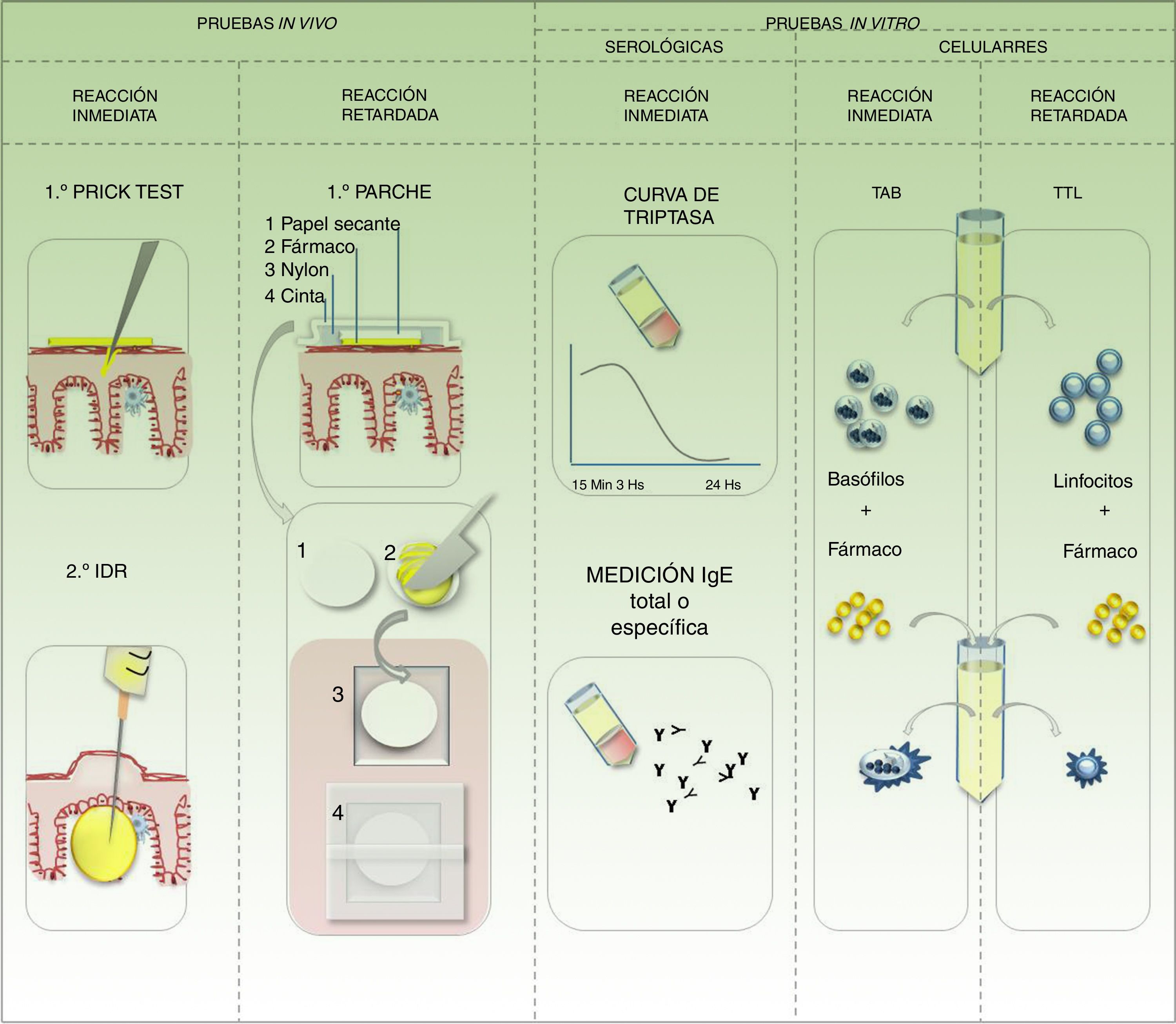
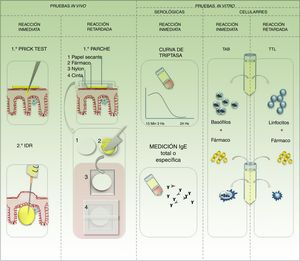
Estudios in vivo disponibles para identificar el fármaco desencadenante de una reacción de hipersensibilidad5,12,13Prueba de punción o prick testEs de elección cuando se sospecha una RHF tipo-i. Requiere la aplicación del fármaco en presentación inyectable sobre la piel sana del antebrazo, y sobre este la realización de una punción superficial. Se puede probar el medicamento sospechoso, aunque lo más conveniente es probar el principio activo y los excipientes por separado. De haber padecido una reacción urticariana se aconseja iniciar con diluciones seriadas (10−3, 10−2, 10−1). Se deben aplicar controles: negativo (con solución fisiológica 0,9%) y positivo (con histamina a 10mg/ml). Se considera una respuesta positiva cuando presenta una pápula de 3mm de diámetro a los 20minutos en el sitio de punción con el fármaco sospechoso, y el control negativo no evidencia reacción. Este resultado confirma una RHF tipo-i, evidenciando in vivo la presencia de IgE especifica. Si fuera un fármaco histaminoliberador podría corresponder a un falso positivo por pseudoalergia. Un resultado negativo de test de punción nunca descarta la relación causal (fig. 6).
IntradermorreacciónTras un resultado negativo de la prueba de punción, con una fuerte sospecha clínica de RHF tipo-i se puede realizar la intradermorreacción. Se debe aplicar el fármaco a concentraciones estipuladas por guías internacionales. Las diluciones deben prepararse con solución fisiológica al 0,9% a no más de 2horas de su aplicación, y en condiciones de asepsia bajo flujo laminar. Si la dilución de prueba no se encuentra descrita se debe iniciar con concentraciones 10-4 e ir disminuyendo de a un cero a no más de 0,04ml de solución, lo que genera una pápula intradérmica de 4 a 6mm de diámetro. La lectura de la reacción se realiza a los 30minutos, 6horas y 24horas. El paciente queda bajo vigilancia las primeras 6horas con especial cuidado de la frecuencia del pulso y presión arterial. Se recomienda realizar la prueba con un acceso venoso periférico colocado y la infusión de solución glucosada. Si a los 30minutos se genera una pápula de 10mm se reconoce como resultado positivo. Si pasados estos 30minutos aún no se evidencia reacción se puede aumentar la concentración hasta alcanzar la concentración pura. Una reacción dentro de las primeras 6horas confirma una RHD-tipo-i. Se debe tener en cuenta también la posibilidad de falsos positivos por pseudoalergia. Cuando aparece la reacción de modo tardío se confirma una RHF retardada, y debe consignarse la medida de la pápula en la historia clínica y controlar nuevamente a la semana. Si la reacción temprana fue negativa también se recomienda contactar al paciente a la semana para reconfirmar la negatividad. La negatividad de la prueba no descarta la asociación causal (fig. 6).
Prueba del parche o patch testEs de elección cuando se sospecha clínicamente una reacción retardada. Aunque es menos sensible que las 2 anteriores para las reacciones inmediatas, puede ser una alternativa si no se dispone de una formulación inyectable. Idealmente se debe probar el principio activo, los excipientes por separado. La concentración a la que se debe formular se encuentra estandarizada. Cuando se desconoce, el fármaco puro se formula al 5% o 10%. De no tener acceso al fármaco puro (principio activo) se puede probar la forma farmacéutica sospechosa al 30% como máximo, y no puede conservarse la preparación más de 24horas. En caso de poseer cápsula esta debe probarse por separado previa hidratación y disolución. En este caso, usando la forma farmacéutica sospechosa ante un resultado positivo, no se podrá discriminar si el alérgeno es un excipiente o el principio activo. Para disminuir el riesgo de falsos positivos por irritación se deben formular los fármacos en vaselina y/o agua destilada. De no usar un sistema comercial se debe ser cuidadoso en la preparación artesanal (fig. 6). Se debe aplicar la formulación sobre piel sana del antebrazo o el dorso y esperar 20minutos para la primera lectura. Esto despeja la posibilidad de alergia inmediata o reacción irritante. El parche se mantiene ocluido por 48horas. Cumplidas, se destapa, se quita el excedente sin friccionar, se esperan 20minutos al aire libre y se realiza la primera lectura de fase tardía. Luego se realizan lecturas a las 72 o 96horas y posteriormente a la semana. Si se sospecha de una fotoalergia inducida por el fármaco se debe probar el fármaco en un parche y el fármaco con fotoestimulación a las 48horas (UVA 5j/cm2) en un parche por separado. Si se está probando una reacción de eritema fijo pigmentario se debe realizar un parche sobre piel sana y otro en el área del eritema fijo. Una repuesta positiva implica desde una reacción leve con eritema y edema, hasta una reacción intensa con vesículo-ampollas o erosiones. Sin importar el grado de reacción una prueba positiva confirma la RHF. Sin embargo, una reacción negativa no descarta la relación causal. La prueba del parche es útil para probar reacciones como exantemas maculopapulares, pustulosis exantemática generalizada aguda, reacción a fármacos con eosinofilia y síntomas sistémicos o el exantema intertriginoso y flexural simétrico por fármaco. La sensibilidad varía de acuerdo al fármaco y a la forma clínica de la reacción. Barbaud et al., en una serie de 134 pacientes, demostraron una sensibilidad global de la prueba cercana al 60%. Pierde sensibilidad en exantemas maculares (eritema fijo pigmentario), reacciones urticarianas y formas exfoliativas (SSJ-NET). No son útiles en reacciones órgano específicas14.
Pruebas de exposición controladaLa prueba de exposición controlada (PEC) está contraindicada en RAMc graves, y solo se debe realizar cuando sea improbable clínicamente que el fármaco sospechoso sea el causante. La mayoría de las veces esta prueba de exposición ocurre accidentalmente, no de modo controlado, cuando el paciente sin saberlo se expone nuevamente al fármaco y refiere recurrencia de los síntomas. La PEC es la única prueba que, resultando negativa, descarta la asociación causal con el fármaco sospechoso. La administración del fármaco se hace a dosis creciente y de modo supervisado por el especialista en alergología o un facultativo entrenado. La PEC es el estándar de excelencia (gold standard) para establecer la relación causal, a pesar de las dificultades que entraña su realización.
Estudios in vitro disponibles para identificar el fármaco desencadenante en reacciones de hipersensibilidad a fármacos13Test de activación de basófilosDe utilidad cuando la forma farmacéutica no está disponible en solución inyectable y necesitamos demostrar una RHF tipo-i. Esta prueba consiste en enfrentar en cultivo los basófilos del paciente con el fármaco y medir por citometría de flujo la expresión de receptores de activación (CD63, CD203). La probabilidad de relación causal se expresa como positiva o negativa de acuerdo al porcentaje de células que se hallen activadas.
Medición de triptasa sérica en sangre periféricaEs útil para RHF tipo-i. La triptasa se encuentra contenida en los gránulos de mastocitos y es liberada tras la activación. Se debe trazar una curva con mediciones a los 15minutos, a las 3horas y tardíamente a las 24horas de iniciados los síntomas.
Medición de la inmunoglobulina E específicaEste tipo de paneles se encuentra más desarrollado para alimentos y alérgenos ambientales mediante técnicas como radioinmunoanálisis o ELISA. El panel para diagnosticar alergias a fármacos es bastante limitado. Incluso no siempre una RHF tipo-i cursa con aumento IgE, por lo que la negatividad no descartaría la asociación causal.
Prueba de transformación linfoblásticaEsta prueba es útil cuando se sospecha de reacciones retardadas. Requiere la incubación de linfocitos extraídos de sangre periférica del paciente y el fármaco sospechoso desde 48horas hasta 7 días. Resultan positivas si existe proliferación de linfoblastos. Es la prueba de elección para RHF retardadas graves exfoliativas (SSJ/NET) o las reacciones órgano específicas, ya que la PEC se encuentra contraindicada.
Estudios de susceptibilidad genéticaEn asiáticos se demostró la relación de ciertos HLA y riesgo de RAMc graves para algunos fármacos. La presencia del alelo HLAB*5701 confirmó un valor predictivo positivo del 100% y negativo del 97% para la reacción de hipersensibilidad a abacavir, incluso en diferentes grupos étnicos, algo semejante para el alopurinol y HLAB*5801. Sin embargo, otras asociaciones son más débiles cuando se comparan poblaciones de diferentes líneas ancestrales9.
Podemos resumir que en primer lugar se debe identificar la necesidad de confirmar la relación causal con el fármaco sospechoso después del análisis de imputabilidad. Ante esta situación, de acuerdo al mecanismo fisiopatológico y la forma farmacéutica se debe seleccionar la prueba más indicada. Es importante respetar las condiciones de base del paciente para evitar falsos negativos. Cabe destacar que cualquier prueba positiva confirma, aunque las respuestas negativas no descartan la relación causal, a excepción de la PEC15-17 (fig. 7).
Algoritmo de pruebas de hipersensibilidad para reacciones adversas a medicamentos. IDR: reacción intradérmica; PEC: prueba de exposición controlada. RAMc: reacción adversa a medicamentos con compromiso cutáneo; RHDs: reacción de hipersensibilidad a drogas; TAB: test de activación de basófilos; TTL: test de transformación linfocitaria.
A pesar de la alta prevalencia de RAMc, y la importancia de identificar el agente causal, continúa siendo un desafío principalmente en pacientes polimedicados. Lamentablemente no existe ninguna prueba 100% sensible y segura para la detección del fármaco provocador. Por lo tanto, son la sumatoria de resultados desde el análisis de imputabilidad hasta las pruebas complementarias, todas herramientas útiles para comprobar la relación causal con el fármaco sospechoso.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.