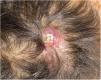
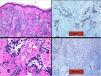
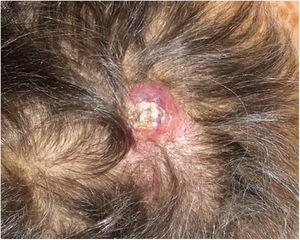
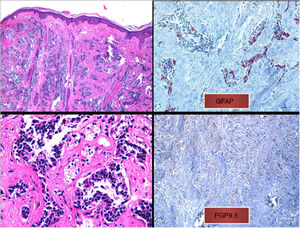
Presentamos el caso de una mujer de 75 años con antecedentes de glioblastoma multiforme (GBM) intervenido mediante craniectomía y exéresis 7 meses antes e incluida en un ensayo clínico con nivolumab/placebo. Acudió a dermatología remitida desde oncología con una masa de 3×4cm de diámetro, eritematosa y de superficie ulcerocostrosa en la región parietal derecha, próxima a la cicatriz de la intervención (fig. 1). La paciente aportaba una resonancia magnética realizada el día anterior donde no se apreciaba solución de continuidad en el hueso. Ante la sospecha de metástasis cutánea de GBM se le realizó una biopsia en la cual se apreciaba una marcada infiltración dérmica difusa de células mononucleares de núcleos hipercromáticos y con marcado pleomorfismo. La inmunohistoquímica reveló un probable origen neural, siendo positivas las tinciones para CD10, PGP9.5 y para la proteína glial fibrilar ácida (GFAP) (fig. 2), mientras que las tinciones para S100, HMB45, citoqueratina 20 y CD99 fueron negativas. La paciente ingresó un mes después en oncología por un cuadro de desconexión del medio. Las pruebas de imagen mostraron una hidrocefalia subaguda secundaria a la intervención inicial sin posibilidad de colocar una derivación ventriculoperitoneal. Curiosamente la lesión y el edema perilesional se mantuvieron sin cambios con respecto a las resonancias iniciales. Ante la mala evolución de la paciente, se decidió tratamiento sintomático paliativo.
a) Infiltrado difuso en dermis papilar y reticular de células tumorales sin contacto con la epidermis (tinción hematoxilina-eosina, x10). b) Células tumorales de núcleo hipercromático y marcado pleomorfismo (tinción hematoxilina-eosina, x40). c) Inmunohistoquímica positiva para la tinción de proteína glial fibrilar ácida (x40). d) inmunohistoquímica positiva para la tinción de PGP9.5 (x20).
Pese a ser el tumor cerebral maligno más frecuente, las metástasis extracraneales de GBM son infrecuentes, habiéndose reportado en un estudio en el 2,7% de 148 pacientes con diagnóstico histológico de glioma a los 5 años de seguimiento1. Si bien las localizaciones más frecuentes son el pulmón, la pleura y los ganglios linfáticos, más raras son las metástasis cutáneas2. Hasta ahora, existen 7 reportes en la literatura de metástasis cutánea de glioma cerebral grados III-IV (tabla 1), siendo el nuestro el primer caso de metástasis cutánea de GBM sin recurrencia de la enfermedad intracraneal3. Se observa habitualmente en pacientes con antecedentes de procedimientos quirúrgicos invasivos, lo que hace creer que la siembra metastásica iatrogénica juega un papel fundamental. Sin embargo, en el 10% de pacientes estas metástasis extracraneales surgen sin evidencia de cirugía previa4 o en una localización alejada de la intervención5, por lo que probablemente existan otras rutas de diseminación (vascular, linfática, perineural, extensión directa). Algunos estudios sugieren que la mutación del gen EGFR es un factor predisponente para el crecimiento extracraneal del GBM6, lo que no se dio en nuestra paciente siendo su determinación negativa. Otras teorías sugieren que el GBM promueve una angiogénesis defectuosa originando zonas hipóxicas en la barrera hematoencefálica con su consiguiente disrupción7. Otra posibilidad es que sea una entidad infradiagnosticada debido a la baja supervivencia de estos pacientes, no existiendo el suficiente tiempo para desarrollar enfermedad diseminada8. También se ha propuesto la irradiación profiláctica inmediatamente después de la cirugía como método para prevenir las metástasis secundarias a siembra tumoral iatrogénica9.
Metástasis cutáneas de tumor glial de alto grado reportadas en la literatura
| Autores | Sexo | Edad | Tumor primario | Tratamiento | Localización metástasis cutánea | Tiempo de metástasis | Recidiva concomitante intracraneal | IHQ | Pronóstico |
|---|---|---|---|---|---|---|---|---|---|
| Jain et al.3 | Hombre | 49 | GBM | Qx+RT | Pericicatriz de craneotomía | 8 meses (4 tras segunda cirugía) | Sí | GFAP+, vimentina+ (más intensa que recidiva intracraneal) | 4 meses tras recidiva |
| Mentrikoski et al.9 | Mujer | 58 | GBM | Qx+RT+TZM | Pericicatriz de craneotomía | 16 meses (10 tras segunda cirugía) | S100+, GFAP focal, vimentina+, NF− | ||
| Hombre | 41 | ODG-A | Qx+implantes intratumorales RT | Pericicatriz de craneotomía | 2 meses | No | GFAP+, S100+, EMA− | ||
| Amitendu et al.1 | Hombre | 27 | Astrocitoma GII --> PXA | Qx+RT | Pericicatriz de craneotomía | 12 meses | No | Compatible con PXA | A los 3 meses recidiva intracraneal con diagnóstico de oligodendroglioma anaplásico |
| Forsyth et al.4 | Mujer | 59 | GBM (EGFR+) | Qx+RT+BVZ | Atraviesa hueso desde intracraneal | 6 meses | Sí | MGMT+, IDH1− | 3,5 meses tras recidiva |
| Ginat et al.8 | Hombre | 62 | GBM (EGFR+) | Qx parcial+RT+TZM | Pericicatriz de craneotomía | 10 meses | Sí | GFAP+ | 14,5 meses tras recidiva |
| Miliaras et al.5 | Hombre | 63 | GBM | Qx+RT+TZM | Región escapular ipsilateral | 7 meses | Sí | 3 meses tras recidiva |
BVZ: bevazizumab; GBM: glioblastoma multiforme; GFAP: proteína glial fibrilar ácida; IHQ: inmunohistoquímica; ODG-A: oligodendroglioma anaplásico; PXA: xantoastrocitoma pleomórfico; Qx: cirugía; RT: radioterapia; TZM: temozolamida.
Al ser una entidad tan infrecuente, no existe la experiencia suficiente como para establecer un patrón determinado de tinciones inmunohistoquímicas. La positividad para la GFAP, generalmente muy intensa en los tumores primarios, puede mostrar diferentes patrones en las metástasis cutáneas, tanto positividad intensa difusa como focal, o una tinción muy fina en los procesos citoplasmáticos de las células neoplásicas, como ocurría en nuestro caso. Además, existen subtipos de GBM (por ejemplo, el GBM de células pequeñas) que pueden ser negativos para la tinción GFAP10, por lo que la inmunohistoquímica orienta hacia el tipo celular que puede estar originando la neoplasia, pero no es definitoria. Se debe hacer una correlación clínico-patológica teniendo en cuenta los antecedentes del paciente y siempre descartando otras entidades mucho más frecuentes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecer al servicio de Anatomía Patológica del Hospital General de Valencia, en especial a la Dra. Ana Pérez, quien nos realizó de forma extraordinaria las tinciones inmunohistoquímicas necesarias y que no disponíamos en nuestro servicio de Dermatología. También agradecer a nuestra técnica de laboratorio Sandra Mínguez su ayuda y dedicación que nos brinda en cualquier caso.