El síndrome de Noonan con lentigos múltiples (SNLM), también conocido como síndrome de LEOPARD, es una rara genodermatosis cuyo acrónimo responde a la descripción en inglés de sus manifestaciones clínicas más habituales: lentigos múltiples, anomalías electrocardiográficas de la conducción, hipertelorismo ocular, estenosis pulmonar, anomalías genitales, retraso del crecimiento y sordera neurosensorial. Este síndrome se asocia habitualmente a una mutación en el gen PTPN11, lo que produce alteraciones de la vía de transducción RAS-mitogen activated protein kinase pathway (MAPK). Esta vía de transducción de señales desempeña un papel fundamental en la tumorogénesis de diversas neoplasias. Además, se han descrito mutaciones en otros genes como RAF1 o BRAF1, lo que permite clasificar este síndrome dentro del grupo de las denominadas «rasopatías»2. La alteración de la función de las vías de transducción de señales anteriormente descritas puede incrementar el riesgo de neoplasias, habiéndose hallado un aumento del riesgo de leucemias y neuroblastomas, entre otros3. Sin embargo, la asociación con melanoma se halla escasamente descrita en la literatura médica, habiéndose publicado solo 4 casos hasta la fecha4–7.
Un varón de 44 años afecto de SNLM, confirmado mediante estudio genético de la mutación p.Tyr279Cys (c.8364>G) en heterocigosis en el gen PTPN11, consultó en el servicio de dermatología para revisión de sus lesiones cutáneas. Como manifestaciones clínicas propias del síndrome presentaba una lentiginosis múltiple, alteraciones electrocardiográficas (bloqueo de rama derecha incompleto y hemibloqueo anterior), una estenosis pulmonar infundibular intervenida quirúrgicamente y alteraciones auditivas.
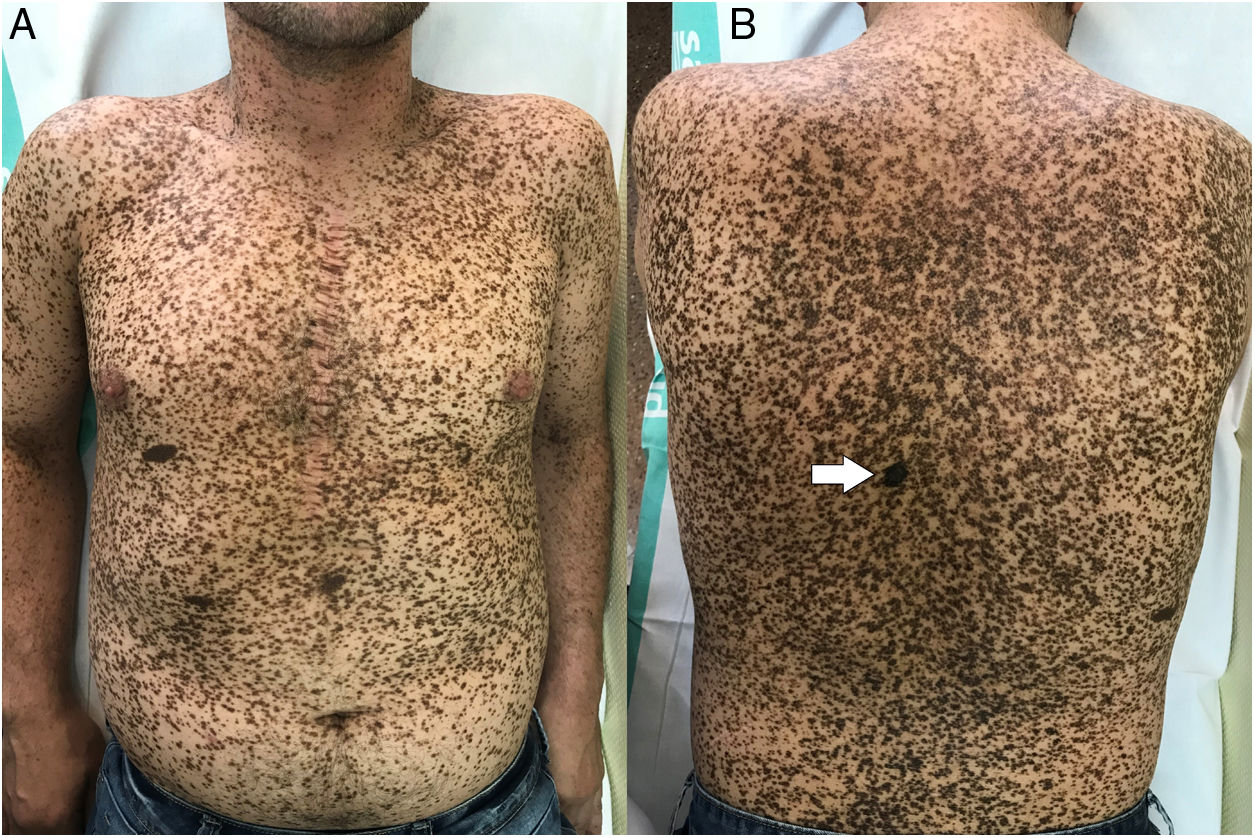
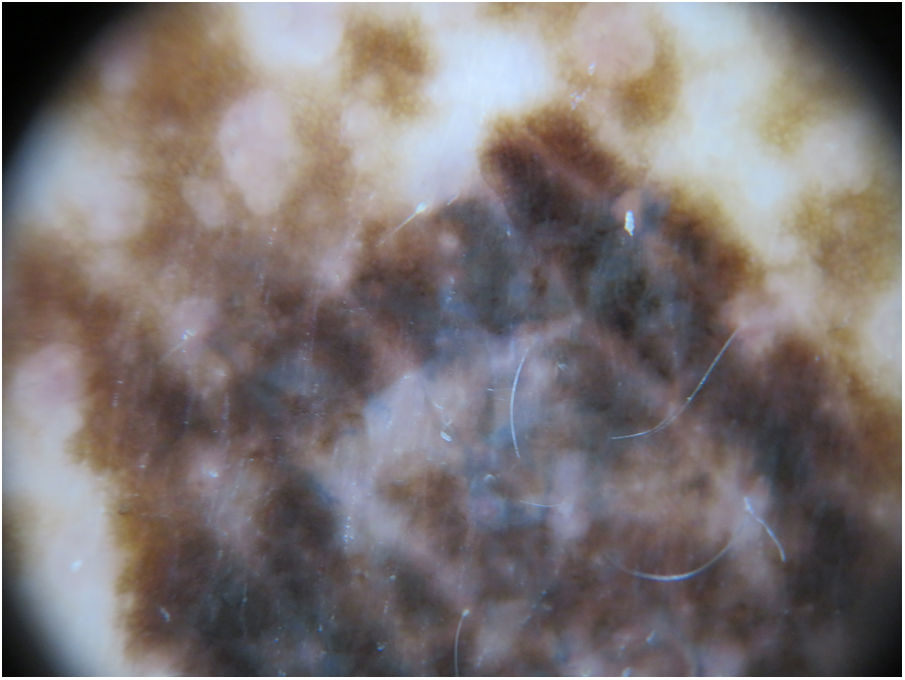
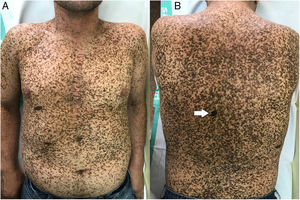
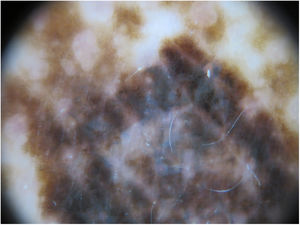
A la exploración física se apreciaba una marcada lentiginosis generalizada en tronco y extremidades, con lesiones en su mayoría menores a 1cm y otras de mayor tamaño en número más escaso. De entre todas las lesiones, destacaba una de ellas a nivel dorsal, de reciente aparición y diferente a las demás lesiones del paciente, con morfología irregular, un diámetro aproximado de 2×1,2cm y pigmentación más intensa. A la dermatoscopia de luz polarizada se apreciaba un retículo pigmentado atípico y áreas azul gris (figs. 1 y 2).
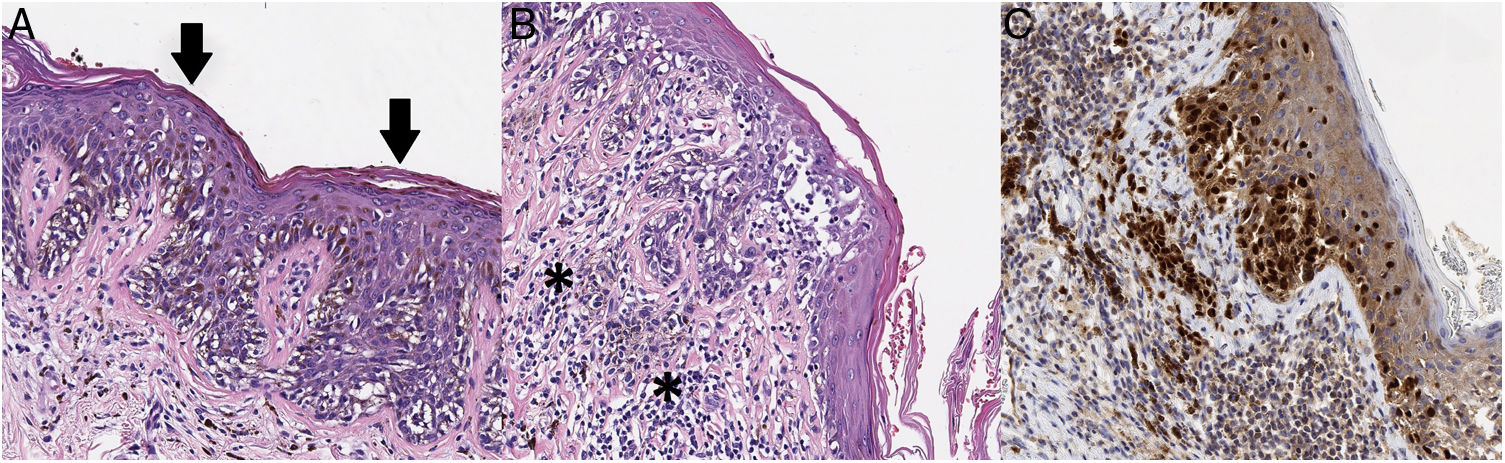
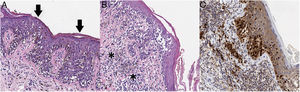
Dadas las características clínico-dermatoscópicas y evolutivas de la lesión, se realizó una exéresis completa de la misma. El resultado histopatológico fue de un melanoma de extensión superficial microinfiltrante con un índice de Breslow de 0,15mm, sin ulceración, mitosis, invasión vascular ni neurotropismo evidente (fig. 3).
A) En el análisis histopatológico se aprecia una neoplasia melanocítica atípica de crecimiento lentiginoso, con diseminación pagetoide (flechas) y apolillamiento de la epidermis (hematoxilina-eosina, ×200). B) En otras áreas se observan melanocitos atípicos infiltrando la dermis en su parte más superficial (asterisco), asociados a fibroplasia de dermis papilar e infiltrado inflamatorio (hematoxilina-eosina, ×200). C) Con inmunohistoquímica se aprecia positividad nuclear en los melanocitos intradérmicos e intraepidérmicos (Sox10, ×200).
El estadio del paciente, según la clasificación de la AJCC de 2017, fue por tanto de un IA.
Recientemente han sido descritas las características clínicas, anatomopatológicas y dermatoscópicas del SNLM8, donde se presentan tanto lentigos simples (lesiones menores a 1cm de diámetro) como manchas CN (lesiones mayores a 1cm de diámetro) que, en función de su pigmentación, características histológicas y dermatoscópicas se han subclasificado en manchas CN de tonalidad oscura y manchas CN de tonalidad medio o claras.
Pese a los pocos casos publicados, se considera que los pacientes con SNLM podrían presentar un riesgo aumentado de desarrollar melanoma. Este incremento del riesgo se explica porque el 90% de los casos de SNLM presentan mutación del gen PTPN111, que codifica para una proteína (SHP-2) con actividad tirosina fosfatasa, la cual regula la actividad de la vía de señalización RAS. Esta proteína actúa como transductora citoplasmática de distintos factores de crecimiento, citoquinas, hormonas e integrinas que producen el fenotipo del SNLM.
Este gen PTNPN11 fue el primer proto-oncogén identificado que codificaba para una proteína con actividad tirosina fosfatasa que es capaz de promover la activación de la vía de señalización RAS-ERK implicada en diversos tipos de cáncer9. También se ha planteado la hipótesis de que este gen pudiera comportarse en algunos tipos celulares como un gen supresor tumoral mediante la inhibición de la vía RAS-ERK. Así la supresión de la proteína SHP-2 favorece la tumorogénesis debido a una alteración de la vía STAT3, vía también implicada en la génesis del melanoma10.
A pesar de que existen pocos casos descritos en la literatura médica, debemos tener en consideración el probable incremento del riesgo de melanoma en pacientes con SNLM. Por ello, estos pacientes deberían someterse a un seguimiento dermatológico periódico y exhaustivo, en busca de lesiones de características atípicas y/o de reciente adquisición. Las características fenotípicas en este síndrome convierten esta tarea en un auténtico reto para el dermatólogo, pudiendo ayudar a su manejo los programas de seguimiento digital con mapas corporales.