La urticaria crónica espontánea es una enfermedad prevalente, de difícil manejo terapéutico y con una importante repercusión en la calidad de vida del paciente.
ObjetivoDescribir las características epidemiológicas, clínicas y la respuesta terapéutica de los pacientes con urticaria crónica espontánea actuando según la guía de consenso EAACI/GA(2)LEN/EDF/WAO.
Material y métodoEstudio descriptivo transversal que incluyó todos los pacientes con urticaria crónica espontánea visitados en una consulta específica de alergia cutánea de un servicio de dermatología de un hospital terciario en España desde julio de 2011 hasta julio de 2015.
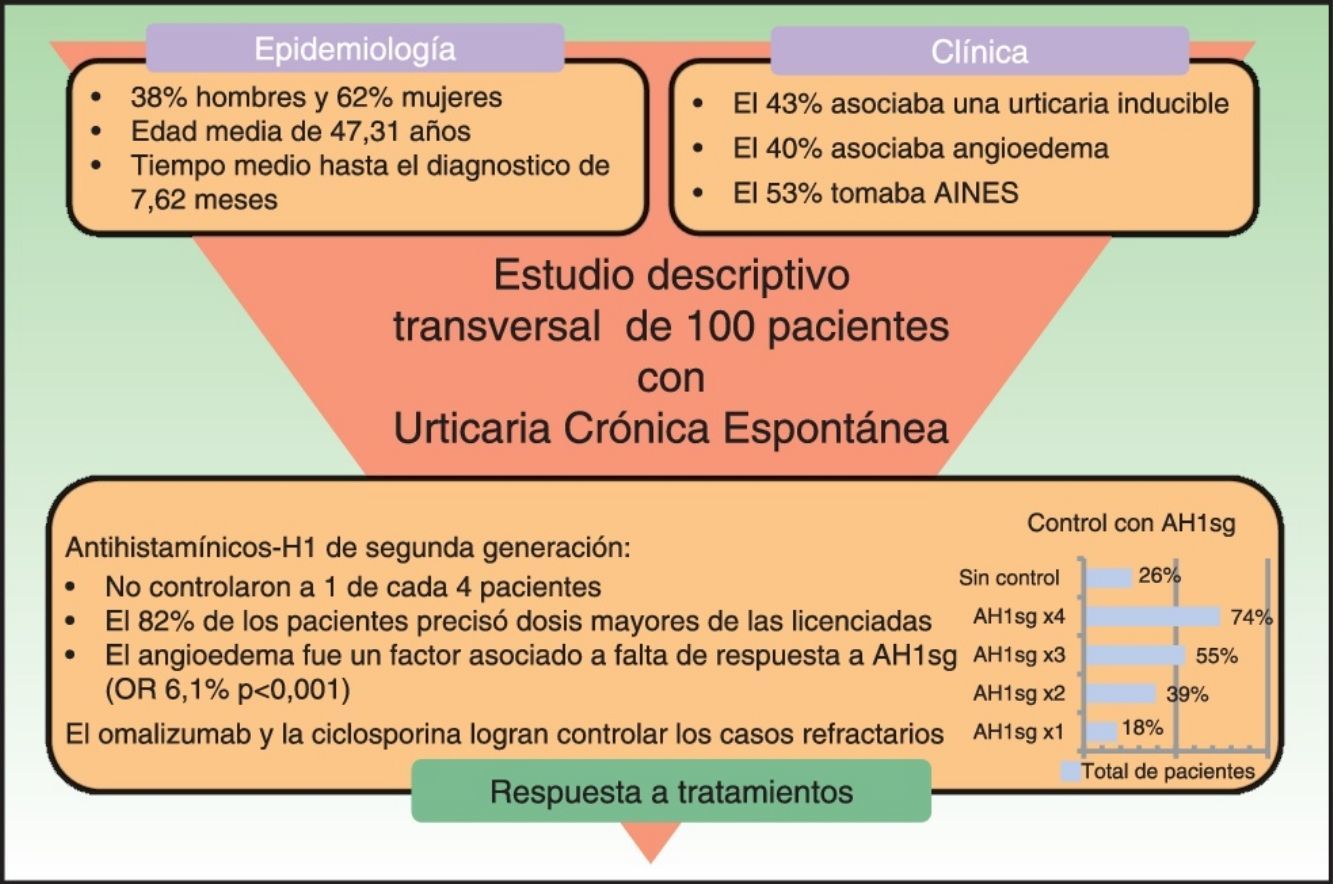
ResultadosCien pacientes con urticaria crónica espontánea participaron en el estudio. El 43% asociaba una urticaria inducible. El 40% asociaba angioedema. El 53% de los pacientes tomaba antiinflamatorios no esteroideos en el momento del diagnóstico. Todos los pacientes fueron tratados con antihistamínicos-H1 de segunda generación, pero solo un 18% se controló con dosis licenciadas, mientras que el aumento hasta 4 veces la dosis logró controlar el 74% de los pacientes. Los pacientes con angioedema requirieron dosis mayores de antihistamínicos-H1 de segunda generación que los pacientes sin angioedema para el control de la urticaria crónica espontánea, siendo el angioedema un factor asociado a falta de respuesta a tratamiento con antihistamínicos-H1 de segunda generación (OR 6,1%, p<0,001). Uno de cada 4 pacientes no respondió a antihistamínicos-H1 de segunda generación y requirió omalizumab o ciclosporina para su control.
ConclusionesEl control de la urticaria crónica espontánea precisa de la utilización de antihistamínicos-H1 de segunda generación a dosis más altas de las licenciadas en la mayoría de los casos. El angioedema se asocia a falta de respuesta al tratamiento con antihistamínicos. El omalizumab y la ciclosporina logran controlar los casos refractarios. La evitación de antiinflamatorios no esteroideos no es una práctica habitual en los pacientes con urticaria crónica espontánea.
Chronic spontaneous urticaria is a prevalent and difficult-to-treat condition that has a very negative impact on patient quality of life.
ObjectiveTo describe the epidemiological and clinical characteristics of patients presenting with chronic spontaneous urticaria and the response to treatment administered according to the EAACI/GA(2)LEN/EDF/WAO consensus guideline.
Material and methodDescriptive cross-sectional study of all the patients with chronic spontaneous urticaria who consulted a skin allergy unit in the dermatology department of a tertiary hospital in Spain between July 2011 and July 2015.
ResultsThe study included 100 patients with chronic spontaneous urticaria; inducible urticaria was present in 43% of cases, and angioedema in 40%. On diagnosis, 53% of patients were taking nonsteroidal anti-inflammatory drugs. All patients were treated with second generation H1-antihistamines, but the standard dose was sufficient in only 18% of cases. Higher doses (up to 4 times the standard dose) achieved control of the urticaria in 74% of the patients studied. Higher doses of second generation H1-antihistamines were required to control the condition in patients with angioedema, and the presence of angioedema was associated with a lack of response to treatment with these drugs (OR, 6.1%; P<.001). One in 4 patients failed to respond to second generation H1-antihistamines and required treatment with omalizumab or ciclosporin to control their condition.
ConclusionsDoses of H1-antihistamines higher than the standard dose are required in most cases to achieve control of chronic spontaneous urticaria. Angioedema is associated with failure to respond to treatment with antihistamines. In refractory cases, control of the condition can be achieved with omalizumab or ciclosporin. Patients with chronic spontaneous urticaria do not generally avoid the use of nonsteroidal anti-inflammatory agents.
La urticaria es una de las afecciones cutáneas más frecuentes en nuestro medio; se caracteriza por la aparición de forma recurrente y transitoria de habones y/o angioedema y se puede clasificar según su duración y causa1,2. Los habones se caracterizan porque las lesiones individuales duran menos de 24horas y el angioedema por la aparición repentina de edema en la dermis profunda y el tejido celular subcutáneo, que afecta frecuentemente a las mucosas, pero también puede localizarse en otras áreas como la cara y las extremidades, puede ir acompañado de dolor o picor y se resuelve espontáneamente hasta en 72horas2. Se denomina urticaria crónica espontánea (UCE) a la presencia de habones y/o angioedema durante más de 6 semanas de causa desconocida y no inducible2.
La UCE representa cerca del 70% de todas las urticarias crónicas, generando una importante repercusión en la calidad de vida del paciente dado su difícil manejo terapéutico3. En el año 2009 se publicó la guía internacional EAACI/GA(2)LEN/EDF/WAO con la intención de unificar la definición, clasificación, diagnóstico y tratamiento de la urticaria en función de la evidencia científica en la literatura y teniendo en consideración la experiencia europea y mundial en esta afección2,4. En el año 2013 se realizó una revisión y actualización de la misma, siendo en la actualidad la guía europea de consenso vigente para el manejo de la UCE5. De acuerdo a esta guía4,5 en caso de no respuesta a dosis regulares de antihistamínicos-H1 de segunda generación (AH1sg) se recomienda el uso de hasta 4 veces la dosis licenciada. Si esto no es efectivo la guía recomendaba en 2009 como tercer escalón terapéutico cambiar de AH1sg. En los casos refractarios la tercera5 línea de tratamiento correspondería al uso de omalizumab, ciclosporina o añadir un antagonista de leucotrienos, entre otros. El uso de corticoides sistémicos solo estaría recomendado para el manejo de las exacerbaciones agudas en pautas cortas de menos de una semana4,5.
El objetivo principal de este estudio es describir la respuesta terapéutica de los pacientes con UCE vistos en un servicio de dermatología de un hospital terciario de España tras actuar de acuerdo a las guías de consenso terapéuticas EAACI/GA(2)LEN/EDF/WAO4,5. El objetivo secundario es describir las características epidemiológicas y clínicas de los pacientes estudiados.
Material y métodoPresentamos un estudio descriptivo transversal que describe las características epidemiológicas, clínicas y de manejo terapéutico de los pacientes con UCE seguidos en la consulta de alergia cutánea de un servicio de dermatología de un hospital terciario de España desde julio de 2011 hasta julio de 2015. Los datos de este estudio fueron recogidos y analizados en octubre de 2015. Se incluyeron todos los pacientes con urticaria de más de 6 semanas de evolución de causa desconocida que fueron valorados en la consulta. Se recogieron datos epidemiológicos (sexo, edad, episodios de urticaria previos, antecedentes de atopia, enfermedades autoinmunes u otras enfermedades relevantes asociadas), datos clínicos (meses de evolución de la urticaria, fecha de inicio de los síntomas y fecha de diagnóstico, tipos de urticaria asociada, causas y factores agravantes de la urticaria, presencia de angioedema, efectos secundarios al tratamiento), resultados de las pruebas de laboratorio (velocidad de sedimentación glomerular, inmunoglobulina E total en suero, anticuerpos antinucleares y anticuerpos antitiroideos) y de la prueba del prick test cutáneo. Se recogieron los siguientes datos referentes al tratamiento: administración de corticoides orales (número de ocasiones, uso en tandas cortas o de forma continuada durante al menos un mes), uso de antihistamínicos (tipo de antihistamínico, dosis a la que se alcanza el control de la urticaria) y uso de antileucotrienos, ciclosporina y omalizumab.
Se consideró que un tratamiento resultaba efectivo cuando logró la desaparición del prurito y de los habones y el angioedema, o cuando consiguió una disminución del prurito, la frecuencia y el número de habones y/o de los episodios de angioedema que el paciente consideró suficiente y renunció al inicio de terapias más agresivas. La resolución de la urticaria fue considerada cuando el paciente no presentó nuevos episodios de prurito, habones ni angioedema, a pesar de haber suspendido el tratamiento durante al menos 3 meses.
Los datos fueron recogidos informáticamente en la historia clínica electrónica de cada paciente. Se realizó un análisis estadístico descriptivo y se analizaron los factores asociados a falta de respuesta al tratamiento con AH1sg mediante el test de Chi-cuadrado con el programa SPSS® Statistics v22.0.0.
ResultadosEn total, 100 pacientes con urticaria crónica espontánea fueron incluidos en el estudio, el 38% fueron hombres y el 62% mujeres. La edad media de los pacientes fue de 47,31 años. El tiempo de media desde el inicio de los síntomas hasta el diagnóstico de la UCE fue de 7,62 meses. En el momento de finalizar el estudio la urticaria había sido resuelta en el 54% de los pacientes, con un tiempo de evolución medio de 23,20±18,72 meses. El 17% de los pacientes había tenido algún brote de urticaria en el pasado.
Tipos de urticaria asociadaDe los 100 pacientes con UCE el 40% asoció algún episodio de angioedema.
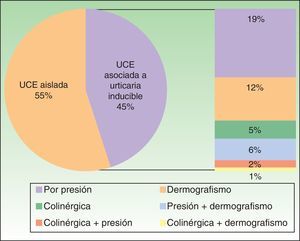
Además, el 45% de los pacientes presentaba algún tipo de urticaria inducible asociada: por presión, dermografismo y/o colinérgica (fig. 1).
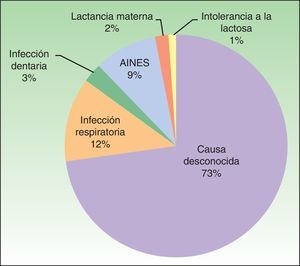
Posibles agentes causales y agravantesAunque todos los pacientes presentaban una urticaria de causa desconocida, el 27% de los pacientes asoció el inicio de la urticaria a algún agente causal: procesos infecciosos, medicamentos (en todos los casos se asoció al uso de antiinflamatorios no esteroideos [AINE]) y otros (fig. 2).
En cuanto a factores agravantes, 6 pacientes apreciaron exacerbación de la urticaria al tomar AINE, estos junto con los 9 pacientes ya mencionados previamente supondría que el 15% del total de pacientes asociaron el inicio o exacerbación de su enfermedad con la toma de AINE. Además, el 53% de los pacientes tomaba AINE en el momento del diagnóstico.
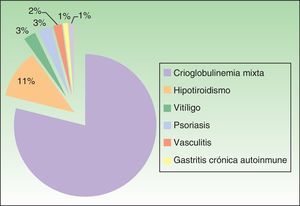
Enfermedades asociadas y pruebas complementariasDe los 100 pacientes con UCE, el 4% presentaba una infección crónica por el virus de la hepatitis B (VHB) o C (VHC). El 17% de los pacientes tenía antecedentes personales de atopia. El 20% de los pacientes padecía alguna enfermedad autoinmune (fig. 3). Las pruebas de laboratorio evidenciaron que el 46,1% (36/78) de los pacientes a los que se les solicitó IgE total en suero tenía unos niveles mayores de 100 UI/ml, considerándose superior a la normalidad. También mostraron anticuerpos antinucleares positivos el 12,7% (10/79) de los pacientes en los que se solicitaron y anticuerpos antitiroideos positivos (y/o anti-TSH) el 20,3% (14/69). La prueba del prick test cutáneo fue positiva en el 20% (8/40) de los pacientes a los que se le realizó, aunque de relevancia desconocida en relación con la urticaria. El 20,5% (16/78) de los pacientes tenía unos niveles de velocidad de sedimentación globular en suero mayores de 20mm/h, considerándose superior a la normalidad.
Respuesta a tratamientosCorticoides sistémicosEl 56% de los pacientes requirió en alguna ocasión tratamiento corticoide sistémico, el 23,6% en al menos 2 ocasiones, y el 40% en 3 o más ocasiones para controlar los brotes. En la mayoría de los casos el tratamiento consistía en prednisona o deflazacort vía oral a dosis descendente durante 7 a 9 días.
El 9% de los pacientes habían recibido tratamiento con corticoides de forma continuada durante al menos un mes, previamente a ser valorados en nuestra unidad.
AntihistamínicosTodos los pacientes iniciaron como primera línea de tratamiento un AH1sg. El 60% de los pacientes probó 2 o más antihistamínicos diferentes y el 26% probó con 3 o más antes de pasar a otro tratamiento. El 43% de los pacientes usó en alguna ocasión antihistamínicos-H1 sedantes previo a acudir a nuestra consulta.
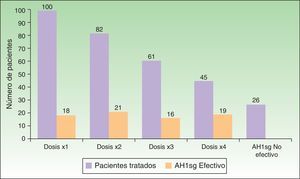
Respecto a la respuesta al tratamiento (fig. 4) el 18% de los pacientes fue controlado con dosis única diaria de AH1sg, mientras que el 82% precisó doblar, triplicar o cuadriplicar la dosis. Uno de cada 4 pacientes (26%) no fue controlado con AH1sg y requirió otras líneas de tratamiento.
AntileucotrienosEl 34% de los pacientes fue tratado con un antagonista del receptor de leucotrienos, montelukast 10mg al día, de forma concomitante al tratamiento antihistamínico a dosis triple o cuádruple. Este fármaco resultó efectivo en uno de cada 3 pacientes tratados (38,2%).
CiclosporinaEn total 11 (11%) pacientes fueron tratados con ciclosporina vía oral como tercera o cuarta línea de tratamiento a dosis entre 3,5-4mg/kg/día, resultando efectiva en el 63,6% de los casos.
Ningún paciente tuvo que suspender el tratamiento a causa de los efectos secundarios ni desarrolló efectos adversos graves a la dosis administrada. Todos los pacientes combinaron el tratamiento con AH1sg.
OmalizumabEn total 16 (16%) pacientes fueron tratados con omalizumab. El 75% (12/16) como tercera línea de tratamiento y el 25% (4/16) como cuarta línea de tratamiento tras el fracaso de ciclosporina. En todos los pacientes el omalizumab resultó efectivo en el control de la urticaria.
Las dosis utilizadas variaron desde 150mg al mes hasta 375mg cada 15 días. Ninguno de los pacientes presentó efectos adversos al tratamiento. Dos pacientes con infección activa por VHC y uno por VHB fueron tratados con éxito. El 44% de los pacientes tratados con omalizumab suspendió el tratamiento previo con AH1sg±montelukast debido a la eficacia del omalizumab en monoterapia.
Factores asociados a falta de respuesta al tratamiento con antihistamínicos-H1 de segunda generaciónSe analizaron como posibles factores asociados a falta de respuesta al tratamiento con AH1sg los siguientes: el sexo del paciente, la presencia de angioedema, la presencia de urticaria inducible, la presencia de anticuerpos anti tiroideos y la presencia de velocidad de sedimentación globular elevada (tabla 1). La presencia de angioedema se asoció con una mayor probabilidad de no responder a AH1sg (OR: 6,1; IC 95%: 2,2-16,6; p<0,001), con un riesgo aumentado hasta 6 veces frente a los pacientes sin angioedema. Los pacientes con anticuerpos antitiroideos positivos mostraron una tendencia a no responder a AH1sg mayor que los pacientes con anticuerpos negativos (OR:2,2; IC 95%: 0,7-7,2; p=0,196). En el resto de factores analizados no se hallaron diferencias relevantes ni estadísticamente significativas.
Frecuencia y factores asociados a falta de respuesta al tratamiento con AH1sg
| No respuesta al tratamiento | OR (IC 95%) | p | ||
|---|---|---|---|---|
| % | (número) | |||
| Angioedema | ||||
| Sí | 45,0 | (18/40) | 6,1 (2,2-16,6) | <0,001 |
| No | 11,9 | (7/59) | ||
| Anticuerpos antitiroideos | ||||
| + | 50 | (7/14) | 2,2 (0,7-7,2) | 0,196 |
| – | 31,5 | (17/54) | ||
| Urticaria inducible | ||||
| Sí | 21,4 | (9/42) | 0,7 (0,3-1,8) | 0,452 |
| No | 28,1 | (16/57) | ||
| Sexo | ||||
| Hombre | 23,7 | (9/38) | 0,9 (0,3-2,2) | 0,777 |
| Mujer | 26,2 | (16/61) | ||
| VSG | ||||
| Elevada | 31,3 | (5/16) | 0,9 (0,3-3,1) | 0,939 |
| Normal | 32,3 | (20/62) | ||
Este es el primer estudio realizado en España que examina el manejo de los pacientes con UCE en la práctica clínica diaria siguiendo las indicaciones de las últimas guías de consenso publicadas2,4,5. Los datos epidemiológicos de nuestro estudio concuerdan con los de la literatura, la UCE afecta predominantemente a mujeres6–8 de edad media6,7. La asociación con angioedema (40%) también concuerda con la descrita en la literatura6,8. Sin embargo, llama la atención que la asociación a algún tipo de urticaria inducible es mayor en nuestro estudio (45%) respecto a otros estudios publicados8,9, esto podría reflejar el esfuerzo que hemos realizado en detectar las urticarias inducibles asociadas mediante una historia clínica minuciosa y los test de provocación10 (rascado y Fric Test®, Temp Test®, test del agua caliente, exposición solar, ejercicio físico…). Saber que existe una urticaria inducible asociada nos va a ayudar a realizar una adecuada prevención de los factores desencadenantes de la misma. Además, consideramos que la obtención de estos datos es muy importante de cara al manejo de la enfermedad, ya que hay trabajos que sugieren una peor respuesta al tratamiento en pacientes con UCE que asocien angioedema y/o urticaria física o inducible8,9, como hemos podido observar en los pacientes que presentaban angioedema en nuestro estudio, con un riesgo 6 veces superior de no responder a AH1sg que los pacientes sin angioedema (p<0,001).
Las causas y los agravantes asociados a la UCE son diversos y varían en función de los estudios. En nuestro estudio el 27% de los pacientes asociaron la aparición de la UCE con un agente causal; estos datos concuerdan con la literatura11, pero son menores de lo esperado según un estudio reciente en el que los autores sugieren que un programa diagnóstico más intensivo llevado a cabo en centros de tercer nivel deriva en un mayor número de pacientes en los que se identifica la causa de la UCE12. La guía2 EAACI/GA(2)LEN/EDF/WAO y otros trabajos publicados13, al igual que en nuestro estudio, reconocen las infecciones y el uso de medicamentos como principales causas responsables a identificar, además de las enfermedades que cursen con inflamación crónica, como la hepatitis. En nuestro estudio 4 (4%) pacientes tenían una infección crónica por VHC o VHB, un porcentaje bastante superior a la prevalencia en la población española general, que oscila según los datos publicados entre el 0,27-2,6%14. La elevada asociación de la UCE con el uso de AINE en nuestro estudio (15%) es significativamente superior a los datos publicados en la literatura15. Se sabe que algunos medicamentos como los AINE, la codeína y los derivados opiáceos pueden inducir o agravar la urticaria crónica mediante una acción directa sobre la degranulación de los mastocitos16. La guía2 recomienda en el proceso diagnóstico de la UCE realizar de forma rutinaria una analítica sanguínea con hemograma y proteína C reactiva, y la eliminación de medicamentos sospechosos como los AINE. Este punto resulta de gran importancia en el abordaje diagnóstico y terapéutico al paciente con UCE en la práctica diaria, ya que hasta un 53% de los pacientes en nuestro estudio tomaba AINE en el momento del diagnóstico. El consumo de AINE en la población española es muy habitual. Normalmente es de forma episódica y muchas veces sin prescripción médica. Consideramos que su evitación en los pacientes con UCE es necesaria y deberíamos realizar esfuerzos en educar adecuadamente tanto a los pacientes como al personal sanitario en este aspecto.
En relación con el resto de pruebas que realizamos en el estudio, es conocida la prevalencia de niveles altos de IgE sérica y prick test positivos en los pacientes con UCE, a pesar de que la urticaria crónica mediada por alergia-IgE es excepcional17. La urticaria crónica autorreactiva o autoinmune es uno de los subtipos más frecuentes de UCE7, para su diagnóstico es necesaria la realización de la prueba de suero autógeno y un test de degranulación de basófilos, con una prevalencia de resultados positivos de hasta un 67% en algunos estudios7,18. Una de las limitaciones de este estudio es que no podemos indicar la proporción de UCE autorreactivas, puesto que no disponemos del material necesario para realizar el test del suero autógeno. No obstante, cabe mencionar que el 41% de nuestros pacientes presentaba signos indirectos de autorreactividad (anticuerpos antinucleares positivos y/o anticuerpos antitiroideos positivos, y/o enfermedad autoinmune asociada). Un resultado positivo en la prueba de suero autógeno se asocia a mayor resistencia al tratamiento, mayor actividad y duración de la urticaria y peor calidad de vida7,8. En nuestro estudio se pudo observar una tendencia a responder peor al tratamiento con AH1sg en los pacientes con anticuerpos antitiroideos positivos frente a los pacientes sin signos indirectos de autorreactividad, aunque sin llegar a obtener diferencias estadísticamente significativas. A pesar de que la guía2 solo recomienda realizar de forma rutinaria un hemograma y proteína C reactiva, en opinión de los autores recomendamos completar el estudio básico de todo paciente con UCE con perfil tiroideo y anticuerpos antitiroideos.
La respuesta al tratamiento en nuestros pacientes ha sido la esperada. El tratamiento con AH1sg a dosis licenciadas controló un número bajo de pacientes (18%) con UCE, la mayoría de ellos precisó un aumento en la dosis de los mismos. El uso de hasta 4 veces la dosis licenciada de AH1sg controló 3 de cada 4 pacientes tratados. No obstante, el 26% de los pacientes no respondió a AH1sg y requirieron otras líneas de tratamiento. Estos datos concuerdan con los estudios publicados8,19–21 que demuestran la eficacia y seguridad de cuadriplicar la dosis de AH1sg que recomienda la guía4,5 como segundo escalón terapéutico. Llama la atención que un tercio (43%) de nuestros pacientes había sido tratado antes de llegar a nuestra consulta con antihistamínicos-H1 sedantes. Este tratamiento no está recomendado por la guía4,5 ni avalado por estudios científicos22,23 para el manejo de la UCE, sin embargo es considerado por muchos un tratamiento seguro debido a su largo tiempo de uso, y resulta una práctica común añadir al tratamiento de la UCE un antihistamínico-H1 sedante por la noche con la creencia de que disminuirá el picor y mejorará la calidad del sueño22. No obstante, se ha demostrado que su uso reduce la capacidad de aprendizaje y la eficiencia en el trabajo, además de estar implicado en accidentes de tráfico y muertes por sobredosificación23. Hemos observado, al igual que en otros estudios11, que muchos de los pacientes reciben este tratamiento junto a corticoides orales como primer escalón terapéutico, al acudir a centros médicos donde los especialistas no están familiarizados con las guías o incluso los pacientes se autoabastecen debido a la facilidad para adquirirlos libremente sin prescripción médica. Creemos que puede ser de especial interés realizar una actualización en el manejo de la UCE en los especialistas de atención primaria, ya que, en la mayoría de los casos, son los primeros médicos que valoran y tratan esta afección.
En la actualización de la guía internacional5 se reduce el algoritmo terapéutico a 3 escalones, situando a los antagonistas del receptor de leucotrienos, la ciclosporina y el omalizumab al mismo nivel en el último escalón terapéutico. En nuestro estudio, el uso de montelukast resultó efectivo en uno de cada 4 pacientes tratados. Pensamos que es un fármaco seguro, de fácil manejo y, en ocasiones, efectivo.
La ciclosporina resultó efectiva en la mayoría de pacientes tratados, mostrándose como un fármaco seguro y bien tolerado a dosis de 3,5-4mg/kg/día. Los estudios publicados24,25 están en concordancia con el nuestro en eficacia y seguridad, si bien usan dosis ligeramente más bajas (3mg/kg/día).
Respecto al tratamiento con omalizumab, hay varios trabajos publicados de su uso en la práctica clínica diaria26–30 para UCE29. En nuestro estudio, el omalizumab nos ha permitido controlar aquellos casos refractarios a prácticamente todos los tratamientos descritos en la guía4,5, con una eficacia del 100% de los casos y sin evidenciar efectos adversos. Hacen falta estudios a largo plazo que nos permitan ajustar las indicaciones, la dosis, el tiempo de mantenimiento, la seguridad a largo plazo, y cuándo y cómo retirarlo31. Pero, desde nuestra experiencia, se postula como la esperanza para aquellos casos de UCE refractaria al tratamiento habitual.
LimitacionesLas principales limitaciones de este trabajo son la falta de medidas de evaluación clínica de la actividad de la urticaria y de la calidad de vida de los pacientes, así como el no haber podido realizar la prueba de suero autógeno para evaluar las UCE, ya que no se encuentra disponible en nuestro centro.
Actualmente disponemos de herramientas validadas para la monitorización de la urticaria y para la valoración de su impacto en la calidad de vida. El Urticaria Activity Score 7, que nos permite evaluar la actividad de la urticaria y la respuesta al tratamiento. El Urticaria Control Test y Angioedema Activity Score.
En la actualidad, se recomienda usar de rutina, al menos, el Urticaria Activity Score 7 y el Urticaria Control Test para un manejo adecuado del paciente con UCE.
ConclusionesLa UCE es una enfermedad compleja, que requiere una aproximación global al paciente, realizando una historia clínica exhaustiva, que descarte las principales causas y factores precipitantes y el inicio de un tratamiento sintomático precoz. La utilización de AINE por parte de los pacientes con UCE continúa siendo una práctica habitual en nuestro medio, y deberíamos insistir en la educación tanto de los pacientes como del personal sanitario para su evitación o sustitución por otros analgésicos. El angioedema es muy frecuente en los pacientes con UCE, es importante interrogar a los pacientes y reconocer su presencia, ya que se asocia a falta de respuesta al tratamiento con AH1sg.
El uso de AH1sg a dosis licenciadas solo consigue controlar uno de cada 5 pacientes. Sin embargo, el aumento de dosis hasta 4 veces permite controlar el 74% de los pacientes. Es preciso familiarizar al colectivo médico para que implemente este tipo de medidas.
La ciclosporina y el omalizumab son fármacos efectivos y seguros para controlar los casos refractarios a las primeras líneas de tratamiento. Consideramos que estos pacientes deben ser manejados en unidades de referencia.
El seguimiento de las guías europeas nos ha permitido controlar casi la totalidad de nuestros pacientes, y por ello animamos a todos los dermatólogos a aplicarlas en su práctica clínica diaria.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.