A pesar del avance que ha supuesto en la supervivencia de los pacientes oncológicos, la aparición de nuevos agentes quimioterápicos y nuevas combinaciones, estos han traído consigo numerosos efectos adversos que pueden llegar a comprometer el tratamiento y, por consiguiente, el pronóstico de la enfermedad. Entre otros efectos secundarios los citostáticos pueden causar toxicidad dermatológica. El efecto adverso más conocido de la quimioterapia es la alopecia que, aunque no es grave, altera la apariencia externa de los pacientes con cáncer. Otros efectos adversos que pueden observarse son las reacciones de hipersensibilidad y fotosensibilidad, el síndrome mano-pie, la necrólisis epidérmica, las reacciones de reactivación, las reacciones esclerodermiformes, el fenómeno de Raynaud, la siringometaplasia escamosa ecrina, la hidradenitis neutrofílica ecrina, las alteraciones ungueales, las alteraciones en la pigmentación y las lesiones por extravasación. La aparición de estos efectos adversos produce en muchas ocasiones una reducción de dosis y/o retraso del tratamiento, lo que puede afectar a la supervivencia y a la calidad de vida del paciente. Por ello, es importante prevenir su aparición e instaurar un tratamiento temprano, para lo que se hace imprescindible la colaboración entre oncólogos médicos y dermatólogos. En este artículo se revisa la toxicidad dermatológica asociada con la quimioterapia, así como su diagnóstico y abordaje terapéutico.
Although the arrival of new chemotherapy drugs and combinations has brought progress in terms of cancer patient survival, they entail many adverse effects that can compromise treatment, and hence prognosis, of the disease. Cytostatic agents can cause dermatological toxicity, among other side effects. The most familiar adverse effect of chemotherapy is alopecia. Although not serious, this changes the outward appearance of cancer patients. Other adverse effects include hypersensitivity and photosensitivity reactions, hand-foot syndrome, epidermal necrolysis, recall reactions, scleroderma-like reactions, Raynaud's phenomenon, eccrine squamous syringometaplasia, neutrophilic eccrine hidradenitis, nail abnormalities, pigmentation changes and extravasation injuries. Onset of these adverse effects often causes dose reduction and/or delayed treatment, which can affect patient survival and quality of life. It is therefore important to prevent their occurrence and treat them promptly, which requires cooperation between medical oncologists and dermatologists. This article reviews chemotherapy-associated dermatological toxicity, along with its diagnosis and therapeutic management.
La quimioterapia convencional continúa siendo un pilar fundamental en el tratamiento del cáncer. De hecho, las indicaciones para la quimioterapia son cada vez más numerosas, para un espectro cada vez más amplio de tumores. Esta es la razón de la existencia de una mayor diversidad de toxicidades, que deben ser identificadas y gestionadas. Un manejo correcto de las mismas se traduce en un mejor control de los síntomas y una mejor calidad de vida para los pacientes. Los fármacos citotóxicos inhiben la división celular al actuar sobre varios puntos del ciclo celular. Por eso, al mismo tiempo que ejercen su actividad sobre las células tumorales, actúan también sobre células sanas con alta tasa de división celular, como son las de la piel y sus apéndices, por lo que muchas estructuras pueden verse afectadas.
Las toxicidades dermatológicas causadas por los quimioterápicos deben ser diagnosticadas correctamente. En muchos casos las medidas terapéuticas empleadas para reducir su gravedad y duración deben instaurarse tan pronto como sea posible. Algunas veces, la toxicidad cutánea significa reducir la dosis, retrasar los ciclos o, incluso, interrumpir la terapia contra el cáncer. Siempre que existan medidas preventivas estas deben ser aplicadas. Un elemento clave en el cuidado de estos pacientes es la evaluación multidisciplinar llevada a cabo por dermatólogos y oncólogos médicos. Este artículo revisa las principales reacciones dermatológicas a la quimioterapia, centrándonos en su diagnóstico y tratamiento.
Clasificación de los agentes quimioterápicos y mecanismo de acción de la toxicidad cutáneaLa toxicidad dermatológica causada por la quimioterapia puede desarrollarse mientras el fármaco o los fármacos están siendo administrados, como por ejemplo las manifestaciones cutáneas por extravasación y las reacciones de hipersensibilidad cutánea. De manera alternativa pueden aparecer como efectos secundarios de la propia citotoxicidad del agente. Las características de las reacciones cutáneas varían según el fármaco implicado. Aunque no se han identificado los mecanismos de acción desencadenantes de las toxicidades concretas, las reacciones pueden ser clasificadas conforme a las clases de fármacos quimioterápicos que las producen (tabla 1)1–9.
Clasificación de los fármacos quimioterápicos, mecanismos de acción y toxicidades cutáneas frecuentes
| Clase de fármaco quimioterápico y mecanismo de acción | Toxicidad cutánea | |
|---|---|---|
| Agentes alquilantes:Forma enlaces covalentes con el ADN; causa la muerte celular por inhibición de la función del ADN | Busulfan | Hiperpigmentación, mucositis, erupción cutánea y prurito |
| Thiotepa | Hiperpigmentación, mucositis, descamación y reacciones alérgicas | |
| Mostazas de nitrógeno: ciclofosfamida, ifosfamida, clormetina, clorambucilo y melfalán | Hiperpigmentación de piel y apéndices con ciclofosfamida e ifosfamidaAlopecia con clormetina, ciclofosfamida e ifosfamidaMucositis con melfalán a dosis altas y ciclofosfamidaErupción y síndrome de Stevens-Johnson con clorambucilo. | |
| Carmustina y estreptozocina | Rubor facial con carmustina | |
| Dacarbazina y temozolomida | Fenómenos de fotosensibilidad | |
| Fármacos de platino:Forman enlaces covalentes con el ADN: causa la muerte celular por inhibición de la función del ADN | Cisplatino, carboplatino y oxaliplatino | Reacciones a la infusiónAlopecia con cisplatino |
| Antimetabolitos:Inhiben la síntesis y reparación del ADN, principalmente por interferencia en la formación de bases nitrogenadas | Antifolatos: metotrexato y pemetrexed | Mucositis, limitante de la dosis con metotrexatoErupción cutánea, fotosensibilidad, hiperpigmentación, alopecia y fenómenos de evocación en zonas irradiadas con metrotexato |
| Fluoropirimidinas: fluorouracil y capecitabina | Mucositis, síndrome mano-pie, hiperpigmentación, fotosensibilidad, dermatitis exfoliativa | |
| Análogos a nucleósidos: gemcitabina, citarabina, azacitidina e hidroxicarbamida | Mucositis, erupción maculopapular y fenómenos de evocación con gemcitabinaMucositis, eritema, hidradenitis y alopecia con citarabina. Raramente, síndrome mano-pie. | |
| Análogos a purinas: mercaptopurina, tioguanina, fludarabina y cladribina | Mucositis, erupción cutánea y fotosensibilidad | |
| Inhibidores de la topoisomerasa:Rompen la doble cadena del ADN y causan la muerte celular por inhibición de la enzima ADN-topisomerasa i (topo i) y ii (topo ii). | Camptotecinas: irinotecan y topotecan | Alopecia |
| Antraciclinas: doxorrubicina, epirrubicina, doxorrubicina liposomal, daunorrubicina, idarrubicina | Mucositis, alopecia, hiperpigmentación ungueal, fotosensibilidad, fenómeno de evocaciónCon las antraciclinas liposomales la alopecia es menor pero son mayores la incidencia de mucositis, síndrome mano-pie y reacciones a la infusión. | |
| Mitoxantrona | Mucositis, alopecia, decoloración ungueal | |
| Dactinomicina | Mucositis, alopecia, hiperpigmentación, fotosensibilidad, fenómeno de evocación | |
| Etopósido y tenipósido | Alopecia, mucositis, fenómeno de evocaciónReacciones a la infusión | |
| Agentes antimicrotubulares:Bloquean la formación de los microtúbulos, que conduce la inhibición de la mitosis y de la división celular | Taxanos: paclitaxel, docetaxel, cabazitaxel y paclitaxel albúmina | Reacciones a la infusiónAlopecia, onicolisis y mucositis con paclitaxelFotosensibilidad, eritema maculopapular, alopecia, hiperpigmentación ungueal, síndrome mano-pie y mucositis con docetaxel |
| Alcaloides de la vinca: vinorelbina, vincristina y vinblastina | Alopecia, mucositis y erupción cutánea | |
Entre las reacciones de hipersensibilidad de tipo i distinguimos la urticaria y el angioedema de las reacciones anafilactoides. Es fundamental esta diferenciación, ya que la aproximación terapéutica es completamente diferente10. Las reacciones tipo i incluyen la hipersensibilidad al carboplatino y al oxaliplatino, manifestándose como urticaria, angioedema, broncoespasmo e hipotensión tras 6-8 ciclos de tratamiento, lo que sugiere una reacción IgE mediada. El uso de fármacos de platino está contraindicado en los casos de reacción de hipersensibilidad previa, debido a la existencia de reacciones cruzadas entre ellos11. El tratamiento de estos episodios consiste en la administración de adrenalina, corticosteroides y antihistamínicos, así como en el cese de la medicación10. Debido a la relevancia de las combinaciones de carboplatino y oxaliplatino para el tratamiento de numerosos tumores, como el de ovario, pulmón o colon, se han propuesto estrategias terapéuticas que permitan mantener el uso de este tipo de fármacos, que incluyen la reducción de la tasa de infusión, la premedicación con fármacos antihistamínicos o corticosteroides o la desensibilización12. Otro ejemplo de hipersensibilidad tipo i es la reacción desencadenada por la L-asparaginasa, que también provoca reacciones a la infusión. Mediante la premedicación y una tasa de infusión más lenta, los pacientes que experimentan reacciones a la infusión pueden continuar con la terapia. Sin embargo, aquellos pacientes que presentan hipersensibilidad a la L-asparaginasa deberían cambiar a la Erwinia chrysanthemi asparaginasa13. En el caso de la doxorrubicina tiene lugar un tipo especial de hipersensibilidad tipo i caracterizada por la aparición de un brote de urticaria sobre la vena en el lugar de la inyección. La roncha lineal puede ir acompañada de sensación dolorosa o escozor, que desaparece a los 45minutos14.
Las reacciones anafilactoides incluyen las inducidas por los taxanos, que son atribuidas al vehículo empleado en su administración (Cremophor EL® y Tween 80). Se manifiestan como enrojecimiento, dificultades respiratorias y erupción, y pueden progresar a hipotensión grave, asistolia y muerte15. Dichas reacciones aparecen a los pocos minutos de la primera infusión y se previenen mediante la premedicación con dexametasona oral10. Ya están disponibles en el mercado formulaciones de Placlitaxel que no contienen Cremophor® (nab-paclitaxel), y que tienen una menor incidencia de este tipo de toxicidad16.
El ejemplo típico de hipersensibilidad tipo iii es la vasculitis causada por la formación de inmunocomplejos, detectada durante el tratamiento a altas dosis de metotrexato o en la terapia con hidroxicarbamida17. Como reacción de hipersensibilidad de tipo iv está la dermatitis de contacto sistémica, que aparece a continuación de la administración intravesical de mitomicina. Se caracteriza por la aparición, a las 24 horas postratamiento, de eccema agudo en las palmas, las plantas, las orejas y la región perineal. Se diagnostica mediante pruebas epicutáneas18.
Los pacientes en quimioterapia sufren frecuentemente fenómenos de fotosensibilidad, consistentes en reacciones fototóxicas causadas por exposición a la radiación ultravioleta. Las lesiones parecidas a quemaduras solares quedan limitadas a las zonas expuestas a la luz y pueden desembocar en hiperpigmentación. Las sustancias que con mayor frecuencia se encuentran implicadas en estas reacciones son el fluorouracilo y sus derivados (capecitabina y tegafur), dacarbazina y vinblastina19.
Lesiones que afectan de manera predominante a la epidermisEl término «eritema tóxico por quimioterapia» fue introducido por Bolognia et al. para referirse a un grupo de reacciones tóxicas que compartían diferentes aspectos de su patogenia, histología y características clínicas20. El mecanismo patogénico responsable incluye citotoxicidad contra los queratinocitos epidérmicos y, en menor medida, las células ductales ecrinas de la epidermis.
El patrón histológico característico es de citotoxicidad epidérmica con dermatitis de interfase pobre en células, degeneración hidrópica basal, necrosis queratinocítica, atipia queratinocítica y presencia de figuras mitóticas en las capas superiores de la epidermis.
Estas lesiones se manifiestan clínicamente como áreas eritematosas dolorosas, a menudo asociadas a edema y en ocasiones con ampollas.
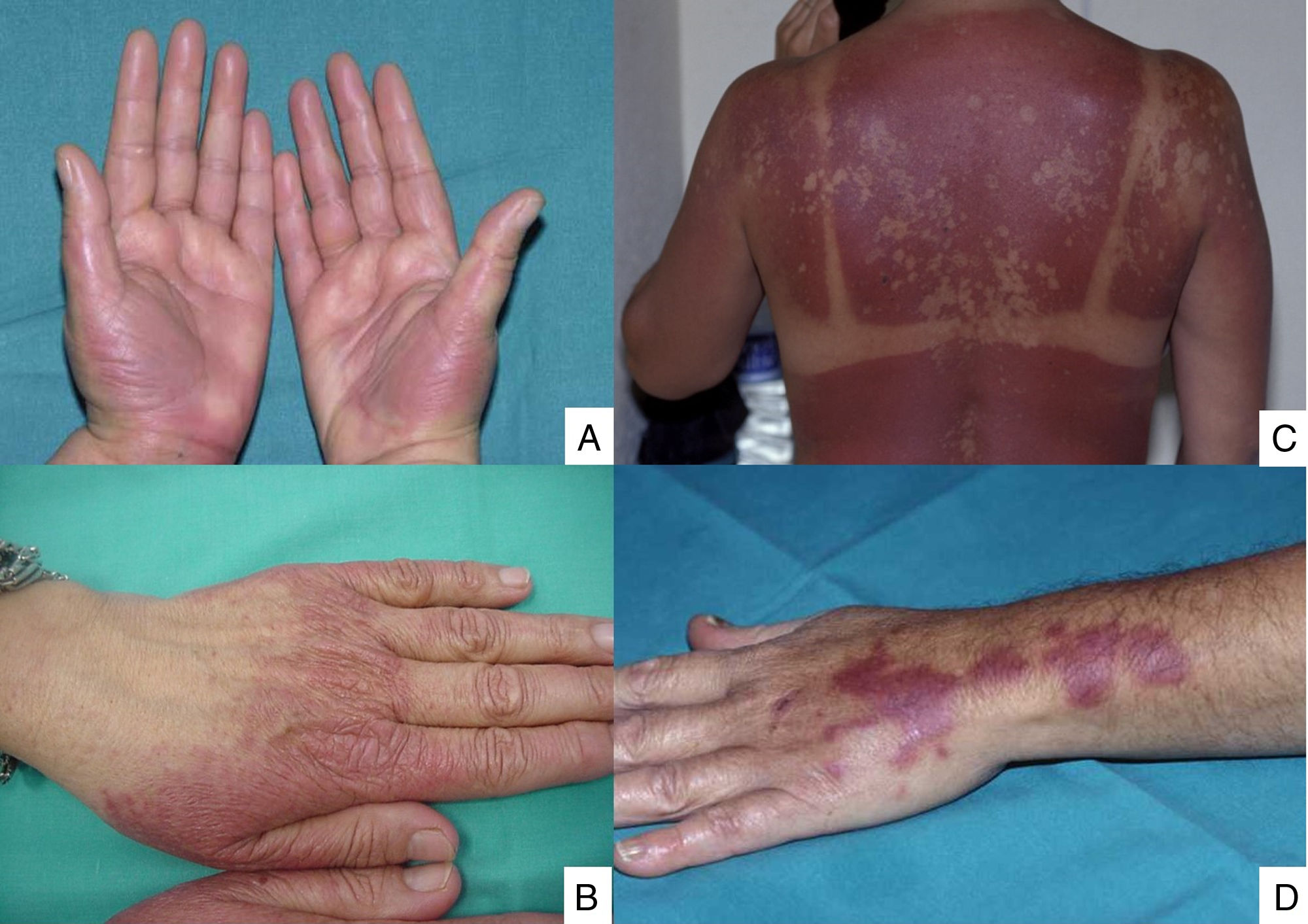
Las lesiones se localizan principalmente en las manos y los pies, en las áreas intertriginosas (especialmente en la axila y la ingle) y, con menos frecuencia, sobre los hombros, rodillas y orejas. Las lesiones del eritema tóxico por quimioterapia son autolimitantes y suelen resolverse con descamación e hiperpigmentación posinflamatoria. El diagnóstico erróneo constituye el principal riesgo en este tipo de lesiones, ya que con frecuencia se describen como reacciones de hipersensibilidad, erupciones alérgicas a fármacos y dermatitis de contacto, así como enfermedad injerto contra huésped, vasculitis o infecciones cutáneas. Este grupo de lesiones incluyen el eritema acral inducido por quimioterapia, lesiones inflamatorias en el lugar de la inyección de la quimioterapia, fenómenos de evocación y eritema difuso inducido por quimioterapia (fig. 1).
El eritema acral también se conoce como eritrodisestesia palmar-plantar o síndrome mano-pie. Tiene lugar a partir de las 48horas postratamiento. Se manifiesta con eritema, edema y descamación palmar-plantar, asociadas a sensación de incomodidad localizada como parestesia, dolor y escozor. Las formas más graves evolucionan a lesiones fisuradas y ampollas. Las lesiones persisten una o 2 semanas y empeoran en cada ciclo de quimioterapia. El proceso se resuelve tras la interrupción del tratamiento o reducción de la dosis21. Los fármacos que con mayor frecuencia se asocian a este tipo de toxicidad son el fluorouracilo, capecitabina, citarabina, doxorrubicina liposomal, vinorelbina, docetaxel y paclitaxel1,22. La erupción es dosis dependiente, por lo que la quimioterapia a altas dosis es la responsable en mayor medida de este tipo de lesiones22. Las descripciones clásicas del eritema acral hacen referencia a lesiones localizadas, típicamente en las palmas y plantas. Sin embargo, en ocasiones puede aparecer en localizaciones atípicas, como son el dorso de las manos y los pies, los hombros o, incluso, en las orejas20,23. Estas localizaciones atípicas suelen verse con mayor frecuencia con los taxanos y la doxorrubicina liposomal. Las lesiones consisten en eritema, edema y descamación en el dorso de las manos y los dedos, y deben ser diferenciadas de las erupciones fototóxicas24.
El eritema acral se asocia a menudo a la onicolisis, en especial en pacientes sometidos a ciclos de docetaxel y paclitaxel semanales25. Es causa frecuente de toxicidad dosis-limitante, en especial durante la terapia con capecitabina y doxorrubicina liposomal. De hecho, es la lesión cutánea que aparece implicada con mayor frecuencia en la toxicidad dosis-limitante. Aparte de reducir la dosis, prolongar el intervalo de dosificación y, como último recurso, retirar el fármaco, no existe tratamiento para el eritema acral. Los pacientes pueden conseguir una mejoría sintomática mediante la aplicación local de compresas frías, emolientes y corticosteroides tópicos y con analgésicos orales21. En el eritema acral inducido por docetaxel se ha usado el enfriamiento de manos y pies durante la administración del agente, con resultados parciales26. La terapia con corticosteroides sistémicos puede ser de ayuda en algunos casos. Este tratamiento se ha utilizado con éxito en la prevención del eritema acral inducido por fluorouracilo y doxorrubicina liposomal. También se ha utilizado la piridoxina (vitamina B6) en dosis de 300 y 1.500mg/día cuando las lesiones aparecen durante el tratamiento con fluorouracilo, docetaxel, etopósido y doxorrubicina27, si bien no se ha confirmado la eficacia del mismo en ensayos clínicos controlados.
Necrólisis epidérmica localizada en el lugar de la inyecciónLa necrólisis epidérmica es una erupción eritematosa y/o edematosa, ocasionalmente bullosa, que tiene lugar entre las 24-48horas tras la inyección del citostático. Aparece a lo largo del recorrido de la vena inyectada. Histológicamente se caracteriza por un patrón de citotoxicidad epidérmica. Este daño siempre tiene lugar tras una sesión de quimioterapia sin complicaciones (ni extravasación ni flebitis química). La erupción persiste durante una o 2 semanas y puede dejar una hiperpigmentación residual tras su curación.
No existe ningún informe consistente sobre la necrólisis epidérmica en la literatura, de manera que el conocimiento clínico e histológico procede únicamente de la comunicación de casos aislados. Los diferentes términos utilizados para definirla son eritema multiforme semejante a reacción en el sitio de la inyección, erupción supravenosa persistente, placas de eritrodisestesia fijas y erupción farmacológica fija en el sitio de la inyección28–30. Según los casos de erupción supravenosa persistente documentados en la literatura esta manifiesta con lesiones eritematosas lineales, maculares a lo largo de la vena inyectada con el fármaco quimioterápico28. Los casos de eritema multiforme localizado consistieron en pápulas edematosas y vesículas agrupadas en el sitio de la inyección, y siguiendo una trayectoria lineal a lo largo de la vena en la que se ha administrado la infusión29. Los informados como eritema fijo o placa de eritrodisestesia se manifestaron con una placa eritematosa solitaria en el sitio de la inyección que evoluciona a una ampolla30. Todos ellos presentaron características clínicas e histológicas típicas de eritema tóxico por quimioterapia. Los fármacos que con mayor frecuencia se asocian a estas erupciones son los alcaloides de la vinca (especialmente vinorelbina), los taxanos (especialmente docetaxel) y el fluorouracilo. Estas lesiones se deben a un fenómeno de citotoxicidad que afecta directamente a la epidermis, debido a las altas concentraciones locales del medicamento quimioterápico en la vena inyectada.
Reacciones de evocación (fenómenos de evocación)La dermatitis de evocación es el resultado de una toxicidad tisular aguda en un área de piel previamente expuesta a radiación o quemadura solar, cuando a continuación (días o años más tarde) el paciente recibe quimioterapia o, con menos frecuencia, en el contexto de la administración de otra medicación. Los fármacos que con más frecuencia se asocian a las lesiones de este tipo son los taxanos, el metotrexato, la dactinomicina y la doxorrubicina31,32. La erupción está muy bien delimitada y confinada a la zona previamente dañada. Se manifiesta clínicamente como eritema, edema y dolor. El período de latencia entre la dermatosis inicial y su reactivación por la quimioterapia puede oscilar desde un mes a más de 5 años32. Se calcula una prevalencia del 6% para la dermatitis evocada por radiación entre los pacientes tratados con radioterapia y taxanos, mientras que en pacientes sometidos a radioterapia y tratamiento con dactinomicina es del 47%33.
Lesiones que afectan preferentemente a la dermisReacciones similares a la esclerodermia inducidas por taxanosLa aparición de cambios semejantes a la esclerodermia ha sido asociada con las terapias con docetaxel y paclitaxel. Los taxanos inducen la esclerosis por sí mismos, no sus excipientes ni sus compuestos solventes34. En la etiopatogenia de estos cambios están implicados altos niveles de factor de necrosis tumoral-α e interleuquina 635. La mayoría de los casos descritos tiene lugar a los 3 a 10 meses tras el comienzo de la terapia. La reacción comienza como un edema que afecta a ambos miembros inferiores y, en cuestión de semanas, progresa hacia la induración y esclerosis de la piel36. También se han documentado casos que afectan a la cara y a los miembros superiores. Por lo general, este proceso se detiene mediante la interrupción del tratamiento. Puede incluso desaparecer, pero empeora cuando se reanuda el tratamiento con el fármaco. Aunque poco frecuente, ha habido casos aislados de esclerosis sistémica (esófago, músculos)35. Por lo general, sin embargo, no se presentan otras características típicas de la esclerodermia sistémica como los cambios capilares del lecho ungueal, fenómeno de Raynaud, calcinosis y autoanticuerpos de esclerodemia37. El examen histológico de la piel revela cambios indistinguibles de los observados en la esclerodermia, con una dermis engrosada, compuesta de haces de colágeno esclerótico, atrofia de los apéndices y engrosamiento septal interlobular en el tejido celular subcutáneo.
Fenómeno de Raynaud inducido por bleomicinaEl fenómeno de Raynaud es una manifestación cutánea asociada con el uso de bleomicina. Por lo general ocurre con dosis de fármaco acumulativa, por lo que tras 3-4 ciclos de terapia el 35-45% de los pacientes desarrolla el fenómeno de Raynaud persistente, y es más probable que aparezca en personas que reciben bleomicina en forma de bolos intravenosos en vez de en infusión continua38. Sin embargo, según se informa, en pacientes con antecedentes de síndrome idiopático de Raynaud y en fumadores38 el fenómeno de Raynaud se produjo después de la primera infusión del medicamento. El espasmo venoso sufrido por dichos pacientes provoca dolor intenso e incluso puede causar necrosis en los dedos distales o de los pies. No ha sido totalmente dilucidada la etiología de este fenómeno en el contexto de la quimioterapia, sin embargo se han sugerido 2 mecanismos posibles: daño farmacológico directo sobre las células endoteliales, o estimulación simpática anormal por neuropatía inducida por quimioterapia, con vasoconstricción resultante39. Para el tratamiento del fenómeno de Raynaud se han utilizado fármacos vasodilatadores que van desde la nifepidina al sildenafilo, iloprost o bosentan.
Lesiones que afectan de manera predominante a las glándulas ecrinasSiringometaplasia escamosa ecrinaEl término siringometaplasia escamosa ecrina (SEE) describe la sustitución del epitelio cúbico del conducto ecrino por 2-3 capas de epitelio escamoso queratinizado en el interior del conducto. Este patrón histológico se he descrito como un hallazgo accidental en el contexto de dermatosis infecciosas, inflamatorias y relacionadas con tumores, reacciones fototóxicas e, incluso, en úlceras debidas a múltiples etiologías. Sin embargo, este efecto adverso se ha asociado con la administración de una amplia gama de fármacos de quimioterapia. Es particularmente frecuente con la doxorrubicina liposomal pegilada, y con menos frecuencia con la ciclofosfamida, la gemcitabina, los taxanos y el temsirolimus, así como con algunos de los nuevos fármacos inhibidores de la quinasa, como son el imatinib, el sunitinib, el vemurafenib y el dabrafenib. Se especula que la SEE puede tener lugar por el efecto tóxico de los quimioterápicos sobre el epitelio ecrino ductal40–44.
Clínicamente, la SEE se suele presentar en los primeros 30 días de tratamiento con quimioterapia como una erupción compuesta por lesiones y placas eritematosas, algunas de las cuales pueden estar erosionadas o parcialmente descamadas. Normalmente se localizan en los pliegues cutáneos (axilas, ingles y debajo de las mamas), y en el cuello y los párpados. Como tratamiento, la aplicación de corticoides moderadamente potente durante 10 días suele ser suficiente. Los corticosteroides orales deben reservarse para los casos más graves. Si el paciente necesita recibir más ciclos con el mismo fármaco quimioterápico, una reducción de la dosis de entre el 15-20% suele prevenir la recurrencia de las lesiones40.
Hidradenitis ecrina neutrofílicaActualmente se considera la hidradenitis ecrina neutrofílica (HEN) como parte del espectro de las dermatosis neutrofílicas. Clínicamente se suele manifestar como placas eritematosas diseminadas, algunas veces con apariencia de urticaria, en el contexto de una enfermedad febril. Histológicamente, se caracteriza por la presencia de un infiltrado neutrofílico alrededor de los conductos ecrinos, junto con la necrosis de algunas células ductales.
A menudo se asocia a un amplio abanico de malignidades y fármacos, pero se suele relacionar con la leucemia mieloide y la citarabina45. Al igual que lo descrito anteriormente para la SEE, la HEN se ha asociado con las nuevas terapias dirigidas utilizadas para el tratamiento del melanoma, como son el vemurafenib o dabrafenib46. Se desconoce la patogenia de esta enfermedad, aunque se ha sugerido el efecto tóxico de los fármacos sobre el epitelio ductal.
Algunos autores consideran que la HEN y la SEE son parte de un espectro de reacciones cutáneas a los fármacos quimioterápicos que pueden aparecer incluso a lo largo del tiempo en el mismo paciente. La HEN representaría así la etapa temprana, con infiltrado neutrofílico denso, y la SEE sería la etapa tardía, en la que el epitelio ductal está experimentando una diferenciación escamosa47.
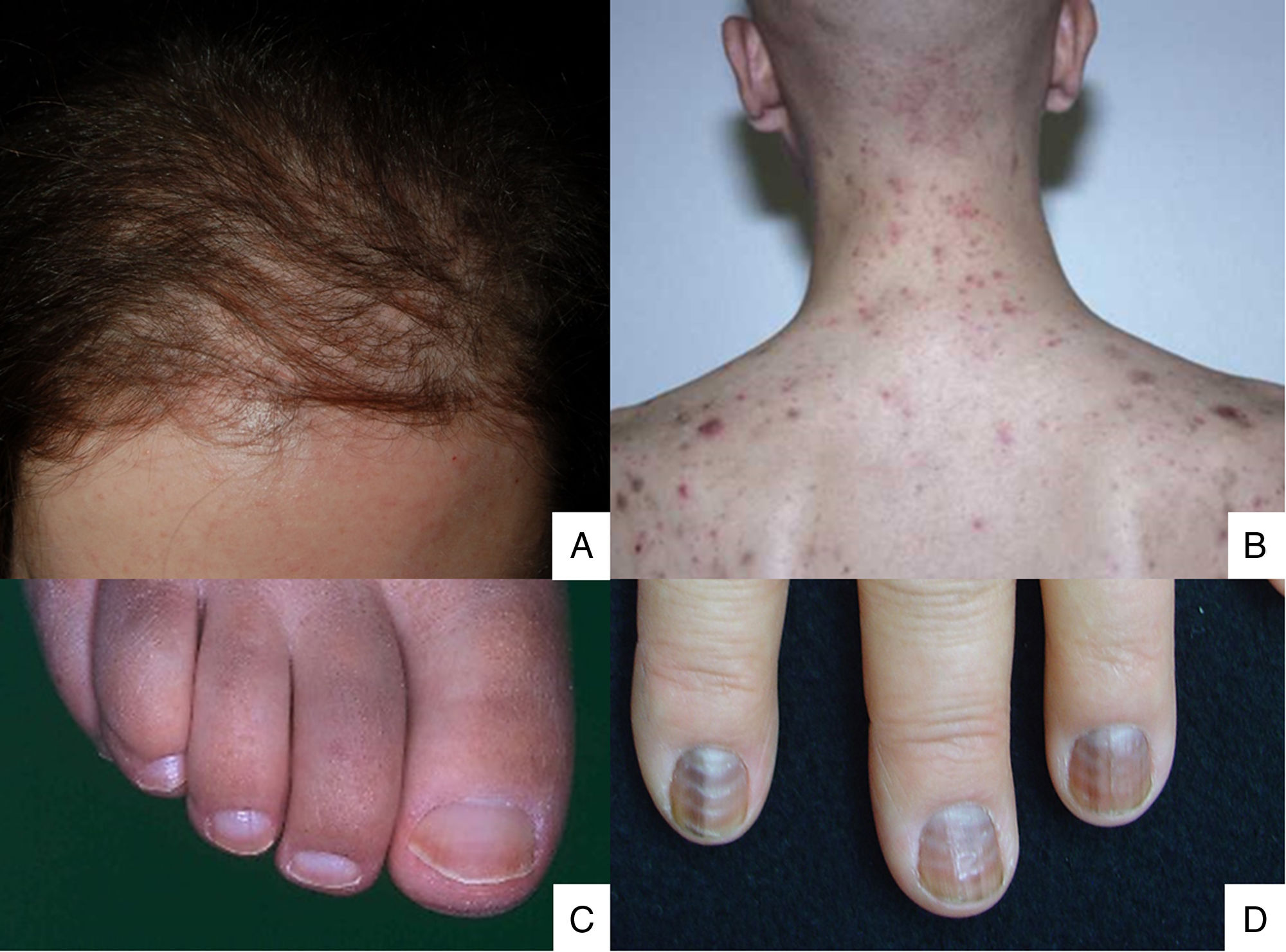
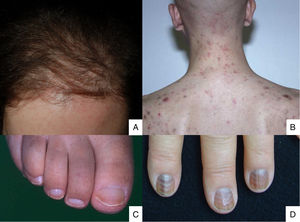
Lesiones que afectan de manera predominante al folículo piloso y al aparato unguealLa alopecia es frecuente después de la quimioterapia debido al hecho de que el epitelio folicular posee una tasa mitótica alta. Este proceso afecta principalmente a la fase proliferativa del folículo (efluvio anágeno). La forma de presentación guarda relación con el fármaco empleado, la dosis, la duración del tratamiento y la respuesta del paciente48. Son muchos los fármacos que la causan (tabla 2)49,50. Se manifiesta a los pocos días o semanas del inicio de la quimioterapia y es casi completa a los 2-3 meses (fig. 2A). La zona del borde de implantación del cabello suele estar respetada. En los hombres suele afectar a la región occipital (50% de los casos) y frontal (15%), o puede producirse una alopecia total (35%). En las mujeres puede ser total (52%), o como en el caso anterior afectar a la región frontal (40%) u occipital (8%)51. La pérdida de pelo es difusa o parcheada.
A. La alopecia posquimioterapia es difusa, aparece en las primeras semanas del tratamiento y respeta el borde de implantación del cabello. B. Foliculitis tras la administración de dactinomicina; C. Uñas mitad-mitad. D. Líneas de Muehrcke con pigmentación difusa después de la administración de ciclofosfamida.
Histológicamente en las etapas tempranas se observan queratinocitos necróticos y disqueratósicos, acompañados de vacuolización del epitelio folicular. En los estadios avanzados se observan pelos telógenos y unos pocos folículos en fase anágena. Hay una muy pequeña cantidad de infiltrado inflamatorio52. La recuperación del pelo tiene lugar entre el mes y los 3 meses una vez que cesa la quimioterapia. Algunos pacientes experimentan cambios en la textura, color y grosor de los folículos. Se denomina alopecia permanente cuando el crecimiento del folículo es incompleto o no se produce tras los 6 meses posquimioterapia. Este fenómeno es más frecuente en niños que en adultos53. Se ha sugerido que, en dosis altas, la acción de algunos fármacos de quimioterapia sobre las células madre foliculares o las vías de señalización folicular pueden ser la causa de la alopecia permanente54,55. Este hecho se ha descrito con más frecuencia tras la administración de taxanos e IFN-α-2a56,57. El enfriamiento del cuero cabelludo puede prevenir la aparición de la alopecia.
La foliculitis inducida por quimioterapia ha sido descrita en casos aislados, a pesar de ocurrir en más del 40% de los pacientes tratados con fármacos como la dactinomicina (fig. 2B)58,59. De acuerdo con la experiencia de los autores, la foliculitis también puede aparecer tras la administración de paclitaxel, docetaxel, doxorrubicina, ciclofosfamida y carboplatino. Se manifiesta de forma generalizada en la cara, el tronco y las nalgas, y a veces evoluciona a comedones, que pueden confundirse con acné en pacientes adolescentes. En otras ocasiones aparece de manera localizada sobre el rostro, el cuero cabelludo, la frente y la nuca. En estos casos se asocia a la terapia con ciclofosfamida/ifosfamida y fármacos de platino. Normalmente no se acompaña de comedones aunque se suele asociar con la neutropenia febril. Los cultivos son negativos y la biopsia de piel revela una foliculitis supurativa. No obstante, cuando las lesiones pustulares aparecen en estos pacientes se debería realizar siempre un diagnóstico diferencial con la foliculitis secundaria a la administración de corticoides orales (incluida en la medicación administrada previamente a la quimioterapia, o prescrita por otros motivos). Las alteraciones ungueales aparecen como decoloración marrón, bien transversal o longitudinal (melanoniquia estriada), o difusa (melanoniquia difusa)60. Se asocian a la terapia con ciclofosfamida, doxorrubicina, hidroxicarbamida, busulfán, taxano, capecitabina, cisplatino o bleomicina. También se pueden manifestar como leuconiquia transversa o líneas de Mees, ya que la queratinización de la uña está dañada debido al efecto de los fármacos citostáticos (doxorrubicina, ciclofosfamida y vincristina). La leuconiquia también puede aparecer por alteración del flujo sanguíneo a las uñas: uñas mitad-mitad o uñas de Lindsay (la mitad inferior opaca) (fig. 2C), líneas de Muehrcke (bandas blanquecinas paralelas a la lúnula) (fig. 2D) y uñas de Terry (opacas casi en su totalidad). Las líneas de Beau son líneas transversales en la lámina ungueal provocadas por la detención de la actividad de la matriz. Cuando el surco es más profundo y divide la lámina en 2 recibe el nombre de onicomadesis. Los cambios en el grosor pueden causar coiloniquia (uñas en cuchara), onicorrexis (uñas con surcos logitudinales), onicosquicia (fragmentación distal) o traquioniquia (uñas rugosas). También pueden producir onicolisis (desprendimiento distal), siendo en ocasiones hemorrágica con los taxanos. En estos casos se puede asociar con eritema en el dorso de las manos o alrededor de los tobillos y en la zona del tendón de Aquiles. A esto se le ha llamado síndrome de eritema tenar periarticular y onicolisis61. Para finalizar, se ha informado de casos de paroniquia y granulomas piógenos periungueales con tratamientos con capecitabina, metotrexato o doxorrubicina. Las alteraciones de la uña o región ungueal asociadas a la bleomicina pueden deberse a la inducción del fenómeno de Raynaud o a cambios similares a la esclerodermia38.
Lesiones que afectan de manera predominante a la pigmentaciónLos cambios pigmentarios inducidos por quimioterapia constituyen un evento adverso frecuente que puede afectar a la piel, a la mucosa y al aparato ungueal. Pueden estar causados por múltiples agentes quimioterápicos. Aunque el mecanismo patogénico no se conoce con precisión se piensa que el responsable puede ser un efecto tóxico directo sobre los melanocitos62.
Los posibles cambios pigmentarios que pueden tener lugar adquieren la forma principalmente de hiperpigmentación, aunque también se han descrito lesiones semejantes al vitíligo63. La hiperpigmentación es más común en pacientes con fototipos altos, y por lo general aparecen después de varios ciclos de terapia. Sin embargo, pueden aparecer al inicio del tratamiento, o en estadios tardíos tras interrumpir el tratamiento64.
La hiperpigmentación inducida no es específica de un agente quimioterápico concreto, y puede surgir como un componente de varias enfermedades clínicas:
- •
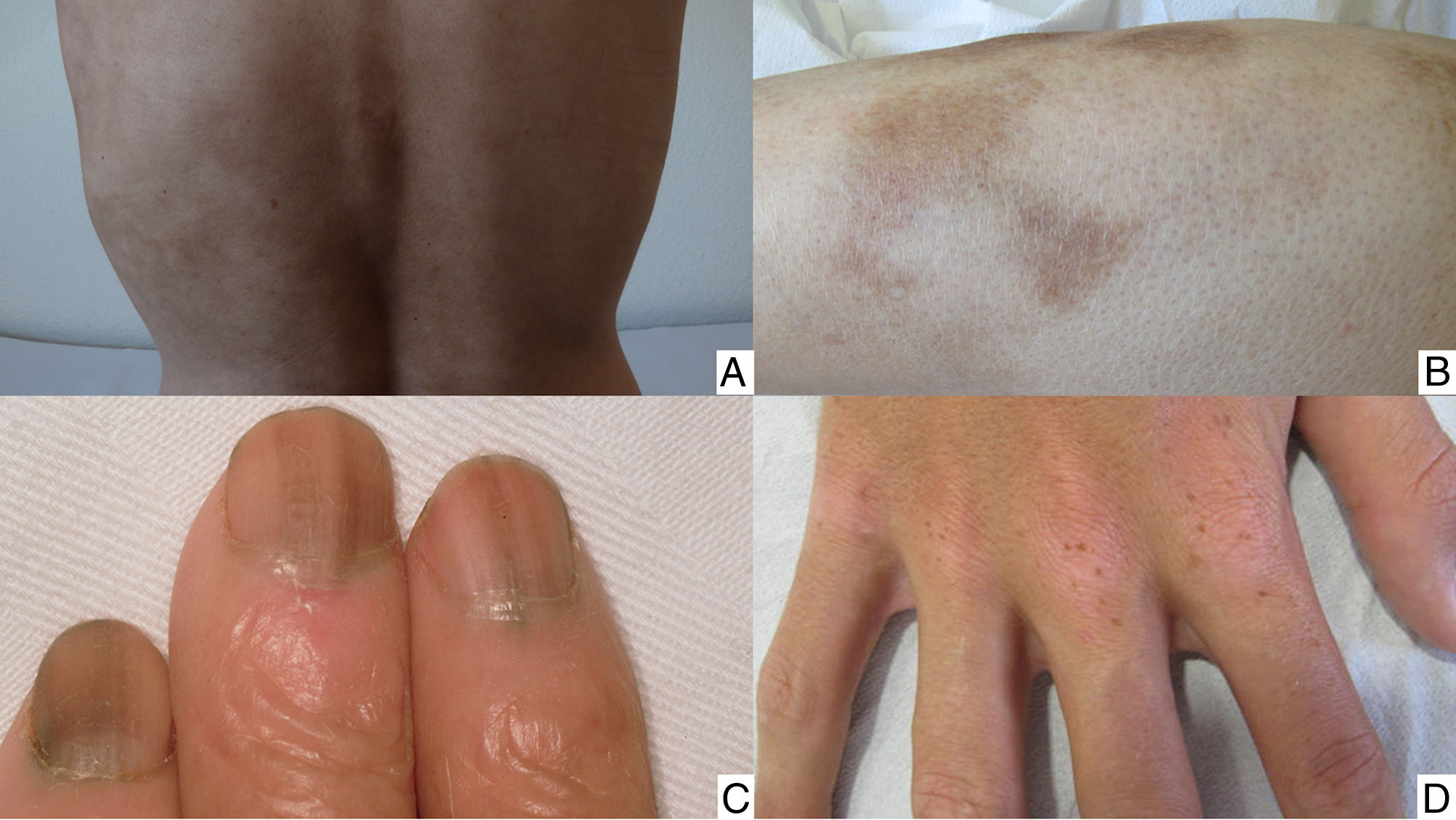
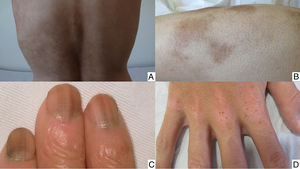
Hiperpigmentación difusa (busulfan, fluorouracilo, capecitabina, ciclofosfamida, doxorrubicina, daunorrubicina) (fig. 3A): localizada en áreas ocluidas, pliegues grandes de la piel y sobre los hombros, las rodillas y las espinillas (ciclofosfamida, ifosfamida, busulfán, tiotepa, doxorrubicina liposomal), en las zonas acrales (fluorouracilo, capecitabina, tegafur, ciclofosfamida, ifosfamida, doxorrubicina65); áreas expuestas a la luz (fluorouracilo, capecitabina, daunorrubicina66); secundaria a dermatosis inflamatorias previas (antraciclinas, agentes alquilantes, antimetabolitos) (fig. 3B)20.
- •
La hiperpigmentación de la mucosa es rara, puede ser pasada por alto, y no siempre se distingue con facilidad de la pigmentación fisiológica o de la coloración por otras causas. Puede deberse a antimetabolitos, algunos agentes alquilantes, antraciclinas o bleomicina67.
- •
Como hemos mencionado anteriormente, varias sustancias son las responsables de la pigmentación ungueal en forma de melanoniquia (fig. 3C). Por lo general aparece tras varias semanas o meses de terapia y tiende a desaparecer cuando finaliza el tratamiento.
- •
La hiperpigmentación flagelada inducida por bleomicina es muy característica de dicho fármaco, pero no solo exclusiva de él. También se ha descrito con bendamustina, docetaxel y trastuzumab, en enfermedades como la dermatomiositis o enfermedad de Still, y después del consumo de setas shiitake. Presenta apariencia lineal y distribución flagelada, preferentemente en el tronco y en los puntos de presión. Puede venir precedida de una fase inflamatorio pruriginosa, y la hiperpigmentación residual puede permanecer durante meses o años68.
- •
La hiperpigmentación supravenosa en serpentina es rara (fluorouracilo, agentes alquilantes, antibióticos antitumorales, taxanos, alcaloides de la vinca, inhibidores del proteosoma). Por lo general se localiza en el antebrazo (lugar de infusión) y sigue la red venosa superficial. El momento de su aparición varía y puede oscurecerse con cada ciclo69,70.
- •
También es poco frecuente la hiperpigmentación reticulada (bleomicina, ciclofosfamida, fluorouracilo, citarabina, idarrubicina, paclitaxel). Afecta especialmente a la espalda, y en menor medida al abdomen, los hombros y las nalgas. El momento de aparición es variable y, en ocasiones, se puede asociar a prurito o eritema. En la mayoría de los casos desaparece cuando la terapia termina71.
- •
Los nevi eruptivos son más frecuentes en niños y jóvenes adultos sometidos a tratamientos frente a malignidades hematológicas. Pueden estar involucradas sustancias como el fluorouracilo, la capecitabina, el metotrexato o la doxorrubicina (fig. 3D). Las palmas y las plantas son especialmente susceptibles. A veces los nevi tienen apariencia displásica y, muy ocasionalmente, pueden evolucionar a melanoma72.
La hiperpigmentación inducida por la quimioterapia rara vez requiere suspensión o detención del tratamiento y, la mayoría de los casos, se resuelve una vez que finaliza la terapia. La exposición a la luz solar puede favorecer su aparición, por lo que se recomienda una fotoprotección adecuada.
Lesiones por extravasaciónLa incidencia general de las lesiones por extravasación es baja y varía según las series (0,01-7%). Pueden aparecer inmediatamente o varios días después de la infusión. Según el tipo de reacción estas pueden ser clasificadas como irritativas o vesicantes73. Las reacciones irritativas son por lo general menos serias (irritación local, dolor, edema y eritema). Pueden ser causadas por agentes alquilantes, fármacos de platino, antimetabolitos, inhibidores de la topoisomerasa o doxorrubicina liposomal. Las reacciones vesicantes son potencialmente más serias y pueden causar incluso necrosis extensa de los tejidos colindantes. Pueden aparecer con los alcaloides de la vinca, los taxanos, las antraciclinas y algunos agentes alquilantes. La prevención es crucial (evitar la infusión en venas frágiles o de pequeño calibre), pero si la extravasación ocurre se debe suspender el tratamiento y seguir los protocolos establecidos según el fármaco implicado. Se reserva la cirugía para aquellos casos en los que sea necesaria, bien un desbridamiento quirúrgico bien tratar secuelas74.
Descripción de varias escalas de toxicidadLa Common Terminology Criteria for Adverse Events (CTCAE), también conocida como «criterios de toxicidad comunes», publicados por el National Cancer Institute (NCI) del National Institutes of Health (NHI), es el esquema de clasificación más ampliamente utilizado para los efectos adversos de la quimioterapia75. Estandariza la definición de cualquier toxicidad inducida por el tratamiento. Se emplea tanto en la práctica médica como en los ensayos clínicos. La toxicidad oscila entre el grado 1 a grado 5 (leve, moderada, grave, peligrosa para la vida y mortal, respectivamente).
El sistema NCI Patient Reported Outcomes-Common Terminology Criteria for Adverse Events (PRO-CTCAE) es una nueva manera de clasificar las toxicidades de acuerdo con la información aportada por los pacientes. Complementa a la CTCAE y su uso aún no se ha extendido. Caracteriza la frecuencia, gravedad e interferencia de 78 toxicidades inducidas por el tratamiento desde el punto de vista del paciente76.
Existen otros modelos de clasificación complementarios, como la Adverse Drug Reaction Terminology de la Organización Mundial de la Salud (WHO-ART)77 o las pautas de notificación de efectos adversos emitidas por el Grupo de Oncología Radioterápica. En ambos casos se codifica la información clínica sobre las reacciones adversas. En la primera, la información está relacionada con los fármacos, mientras que la segunda cubre todos los aspectos del tratamiento, incluida la radioterapia, cirugía y los dispositivos y medicamentos utilizados.
Ajustar y/o retrasar las dosis o interrumpir la terapia en función de la toxicidadDe acuerdo con la toxicidad cutánea se puede retrasar o reducir las dosis, y/o interrumpir la terapia, con las consiguientes repercusiones sobre la eficacia del tratamiento. No existe un criterio general de ajuste de dosis. Se recomienda que los pasos a seguir se tomen teniendo en cuenta la información de prescripción de cada fármaco. Se debe optimizar el tratamiento dermatológico de apoyo con el objeto de minimizar las reducciones y retrasos en las dosis.
Cómo y cuándo se debe remitir el paciente al departamento de dermatologíaAntes de comenzar la terapia los pacientes deben recibir información detallada sobre las toxicidades y sobre cómo actuar si estas tienen lugar. Algunos sitios ofrecen consultas médicas para evaluar la toxicidad dermatológica inducida por la quimioterapia y terapias dirigidas. Los pacientes por lo general también tienen acceso al personal de enfermería, bien de manera presencial o por teléfono, para consultas no programadas.
Cuando aparece la toxicidad cutánea esta debe ser evaluada para valorar la necesidad de remitir o no al paciente al departamento de dermatología, y si así fuera, con cuánta urgencia. Si necesita atención urgente las consultas de dermatología de urgencia son muy útiles. En los casos en los que estas no están disponibles se debe considerar el ingreso hospitalario o la remisión al departamento de urgencias.
Para aquellos pacientes en los que la terapia tenga una alta tasa de toxicidad cutánea, se aconseja su remisión al departamento de dermatología para ser sometidos a una evaluación inicial previa al inicio del tratamiento. Se debe elaborar un conjunto de recomendaciones y se debe monitorizar al paciente durante la terapia.
ConclusionesLa gestión, diagnóstico y tratamiento de la toxicidad cutánea inducida por la quimioterapia en pacientes con cáncer es una cuestión de probada importancia. Es necesario comprender y manejar correctamente los efectos adversos cutáneos. Necesitan tratamientos específicos, para permitir el diagnóstico temprano y prevenir las enfermedades que puedan tener repercusiones sobre la terapia de los pacientes con cáncer. Dichas repercusiones incluyen retrasar o reducir las dosis de fármaco, cambiar de fármaco o una mala adherencia al tratamiento, con las implicaciones resultantes para el pronóstico de los pacientes.
Debido a que la complejidad de la enfermedad puede dar lugar un error diagnóstico y del manejo de los efectos adversos, es fundamental la estrecha colaboración entre los oncólogos y los dermatólogos. La aproximación a todas las complicaciones relacionadas con la quimioterapia está mejorando día a día. En cuanto a las lesiones cutáneas este hecho se alcanza a través de una aproximación multidisciplinar encaminada a prevenir, diagnosticar y tratar aquellas toxicidades con mayor efectividad, y en consecuencia mejorar el pronóstico y la calidad de vida de los pacientes sometidos a quimioterapia.
Además de aquellas toxicidades graves que necesitan tratamiento urgente, las complicaciones dermatológicas también causan lesiones cuyo efecto más importante afecta a la propia imagen corporal. Los pacientes pueden estar recordando continuamente su enfermedad, con las consiguientes repercusiones psicológicas. Aquellos pacientes que mantienen una buena imagen corporal poseen una mejor calidad de vida y toleran mejor tanto la enfermedad como las terapias recibidas.
AutoríaOnofre Sanmartín, Carmen Beato, Hae Jin Suh Oh, Isabel Aragón, Agustín España, Margarita Majem, Sonia Segura, Alfonso Gúrpide, Rafael Botella, Cristina Grávalos participaron en la concepción y diseño del estudio, recopilación y análisis los datos, redacción, revisión crítica y aprobación de la versión final del manuscrito.
FinanciaciónEste proyecto ha sido desarrollado a través de subvenciones sin restricciones de AstraZeneca, Avène, Boehringer Ingelheim, Pierre Fabre, Roche Farma y La Roche Posay.
Conflicto de interesesLos autores declaran que, durante la redacción y revisión del texto, desconocían los nombres de las compañías que han proporcionado el apoyo financiero para llevar a cabo este proyecto, por lo que dicho apoyo no ha influido en el contenido de este artículo.
Los autores agradecen a Fernando Sánchez-Barbero de HealthCo (Madrid, España) la asistencia editorial en la producción de este manuscrito. La SEOM y la AEDV agradecen a AstraZeneca, Avène, Boehringer Ingelheim, Pierre Fabre, Roche Farma y La Roche Posay, el apoyo financiero para el desarrollo de este proyecto a través de subvenciones sin restricciones.