Muchos dermatólogos están muy poco familiarizados con las malformaciones arteriovenosas (MAV). Ello es debido, en parte, a la baja prevalencia de dichas lesiones y al hecho de que generalmente suelen ser tratadas por médicos de otras especialidades, en particular radiólogos intervencionistas de adultos y pediátricos, médicos maxilofaciales y cirujanos plásticos. En este artículo revisamos la nomenclatura recomendada para las MAV y nos centramos en sus manifestaciones clínicas y en su diagnóstico, así como en el tipo ideal y el tiempo de tratamiento. El manejo de las MAV debe hacerse desde una aproximación multidisciplinar, siendo el objetivo principal de los dermatólogos realizar un correcto diagnóstico para evitar, de este modo, tratamientos innecesarios.
Many dermatologists are largely unfamiliar with arteriovenous malformations (AVMs). This is partly due to the low prevalence of these lesions and to the fact that they are generally managed by other specialists, in particular, interventional radiologists and pediatric, maxillofacial, and plastic surgeons. In this article, we review the recommended nomenclature for AVMs and look at their clinical manifestations and diagnosis, as well as the ideal type and time of treatment. AVMs should be managed from a multidisciplinary approach, and the dermatologist's primary goal should be to make a proper diagnosis and thereby avoid unnecessary treatments.
Las malformaciones arteriovenosas (MAV) son anomalías vasculares de alto flujo debidas a un error en la embriogénesis, con comunicación directa entre la arteria y la vena sin lecho capilar de por medio1.
NomenclaturaLas MAV representan solo del 10 al 15% de las malformaciones vasculares pero:
¿Se usa la nomenclatura de forma correcta?Clásicamente en la nomenclatura de las malformaciones y tumores vasculares se han utilizado indistintamente términos como mancha salmón, mancha en fresa, en vino de Oporto o angioma, sin diferenciar aspectos clínicos, histopatológicos y terapéuticos entre unos y otros a pesar de tener una etiopatogenia distinta.
No fue hasta 1982 cuando Mulliken y Glowacki2 establecieron una clasificación aunando la estructura y aspectos histológicos del endotelio predominante con el comportamiento biológico de las anomalías vasculares.
Esta clasificación fue redefinida por Mulliken y Young en 1996 y adoptada por The International Society for the Study of Vascular Anomalies (ISSVA) donde la malformación es descrita por el componente predominante de la lesión vascular, separando las anomalías vasculares en tumores y malformaciones, pudiendo ser estas últimas de bajo o alto flujo. Esta clasificación es considerada hoy en día como la clasificación clásica3.
En la Clasificación de Hamburgo de 1988 se definieron las malformaciones vasculares en función de la lesión vascular predominante (arterial, venosa, Shunt AV y combinada) y en tronculares y extratronculares en función del eje vascular afectado.
Sin embargo, en un trabajo reciente de Hassanein y Mulliken4, donde se revisan los artículos publicados en Pubmed durante el año 2009, se refleja que el término hemangioma se usó de forma errónea en el 71,3% de los casos, demostrándose que incluso hoy en día la nomenclatura sigue siendo un problema importante, pudiendo causar confusión a la hora de recibir un tratamiento (como por ejemplo propranolol) que puede no estar indicado. En un futuro próximo, en la clasificación de las MAV, se tendrá en cuenta la genética, así como las pruebas diagnósticas basadas en la biología molecular de la lesión, la velocidad de flujo o la respuesta a tratamientos farmacológicos.
EtiologíaLa teoría etiopatogénica de mayor consenso postula que las MAV se deben a un aumento en el número de vasos, debido a un defecto en el desarrollo vascular, especialmente en la angiogénesis5. La localización más frecuente de las MAV es la cerebral y, por tanto, la más estudiada. A pesar de que no sabemos si se pueden extrapolar los hallazgos obtenidos del estudio de dichas MAV cerebrales a las MAV extracraneales, sí que parecen estar implicados en el crecimiento distintos factores angiogénicos como el Vascular Endothelial Growth Factor (VEGF) o el factor de crecimiento plaquetario. Se ha sugerido que esta sea la causa del proceso dinámico vascular que sufren las MAV, produciéndose la alteración de la angiogénesis de forma temprana, a diferencia de lo que ocurre en las malformaciones venosas (prueba de ello es el aumento del nivel sérico de metaloproteasas evidente en estas malformaciones). Las proteínas Signal transducers and activators of transcription (STAT) están también involucradas en la fisiopatología de la angiogénesis de las MAV. Un grupo de estas proteínas, concretamente las STAT 3, tiene su actividad preponderante en la etapa fetal y podría tener un papel importante en la angiogénesis. Conocer profundamente este proceso conllevará en el futuro a un tratamiento más específico y adecuado a cada situación.
Sin embargo, queda mucho por investigar al respecto sobre la importancia genética de estos trastornos y sus factores desencadenantes.
¿Existen factores desencadenantes?Sí. Los cambios hormonales (adolescencia, embarazo), traumatismos, procedimientos quirúrgicos o infecciones. Estos últimos suelen ser los factores implicados en las formas adquiridas acrales.
Sin embargo, hay muchos casos de MAV que permanecen en fase quiescente durante todo su curso clínico y otros que avanzan rápidamente, de forma similar a lo que acontece en tumores malignos de estirpe y estadio similares, donde unos se diseminan rápidamente y otros se estabilizan. Ambos casos podrían explicarse por el concepto de Knudson6, donde una penetrancia incompleta de los genes afectos da lugar a una gran variabilidad de la expresividad clínica.
Para Buckmilller et al.7, sin embargo, las malformaciones vasculares arteriovenosas se comportan como verdaderos tumores de crecimiento lento basándose en la demostrada existencia de recambio celular, inexistente en malformaciones venosas, capilares o linfáticas.
¿Existe algún avance en genética?La mayoría de los casos de MAV son esporádicos, donde no parecen haberse encontrado defectos genéticos. En algunas formas de MAV familiares se han identificado genes alterados8 (tabla 1), como ocurre en la telangiectasia hemorrágica hereditaria (Rendu-Osler)9 donde se atribuye a una mutación en la endoglina (ENG)10 y la activin receptor-like kinasa i (ALK-1)11,12 que afecta a la señalización del transforming growth factor beta (TGFb); así como mutaciones en ACVRLK1 y SMADH4, o como ocurre en las malformaciones capilares-MAV, donde existe una mutación en el gen RASA 113 que se localiza en el cromosoma 5 q 13-22 cuya disfunción produce una alteración en la vía de señalización Ras (alteración de la proteína que codifica la p120 Ras GTP).
MAV familiares
| Malformación | Clínica | Locus | Gen |
| THH | EpistaxisTelangiectasiasMAV (30-50% pulmón, 40% hígado, GI 30%, cerebro 5-20%) | 9q 33-3412q 11-145q7p14 | ENGACVRL1SMAD4 |
| MC-MAV | 30% de MAV, FAV, síndrome Parkes WeberMúltiples lesiones, más pequeñas, con halo blanquecino | Sq 13-22 | RASA 1 |
GI: gastrointestinal; MC-MAV: malformación capilar-malformación arteriovenosa; THH: telangiectasia hereditaria hemorrágica.
Hay muchos casos de MAV-sindrómicas (tabla 2), como es el caso de los pacientes con mutaciones del gen PTEN14–16 Cowden, Proteus o Bannayan que también desarrollan anomalías arteriovenosas. Otros síndromes asociados con MAV son: el síndrome (Sd) de Cobb (MAV vertebral y medular con afectación cutánea capilar metamérica), Sd de Parkes-Weber (SPW) (hipertrofia generalizada de la extremidad asociada a una MAV y a una malformación capilar), el Sd de Bonnet-Dechaume-Blanc (MAV metamérica cerebral que se extiende desde la región craneofacial hasta la órbita) y el Sd de Stewart-Bluefarb17 (lesiones unilaterales en las piernas de pacientes jóvenes con una MAV subyacente).
Síndromes asociados a MAV
| Síndrome de Bonnet-Dechaume-Blanc: MAV retina o coroides |
| Síndrome de Wyburn-Mason: síntomas neurológicos y alteraciones mentales |
| Síndrome de Brégeat: MAV conjuntiva, mejillas, nariz y boca |
| Síndrome de Cobb's: MAV medulares en el mismo metámero |
| Síndrome de Parkes Weber: MAV en un miembro |
| Enfermedad de Rendu-Osler |
| Telangiectasia hemorrágica benigna |
| Enfermedad de Cowden |
| Neurofibromatosis |
| Hemangioma epitelioide |
| Síndrome de Bluefarb-Steward |
| Angiomatosis dérmica difusa |
| Síndrome de Lhermitte-Duclos |
| Acroangiodermatitis de Mali |
| Hiperplasia angiolinfoide con eosinofilia |
| Angioendoteliomatosis reactiva |
| Angioqueratoma corporis diffusum sin Fabry |
| Malformaciones capilares: alteraciones gen RASA-1 |
| Hamartoma folicular cutáneo múltiple |
| Tumores glómicos múltiples |
| Hemangiomas faciales |
| Aplasia cutis congénita |
| Síndrome de nevus sebáceo |
| Síndrome PHACE |
Son múltiples las formas de presentación clínica18 (tabla 3). En etapas tempranas son difíciles de diferenciar de otros procesos patológicos como es el caso de las manchas en vino de Oporto.
Presentación clínica
| Mancha rosada, roja |
| Masa violácea, azulada |
| Varias lesiones pequeñas y a menudo con un halo blanquecino (en CM-MAV) |
| Venas dilatadas (puede con thrill) o vibración cutánea |
| Lesiones pulsátiles |
| Nodularidad sobre una mancha |
| Hipertrofia difusa con aumento de tamaño del miembro afecto (síndrome Parkes-Weber) |
| Cambios cutáneos de pseudosarcoma de Kaposi (síndrome Stewart Bluefarb) |
| Cuadros óseos líticos |
| Fallo cardiaco en presencia de FAV múltiples |
Por ello no es de extrañar que en el pasado hubiera tantas confusiones, diagnosticándose de MAV lesiones que realmente eran hemangiomas congénitos no involutivos.
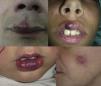
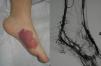
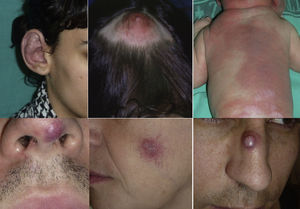
Las MAV son lesiones presentes en el nacimiento, visibles entonces en el 60% de los casos, aunque en el 20-30% se evidencian en la adolescencia y entre el 10-20% en la edad adulta. Se localizan fundamentalmente en la cabeza y en el cuello (fig. 1).
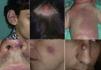
No van a desaparecer como ocurre con los hemangiomas, sino que irán creciendo lentamente o tras un factor desencadenante (fig. 2).
Cuando se asocian a otro tipo de malformaciones pueden afectar al tejido subyacente o producir una hipertrofia del tejido óseo19.
Se les atribuye habitualmente la característica de ser lesiones pulsátiles.
Pero... ¿todas las lesiones son pulsátiles?No. El thrill es muy característico, pero no está presente en todos los casos, bien por diagnosticarlas en etapas muy tempranas, donde las lesiones tienen un shunt mínimo, bien porque la hipertrofia arterial y venosa secundaria a la comunicación entre ambas es mayor en el componente venoso.
¿Tienen distintos comportamientos cuando se diagnostican antes de los 20 años o despúes de los 40?No sabemos por qué unas MAV permanecen asintomáticas hasta la edad adulta mientras que otras desarrollan síntomas en la adolescencia temprana20.
Los niños que presenten una exacerbación de una MAV a una edad temprana tendrán un peor pronóstico, con un mayor número de procedimientos quirúrgicos, morbilidad y secuelas, si lo comparamos con aquellos pacientes adultos que presentan cambios a la edad de 40-50 años.
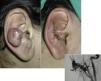
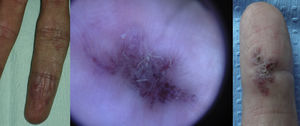
Las lesiones que se diagnostican más allá de los 40 años pueden eventualmente ser adquiridas, especialmente tras un traumatismo como ocurre en zonas acrales (fig. 3)21. Estas lesiones parecen reactivas y no se ven influenciadas por los cambios hormonales, como ocurre en las lesiones de diagnóstico temprano.
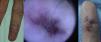
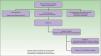
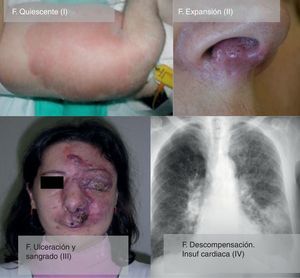
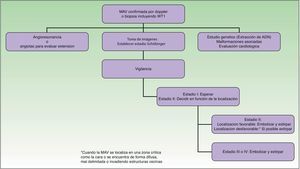
Desde el punto de vista clínico el estadio evolutivo de estas malformaciones está establecido en la clasificación de Schöbinger (fig. 4) y (tabla 4).
Estadios de Schöbinger
| Fase I o quiescente | Mácula rosada-violácea, con la presencia de shunt arteriovenoso detectado en ecografía doppler, generalmente asintomática, presente desde el periodo de recién nacido hasta la adolescencia |
| Fase II o expansión | Igual al estado anterior pero clínicamente pulsátil con evidencia clínica de vasos tensos tortuosos en la pubertad |
| Fase III o destrucción | Aparecen cambios cutáneos distróficos, ulceración, sangrado y dolor continuo, incluso con necrosis y lesiones líticas óseas |
| Fase IV o descompensación | Fallo cardiaco |
En menores de 20 años son lesiones vasculares que empiezan a crecer y sangrar, sobre todo en la pubertad o con cambios hormonales (la mayoría mal diagnosticadas de hemangioma).
En mayores de 40 años los pacientes no han sido conscientes previamente de las lesiones, contando una historia de reciente comienzo. Generalmente refieren su aparición despúes de haber sufrido un traumatismo.
Cuando se afecta el pabellón auricular suele existir también una MAV en el cuero cabelludo y en el cuello.
La evolución de las lesiones se manifiesta como un incremento de la comunicación, resultando en un robo arterial y una hipertensión venosa, reduciendo así la perfusión tisular. Esta isquemia tisular se manifiesta con dolor, ulceración y sangrado.
SangradoEl sangrado aparece en torno a un 3-4% por año en los pacientes de entre 10-55 años, pudiendo llegar a ocasionar el exitus en el 1% de los casos.
Una vez que el paciente ha sangrado presenta un riesgo aproximado del 20% de resangrado en el primer año si no se toman medidas terapéuticas.
Sin embargo, es raro que una MAV/fístula AV de alto débito desde el nacimiento ponga en peligro la vida del niño por sobrecarga cardiaca (a excepción de las intracraneales).
¿Deberíamos descartar una malformación arteriovenosa ante todo nódulo que aparezca en una malformación capilar?Ante la existencia de un granuloma piogénico sobre una presunta malformación capilar deberíamos descartar que se trate de una MAV.
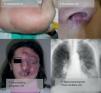
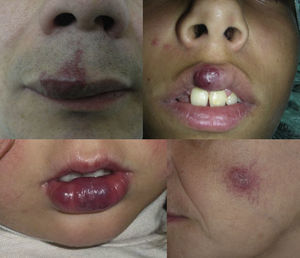
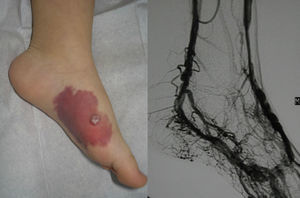
Recientemente se han publicado varios artículos al respecto. En uno de ellos22 se analizan 31 pacientes con malformaciones capilares sobre las que aparecen nódulos. Tras analizarlos histológicamente se observa que el 45,1% son granulomas piogénicos, el 32,3% son MAV (fig. 5), una coexistencia de ambas lesiones ocurre en el 16% y en un 6,5% ectasia vascular tipo cavernosa. Parecen ocurrir con más frecuencia en la segunda rama del trigémino.
Existen trabajos23 donde se postula que la patogenia y evolución características de un granuloma piogénico sobre una malformación capilar se debe a que son verdaderamente MAV. Generalmente son nódulos únicos, pero también se han publicado casos24 de granulomas piogénicos agminados donde la histología y el eco doppler sugerían una MAV subyacente.
DiagnósticoLa historia clínica y la exploración son diagnósticas en el 90% de los casos. Las dificultades más significativas se producen en los primeros meses de vida ante una mancha congénita de coloración rosada.
¿Es una malformación capilar o una malformación arteriovenosa? (tabla 5)En la etapa neonatal se debe incluir los hemangiomas en el diagnóstico diferencial, sobre todo en fases muy precoces25.
La clínica e incluso las pruebas diagnósticas habituales no diferencian entre una y otra entidad en edades tempranas. Será la evolución clínica de las lesiones la que en la mayoría de los casos nos dé el diagnóstico definitivo. Esta dificultad va camino de eliminarse gracias a las últimas aportaciones en inmunohistoquímica26 con el marcador Wilms Tumor 1 (WT-1)27,28. WT-1 es positivo en neoplasias vasculares y malformaciones arteriovenosas y negativo en malformaciones venosas y capilares. Como factor de complejidad adicional el 30% de las MAV asociadas a malformaciones capilares (CM-MAV) presentan mutación en RASA 129–31, con lo que una positividad para esta mutación no los diferencia.
Pruebas diagnósticas (fig. 6)¿Es necesaria alguna prueba diagnóstica?32El aspecto firme a la palpación, el rápido relleno tras exprimir la lesión y el latido (en caso de que existiera) nos hacen sospechar el diagnóstico.
En aquellos casos durante el periodo neonatal en los que el diagnóstico no está claro, la evolución de la lesión será la clave diagnóstica: los hemangiomas aumentan de tamaño de forma rápida a diferencia de las MAV que no cambian de forma tan inmediata33.
¿Cuándo pedir una prueba diagnóstica y cuál?La solicitud de pruebas diagnósticas se hace en función de la edad, zona afectada y el estadio de Schöbinger34.
La eco-doppler35 se utiliza en el diagnóstico inicial por ser una prueba inocua que diferencia fácilmente las MAV de las malformaciones venosas y linfáticas. Además de información anatómica nos proporciona datos hemodinámicos al determinar el flujo vascular. En el caso de las MAV se observan ondas arteriales y venosas (arterias nutricias gruesas y venas de desagüe igualmente gruesas y pulsátiles) con un flujo abundante, con turbulencias de velocidad moderada-alta. Con la eco-doppler se puede caracterizar mejor una pequeña lesión vascular, proporcionándonos información que nos permita descartar además que el trastorno sea linfático, venoso o mixto.
Para los casos de lesiones atípicas pequeñas, de escaso flujo, en pacientes recién nacidos, es de vital importancia la experiencia del ecografista y el uso de transductores de hasta 20MHz.
En la radiografía las MAV (al igual que ocurre en las malformaciones venosas) no son lesiones visibles, pero sí lo son los efectos sobre las estructuras óseas adyacentes (lesiones líticas, hipertrofia o atrofia asimétrica, etc.)36.
La RMN (T1 y T2) sigue siendo la principal prueba diagnóstica para el estudio de malformaciones vasculares37. Se realiza una vez confirmado el diagnóstico con la eco doppler, y tiene como ventajas no aplicar radiaciones ionizantes, obtener imágenes en distintos planos, así como una información hemodinámica. Sirve por todo ello además como prueba de control. Pero en muchas ocasiones resulta insuficiente para precisar las aferencias, eferencias, nidus y flujos. En ese caso es necesario una angio-TAC.
La TAC es una técnica que suele precisar de contraste (con los posibles efectos adversos que ello conlleva) y que suele requerir sedar al paciente, especialmente a los niños, a los cuales se les está exponiendo a radiaciones ionizantes.
La imagen que se obtiene con la angio TAC previa a la cirugía es de gran ayuda, proporcionando información de las estructuras óseas subyacentes y del sistema vascular. Se sigue haciendo una angio TAC multicorte cuando se va a operar una zona crítica, sustituyendo a la arteriografía que no está indicada si no se va a embolizar.
La arteriografía por tanto es terapéutica (se realiza siempre que se vaya a realizar una embolización, pero no como medio diagnóstico). En el caso de que la angio TAC y la angio RM no ofrecieran la información necesaria para la embolización o el tratamiento quirúrgico, se realizaría una arteriografía. Sin embargo, esto no suele ocurrir si el radiólogo intervencionista es experto.
Entre las pruebas menos invasivas de reciente aparición para ver la evolución de las malformaciones vasculares se encuentra la transarterial lung perfusion scintigraphy (TLPS) y el whole body blood pool scintigraphy (WBBPS).
La TLPS tiene un papel único en determinar el grado de comunicación arteriovenosa en las MAV de una extremidad, desplazando en este caso a la angiografía. Sin embargo, son técnicas no disponibles en todos los hospitales.
El WBBPS es muy útil para malformaciones vasculares no aparentes para el seguimiento/progresión de las lesiones, especialmente cuando el TLPS no está disponible.
La biopsia rara vez es necesaria, dado que con la clínica y con la eco doppler se diagnostican el 99% de las MAV. Solo se realiza cuando hay dudas con otros tumores o linfomas, y en el caso de las malformaciones capilares se utilizará la tinción WT1. En estadios tempranos, ante el posible diagnóstico diferencial entre las malformaciones capilares y las MAV se han descrito datos histopatológicos que pueden ayudar a discernir entre uno u otro25. Sin embargo, se evita realizar una biopsia en la medida de lo posible por el riesgo de sangrado y por la posibilidad de ser un desencadenante del crecimiento de la MAV. Por ello, la información histológica aprendida se debe al estudio histológico de las piezas quirúrgicas.
Finalmente, nuevas pruebas como el Arterial Spin Labelling (ASL), a través de una resonancia con equipo de 3 Teslas, nos dará datos de flujo, y probablemente se convierta en un estándar a corto plazo para distinguir tipos y estudiar subtipos.
TratamientoEl tratamiento requiere un abordaje multidisciplinar38.
¿Tratar o no tratar y cuándo?Va a depender del estadio de Schöbinger, del tamaño, de la localización de la MAV, de la edad del paciente y de la progresión o no de la lesión39 (tablas 5 y 6).
Diferencias entre malformaciones capilares y MAV
| Malformaciones capilares | Malformaciones arteriovenosas |
| Presentes nacimiento | Presentes nacimiento |
| Crecimiento lento | Crecen de repente: desencadenantes (hormonal, infecciones, traumatismos, desconocidos) |
| No involucionan | No involucionan |
| Sexo 1:1 | Sexo 1:1 |
| No pulsátil | Pulsátil, pero no siempre |
| Cambios color y grosor | Color no cambia |
| AP: capilares aumentados en tamaño y número. Error embriogénesis | AP: ausencia lecho vascular. Error embriogénesis |
| WT1-, GLUT1- | WT1+, GLUT1- |
| RASA 1 (malf. capilar-MAV) | ENG (Rendu-Osler)ALKRASA 1 (malf. capilar-MAV)PTEN (síndromes)VEGFR |
| Eco-doppler: flujo lento | Eco-doppler: flujo rápido |
| Tratamiento estético | Tratamiento por ulceración, sangrado, deformidad |
Indicaciones para el inicio del tratamiento
| Progresión rápida a estadio II |
| Hemorragia. Estadio III |
| Insuficiencia cardiaca. Estadio IV |
| Complicaciones secundarias a isquemia arterial |
| Complicaciones secundarias a hipertensión venosa crónica |
| Dolor incontrolable |
| Discapacidad funcional |
| Deformidad cosmética severa |
| Síndrome vascular-óseo |
| Afectación visceral (riesgo de sangrado incontrolado) |
Protección de la zona, evitando traumatismos.
Si la paciente toma anticonceptivos orales se recomienda que solo contengan progesterona por el riesgo proangiogénico de los estrógenos41. Sin embargo, a pesar de que en teoría el embarazo aumenta la expansión de las MAV, en el estadio i no se han descrito cambios.
La compresión de las lesiones en las piernas puede mejorar el dolor, pero por otra parte puede empeorar la MAV por la hipoxia.
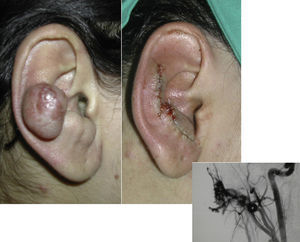
Tratamiento quirúrgicoEl tratamiento definitivo es la cirugía, que puede ser total o subtotal en función de la localización y del tamaño, siendo la curación definitiva cuando la extirpación es total (fig. 7).
Se consideran 4 áreas extracraneales de abordaje quirúrgico: cabeza y cuello, visceral, extremidades superiores y extremidades inferiores. Cada área presenta unas peculiaridades que, a la hora del abordaje quirúrgico, nos hará plantear los pros y contras de una actitud proactiva.
No obstante, en ocasiones, una extirpación subtotal, aunque no cure, mejora la calidad de vida y retrasa la progresión. La extirpación subtotal debe garantizar al menos un 70% de la extirpación, ya que de lo contrario puede ser incluso contraproducente.
Lo más difícil en cuanto al manejo de las MAV es escoger el momento adecuado para la cirugía.
Cuando la MAV está localizada en una zona no crítica (por ejemplo en un brazo, en una pierna42 o en el tronco) la extirpación puede realizarse en cualquier momento y, de hecho, así se aconseja para prevenir posibles deformidades y otros problemas43.
Cuando la MAV se localiza en una zona crítica como la cara, o se encuentra de forma difusa, mal delimitada o invadiendo estructuras vecinas, la extirpación con márgenes libres resulta extremadamente difícil. En estos casos, si se puede, la mejor opción es la observación, dado que la extirpación probablemente no sea completa y haya riesgo de recurrencia o exacerbación. Si tuviéramos que realizar una cirugía el objetivo principal será aliviar los síntomas, preservar las funciones vitales y mejorar la deformidad. Gracias a los avances en técnicas endovasculares y los materiales usados hoy día se requiere de una cirugía menos agresiva. De otra parte no debe olvidarse que una intervención demasiado tardía será más compleja y con menos posibilidades de ser curativa.
La diferencia intraoperatoria entre los vasos normales y los patológicos es difícil de establecer y, por tanto, existe una dificultad para establecer los límites de la lesión y conseguir una correcta resección quirúrgica. En las MAV existe una hiperplasia de los vasos anómalos alrededor de la malformación por aumento del flujo de retorno venoso, aunque los vasos tienen características normales.
Tres de cada 4 pacientes requerirán tratamiento quirúrgico en la infancia y adolescencia, y uno de cada 4 en la edad adulta.
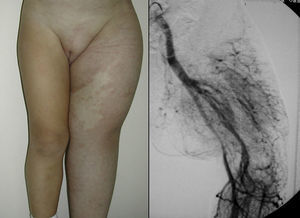
En el SPW (fig. 8) la cirugía es útil en cuanto a la mejoría de la calidad de vida del paciente, corrigiendo por ejemplo dismetrías o úlceras isquémicas.
La embolización se realiza 24-72h previas a la cirugía, con el objetivo de reducir la pérdida de sangre. No obstante, hay radiólogos intervencionistas que realizan como único tratamiento una embolización vía arterial, venosa y percutánea de forma simultánea consiguiendo resultados similares a la cirugía, especialmente en localizaciones complicadas como son la cabeza y el cuello44; si bien es cierto que suelen precisar varias intervenciones. Por el contrario, una embolización de una sola vía aislada en manos de un radiólogo inexperto puede desencadenar un empeoramiento de la lesión. Los materiales de embolización a usar dependen de cada radiólogo y de si se trata de una embolización previa a una cirugía donde las sustancias oclusivas pueden ser temporales, o bien embolización aislada donde nos interesa un material de larga duración. En la actualidad se usan ónix, alcohol, cianoacrilato y coils de platino45–48. Hay acuerdo y consenso en que la embolización debe ser muy distal, en el mismo nidus si es posible y actualmente se considera también indispensable esclerosar por vía percutánea simultáneamente las venas de drenaje para que el efecto del agente embolizador arterial se potencie al enlentecer el flujo.
La complicación más frecuente es la ulceración, sobre todo en lesiones superficiales.
Como los pacientes pasan la noche en el hospital, si se hinchara la zona se pueden administrar corticoides intravenosos durante 24h seguidos de una semana de corticoides por vía oral.
El mayor número de recurrencias (98%) ocurre en los primeros 5 años tras la embolización, por lo que pasados los mismos existe un buen control a largo plazo.
Otros tratamientosA nivel cutáneo el tratamiento con láser estaría en principio contraindicado, aunque existe escasa experiencia y quizás el láser de Nd:YAG49 sí que pudiera ser útil en MAV acrales incipientes (estadio i)50. El pulse Dye Laser (láser PDL) se ha utilizado junto a la terapia fotodinámica51, consiguiendo resultados variables en distintas alteraciones vasculares52 como son las malformaciones capilares53–55; sin embargo, en las MAV no se ha evidenciado que sea eficaz.
Actualmente las malformaciones venosas son las que más se benefician del tratamiento con láser tipo diodo intravascular56. Es de esperar que en los próximos años este tratamiento se extienda también al plano intraarterial.
La angiogénesis puede explicar la expansión arteriovenosa5. De hecho, en las MAV se han encontrado un aumento de VEGF y angiopoietina 2, así como otros factores proangiogénicos, siendo la terapia antiangiogénica una nueva diana terapéutica57. De la misma manera se están obteniendo resultados prometedores con los inhibidores de las metaloproteinasas (enzimas proteolíticas que degradan la matriz extracelular)58.
Existen otros tratamientos38 en fase experimental además de los tratamientos antiangiogénicos mencionados59, y aunque se está investigando a nivel clínico con varios de ellos (sirolimus60–62, marimastat, doxiciclina63 o talidomida64) ninguno está oficialmente recogido en los protocolos de tratamiento ni avalado oficialmente por la ISSVA. De hecho, el sirolimus está contraindicado en MAV con herida cutánea, ya que empeora la ulceración. Publicaciones recientes por reconocidos expertos65 declaran actualmente como inexistente el tratamiento farmacológico de las MAV.
PronósticoVan a influir muchos factores en el curso clínico de las MAV como son la edad al diagnóstico o el manejo adecuado de las lesiones. Sin embargo, sigue sin conocerse completamente por qué unas lesiones permanecen quiescentes y otras crecen, por lo que el pronóstico es incierto.
En la revisión de Lui et al.43 se observó que los niños con una MAV en estadio i tuvieron un riesgo del 43,8% de progresar antes de la adolescencia y un 82,6% antes de la edad adulta. No se observó que el sexo, la localización y el embarazo influyeran en la evolución. En cuanto al tratamiento se obtuvieron peores resultados con embolización sin cirugía.
Mención aparte deben tener las fístulas arteriovenosas (FAV) debidas a un traumatismo, dado que tienen un curso también impredecible y una respuesta distinta al tratamiento de las FAV primarias o congénitas66. Melliere et al. publicaron que la media de tiempo entre el traumatismo causante de la FAV y el diagnóstico era aproximadamente de 20 años. Aquellas FAV de alto flujo se podían asociar a complicaciones cardiacas y las de flujo intermedio podían asociarse a una dilatación arterial proximal y descubrirse más tarde con o sin complicaciones cardiacas concomitantes67.
ConclusiónLas MAV son, por tanto, una entidad poco conocida y en numerosas ocasiones mal diagnosticada. Es necesario un enfoque terapéutico multidisciplinar con cirujanos y radiólogos, junto con el diagnóstico de sospecha precoz por parte del dermatólogo.
Generalmente el diagnóstico es clínico, confirmándose cuando hay dudas con una eco doppler. La dificultad radica, como hemos expuesto, ante una mancha rosada en los primeros meses de vida, donde por el momento no existen pruebas diagnósticas simples que diferencien entre una entidad y otra, siendo necesaria la biopsia.
Elegir el tratamiento adecuado no siempre es fácil. Ante MAV quiescentes pero localizadas en una zona donde la extirpación es posible, sin ser muy traumática, la cirugía es de elección. En aquellas MAV localizadas en la cabeza y en el cuello se nos plantea la duda de si intervenir antes de la pubertad o no, por ser una cirugía más cruenta. No obstante, siempre que las MAV empiecen a crecer sería conveniente plantearnos un tratamiento quirúrgico siempre que sea posible con o sin embolización previa. Se están estudiando nuevos tratamientos médicos para estadios avanzados como son los inhibidores de la vía mTOR62.
Las MAV del sistema nervioso central, dado que son 20 veces más frecuentes que las cutáneas, se han estudiado mucho más. Sin embargo, no se puede extrapolar conclusiones a partir de las MAV del SNC, dado que no sabemos si el comportamiento es el mismo que las MAV cutáneas. Así como tampoco sabemos si la asociación de las MAV cutáneas con síndromes tienen un peor pronóstico.
Tras revisar extensamente la literatura, y con las múltiples dudas planteadas, es de esperar que se vayan conociendo más datos sobre esta enfermedad en un futuro próximo, y con ello nuevas alternativas de tratamiento.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.