Las tiazidas son diuréticos que se comenzaron a usar en la década de 1950 y su uso está muy extendido en la actualidad. Poco después de su introducción se describieron las primeras reacciones de fotosensibilidad, aunque han sido descritas solo de forma infrecuente con posterioridad.
Revisamos los casos de fotosensibilidad por tiazidas publicados hasta diciembre de 2011. Encontramos 62 casos, de los cuales 33 eran mujeres y 29 varones. La forma de presentación más común fue con lesiones eccematosas fotodistribuidas. La hidroclorotiazida fue el agente causal más frecuente. Solo algunos casos publicados recogen el resultado del estudio fotobiológico. En la mayoría el fototest mostró un respuesta alterada a ultravioleta A (UVA) sola y a UVA+ultravioleta B (UVB). En algunos casos el fototest fue normal y solo el fotoparche estaba alterado.
El diagnóstico de fotosensibilidad por tiazidas requiere un alto índice de sospecha. De forma ideal debería confirmarse mediante estudio fotobiológico.
Thiazides are widely used diuretics that first became available in the 1950s. The first reports of photosensitivity reactions to thiazides were published shortly after the introduction of these drugs, but few cases have been described since.
We review all the cases of photosensitivity due to thiazides published up to December 2011. We found 62 cases, 33 in women and 29 in men. The most common presentation was eczematous lesions in a photodistributed pattern, and the most common causative agent was hydrochlorothiazide. The results of photobiological studies were published in only some of the cases reviewed. In most cases, phototesting revealed an abnormal response to UV-A alone or to both UV-A and UV-B. In some cases, the results of phototesting were normal and only photopatch testing yielded abnormal results.
Diagnosis of photosensitivity due to thiazides requires a high degree of suspicion. Ideally, diagnosis should be confirmed by a photobiological study.
Las tiazidas son un grupo de fármacos empleados para el tratamiento de la hipertensión arterial (HTA) desde finales de la década de 1950. Este grupo incluye, entre otros: hidroclorotiazida (HCTZ), clorotiazida, clortalidona, metozalona, bendroflumetiazida, triclormetiazida e indapamida. Estos fármacos ejercen su efecto antihipertensivo mediante una acción vasodilatadora directa y además inhiben el cotransportador Na-Cl del túbulo contorneado distal, dando lugar a una depleción de sal y de volumen1.
La estructura química de las tiazidas deriva de las sulfonamidas, que son moléculas que tienen un grupo sulfonilo unido a una amina. Esta estructura es común a muchos fármacos que por lo demás difieren en el resto de su estructura, peso molecular y propiedades. Entre los fármacos derivados de las sulfonamidas hay algunos con potencial fotosensibilizante, como la dapsona y algunos antidiabéticos orales2.
La fotosensibilidad por fármacos viene determinada por la capacidad que tienen algunos medicamentos de modificar la sensibilidad de un individuo a la radiación solar o artificial3,4.
Las reacciones de fotosensibilidad son un problema creciente en Dermatología. Conforme se van introduciendo nuevas moléculas en el mercado farmacéutico, a pesar de los estudios previos a la comercialización, continúan apareciendo nuevas comunicaciones de reacciones de fotosensibilidad como efecto adverso3,5.
Los diuréticos tiazídicos figuran entre los medicamentos que producen estas reacciones de fotosensibilidad con más frecuencia5. Se ha estimado que entre 1/1.000 a 1/100.000 de los pacientes que toman tiazidas tienen fotosensibilidad clínica6. Sin embargo, a pesar de su amplia utilización, las referencias que se encuentran en la literatura son escasas.
Las primeras reacciones de fotosensibilidad por tiazidas se describieron poco después de su introducción7,8. La HCTZ es la más utilizada, y es también la implicada en la mayoría de los casos de fotosensibilidad6. Otras manifestaciones clínicas de fotosensibilidad por tiazidas descritas son vasculitis9, reacciones liquenoides y eritema multiforme10.
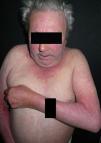
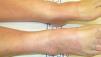
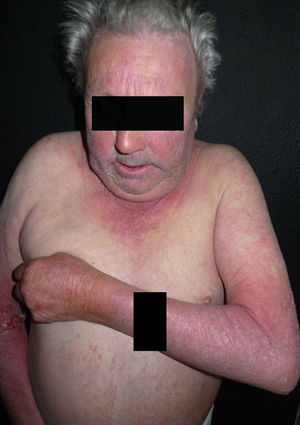
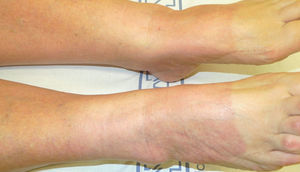
ClínicaClínicamente, las reacciones de fotosensibilidad sistémica se presentan con una dermatosis de distribución simétrica en las áreas fotoexpuestas, con lesiones localizadas en la cara, el cuello, la «V» del escote, la cara dorsal de los antebrazos y de las manos (fig. 1). Generalmente, se observa un límite neto entre las zonas afectas expuestas y las zonas cubiertas por la ropa, joyas, gafas, relojes, etc. (fig. 2)3,10,11. No obstante, en algunas ocasiones se pueden observar lesiones diseminadas10.
A continuación se describen los tipos clínicos de fotosensibilidad por tiazidas que han sido publicados hasta la actualidad:
- a)
Eritema. Clínicamente muy similar al eritema inducido por quemadura solar. Los pacientes pueden referir sensación de quemazón y/o prurito, que puede llegar a ser de gran intensidad10.
- b)
Eccema. La fotosensibilidad por diuréticos tiazídicos puede manifestarse como placas eritemato-descamativas de aspecto eccematoso12.
- c)
Reacción tipo lupus eritematoso cutáneo subagudo (LECS). Esta se presenta a modo de placas eritemato-descamativas clínica e histológicamente indistinguibles de un LECS idiopático. Además, puede observarse la presencia de anticuerpos antinucleares, Ro/SS-A y La/SS-B positivos en suero, así como depósito de inmunocomplejos en la membrana basal10,13–18.
- d)
Reacción liquenoide. Clínica e histológicamente similar al liquen plano7,19.
- e)
Reacción petequial fotodistribuida8.
- f)
Pseudoporfiria. Clínica e histológicamente similar a la porfiria cutánea tarda, sin alteraciones en el metabolismo de las porfirinas20,21.
- g)
Fotoonicolisis. Suele aparecer acompañando a una reacción de fotosensibilidad cutánea generalizada o, menos frecuentemente, puede ser la única manifestación de la fotosensibilidad22.
- h)
Pigmentación. Suele suceder a la reacción eritematosa y generalmente se trata de una hiperpigmentación difusa en zonas fotoexpuestas, aunque también se ha descrito un patrón reticulado. Se atenúa a medida que mejora la fotosensibilidad clínica, aunque en ocasiones persiste cierta pigmentación10.
- i)
Fotosensibilidad persistente. Robinson et al. describieron 4 pacientes con lo que denominaron fotosensibilidad crónica (sic) que atribuyeron a la HCTZ23. En algunos de estos casos la imputabilidad del fármaco es cuestionable. Addo et al.10. pusieron en duda las conclusiones de ese trabajo porque en su experiencia no han encontrado casos de fotosensibilidad persistente provocada por tiazidas.
- j)
Queilitis. Se ha descrito un caso de fotosensibilidad cuya única manifestación fue queilitis en el labio inferior. Los autores no realizaron estudio fotobiológico, pero consideraron que las lesiones se podrían atribuir a una reacción de fotosensibilidad por metformina o HCTZ24.
- k)
Carcinogénesis. Se ha descrito un discreto aumento del riesgo de carcinoma epidermoide cutáneo (CEC) y de melanoma en pacientes que toman amilorida+HCTZ25.
- l)
Fotoleucomelanoderma. Aparición de máculas eritemato-marronáceas con zonas hipocrómicas en áreas fotoexpuestas26.
Hasta la fecha se han publicado 62 casos de fotosensibilidad por tiazidas (tablas 1–4) que han podido identificarse en relación con este fármaco.
Casos aislados de fotosensibilidad de tipo eccematoso por tiazidas
| Autor | Edad | Sexo | Fármaco implicado | Tiempo de evolución | Tiempo desde la introducción del fármaco | Clínica | Biopsia | ANA | Fotoparche | Fototest |
| Harber et al.7(1959) | 60 | Mujer | Clorotiazida | Nd | Nd | Reacción eccematosa aguda | No | Nd | No | Sí (tras suspender fármaco y con luz natural) |
| White11(1983) | 68 | Varón | HCTZ | 5sem | 3 meses | Reacción eccematosa aguda | No | Nd | No | Sí |
| Schwarze et al.12(1998) | 70 | Mujer | Altizida | Nd | 15 años | Erupción eritematosa papuloescamosa | No | Nd | Sí: UVA (−), UVB (+) | Sí: UVA y UVB (−) |
ANA: anticuerpos antinucleares; Nd: no disponible; sem: semanas; UVA: ultravioleta A; UVB: ultravioleta B.
Casos de lupus eritematoso cutáneo subagudo por tiazidas
| Autor | N.° casos | Edad (años) | Sexo | Fármaco | Tiempo de evolución | Tiempo desde introducción del fármaco | Clínica | Biopsia | ANA | Estudio fotobiológico |
| Reed et al.14(1985) | 5 | 42-68 | 4 varones, 1 mujer | HCTZ | 1-10 meses | 6 meses-5 años | LECS | Sí | +/- 1/4 | No |
| Addo et al.10(1986) | 1 | 64 | Mujer | HCTZ | Nd | Nd | LECS | Sí | - | Sí |
| Darken et al.15(1988) | 3 | 61-75 | 2 varones, 1 mujer | HCTZ | 1,5-3 meses | Nd | LECS | Sí | +/- 1/3 | No |
| Parodi et al.16(1989) | 1 | 64 | Mujer | HCTZ | 2 meses | 4 meses | LECS | Sí | - | No |
| Brown et al.17(1995) | 1 | 65 | Varón | HCTZ | Nd | 2 años | LECS | Sí | + | No |
| Srivastava et al.18(2003) | 5 | 44-65 | 4 varones, 1 mujer | HCTZ | Nd | 1-2 meses | «fotoeritema» en todos, LECS en 2 | Sí | + en todos | No |
ANA: anticuerpos antinucleares; HCTZ: hidroclorotiazida; LECS: lupus eritematoso cutáneo subagudo; Nd: no disponible.
Formas atípicas de fotosensibilidad por tiazidas
| Autor | NC | Edad (años) | Sexo | Fármaco | TE | TIF | Clínica | Biopsia | ANA | Estudio fotobiológico |
| Norins8(1958) | 1 | 87 | Mujer | HCTZ | Nd | 2 semanas | Petequias | No | No | No |
| Harber et al.7(1959) | 2 | 66, 71 | Mujer | HCTZ, clorotiazida | Nd | Nd | Liquen plano | Sí | Nd | Sí |
| Robinson et al.23 (1985) | 4 | 44-68 | 2 varones, 2 mujeres | HCTZ | 1-20 años | Nd en 3, 2 años en uno | Fotosensibilidad crónica persistente de tipo eccematoso | Sí | - en 3, Nd en uno | Sí (en 3 solo tras supresión del fármaco) |
| Motley20 (1990) | 1 | 65 | Varón | HCTZ | 12 meses | Un mes | Pseudoporfiria en zonas de vitíligo | Nd | Nd | No |
| Jonhston19(2002) | 1 | 77 | Varón | HCTZ | 2 meses | 6-8 meses | Liquen plano | Sí | - | No |
| Masuoka et al.26(2011) | 1 | 68 | Varón | HCTZ | 6 meses | 9 meses | Fotoleucomelanoderma | Sí | Nd | Sí |
ANA: anticuerpos antinucleares; HCTZ: hidroclorotiazida; NC: número de casos; Nd: no disponible; TE: tiempo de evolución; TIF: tiempo desde la introducción del fármaco.
Casos de fotosensibilidad por tiazidas estudiados por Addo et al
| Fueron estudiados 33 pacientes que tomaban tiazidas por cuadros de fotosensibilidad; en 24 de ellos la clínica se atribuyó al diurético |
| Edad: 29-75 años |
| Clínica:La mayoría de los pacientes presentaron combinaciones variables de eritema, edema, descamación y pigmentaciónUn caso reacción tipo LECS |
| Tiempo de evolución de la clínica y de la duración del tratamiento: no disponibles |
| Fototest: respuesta anormal enUVA+UVB: 10 pacientesUVA: 11 pacientesUVA+visible: 2 pacientesUVA+UVB+visible: 2 pacientesUVB: un paciente |
| Fotoparche: no realizado |
| Estudio inmunológico: no disponible en la mayoría. En un caso ANF (sic) dudoso |
| Estudio histológico: (realizado en 5 casos) mostró datos de dermatitis espongiótica |
| Evolución y tratamiento: se suspendió la tiazida en 16-18 pacientes. Se mantuvo en 6 asociando medidas de fotoprotección |
ANF: anticuerpos antinucleares; LECS: lupus eritematoso cutáneo subagudo; UVA: ultravioleta A; UVB: ultravioleta B.
Fuente: Addo et al.10.
De los casos publicados de fotosensibilidad por tiazidas 29 eran varones y 33 mujeres. La HCTZ fue la implicada en la mayoría de los casos. Sin embargo, muchos pacientes recibían además otros tratamientos, y en algunos casos esto no se especifica.
Llama la atención que, de los casos descritos, en 15 de ellos se trataba de manifestaciones tipo LECS (tabla 2), en 3 casos eran reacciones liquenoides o erupciones tipo liquen plano y 2 eran casos de pseudoporfiria (tabla 3). Este hecho probablemente pueda explicarse porque las reacciones infrecuentes son más a menudo objeto de publicación.
Addo et al.10. presentaron la mayor serie de casos de fotosensibilidad por tiazidas (tabla 4). Se trata de 33 pacientes que fueron estudiados por reacciones de fotosensibilidad. En 24 de ellos la reacción se atribuyó a la tiazida. En el resto, la imputabilidad de estos fármacos fue más difícil de establecer porque tomaban otros fotosensibilizantes o tenían además otra fotodermatosis.
Estudios fotobiológicosDe los casos de fotosensibilidad por tiazidas publicados solo algunos recogen el resultado del fototest7,10–12,23,26. Addo et al.10. realizaron sus estudios fotobiológicos empleando un monocromador y un simulador solar (tabla 4). En esta serie la respuesta estaba alterada en el rango de ultravioleta A (UVA)+ultravioleta B (UVB) en 10 pacientes, en UVA en 11 pacientes, en UVA+UVB+visible en 2, en UVA+visible en otros 2 y en UVB en un paciente. En 10 pacientes se realizó fototest basal tras suspender el fármaco sospechoso. En 7 de ellos la respuesta se había normalizado, y en los 3 que seguía alterada había otra causa o se había retirado el tratamiento recientemente. El tiempo hasta la normalización del fototest fue variable. La mayoría se había normalizado en el control realizado a los 2 meses. Sin embargo, se desconoce cuál es el tiempo exacto que tarda en normalizarse, ya que el fototest se realiza cuando el paciente vuelve a la consulta, pero no sabemos en qué momento del intervalo que transcurre entre 2 fototest se ha normalizado. La fotosensibilidad clínica tardó entre uno y 6 meses en desaparecer. Ninguno desarrolló dermatitis actínica crónica.
Masuoka et al.26 presentaron el caso de un varón japonés que tuvo una reacción anómala a UVA mientras tomaba HCTZ+losartán y que se normalizó en un control realizado a los 2 meses de suspender el fármaco. En este paciente el fotoparche realizado con UVA fue positivo. Schwarze et al.12 publicaron un caso de fotosensibilidad en un paciente que tomaba una combinación de altizida y espironolactona. El fototest no mostró alteraciones, pero el fotoparche con UVB fue positivo, mientras que con UVA fue negativo. Estos 2 pacientes tomaban fármacos que combinaban una tiazida y otro principio activo. La reacción de fotosensibilidad se atribuyó a la tiazida en ambos casos; sin embargo, el fotoparche no se realizó con los fármacos por separado, sino con las combinaciones. En estos trabajos no se especifica si realizaron fotoparche en controles.
Robinson et al.23 presentaron 4 pacientes con fotosensibilidad persistente posiblemente relacionada con la toma previa de HCTZ. En todos los casos el fototest estaba alterado, pero en 3 de ellos se hizo después de la suspensión del fármaco. La DEM para UVB estaba disminuida en 2 casos, en uno fue normal y en el otro no se realizó. Tres pacientes tuvieron una reacción anómala a UVA, y fue normal en uno. No se hizo fotoparche en ninguno de los casos. Los autores atribuyeron la fotosensibilidad de estos 4 pacientes a la toma previa de tiazidas. Addo et al. pusieron en duda las conclusiones de este trabajo porque en su experiencia no han encontrado ningún caso de fotosensibilidad persistente por tiazidas10.
Mecanismos molecularesAunque la fotosensibilidad inducida por tiazidas es bien conocida, su mecanismo de acción no está claro27; no obstante, se ha demostrado daño en los lípidos de membrana y en el ADN27–29.
Para predecir el potencial fotosensibilizante de los fármacos han sido empleadas diferentes técnicas como los ensayos in vitro (entre otros: test de fotohemoólisis, de peroxidación lipídica, de Candida albicans y estudios en líneas celulares)30, los estudios en modelos animales5,31 y la investigación en humanos6,32.
Ningún test ha sido capaz de detectar todos los posibles fotosensibilizantes, por lo que para hacer el screening de fotosensibilidad de un fármaco es importante usar varios métodos27.
La radiación UVA parece ser la responsable de los efectos fotosensibilizantes de los fármacos derivados de las sulfonamidas5. Sin embargo, estudios in vivo e in vitro indican que la radiación UVB y UVA podrían tener efectos aditivos o incluso sinérgicos33.
Manejo de las reacciones de fotosensibilidadDiagnósticoLa sospecha diagnóstica se basa en los hallazgos de la exploración física y en la anamnesis. De forma ideal, el diagnóstico debe confirmarse mediante el estudio fotobiológico.
Si la distribución de las lesiones sugiere una reacción de fotosensibilidad se debe hacer una anamnesis dirigida que incluya los fármacos que toma el paciente, la fecha de inicio y los cambios en la dosis. Es preciso interrogar también sobre la exposición solar o actividades al aire libre. Asimismo es importante realizar un estudio histopatológico con el fin de conocer el patrón de reacción inflamatoria y así hacer diagnóstico diferencial con otras entidades.
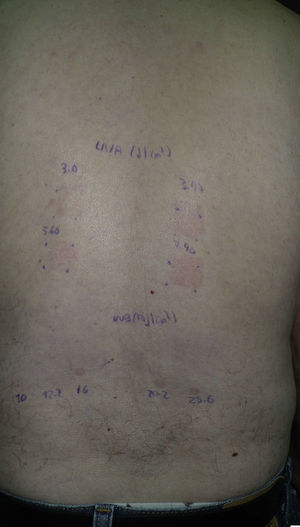
FototestSe debe realizar un fototest mientras el paciente toma el fármaco, determinando la DEM-UVB y la respuesta a UVA (fig. 3)10. Después de suspender el fármaco sospechoso, el fototest se repite a las 3 semanas y si la DEM continúa disminuida o persiste la reacción a UVA, este se repite cada 2-3 meses hasta observar normalidad. No hay unanimidad sobre cuánto tiempo esperar a que se normalice un fototest, pero en nuestro servicio esperamos hasta un año. Si transcurrido un año desde la supresión del fármaco los resultados del fototest no han cambiado, consideramos que esos resultados del fototest son los normales para ese paciente. Se considera normalidad en el momento en que la DEM se incrementa un 40% con respecto a la previa, o cuando no hay reacción a UVA34. Una limitación del fototest radica en que el valor normal de la DEM-UVB no está bien definido. Por tanto, no podemos saber a priori si una DEM-UVB es normal o baja. El seguimiento evolutivo del paciente y los fototest de control permitirán determinar si la DEM-UVB estaba disminuida o era la normal para ese paciente.
Cuando el paciente toma un único fármaco, realizar el estudio fotobiológico es relativamente sencillo. Sin embargo, con cierta frecuencia encontramos pacientes que toman múltiples fármacos en los que hay que hacer un fototest tras suspender cada medicamento, empezando por los fotosensibilizantes conocidos. En algunos casos el paciente que llega a nuestra consulta relata una historia sugestiva de una reacción de fotosensibilidad a un fármaco, pero ya ha suspendido la toma del medicamento sospechoso. En este caso no podremos realizar el fototest mientras el paciente toma el fármaco (salvo que decidamos reintroducirlo con ese fin). No será posible saber si la DEM sin la toma del fármaco es al menos un 40% mayor que la DEM durante la toma del fármaco. En estos casos únicamente podremos hacer un diagnóstico de presunción basándonos en la mejoría clínica.
FotoparcheConsiste en la aplicación de los fotoalérgenos por duplicado en piel no afecta de la espalda. Al cabo de 48hse irradia una de las series con una dosis de 5 J/cm2 de UVA, una de las 2 series se irradia35,36. La lectura se realiza a las 24-48h de la irradiación, aunque se pueden hacer lecturas más tardías. En la fotoalergia de contacto el fotoparche debe ser positivo para confirmar el diagnóstico. Sin embargo, en la fotosensibilidad sistémica el fotoparche con frecuencia es negativo. Si es positivo confirma el diagnóstico de fotoalergia sistémica por el fármaco testado, pero si es negativo no se puede excluir el diagnóstico de fotosensibilidad sistémica. Esto puede ser debido a que sean metabolitos del fármaco los responsables de la fotosensibilidad, y no el fármaco en sí. Aunque la radiación UVA se ha implicado en la mayoría de las reacciones fotoalérgicas, y por eso la recomendación general es hacer el fotoparche con UVA, hay casos de fotosensibilidad sistémica en los que el fotoparche con dosis sub-DEM-UVB fue positivo y sin embargo con UVA no hubo respuesta12,36.
TratamientoCuando se produce una reacción adversa a un fármaco lo recomendado habitualmente es suspenderlo. Si el medicamento es imprescindible y no hay una alternativa terapéutica válida se debe valorar el tipo y gravedad de la reacción adversa antes de retirarlo definitivamente. Si el medicamento no es imprescindible la existencia de reacciones de fotosensibilidad clínica justifica su retirada. Las medidas de fotoprotección son útiles en la fase inicial de la reacción de fotosensibilidad. Se pueden utilizar también antihistamínicos y corticoides para el alivio sintomático si la intensidad de la reacción así lo requiere. En los casos de fotosensibilidad persistente posiblemente inducida por tiazidas se ha empleado la PUVA-terapia con éxito23. Se puede mantener el tratamiento asociando medidas de fotoprotección10.
Es importante recordar la posibilidad de reacción cruzada de las tiazidas con el ácido para-aminobenzoico contenido en algunos fotoprotectores4, con las sulfonamidas y la para-fenilendiamina37.
En el caso de la HCTZ una alternativa sería un diurético de asa como la bumetanida, que tiene menor potencial fotosensibilizante3. Aunque la furosemida y la bumetanida están químicamente relacionadas con las sulfonamidas, es muy raro que presenten reacción de hipersensibilidad cruzada con las tiazidas.
Otra posibilidad es utilizar una dosis nocturna para reducir la fotosensibilidad clínica, como sucede con otros fármacos fotosensibilizantes como las quinolonas. En el caso de las tiazidas esto podría ser útil, pero no se han publicado estudios al respecto. Sin embargo, la dosis nocturna puede no ser apropiada para fármacos diuréticos como la HCTZ, cuya máxima acción es a las 4h.
ConclusionesLas tiazidas son un grupo farmacológico muy utilizado, con un perfil de seguridad que en general es bueno. Dentro de los efectos adversos cutáneos, las reacciones de fotosensibilidad figuran como las más frecuentes. Estas reacciones de fotosensibilidad pueden presentar diferentes patrones clínicos, siendo el más frecuente el tipo eccematoso. El diagnóstico, si es posible, debe confirmarse mediante fototest y fotoparche. El tratamiento definitivo de la fotosensibilidad por tiazidas requiere su identificación como agente causal, su eliminación y/o medidas de fotoprotección. Es por tanto que el dermatólogo debe estar familiarizado con el diagnóstico y manejo de estas reacciones.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.