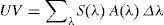La vitamina D aumenta la salud musculoesquelética y reduce la mortalidad asociada a problemas óseos en algunos grupos de población, especialmente en los ancianos y otros grupos de riesgo. Existen evidencias de que la vitamina D influye en el desarrollo del cáncer, la enfermedad cardiovascular, los procesos autoinmunes y las infecciones. Por otro lado, distintos estudios epidemiológicos avalan un estado de deficiencia o insuficiencia de vitamina D en la población de casi todo el mundo. Ante todas estas evidencias surgen diferentes controversias, en parte relacionadas con las medidas de fotoprotección impulsadas para prevenir el cáncer cutáneo. Las últimas recomendaciones del Instituto de Medicina Americano (IOM) consideran que niveles séricos de 20ng/ml (50nmol/l) parecen suficientes y alcanzables para la población general, incluso en condiciones de mínima exposición solar. Si atendemos a estas cifras, quizás la prevalencia de esa hipovitaminosis casi pandémica comunicada en los últimos años esté sobreestimada.
El presente artículo recoge todas estas evidencias y controversias, además de profundizar en el papel de la radiación ultravioleta en la síntesis cutánea de la vitamina D. La conclusión es que no se debe tomar el sol como fuente primordial de vitamina D, puesto que se tiene certeza de que la radiación ultravioleta es un carcinógeno cutáneo. Lo saludable es combinar una exposición solar limitada junto a una adecuada alimentación y la administración de suplementos cuando sean necesarios.
Vitamin D enhances musculoskeletal health and reduces mortality related to bone disease in some populations, particularly the elderly and other high-risk groups. Evidence suggests that vitamin D has an impact in cancer, cardiovascular disease, autoimmune processes, and infections. Epidemiologic studies have also detected vitamin D deficits or insufficiency in nearly all the world's populations. Such evidence has led to debate related, to a certain degree, to photoprotective measures that aim at protecting against skin cancer. The latest recommendations of the American Institute of Medicine consider that serum levels of 20 ng/mL (50 nmol/L) appear to be adequate in the general population and achievable even with minimal sun exposure. If these figures are reliable, the apparent pandemic of vitamin D deficiency reported in recent years may be exaggerated. This article reviews the evidence and issues under discussion, looking especially at the role ultraviolet radiation plays in synthesizing vitamin D in the skin. The conclusion is that sun exposure should not be used as the only source of vitamin D given that it is also clearly carcinogenic for the skin. A healthful approach combines moderate sun exposure, adequate food sources of the vitamin, and supplements whenever required.
La vitamina D es conocida como la vitamina del sol. En sentido estricto no se le puede denominar vitamina pues se consideran como tales aquellos compuestos orgánicos que el organismo requiere como nutrientes en pequeñas cantidades. Por el contrario, dado que los organismos vivos somos capaces de sintetizar vitamina D gracias a la exposición solar, se le puede considerar una auténtica hormona1.
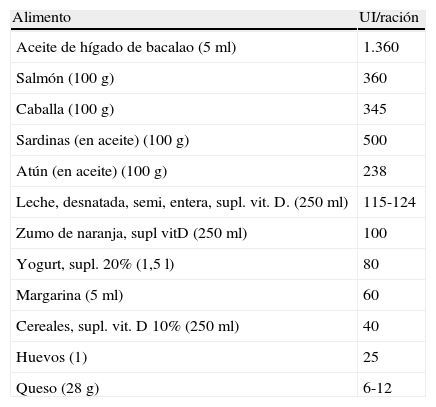
Pese a que la principal fuente natural de vitamina D es consecuencia de la exposición solar, también es necesaria una dieta completa y saludable. Desafortunadamente, muy pocos alimentos contienen vitamina D y muchos de ellos no son de consumo habitual (tabla 1). Esta es una de las principales razones por las que la deficiencia de vitamina D ha adquirido unas proporciones epidémicas en nuestra civilización. A esto se le añade nuestro estilo de vida «a cubierto» con una exposición solar poco saludable, intensa y esporádica. Además, los movimientos migratorios que han hecho que las personas con piel más oscura vivan en latitudes altas, aumentando así su riesgo de deficiencia de vitamina D, y aquellas con piel más clara lo hagan en áreas más cercanas al ecuador, aumentando su riesgo a padecer cáncer cutáneo. El resultado de todo ello es una población deficitaria en vitamina D y paradójicamente endémica en cáncer cutáneo. Diversos estudios ecológicos han mostrado que la prevalencia de muchas enfermedades, como determinados tipos de cánceres2, la enfermedad inflamatoria intestinal, la esclerosis múltiple3, la artritis reumatoide4, la diabetes tipo 1 y, por supuesto, la osteoporosis muestran variaciones geográficas, con una mayor prevalencia en latitudes más al norte respecto de aquellas más al sur5. Estas observaciones han conducido a pensar que una insuficiencia de vitamina D podría estar implicada en su patogénesis o influir en su pronóstico6.
Alimentos ricos en vitamina D
| Alimento | UI/ración |
| Aceite de hígado de bacalao (5 ml) | 1.360 |
| Salmón (100 g) | 360 |
| Caballa (100 g) | 345 |
| Sardinas (en aceite) (100 g) | 500 |
| Atún (en aceite) (100 g) | 238 |
| Leche, desnatada, semi, entera, supl. vit. D. (250 ml) | 115-124 |
| Zumo de naranja, supl vitD (250 ml) | 100 |
| Yogurt, supl. 20% (1,5 l) | 80 |
| Margarina (5 ml) | 60 |
| Cereales, supl. vit. D 10% (250 ml) | 40 |
| Huevos (1) | 25 |
| Queso (28 g) | 6-12 |
Adaptado de: http://dietary-supplements.info.nih.gov/factsheets/vitamind.asp#h3
Oficina de Suplementos Dietéticos, Instituto Nacional de la Salud, USA.
Departamento de Agricultura, Servicio de Investigación Agrícola.
USDA Nutrient Database for Standard Reference, Release 21, 2009, Table 3.
Sin embargo, como dermatólogos nos surgen muchas preguntas ¿realmente la exposición solar que estamos recomendando a la población es saludable? Y a nuestros pacientes con cáncer cutáneo ¿qué tipo de fotoprotección debemos recomendarles? Y respecto a los niños y adolescentes ¿son sus niveles de vitamina D apropiados para asegurar un adecuado desarrollo? ¿Se debería recomendar suplementos de vitamina D a determinados grupos poblacionales en nuestro medio?
Este artículo pretende revisar las evidencias acerca de los efectos de la vitamina D sobre la salud y dar una visión crítica de sus controversias. Todo ello para intentar plantear estrategias dirigidas a nuestra población, con características propias y diferentes de aquellas de donde proceden la mayoría de estudios que sobre este tema se están realizando, los países anglosajones.
Evidencias acerca de la vitamina DUn poco de historiaDesde una perspectiva evolutiva, la vitamina D es un avance evolutivo remoto. El fitoplancton y el zooplancton que existen en los océanos desde hace 500 millones de años producen vitamina D cuando se exponen al sol7.
El precursor provitamina D (ergosterol o 7-dehidrocolesterol) está incorporado dentro de la bicapa lipídica de la membrana plasmática. Durante el proceso de producción de la pre-vitamina D, debido a la exposición a la radiación UVB solar, su anillo se abre y se convierte en una estructura abierta menos rígida, que proporciona a la membrana una mayor permeabilidad a diversos iones, incluido el calcio. Esta puede ser la causa por la cual la vitamina D se ha mantenido tan importante en la regulación del metabolismo del calcio y en última instancia en la evolución de las formas vivas a desarrollar endoesqueletos y aventurarse a la vida en la tierra5.
Las primeras evidencias de la importancia de la luz solar para la salud humana se tuvieron en la revolución industrial en el norte de Europa. La gente se congregó en las ciudades, en condiciones de hacinamiento, escasez de alimentos y polución. Glissen, DeBoot, y Whistler fueron los primeros en constatar que los niños de estas ciudades del norte de Europa mostraban un retraso en el crecimiento y desarrollaban deformidades esqueléticas, denominándolo raquitismo5. En 1822, Sniadecki fue el primero en atribuir el desarrollo de esta enfermedad en los niños a la falta de una adecuada exposición solar8. En 1921, McCollum identificó una sustancia presente en ciertas grasas que podía prevenir el raquitismo. Fue el descubrimiento de la cuarta vitamina y por eso se denomina vitamina D. En 1922, Hess9 publicó que exponer diariamente durante meses a niños en el tejado de su Hospital en Nueva York era un tratamiento efectivo para el raquitismo.
A partir de 1930, se suplementaron diversos alimentos en EE.UU. y también en Europa. Tras la II Guerra Mundial este proceso no se monitorizó adecuadamente lo que causó un brote de intoxicación por vitamina D en niños y jóvenes10, lo que llevó a prohibir la suplementación con vitamina D de los alimentos lácteos en la mayoría de los países europeos11. En la actualidad sólo algunos productos lácteos están suplementados con vitamina D en nuestro país.
Biosíntesis de la vitamina DCon el término de vitamina D se definen dos moléculas diferentes en estructura y origen:
- –
La vitamina D2 o ergocalciferol, formada por la acción de la radiación ultravioleta sobre el esteroide ergosterol en las plantas.
- –
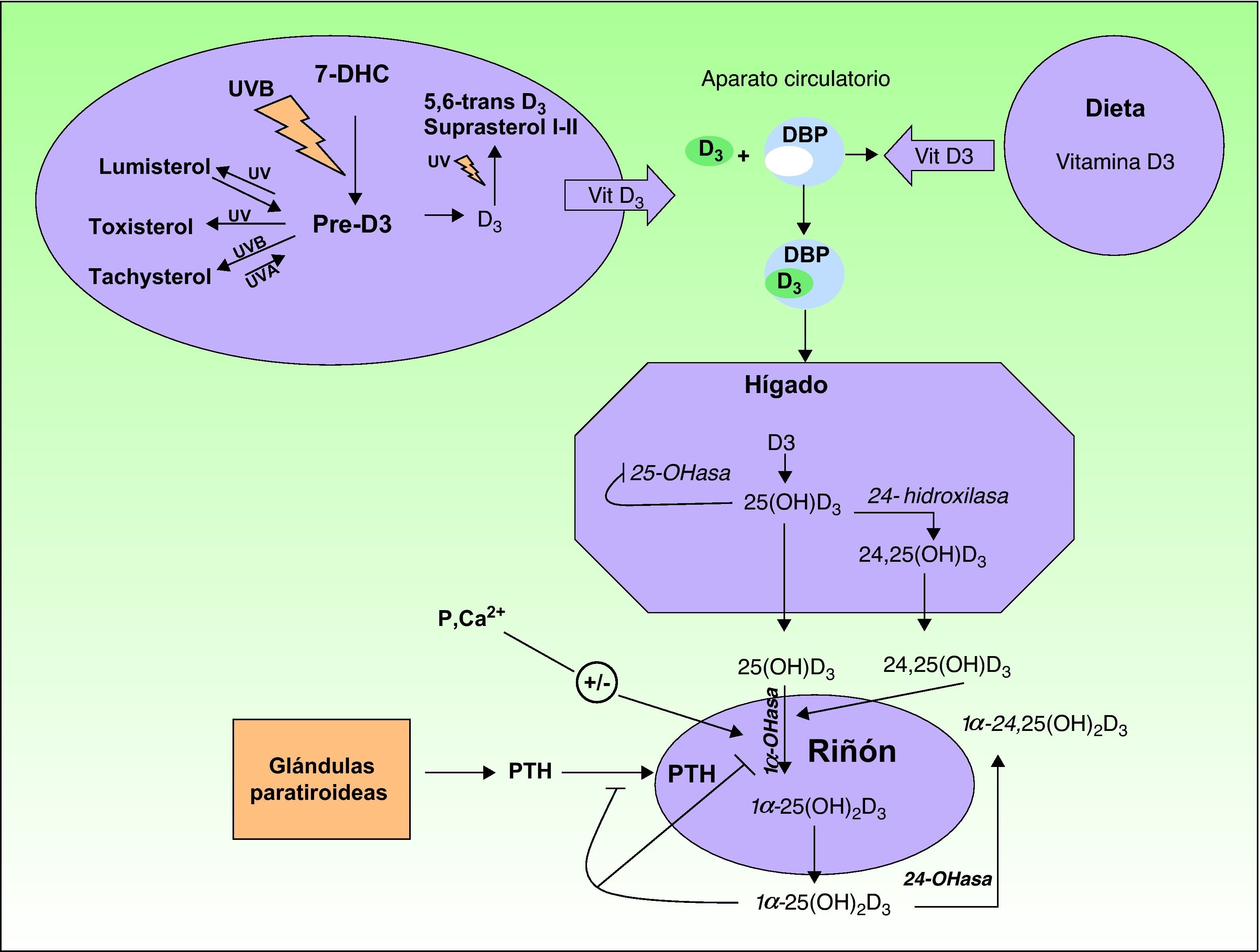
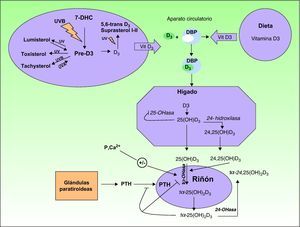
La vitamina D3 o colecalciferol, formada en la piel a partir de la absorción de radiación ultravioleta por el 7-dehidrocolesterol (fig. 1).
A partir del 7-dehidrocolesterol, también llamado provitamina D3, y tras la absorción de radiación ultravioleta se forma el compuesto denominado pre-vitamina D3. Este es el primer paso en la formación de la vitamina D3 o colecalcifierol a partir de una reacción termoquímica del estado excitado del 7-dehidrocolesterol. A partir de la pre-vitamina D3, y mediante la absorción de fotones tanto del tipo UVB como UVA en una serie de reacciones fotoreversibles, se pueden formar otros derivados tipo lumisterol y taquisterol, al igual que mediante la absorción de fotones por parte de la vitamina D3 se pueden formar 5,6-trans-vitamina D3 y suprasterol I y II (fig. 1). La vitamina D3 es excretada al exterior y, unida al cofactor de la proteína transportadora de la vitamina D (DBP), viaja a través del torrente sanguíneo hasta llegar al hígado. Aquí, mediante una serie de reacciones enzimáticas es hidroxilada hasta formar el compuesto 25-hidroxivitamina D3, 25(OH)D3, también llamado calcitriol. Una segunda hidroxilación, catalizada por la enzima 24-hidroxilasa, puede dar lugar a la forma 24,25(OH)D3. El calcitriol es la forma circulante mayoritaria que luego es hidroxilada en el riñón mediante la enzima 1-hidroxilasa a la forma más activa o 1,25-hidroxivitamina D3, 1,25(OH)D3. La producción de todas estas formas activas viene regulada por el metabolismo del fósforo y el calcio, la parathormona (PTH) y el magnesio.
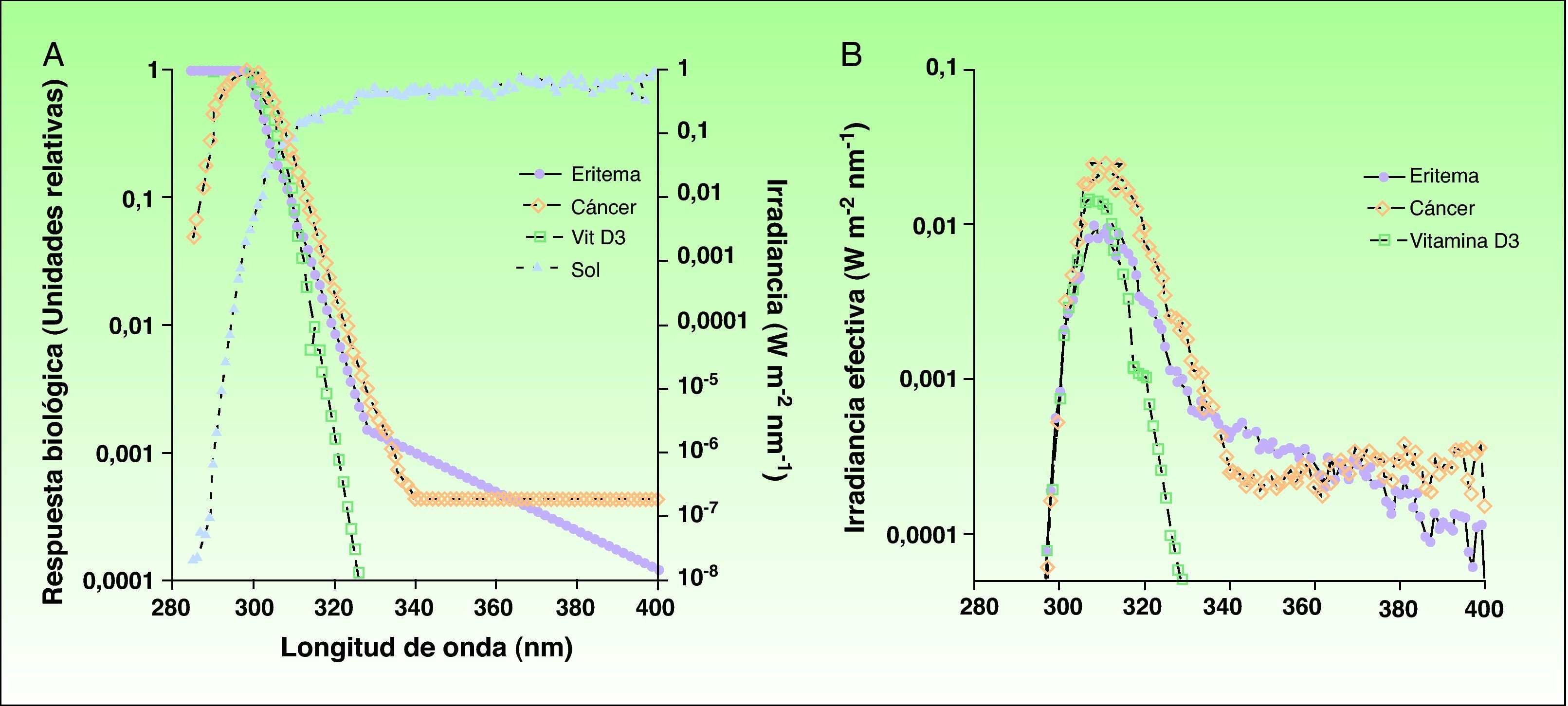
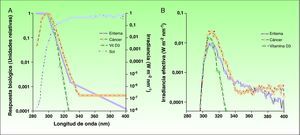
RUV espectro de acción y respuestas biológicasLa zona de espectro de radiación UV más efectiva para la formación de pre-vitamina D3 es la comprendida entre los 295-330nm (fig. 2)12,13. Como contrapartida, también se asocian a estas longitudes de onda efectos negativos, como el eritema solar y el carcinoma espinocelular, ambos con un denominador común: el daño en el ADN celular. En el caso de otras formas de cáncer de piel como el carcinoma basocelular o el melanoma, el espectro de acción no está bien caracterizado, aunque se considera significativa la implicación de la banda de radiación UVA14,15. Por lo tanto, la exposición a radiaciones nocivas solares es necesaria para producir los niveles necesarios de pro-vitamina D3, por lo que el balance riesgo/beneficio ha de ser caracterizado de forma más precisa ya que existen variaciones en cuanto a la dosis de radiación necesaria para producir un efecto biológico u otro, principalmente en la banda del UVB. Este es uno de los puntos clave que generan la controversia en cuanto a la opción de fotoprotección total y el riesgo asociado a la deficiencia de pre-vitamina D3. No obstante, conociendo los niveles de radiación necesarios para la producción de un efecto biológico u otro, podremos determinar con mayor precisión en qué dosis puede haber un balance aceptable entre la fotoprotección y la fotoexposición beneficiosa.
A) Espectros de acción de la generación de eritema y cáncer de piel no melanoma, así como de la producción de vitamina D3 respecto al espectro de radiación solar incidente en las horas centrales del día. B) Espectros de irradiación solar efectiva para los tres efectos biológicos.
Fuente: McKinlay AF et al12; De Gruijl FR et al13 y Erythema Reference Action Spectrum and Standard Erythema Dose21.
En primer lugar, a partir del espectro de incidencia de radiación solar, corregido por el espectro de acción, se puede calcular la radiación solar efectiva para los diferentes efectos biológicos en una localización y en un momento del día preciso, ya que la incidencia de radiación varía en el espacio y el tiempo. La radiación biológica efectiva es el resultado de la suma, en toda la región del espectro correspondiente al ultravioleta16, de todos los productos del espectro de radiación solar y del espectro de acción relativo para cada longitud de onda en dicha banda tal y como se expresa en la siguiente fórmula:
Donde Δλ es el intervalo de longitudes de onda (290-400nm), Σ(λ) es la irradiancia solar a una longitud de onda y A(λ) es el espectro de acción.
En la literatura en general, debido a la similitud entre ambos espectros de acción, de eritema y de producción de vitamina D, se han estimado equivalencias entre la irradiancia efectiva solar para la producción de la vitamina D y la del eritema. De esta forma es posible calcular las dosis de radiación necesarias para establecer el umbral de mínima dosis de producción de vitamina D respecto a la dosis mínima de eritema. Se pretende, por tanto, una simplificación del cálculo de la radiación efectiva para producir vitamina D respecto al eritema, ya que basados en este efecto biológico se han establecido y estandarizado patrones de incidencia solar como el índice UV o los diferentes fototipos cutáneos.
No obstante, la equiparación de radiaciones biológicamente efectivas tiene sus limitaciones, por lo que la irradiancia solar con efecto de acción para la vitamina D debería establecerse de manera independiente al eritema, ya que el espectro de acción es similar pero no igual. Así, el espectro para la síntesis de vitamina D pondera con valores más altos la zona del UVB, mientras que el espectro de acción eritematógeno contempla además la radiación UVA. Este es un punto muy importante, ya que la radiación solar varía en el espacio/tiempo no sólo en cantidad, sino en calidad, por lo que una simple relación matemática entre radiaciones biológicas no se cumple siempre. Por ejemplo, al amanecer y al atardecer, debido a los cambios en el ángulo solar, la relación UVB/UV total varía, del mismo modo que no es similar dicha relación en invierno y en verano. Además, los cambios en la columna de ozono van a determinar variaciones en las proporciones de UVB respecto al total de ultravioleta. Equiparando la irradiancia de producción de vitamina D con respecto al índice UV, se ha descrito una relación lineal cuando los valores de índice UV están por encima de 5,5. No obstante, para valores de índice UV bajos, propios de la época invernal, dicha relación no es lineal. Estos cambios han sido recientemente analizados y ya se están empezando a utilizar modelos que correlacionan la radiación efectiva de vitamina D y el índice UV incluyendo factores como los niveles de ozono y el ángulo cenital17. Sin embargo, existe cierta inconsistencia en nuestro conocimiento sobre la producción de vitamina D por la acción de luz solar. Algunos estudios muestran que para intensidades de UV en latitudes medias durante el invierno, una exposición corporal completa al sol de durante menos de 1 hora bastaría para producir la suficiente cantidad de vitamina D18. Sin embargo, este resultado está en contradicción con lo que hasta ahora se creía, que en dichas condiciones no se puede producir vitamina D en la piel.
Por lo tanto, una mejor caracterización de las radiaciones, tanto las biológicamente efectivas para producir patología cutánea como aquellas beneficiosas para la producción de vitamina D, nos permitirían optimizar la exposición de la piel humana a la radiación UV garantizando los niveles suficientes de vitamina D con un mínimo riesgo.
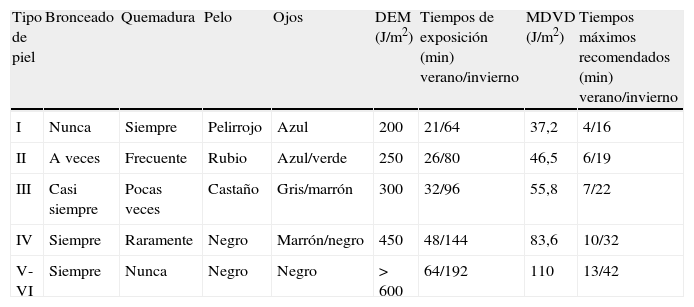
Factores que influyen en la síntesis cutánea de vitamina DCiclo diario de exposición solarLa radiación biológica efectiva de producción de vitamina D presenta un ciclo diario, con valores máximos a mediodía, los cuales disminuyen según nos alejemos de este período central. Dichos cambios están directamente relacionados con el ángulo cenital19 y con disminuciones drásticas de radiación UVB de menor longitud de onda, la cual contribuye con mayor peso a la producción de la vitamina D, tanto al comienzo como al final del día. La tabla 2 muestra la exposición necesaria que una persona ha de tener en España para obtener unos niveles óptimos de vitamina D. En ella se representan los tiempos de exposición a la radiación biológica efectiva en las horas centrales del día para generar eritema y producir vitamina D en zonas costeras del sur de España para cada uno de los fototipos cutáneos20. Los valores de la dosis eritematógena mínima21 se han comparado con los valores de la dosis estándar de producción de vitamina D, la cual se define como la cantidad de radiación UV efectiva equivalente a la ingesta de 1.000 UI de vitamina D, que es la que garantiza los niveles suficientes de vitamina D en sangre para cumplir su función6. La dosis de radiación UV efectiva para producir esa dosis estándar de vitamina D se calcula considerando que es necesario aproximadamente un 25% de la dosis eritematógena mínima de radiación UV incidente en un 25% de la superficie corporal (manos, brazos y cara), además de tener en cuenta la radiación solar ponderada por el momento en el que se hace la determinación. Para hacernos una idea comparativa, el tiempo estimado para la obtención de la dosis eritematógena mínima en la hora central de un día de verano (valores medios de junio a agosto) es aproximadamente de 20 minutos, mientras que la exposición de manos, brazos y cara durante tan sólo 5 minutos garantizan una dosis estándar de vitamina D de 1.000 UI.
Tiempos máximos de exposición a la radiación biológica efectiva en las horas centrales para generar eritema y producir vitamina D en zonas costeras del sur de España según el fototipo cutáneo
| Tipo de piel | Bronceado | Quemadura | Pelo | Ojos | DEM (J/m2) | Tiempos de exposición (min) verano/invierno | MDVD (J/m2) | Tiempos máximos recomendados (min) verano/invierno |
| I | Nunca | Siempre | Pelirrojo | Azul | 200 | 21/64 | 37,2 | 4/16 |
| II | A veces | Frecuente | Rubio | Azul/verde | 250 | 26/80 | 46,5 | 6/19 |
| III | Casi siempre | Pocas veces | Castaño | Gris/marrón | 300 | 32/96 | 55,8 | 7/22 |
| IV | Siempre | Raramente | Negro | Marrón/negro | 450 | 48/144 | 83,6 | 10/32 |
| V-VI | Siempre | Nunca | Negro | Negro | > 600 | 64/192 | 110 | 13/42 |
DEM: dosis eritematógena mínima; MDVD: dosis estándar de producción de vitamina D o cantidad de radiación UV efectiva equivalente a la ingesta de 1.000 UI de vitamina D, que es la que garantiza los niveles suficientes de vitamina D en sangre para cumplir su función.
Fuente: Fioletov V et al17.
Como se ha mencionado anteriormente, no sólo la cantidad de radiación solar sino la calidad de ésta siguen un ciclo estacional, con valores mínimos en la época invernal para nuestra latitud. Así, los valores medios de irradiancia efectiva para producir vitamina D a mediodía durante el período de enero a marzo en zonas costeras del sur de España indican que es necesario un aumento de aproximadamente 4 veces el tiempo de exposición con respecto al necesario para la obtención de los niveles saludables de vitamina D durante el verano (tabla 2).
LatitudLa elevación solar, al igual que ocurre con los ciclos diarios de radiación, es el factor responsable de una disminución de las bandas de radiación correspondientes al UVB más energético y de las cuales dependen la fotoconversión de la vitamina D. Así, en latitudes por encima de los 51° se ha descrito el denominado «invierno de vitamina D» durante los meses fríos22, con valores mínimos de UVB efectivo, lo que implica niveles de producción de vitamina D en la población inferiores a los saludables. En época estival, para latitudes altas, el período de radiación UV óptimo para la producción de vitamina D es corto y el aprovechamiento de dicha radiación por parte de la población coincide con un aumento del riesgo de quemadura solar22. No obstante, que los niveles de vitamina D aumenten o disminuyan de forma inversa a la latitud no es un hallazgo constante en la literatura existente al respecto18. Un metaanálisis reciente de 400 estudios no encuentra un gradiente de los niveles de 25(OH)D con la latitud, salvo en el grupo de personas con piel clara23. Lo mismo ocurre en un estudio realizado en mujeres postmenopáusicas en Europa24. Factores como la adaptación de la piel a la radiación solar y la dieta podrían moderar el gradiente de vitamina D en comparación con el de radiación UVB solar que induce la síntesis de vitamina D. Por tanto, es necesario corroborar aquellos estudios ecológicos y epidemiológicos que atribuyen diferencias en la incidencia de determinadas enfermedades o en mortalidad a los niveles de vitamina D en base a la latitud.
Fototipo cutáneoLa dosis de irradiación necesaria para la producción de mínimos saludables de vitamina D en la piel depende del fototipo cutáneo al igual que ocurre para la producción del eritema (tabla 2). Cuanto más oscura es la piel mayor es la dosis solar necesaria25. Este es un hecho muy significativo, ya que en latitudes altas, con baja insolación los niveles de vitamina D en la población son inversamente proporcionales al fototipo26; esto es debido a que la melanina compite con los fotones activos para la producción de vitamina D. De ahí que una de las teorías más importantes sobre los movimientos migratorios humanos, que han determinado la localización de distintas razas en diferentes latitudes del planeta, es que vienen determinados más por los niveles de vitamina D y las patologías derivadas de su falta, que por la tasa de cáncer de piel en dichas poblaciones. No obstante, algunos estudios recientes apuntan a que la causa de estos bajos niveles de vitamina D en la población están relacionados más que con el fototipo en sí mismo con los hábitos de exposición solar que conllevan27. Incluso un trabajo demuestra que en individuos sometidos a radiación UVB, el incremento de niveles séricos de 25(OH)D está inversamente relacionado con sus niveles de partida y directamente con los de colesterol, mientras que es independiente del fototipo28. Todas estas variables hacen que no sea fácil dar una recomendación sencilla y universal sobre las dosis óptimas de exposición a UV-B que permitan incrementar suficientemente la síntesis de vitamina D sin aumentar el riesgo de sufrir cáncer de piel.
Factores ambientales. Capa de ozonoLa radiación UVB que llega a la superficie terrestre es directamente dependiente de los niveles de ozono estratosféricos y la influencia de los cambios atmosféricos de este gas determinan las longitudes de onda más bajas de dicha banda espectral incidente29. El denominado «agujero de ozono» o pérdidas puntuales en la concentración de este gas influyen mucho en el nivel de vitamina D fotoconvertible en la piel. De esta forma, a menor concentración de ozono atmosférico las bandas espectrales solares incidentes bajan de los 295nm, lo que influye en gran medida en la fotoconversión de la vitamina D. Por el contrario, dichas longitudes de onda también son altamente carcinogénicas, por lo que en determinadas latitudes la educación en fotoprotección está llevando a fenómenos extremos, que incluso podrían considerarse de fobia al sol30. A partir del protocolo de Montreal se ha conseguido una disminución en la concentración de gases destructores de ozono en la estratosfera, por lo que la recuperación de la capa de ozono está siendo positiva y gradual18,31. Esta recuperación se está produciendo dentro del siglo xxi, aunque aún existen incertidumbres en relación con la interacción con el cambio climático. Un estudio reciente sugiere que, en respuesta al cambio climático, la cobertura de nubes aumentará en latitudes altas pero disminuirá en las bajas. Si esta predicción es correcta, esto puede tener importantes implicaciones en la salud humana, ya que la radiación UV podría aumentar en áreas terrestres de baja latitud, donde ya es alta, y disminuir en las de baja latitud, donde ya es baja18.
Esto ha de ser transmitido a la población como un fenómeno positivo y, por tanto, ir concienciándola de que es probable que en el futuro sea necesaria una mayor exposición solar natural en beneficio de un aumento de los niveles de vitamina D.
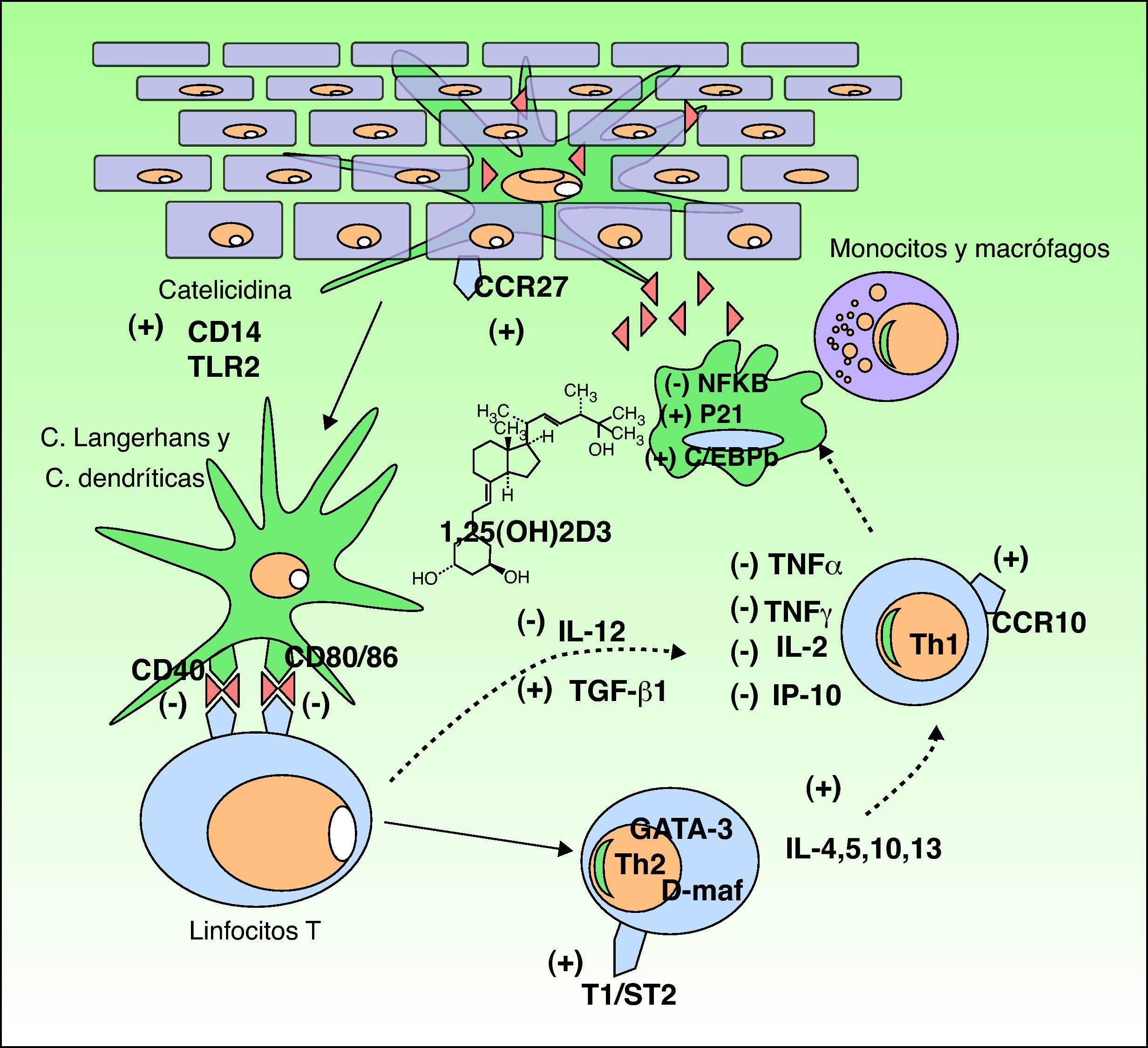
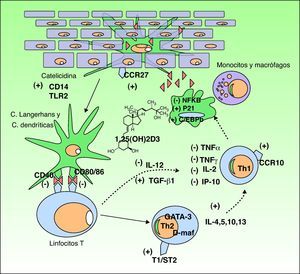
Funciones de la vitamina DLa vitamina D3 tiene dos funciones muy importantes en el organismo: 1) la homeostasis del calcio y el fósforo, y 2) la modulación de la respuesta inmune. Nos centraremos en esta segunda, por ser la más implicada en muchos de los trastornos que recientemente se han relacionado a la vitamina D (fig. 3).
Efecto inmunomodulador de la vitamina D en la piel. La producción de vitamina D promueve la respuesta inmune innata a través de la activación en el queratinocito epidérmico de receptores inmunes tipo catelicidina, CD14 y TLR2 (toll like receptor) y de la activación del ligando CCR27, el cual atrae al linfocito T. La vitamina D además estimula la diferenciación y activación de monocitos y macrófagos a través de la inducción de p21 y C/EBPb. Por el contrario, la vitamina D disminuye la capacidad de reconocimiento antigénico de las células de Langerhans, la maduración de las células dendríticas y la presentación antigénica (disminución de los receptores CD40 y CD80/86). Inhibe la producción de Th1 a través de la disminución de la síntesis de IL-12 y aumento de TGFb1 e inhibe parcialmente la acción de los Th1 a través de la disminución de la producción de citocinas IL-2, INFg, TNFα e IP-10. Por otro lado, se estimula la diferenciación a linfocitos Th2 (sobreexpresión del receptor T1/ST2 de la IL-1). La vitamina D produce además una sobreexpresión de genes GATA-3 y D-maf que promueven la liberación de citocinas IL-4, 5, 10, 13 en estos linfocitos.
Tras descubrirse la expresión del receptor de la vitamina D en la mayoría de las células del sistema inmune adaptativo, se ha demostrado que la 1,25D3 inhibe la proliferación de los linfocitos T, la secreción de citocinas y la progresión del ciclo celular32. Esta vitamina puede regular los linfocitos T de modo directo e indirecto, a través de su efecto inhibidor de las células presentadoras de antígenos y las células dendríticas. La vitamina D3 disminuye la secreción de interleucinas (IL) 2 y 12, interferón γ y TNF-α, todas ellas relacionadas con la vía de los linfocitos Th1 (inmunidad celular). Por otro lado, activa algunos promotores de genes relacionados con interleucinas de la vía Th233,34. Además, la 1,25D3 influye en la inducción de las células T reguladoras y la expresión de receptores de superficie en células presentadoras de antígenos, como las células dendríticas32.
Esta acción inmunológica se produce mediante la unión con receptores celulares35 que activan factores de transcripción los cuales ponen en marcha las siguientes funciones: 1) inhibición de células dendríticas y células presentadoras de antígenos; 2) disminución de la producción de IL2, IL12, TNF-α e interferón-γ; 3) activación de TGF-β que suprime acciones proinflamatorias de los linfocitos Th1; 4) activación de genes GATA-3 y c-maf los cuales promueven la síntesis de citocinas del sistema Th2 (IL-4, IL-5-IL-13); y 5) incremento de IL-10, la cual a su vez inhibe los linfocitos Th1. El resultado es un desequilibrio a favor de la vía Th2, lo que favorece la respuesta de inmunidad humoral, los procesos antiinflamatorios y la inmunosupresión36. Este incremento de la vía Th2ha llevado a emplear la vitamina D3 en el tratamiento de algunas enfermedades autoinmunes37 como se verá posteriormente.
La vitamina D activa producida en la piel interviene de forma activa en la inmunidad innata y adquirida de la piel y en la respuesta inflamatoria de la piel frente al daño actínico38. Se ha demostrado que la vitamina D puede ser crucial en la respuesta intrínseca frente al daño producido por la radiación ultravioleta en las células de la piel39,40. En diferentes modelos experimentales sobre queratinocitos humanos se ha podido demostrar un efecto fotoprotector del calcitriol, metabolito activo de la vitamina D, frente a la producción de dímeros de pirimidina y una disminución significativa de otros fotoproductos inducidos por la radiación UV39–41.
La vitamina D interviene también en la regulación de los péptidos antimicrobianos, especialmente en la promoción de catelicidina y defensina B4. Cuando una infección o herida activa a los receptores Toll-like 2 en queratinocitos y monocitos se induce la expresión de CYP27B1, causando la conversión de 25(OH)D a su forma activa 1,25-D3, y la subsecuente inducción de catelicidina y defensina42. La expresión de estos receptores Toll-like 2 se ve incrementada por el IFN-γ, disminuida por la IL-4 y no se afecta por la IL-1743.
Relación entre vitamina D y enfermedadHasta hace unos años la vitamina D era «la vitamina de los huesos», es decir, su acción fundamental sobre el metabolismo óseo la asociaba a enfermedades como el raquitismo la osteomalacia o la osteoporosis. En los últimos años, prácticamente no ha quedado una especialidad médica en la que no se haya demostrado la participación de la vitamina D: el cáncer, el síndrome metabólico, las infecciones, diversos procesos autoinmunes, metabólicos o neurológicos e incluso el dolor. Esto ha llevado a acuñar el término de insuficiencia de vitamina D como niveles séricos bajos de 25(OH)D que pueden asociarse a diversas enfermedades44. Sin embargo, establecer un punto de corte que separe deficiencia de insuficiencia es problemático dada la variabilidad individual de los efectos funcionales de la vitamina D y su interacción con la ingesta de calcio. Algunos autores consideran deficiencia, cuando estos niveles son ≤ 10 ng/ml, y de insuficiencia si están entre 10 y 20 ng/ml44.
A continuación se exponen las evidencias que, por el momento, se tienen de la vinculación de esta vitamina con estos procesos.
Vitamina D y metabolismo óseoLa vitamina D desempeña un papel fundamental en el mantenimiento de los niveles séricos de calcio, evitando así la tetania por hipocalcemia y estimulando la mineralización. Existe un triple mecanismo a través del cual la vitamina D contribuye a esta función. En primer lugar, es la única hormona conocida capaz de estimular las proteínas implicadas en la absorción intestinal de calcio. Además, en ausencia de aporte alimentario de este mineral, favorece la movilización de sus reservas a partir de la masa ósea, estimulando la osteoclastogénesis. Finalmente, la vitamina D en colaboración con la hormona paratiroidea estimula la reabsorción de parte del calcio filtrado en el túbulo renal45. Desde un punto de vista clínico, el déficit de vitamina D es un importante factor de riesgo para la osteoporosis. Dos metaanálisis de ensayos clínicos controlados y aleatorizados muestran que la toma de altas dosis de vitamina D reduce el riesgo de caída en un 19% y de fracturas entre un 15 y un 29%46. Sin embargo, un estudio reciente ha demostrado un riesgo aumentado de caídas en mujeres ancianas a las que se les administró una dosis alta de vitamina D (500.000 UI) única anual47. Estos resultados contradictorios pueden estar relacionados con la pauta de administración de la vitamina D, es decir, el beneficio estaría más en relación con una pauta de administración más frecuente que con la dosis total administrada. No obstante, y considerando que las concentraciones séricas de 25(OH)D alcanzadas en este estudio pueden obtenerse con otras pautas de administración, se necesitan más estudios que establezcan la dosis y pauta de vitamina D óptimas para el metabolismo óseo.
Vitamina D y enfermedades autoinmunesLa intervención de la vitamina D en la respuesta inmunitaria, tal y como ya se ha expuesto, justifica que las dianas más relevantes de los efectos beneficiosos de la vitamina D sean precisamente algunas de las enfermedades autoinmunes más prevalentes4.
Esclerosis múltipleExisten diversas circunstancias epidemiológicas que apoyan la relación entre el déficit de vitamina D y un mayor riesgo de padecer una esclerosis múltiple (EM). Mientras que la EM es una enfermedad prácticamente inexistente en el ecuador, su prevalencia se incrementa de forma proporcional a la distancia a aquel. Los brotes de EM ocurren de forma característica durante el invierno y la primavera, períodos que se corresponden con los meses de menor irradiación UV y, por consiguiente, menores niveles séricos de vitamina D. En un estudio poblacional sobre 187.000 pacientes seguidos entre 10 y 20 años se comprobó una relación inversa entre los niveles de vitamina D y la incidencia de EM, siendo ésta un 40% inferior en aquellas mujeres en las que los niveles de vitamina D eran adecuados; no obstante, esta asociación entre niveles bajos de vitamina D y EM solo se encontró en pacientes de raza blanca, mientras que en aquellos de raza negra o hispanos, grupos poblacionales que en general presentan niveles séricos más bajos de vitamina D, no se encontró dicha asociación48. Por último, diversos estudios sugieren que suplementar con vitamina D a los pacientes con EM en remisión puede protegerles frente a nuevos brotes49. Sin embargo, estas observaciones requieren cierta prudencia, en el sentido de que la propia enfermedad se asocia a una reducción tanto de la ingesta en general –pudiendo condicionar déficits de este y otros elementos– como de las actividades al aire libre y, por lo tanto, de exposición a la radiación ultravioleta, que serán más acusados en aquellas zonas de escasa irradiación solar. La evidencia más firme de que la vitamina D puede ser un factor protector natural de la EM procede de datos obtenidos a partir de la encefalomielitis experimental, un modelo murino de EM, en el cual la administración de 1,25-(OH)2D3 inhibe tanto su inicio como la progresión50. Existen ensayos clínicos en marcha para corroborar estas hipótesis, establecer la dosis óptima y determinar qué pacientes con EM se beneficiarían de la administración de vitamina D.
Vitamina D y diabetes mellitusSe han observado variaciones estacionales en los picos de incidencia de diabetes mellitus que, entre otras circunstancias, se han asociado a las oscilaciones periódicas en los niveles de vitamina D51. En un amplio estudio multicéntrico realizado de forma prospectiva durante 4 años en 51 regiones mundiales se comprobó una relación inversa entre la radiación UVB en cada una de aquellas y la incidencia de DM de tipo I52. En esta enfermedad, las acciones intervencionistas parecen tener cierta utilidad al menos en la edad infantil, pues se ha comprobado que la administración de 2.000 IU/día de vitamina D redujo de forma significativa el desarrollo de DM insulinodependiente tras un prolongado seguimiento de hasta 30 años53. No obstante, por el momento no existen evidencias suficientes que permitan afirmar su utilidad en el manejo de la enfermedad.
Vitamina D y psoriasisLa relación entre vitamina D y psoriasis ha sido estudiada desde los años 30 del pasado siglo. Krafka54 y Thacker55 publican las primeras evidencias que las relacionan. En 1985 Morimoto et al56 descubren de forma fortuita que la administración de vitamina D3 mejora la psoriasis en un caso aislado. Los intentos de emplear vitamina D oral como tratamiento antipsoriásico se vieron limitados por su capacidad para alterar el metabolismo del calcio. Se inició entonces una carrera hacia la consecución de nuevos análogos de la vitamina D (calcipotriol, tacalcitol) con menos actividad hipercalcemiante. Éstos son actualmente un tratamiento tópico bien establecido de la psoriasis. Las acciones biológicas de los análogos de la vitamina D incluyen la regulación de la proliferación y diferenciación celular epidérmica, la inhibición de la angiogénesis y la modulación de la producción de citocinas57. Por ello, son aplicables también en otros procesos centrados en la alteración de la cinética celular como algunos tipos de cáncer. Diversos estudios han intentado determinar una relación entre los niveles de vitamina D y la psoriasis. En 1990, Morimoto et al58 no encuentran un mayor déficit de vitamina D en psoriásicos respecto a controles. Sin embargo, sí detectan una vitamina D circulante más baja en los que presentaban psoriasis más grave. En los últimos años, algunos grupos de investigación se han centrado en el receptor de la vitamina D (VDR). Okita et al59 estudian los polimorfismos del VDR en pacientes con psoriasis. No encuentran ninguna relación de los citados polimorfismos ni con el tipo de psoriasis ni con su gravedad, pero sí descubren una relación significativa entre el genotipo AA y la disfunción hepática presente en algunos pacientes. Este hallazgo apuntaría hacia la vía de la vitamina D como reguladora de la expresión del síndrome metabólico que acompaña a la enfermedad psoriásica. Otra línea de estudio muy interesante es la que relaciona los péptidos antimicrobianos (defensina, catelicidina) con la actividad de la psoriasis60. La actividad proinflamatoria de dichos péptidos puede ser inhibida por los análogos de la vitamina D, y por la radiación ultravioleta que estimula su síntesis en la piel61. Estos hallazgos añaden nuevas perspectivas a la fisiopatología de la enfermedad y nuevos enfoques terapéuticos.
Otras enfermedades autoinmunesSe han realizado estudios experimentales y/o clínicos acerca de la posible implicación de la vitamina D en diversas enfermedades autoimunes. De este modo, el empleo de 1,25(OH)2D3 en las fases iniciales de la artritis reumatoide podría prevenir la progresión de la enfermedad, según se deriva de modelos de artritis en animales62. En el caso del lupus eritematoso (LE), está demostrado que los pacientes presentan niveles bajos de 25(OH)D. A ello contribuye por un lado los mecanismos fisiopatológicos de su propia enfermedad, el que algunos pacientes desarrollan anticuerpos anti-vitamina D, y cómo no la fotoprotección a la que están obligados63. Por tanto, parece recomendable la administración de suplementos de esta vitamina a estos pacientes63.
Vitamina D e infeccionesEs conocido que la vitamina D es uno de los eslabones necesarios para la activación de la inmunidad inmediata a través de los Toll-like receptors, circunstancia que permite sugerir su participación en la aparición de diversas infecciones. Como prueba indirecta de ello estaría la sobreexpresión de un péptido antimicrobiano, conocido como catelicidina, en los monocitos humanos cuando se añadía vitamina D. En esta misma línea, se ha comprobado cómo la adición de 1,25(OH)2D a los macrófagos infectados con Mycobacterium tuberculosis reduce el número de bacilos viables.
Estas observaciones de laboratorio parecen ser coherentes con diversos hallazgos clínicos, como que tanto los niveles de catelicidina como los de vitamina D en pacientes con sepsis ingresados en una unidad de cuidados intensivos son más bajos que los de aquellos pacientes que, también ingresados, no presentaron sepsis64. Además, en este trabajo los niveles de mRNA de catelicidina fueron sensiblemente inferiores en los pacientes afroamericanos, que por otro lado tienen menores niveles de 25(OH)D en el suero que las personas blancas. Además, los suplementos de 25(OH)D administrados a los pacientes con déficit permitieron que la probabilidad de padecer una sepsis se igualase entre ambos grupos65.
En relación con las infecciones respiratorias, se ha encontrado asociación entre los niveles deficientes de vitamina D en los jóvenes en edad militar y un mayor número de días de baja por infecciones respiratorias de vías altas, en particular en pacientes con antecedentes de asma bronquial o enfermedad pulmonar crónica65,66. La relación estadística de distintos polimorfismos de los receptores de vitamina D con la incidencia de infecciones respiratorias apoya también el valor pronóstico de la vitamina D en el control de dichos procesos67.
Desde un punto de vista intervencionista, la evaluación sistemática en cuanto al empleo de derivados de la vitamina D en la prevención o el tratamiento de las infecciones permite recopilar una decena de estudios controlados con placebo. La conclusión es que podrían ser de utilidad en el tratamiento de la tuberculosis, la gripe y las infecciones respiratorias de vías altas, aunque no con la evidencia suficiente que permita hacer recomendaciones definitivas68.
Vitamina D en las enfermedades cardiovascularesVitamina D e hipertensiónLa vitamina D se encuentra implicada en el control de la tensión arterial a través de la inhibición del sistema renina-angiotensina69, aunque probablemente también están implicados otros factores tales como la prevención del hiperparatiroidismo primario o el control sobre el metabolismo del calcio. Estas propuestas cuentan con el soporte de datos experimentales, tales como los aportados por Li et al, quienes comprobaron cómo la administración de 1,25 hidroxivitamina D[1,25(OH)2D] inhibía la expresión del gen de la renina en ratones knock out para la expresión del receptor de la vitamina D70. Asimismo, la hipertensión que generan de forma espontánea estos ratones puede ser revertida tanto con captopril como con 1,25(OH)2D71.
De hecho, las actuaciones intervencionistas arrojan de nuevo unos resultados discretos. Un metaanálisis llevado a cabo al respecto evaluó 11 estudios aleatorizados y controlados, en general con un número de pacientes escaso y heterogéneo en cuanto a calidad metodológica. Como conclusión, se comprobó un descenso no significativo de TA sistólica y significativo pero discreto en la diastólica en los grupos a los que se les suministró vitamina D comparados con el grupo placebo. Por otro lado, el efecto sólo parece aplicable a la población de individuos hipertensos, pero no a los normotensos72. De este modo, la población diana que potencialmente se beneficiaría de los efectos cardiovasculares de la vitamina D serían los hipertensos con déficit de vitamina D73.
Vitamina D e insuficiencia cardiaca congestivaLa relación entre déficit de vitamina D e insuficiencia cardiaca congestiva (ICC) podría estar, a priori, relacionada con la asociación de este proceso a una mayor prevalencia en este grupo de factores de riesgo para padecer cardiopatía tales como la DM o la HTA. Sin embargo, en los últimos años el concepto fisiopatológico de la ICC ha cambiado desde una perspectiva meramente hemodinámica hacia una visión más compleja que incluye la implicación de citocinas proinflamatorias, tales como el factor de necrosis tumoral o la interleucina 6, sobre los que podrían actuar, mediante sus efectos inmunomoduladores, los derivados de la vitamina D74. Existen algunos datos epidemiológicos que apuntan en este sentido, como la elevada prevalencia de hipovitaminosis D en pacientes con ICC y enfermedad coronaria, que llega a ser de hasta el 75%75. La mortalidad en los pacientes con ICC fue mayor también durante los meses de invierno, coincidiendo con la menor radiación UV76. Diversos datos experimentales van también en esta misma línea. De este modo, los receptores de vitamina D se expresan en los cardiomiocitos, las células del músculo liso vascular y el endotelio, en dónde la vitamina D podría estar implicada en la inflamación, la proliferación celular y la diferenciación77. En un estudio realizado con modelos murinos knock out para la vitamina D se comprobó una marcada hipertrofia cardíaca y acúmulo de colágeno en el estudio histológico, cambios que se atribuyeron tanto a la sobreestimulación del sistema renina-angiotensina como de los cardiomiocitos, incluyendo el incremento de la contractilidad. Todas estas alteraciones y cambios fueron revertidos mediante la administración de vitamina D durante 13 semanas78. Estos datos permiten sugerir que las acciones de la vitamina D sobre la ICC van más allá de la mera implicación en los factores de riesgo, al intervenir como regulador del propio proceso inflamatorio que acompaña y condiciona la ICC.
Sin embargo, las intervenciones terapéuticas no han tenido por ahora los resultados esperados. Así, la administración de suplementos de vitamina D a pacientes con ICC se asociaba a un incremento en los niveles de la citocina antiinflamatoria IL-10 y a un descenso en los niveles de TNF, pero sin implicación o correlación con la evolución clínica79.
Vitamina D y cáncerEn la literatura se pueden encontrar diferentes estudios, tanto en humanos como en modelos animales, que han aportado datos que demuestran que la vitamina D podría tener un efecto beneficioso frente al cáncer, tanto para disminuir su incidencia como para mejorar la supervivencia de los pacientes que ya lo padecen. En este sentido, según algunos estudios, entre 17-21 tipos de cáncer, incluido el melanoma, se correlacionan negativamente con el índice de UVB en EE. UU.80, Canadá81; y España2.
Su mecanismo de acción está muy probablemente relacionado con los efectos de la vitamina D en la regulación del crecimiento, la muerte celular, la angiogénesis y la diferenciación celular82. El papel que desempeña la vitamina D en la carcinogénesis se ha evaluado a partir del estudio de la relación entre los niveles de vitamina D, los polimorfismos en el receptor de la vitamina D (VDR) y los suplementos dietéticos de vitamina D con la incidencia y la supervivencia de diversas neoplasias.
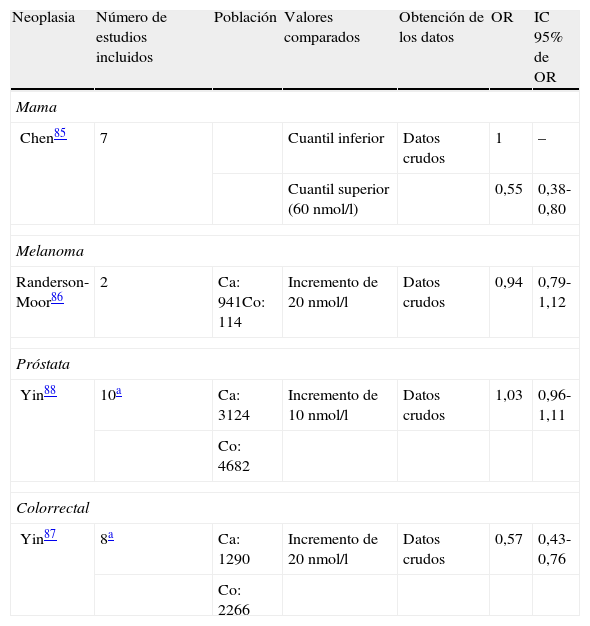
En los últimos años, se han realizado muchos estudios que han intentado relacionar los niveles en sangre de 25(OH)D con la incidencia de algunos cánceres. Para estos estudios, se han utilizado como referencia valores mínimos de 30-35 ng/ml (75-87,5 nmol/l), los cuales son considerados los óptimos para obtener los máximos efectos beneficiosos de la vitamina D83,84. Recientemente, cuatro metaanálisis han mostrado datos concluyentes respecto al efecto protector de unos niveles adecuados de vitamina D frente al cáncer de mama y colorrectal, aunque no frente al cáncer de próstata ni al melanoma (tabla 3)85–88. Este efecto persiste incluso tras el ajuste respecto a factores que podrían influir en los niveles de vitamina D, como el índice de masa corporal o la edad. Algún trabajo incluso estudia el aporte diario óptimo de vitamina D protector frente al cáncer; así, dosis de 1.500 UI por día de vitamina D3 (colecalciferol) reducen un 30% la tasa de mortalidad masculina por cáncer en EE. UU.89.
Resumen de los metanálisis en los que se ha evaluado la implicación de los niveles de 25-(OH)-D2 y el desarrollo de neoplasias
| Neoplasia | Número de estudios incluidos | Población | Valores comparados | Obtención de los datos | OR | IC 95% de OR |
| Mama | ||||||
| Chen85 | 7 | Cuantil inferior | Datos crudos | 1 | – | |
| Cuantil superior (60 nmol/l) | 0,55 | 0,38-0,80 | ||||
| Melanoma | ||||||
| Randerson-Moor86 | 2 | Ca: 941Co: 114 | Incremento de 20 nmol/l | Datos crudos | 0,94 | 0,79-1,12 |
| Próstata | ||||||
| Yin88 | 10a | Ca: 3124 | Incremento de 10 nmol/l | Datos crudos | 1,03 | 0,96-1,11 |
| Co: 4682 | ||||||
| Colorrectal | ||||||
| Yin87 | 8a | Ca: 1290 | Incremento de 20 nmol/l | Datos crudos | 0,57 | 0,43-0,76 |
| Co: 2266 | ||||||
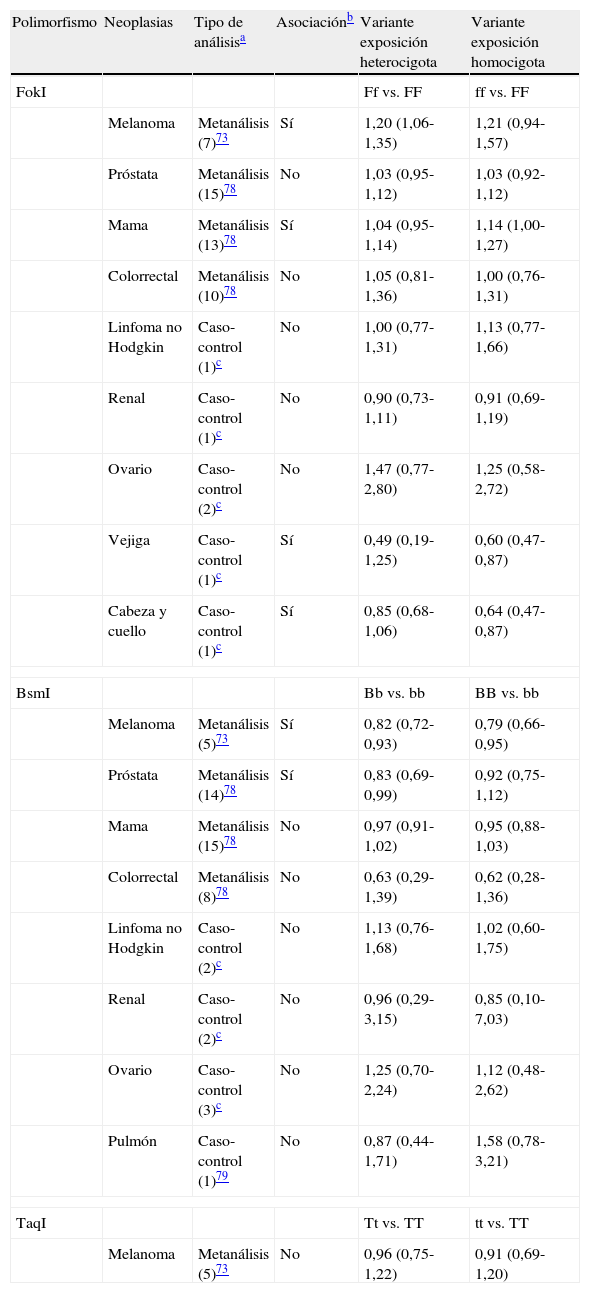
El gen que codifica para el receptor de la vitamina D (VDR) está localizado en la región cromosómica 12q13 y contiene numerosas variantes, algunas de las cuales se considera que pueden alterar la función del receptor. La variante más estudiada se localiza en el punto de restricción Fok I del exón 2 (F/f). Esta variante da lugar a una alteración del punto de iniciación de la translación del gen que genera una proteína codificada (F) más corta que se piensa que es más activa90. La variante f, menos activa, se ha evaluado en dos metaanálisis, observándose que confiere un mayor riesgo de desarrollar un melanoma y un cáncer de mama pero no influye en el cáncer de próstata ni en el colorrectal (tabla 4)86,91. De forma adicional, varios estudios de casos y controles han mostrado que no hay un mayor riesgo asociado a esta variante para el linfoma no-Hodgkin, el cáncer renal, el cáncer de ovario y el cáncer de pulmón91. Curiosamente, la variante f parece conferir un efecto protector frente al cáncer de vejiga y el de cabeza y cuello91.
Resumen de los estudios en los que se han evaluado los polimorfismos en el gen del receptor de la vitamina D (VDR) en la susceptibilidad al cáncer
| Polimorfismo | Neoplasias | Tipo de análisisa | Asociaciónb | Variante exposición heterocigota | Variante exposición homocigota |
| FokI | Ff vs. FF | ff vs. FF | |||
| Melanoma | Metanálisis (7)73 | Sí | 1,20 (1,06-1,35) | 1,21 (0,94-1,57) | |
| Próstata | Metanálisis (15)78 | No | 1,03 (0,95-1,12) | 1,03 (0,92-1,12) | |
| Mama | Metanálisis (13)78 | Sí | 1,04 (0,95-1,14) | 1,14 (1,00-1,27) | |
| Colorrectal | Metanálisis (10)78 | No | 1,05 (0,81-1,36) | 1,00 (0,76-1,31) | |
| Linfoma no Hodgkin | Caso-control (1)c | No | 1,00 (0,77-1,31) | 1,13 (0,77-1,66) | |
| Renal | Caso-control (1)c | No | 0,90 (0,73-1,11) | 0,91 (0,69-1,19) | |
| Ovario | Caso-control (2)c | No | 1,47 (0,77-2,80) | 1,25 (0,58-2,72) | |
| Vejiga | Caso-control (1)c | Sí | 0,49 (0,19-1,25) | 0,60 (0,47-0,87) | |
| Cabeza y cuello | Caso-control (1)c | Sí | 0,85 (0,68-1,06) | 0,64 (0,47-0,87) | |
| BsmI | Bb vs. bb | BB vs. bb | |||
| Melanoma | Metanálisis (5)73 | Sí | 0,82 (0,72-0,93) | 0,79 (0,66-0,95) | |
| Próstata | Metanálisis (14)78 | Sí | 0,83 (0,69-0,99) | 0,92 (0,75-1,12) | |
| Mama | Metanálisis (15)78 | No | 0,97 (0,91-1,02) | 0,95 (0,88-1,03) | |
| Colorrectal | Metanálisis (8)78 | No | 0,63 (0,29-1,39) | 0,62 (0,28-1,36) | |
| Linfoma no Hodgkin | Caso-control (2)c | No | 1,13 (0,76-1,68) | 1,02 (0,60-1,75) | |
| Renal | Caso-control (2)c | No | 0,96 (0,29-3,15) | 0,85 (0,10-7,03) | |
| Ovario | Caso-control (3)c | No | 1,25 (0,70-2,24) | 1,12 (0,48-2,62) | |
| Pulmón | Caso-control (1)79 | No | 0,87 (0,44-1,71) | 1,58 (0,78-3,21) | |
| TaqI | Tt vs. TT | tt vs. TT | |||
| Melanoma | Metanálisis (5)73 | No | 0,96 (0,75-1,22) | 0,91 (0,69-1,20) | |
La segunda variante más estudiada es el polimorfismo detectado por la enzima de restricción BsmI en el intrón 8 (B/b). Aunque este polimorfismo es considerado silente, por cuanto no altera la secuencia de la proteína codificada, podría afectar a la expresión génica mediante una alteración de la estabilidad del ARN mensajero90. La variante b confiere un riesgo aumentado de desarrollar un melanoma y un cáncer de próstata, pero no de mama ni colorrectal, según los dos metaanálisis más recientes (tabla 4)86,91. Además, tampoco se ha observado asociación en varios estudios de casos y controles con el linfoma no-Hodgkin, el cáncer renal, el cáncer de ovario y el cáncer de pulmón91,92.
Es especialmente interesante la relación que se ha observado entre los niveles de vitamina D y la supervivencia. En un estudio retrospectivo reciente se constató una asociación entre los niveles altos de vitamina D3 al diagnóstico y un menor espesor tumoral93, así como con un efecto protector independiente frente a la recaída o la muerte por melanoma. Además, observaron una clara interacción entre los niveles de la vitamina D y el genotipo BsmI del receptor de la vitamina D sobre el intervalo libre de enfermedad93. Estos resultados sugieren la necesidad de establecer pautas adecuadas para mantener unos niveles de vitamina D óptimos en los pacientes con melanoma.
En cuanto a la relación entre la vitamina D con el cáncer de piel, el tema es especialmente complejo debido a la interrelación de ambos con la radiación ultravioleta. Lo que sí parece claro es que aquellos pacientes que han padecido cáncer de piel parecen tener un mayor riesgo de niveles insuficientes de vitamina D, ya sea por las medidas de fotoprotección que utilizan para evitar un nuevo cáncer cutáneo o por otros factores todavía no bien conocidos94.
No obstante, la asociación entre exposición solar y protección frente a diversos cánceres internos, posiblemente debido a la producción de la vitamina D, sigue siendo controvertida. Mientras que instituciones como la International Agency for Research on Cancer (IARC) Working Group on «Vitamin D and Cancer» encuentra una limitada evidencia que apoye la asociación entre la exposición solar y una reducción en el riesgo de cáncer de mama, colon y próstata95, otros investigadores están en desacuerdo y creen que estas evidencias son más sólidas y avalan la prevención del cáncer mediante la producción de vitamina D96.
Controversias acerca de la vitamina D¿Existe un marcador sanguíneo óptimo del estado de vitamina D y cuáles son sus niveles deseables?Una revisión sistemática revela que la vitamina 25(OH)D circulante es un marcador robusto y fiable del estado de vitamina D97. No están definidos cuáles son sus niveles sanguíneos óptimos para el ser humano, si estos son los mismos para todas las edades y cuál es el dintel para establecer la necesidad o no de tratamiento con vitamina D. Esto en parte es debido a la variabilidad de concentraciones de vitamina D según la localización geográfica y las diferencias en la técnica de medida. En cualquier caso, la concentración sérica de 25(OH)D inducida por la exposición solar no excede nunca de alrededor de 60 ng/ml. En general, se acepta que niveles circulantes de 25(OH)D alrededor de 30-35 ng/dl (75 nmol/L) son los adecuados para una salud óptima98. Sin embargo, el comité de la IOM99 en sus últimas recomendaciones de 2011, modera estas cifras. Tras una cuidadosa revisión de la evidencia afirman que niveles de 16 ng/ml (40 nmol/l) cubren los requerimientos de aproximadamente la mitad de la población, y niveles de 20 ng/ml (50 nmol/l) los del 97,5% de la misma. Los datos acerca de los beneficios de niveles séricos más altos son escasos, en particular los que hacen referencia a los efectos a largo plazo de concentraciones altas mantenidas de forma crónica. Concentraciones de 50 ng/ml (125 nmol/l) deben alertar al clínico sobre el potencial de producir efectos adversos.
Cambios ambientales, fotoprotección y vitamina D: ¿existe el dilema?Las dosis personales de radiación UV dependen, como ya se ha comentado, de muchos factores: ambientales (latitud, altitud, aerosoles, nubes y dispersión) y sociales (tipo de trabajo, ocio, estética, etc). La mayor sensibilización de la población sobre los daños de la radiación solar UV ha incrementado las medidas fotoprotectoras de carácter preventivo, como evitar la sobreexposición solar, utilizar asiduamente fotoprotectores, etc. El informe de expertos de la UNEP100 plantea una gran controversia en la comunidad científica: hay investigadores que defienden que se están sobreestimando los efectos adversos de la radiación UVB y subestimando los beneficiosos como la síntesis y acumulación de vitamina D.
Ante esta situación, nos podemos preguntar: «¿la mayor fotoprotección de la población frente al eritema o la quemadura solar por un mayor uso de cremas fotoprotectoras en un escenario de recuperación de la capa de ozono afectará a la capacidad de síntesis de vitamina D3 y por lo tanto a sus efectos beneficiosos?». En el informe UNEP de 2006 sobre efectos de la radiación UV en el medio ambiente y la salud humana se recoge una controversia entre dos grupos de científicos en relación con la exposición solar y el balance entre los efectos beneficiosos y perjudiciales de la misma. Un grupo29 establece que, aunque la radiación UV tiene el efecto beneficioso de la síntesis de vitamina D, no se pueden establecer recomendaciones sencillas que garanticen un balance entre los efectos positivos de la vitamina D y los negativos de la sobreexposición a la RUV. Mientras, el otro grupo101 defiende que en el balance riesgo/beneficio de la radiación UVB predomina el beneficio. Esto se ha llegado incluso a cuantificar, de forma que se estima que el déficit de vitamina D por una inadecuada exposición solar y/o una dieta insuficiente conlleva un coste de 40-56 billones de dólares por osteoporosis, cánceres de órganos internos y enfermedades virales, mientras que los costes derivados del exceso de radiación UV es de 6-7 billones de dólares102.
Sí es importante tener en cuenta cuál es la población con más riesgo de deficiencia de vitamina D: ancianos que requieren cuidados intensivos o están institucionalizados, por su escasa exposición al sol, personas con cáncer de piel u otros problemas dermatológicos que requieran evitar el sol, personas de piel muy oscura, mujeres que van totalmente cubiertas con velo y pacientes con mala absorción de vitamina D.
¿Es la exposición solar la fuente de vitamina D más importante en la población?Gilchrest103 ha demostrado la relación entre la dosis de radiación UV y la quemadura, el bronceado, la formación de fotoproductos del ADN y la cantidad de pre-vitamina D3 en la piel. En el caso de la quemadura solar y el bronceado, la respuesta es dosis dependiente hasta llegar a un umbral por encima del cual se produce la formación de ampollas. En el caso de los fotoproductos del ADN, la respuesta aumenta linealmente desde cantidades muy pequeñas a muy grandes de radiación UV. En el caso de la formación de pre-vitamina D3, la cantidad se incrementa linealmente a pequeñas dosis de radiación UV hasta llegar a un plateau a dosis por debajo de 1 MED. Esto es debido a que exposiciones a radiación UV más altas dan como resultados la conversión de pre-vitamina D3 a fotoproductos inactivos, como el luminsterol y el taquisterol. Por tanto, la eficiencia de nuestra piel para la producción de pre-vitamina D3 es mayor que para la producción de eritema, es decir su síntesis se consigue con dosis suberitematógenas de radiación UV.
Desde un punto de vista más epidemiológico, no está claro que a mayor exposición solar más cantidad de vitamina D. Así, diversos estudios epidemiológicos realizados en zonas muy soleadas, como Honolulu, el sur de Arizona o de Florida, Queensland (Australia), la India o Brasil, encuentran que alrededor del 70% de la población estudiada presentaba niveles de vitamina D inferiores a 30 ng/ml104,105. Acorde con esto, un metaanálisis que incluyó 394 estudios concluyó que la latitud no influye de forma global en los niveles de vitamina 25(OH)D106, si bien, un análisis separado mostró un descenso de la vitamina 25(OH)D con la latitud sólo en las personas de raza blanca, pero no en el resto. Sin embargo, estudios como el de Terushkin et al107 nos muestran como la síntesis de una cantidad equivalente a 400 UI de vitamina D diarias se puede obtener con exposiciones solares cortas (3-8 minutos) en un 25% de la superficie cutánea, en individuos de piel blanca, con distintos fototipos, en un área geográfica con la latitud de Miami durante todo el año y de abril a octubre en Boston; es decir, según este estudio, la latitud sí sería un factor limitante en la síntesis de vitamina D durante los meses de octubre a abril en latitudes altas. Hay que considerar que en los niveles de vitamina D no sólo influye la síntesis cutánea de la misma sino también una destrucción aumentada de pre-vitamina o vitamina D3, una regulación negativa de la síntesis de vitamina D cuando se sintetiza melanina, alteraciones en su transporte y probablemente otros factores todavía no bien conocidos que condicionen una restricción en la síntesis de vitamina D en respuesta a la radiación UV. Por lo tanto, no existen evidencias que permitan atribuir la deficiencia de vitamina D que observamos en las poblaciones de forma exclusiva a una inadecuada exposición solar.
En cuanto a las lámparas de radiación UVB artificial, un reciente estudio demuestra como la fototerapia con UVB de banda estrecha induce un incremento de la media de los niveles plasmáticos de vitamina D en los pacientes psoriásicos de 23 ng/ml a 50 ng/ml108.
Aunque los fotoprotectores pueden bloquear casi por completo la producción de pre-vitamina D en la piel bajo condiciones teóricas, en la práctica no ocurre109. Esto es principalmente debido a su inadecuada aplicación en la piel y, además, posiblemente a que los individuos que se aplican fotoprotector están más horas expuestos que aquellos que no lo aplican. Así, según Diffey110 y Thieden et al111 la mayor dosis de radiación UV se recibe durante los periodos estivales que es a su vez cuando se utilizan más los fotoprotectores que cualquier otro método de fotoprotección. Otro estudio realizado en pacientes con lupus encuentra que los niveles de vitamina D están débilmente relacionados con el uso de fotoprotectores, mientras que la asociación es muy alta con el uso de ropas y con limitar la exposición solar112. Por tanto, no poseemos evidencias de que los fotoprotectores condicionen déficit de vitamina D en la población.
Tal y como Weinstock apunta98, parece que la prevención del cáncer de piel no es la causa de los niveles bajos de vitamina D que se registran en el mundo y, por tanto, abandonar las medidas de fotoprotección no va a ser la solución. Además, la mayoría de los estudios en los que se ha demostrado un beneficio al aumentar los niveles plasmáticos de vitamina D se han conseguido con suplementación oral. No obstante, los dermatólogos debemos ser conscientes de que en muchos de los pacientes a los que recomendamos fotoprotección se puede disminuir la fotosíntesis de dicha vitamina en la piel por lo que tienen un mayor riesgo de hipovitaminosis D.
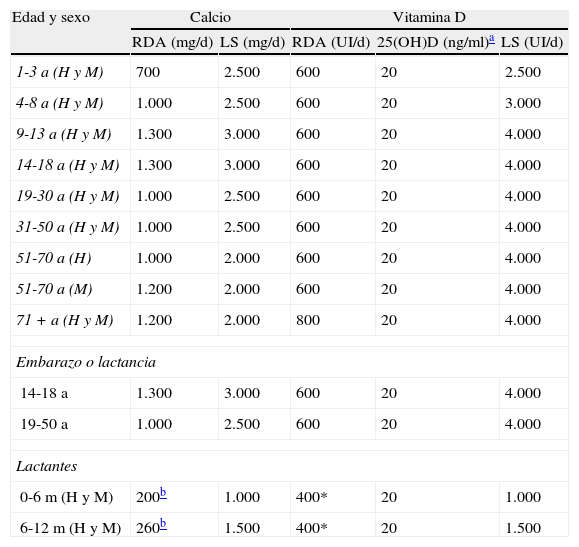
¿Cómo prevenir y tratar la hipovitaminosis D?Aunque factores como la obesidad, la dieta, el color de la piel o la cantidad de exposición solar, entre otros, puedan influir en los niveles de vitamina D, sólo su determinación sanguínea nos revelará la existencia o no de un déficit. En la tabla 5 se recogen los requerimientos de calcio y vitamina D, considerando la salud ósea como indicador, según la edad y el sexo y en situaciones especiales como durante el periodo de embarazo y lactancia. Las recomendaciones diarias del IOM99 para población general son de 600 UI de vitamina D para edades entre 1 y 70 años y de 800 UI por encima de esta edad, lo que corresponde a unos niveles séricos de 25(OH)D de al menos 20 ng/ml (50 nmol/l). En caso de administrar suplementos, las recomendaciones son de 400 o 1.000 UI diarias de vitamina D con o sin calcio; 10.000 UI cada 7 o 10 días o 50.000 UI mensuales. Posteriormente, es importante monitorizar los niveles de nuevo pues existe gran variabilidad entre individuos en el incremento alcanzado113. Si se parte de niveles de 25(OH)D inferiores a 15mg/dl se administrarán 50.000 UI semanales durante 8 semanas para continuar luego con las dosis previamente expuestas. Aunque la intoxicación por vitamina D se ha asociado con niveles de ingesta entre 50.000 y 1 millón de UI/día durante meses o incluso años, el riesgo potencial de litiasis renal, daño vascular, e incluso fracturas con administración de dosis altas de vitamina D nos obliga a ser cautos a la hora de una administración indiscriminada de la misma a la población. Por ello, desde un punto de vista de la salud pública, aumentar el número de alimentos suplementados de uso habitual es la única forma de llegar de una forma equilibrada a toda la población98.
Requerimientos dietéticos de calcio y vitamina D según sexo y edad (Instituto de Medicina de América)
| Edad y sexo | Calcio | Vitamina D | |||
| RDA (mg/d) | LS (mg/d) | RDA (UI/d) | 25(OH)D (ng/ml)a | LS (UI/d) | |
| 1-3 a (H y M) | 700 | 2.500 | 600 | 20 | 2.500 |
| 4-8 a (H y M) | 1.000 | 2.500 | 600 | 20 | 3.000 |
| 9-13 a (H y M) | 1.300 | 3.000 | 600 | 20 | 4.000 |
| 14-18 a (H y M) | 1.300 | 3.000 | 600 | 20 | 4.000 |
| 19-30 a (H y M) | 1.000 | 2.500 | 600 | 20 | 4.000 |
| 31-50 a (H y M) | 1.000 | 2.500 | 600 | 20 | 4.000 |
| 51-70 a (H) | 1.000 | 2.000 | 600 | 20 | 4.000 |
| 51-70 a (M) | 1.200 | 2.000 | 600 | 20 | 4.000 |
| 71 + a (H y M) | 1.200 | 2.000 | 800 | 20 | 4.000 |
| Embarazo o lactancia | |||||
| 14-18 a | 1.300 | 3.000 | 600 | 20 | 4.000 |
| 19-50 a | 1.000 | 2.500 | 600 | 20 | 4.000 |
| Lactantes | |||||
| 0-6 m (H y M) | 200b | 1.000 | 400* | 20 | 1.000 |
| 6-12 m (H y M) | 260b | 1.500 | 400* | 20 | 1.500 |
H: hombre; LS: límite superior por encima del cual existe riesgo de efectos adversos; este límite no se debe tomar como nivel a alcanzar ya que no existe evidencia de una mayor beneficio con niveles superiores a los RDA; M: mujer; RDA: Recommended Dietary Allowances o recomendaciones diarias.
Fuente: Ross AC et al99.
Los beneficios de la vitamina D y la mejor manera de obtener y mantener unos niveles óptimos son asuntos muy controvertidos y con importantes implicaciones potenciales en la salud humana. La vitamina D aumenta la salud musculoesquelética y reduce la mortalidad asociada a problemas óseos en algunos grupos de población, especialmente en los ancianos y otros grupos de riesgo. Existen evidencias de que la vitamina D influye en el desarrollo de cáncer, la enfermedad cardiovascular, los procesos autoinmunes y las infecciones. No obstante, esta evidencia, aunque altamente sugestiva, no es lo suficientemente robusta para extraer conclusiones que establezcan una relación causa efecto. Existen discrepancias en los niveles séricos deseables de vitamina D, y mientras que en los últimos años se hablaba de 30 ng/ml (75 nmol/l) como óptimos, las últimas recomendaciones de la IOM consideran que niveles séricos de 20 ng/ml (50 nmol/l) parecen suficientes y alcanzables para la población general incluso en condiciones de mínima exposición solar. Si atendemos a estas cifras, quizás la prevalencia de esa «hipovitaminosis casi pandémica» comunicada en los últimos años esté sobreestimada.
Muchas de las dudas y controversias acerca del balance entre riesgo y beneficio de la vitamina se están investigando en un estudio europeo multinacional «ICEPURE: impacto del clima y los factores ambientales en la exposición a la radiación UV individual y en la salud humana» (http://www.icepure.eu). Además, necesitamos comprender mejor la relación entre el mantenimiento de los niveles de vitamina D mediante la radiación UVB frente a la dieta o la suplementación, así como sus interacciones114.
Por todo ello, son necesarios más estudios poblacionales y a largo plazo, así como ensayos clínicos aleatorizados que aporten luz y evidencias que permitan evitar los problemas derivados tanto del defecto como del exceso de vitamina D. Si consideramos todo lo dicho, lo más cauto es adoptar la recomendación de las Academias de Dermatología Australiana y Americana que advierten a la población de que no se debe tomar el sol como fuente primordial de vitamina D, puesto que se tiene certeza de que la radiación ultravioleta es un carcinógeno cutáneo, sino que lo saludable es combinar una exposición solar limitada junto a una adecuada alimentación y suplementos cuando fueran necesarios.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.