La biopsia del ganglio centinela es una técnica que se realiza de forma rutinaria en el manejo del melanoma, en el cual la afectación ganglionar ha demostrado ser el mejor indicador pronóstico de supervivencia. Dado que la utilidad de la misma en este tipo de neoplasia cutánea está demostrada, se ha venido realizando en otros tumores cutáneos en los cuales la experiencia es mucho menor y cuya utilidad en la mayoría de los casos está todavía por demostrar. Realizamos una revisión crítica de los distintos tumores cutáneos en los cuales se ha realizado esta técnica y se discute acerca de su utilidad.
Sentinel lymph node biopsy is performed routinely in melanoma because lymph node progression has been shown to be the strongest predictor of survival. Given the proven relevance of biopsy findings in this type of skin cancer, the procedure has been extended to other skin tumors. Experience in nonmelanoma cancer is much more limited and the prognostic usefulness of biopsy results remains to be shown. This critical review of the literature on the various skin tumors in which sentinal node biopsy has been practiced discusses the usefulness of this procedure.
La técnica de la biopsia del ganglio centinela (BGC) se basa en la hipótesis de que el flujo linfático eferente de las neoplasias sólidas no se distribuye al azar, sino que parece seguir un patrón, se dirige a un ganglio determinado que es el receptor directo y, posteriormente, se produce un paso secundario a otros ganglios. La localización y biopsia selectiva de este primer ganglio permite una valoración directa de la histología de diseminación ganglionar. Por el contrario, la negatividad del estudio anatomopatológico de este ganglio permite evitar la realización de linfadenectomías innecesarias.
Esta técnica ha demostrado ser el mejor indicador pronóstico de supervivencia en pacientes con melanoma1. Asimismo, ha permitido cambiar los hábitos quirúrgicos para evitar la realización de linfadenectomías profilácticas, muchas de las cuales eran realizadas en pacientes que no lo precisaban.
Mecanismo de metástasis linfáticasLas células que van a producir metástasis por vía linfática alcanzan los ganglios a través de los vasos linfáticos aferentes en los sinusoides subcapsulares, de forma individual o en pequeños grupos de células. Como las células tumorales llegan al espacio subcapsular, la afectación de la cápsula puede realizarse en cualquier momento desde la invasión ganglionar.
Las células tumorales van proliferando, en un principio en el córtex, pudiendo posteriormente extenderse hasta la médula del ganglio y sustituir la estructura ganglionar normal. Las células tumorales se diseminan a través de los linfáticos eferentes localizados en el hilio de los ganglios.
El patrón de crecimiento de las metástasis ganglionares está bien establecido, en un principio como células tumorales aisladas, después como micrometástasis y posteriormente como macrometástasis.
Técnica del ganglio centinelaTrazadoresPara la detección del ganglio centinela se utilizan unos trazadores específicos que se inyectan vía intradérmica en la vecindad del tumor y que marcan el drenaje linfático característico de cada paciente. En general se utilizan isótopos radiactivos (tecnecio [Tc]) en partículas coloidales asociados o no a colorantes vitales.
Tras la administración del trazador las partículas difunden por el incremento de la presión intersticial por los vasos y son transportadas hasta los ganglios de drenaje, donde permanecen en el ganglio centinela. Esto va a permitir posteriormente su detección mediante el instrumental adecuado.
Según sea el tamaño del coloide (entre 2nm y 400nm) en el que va vehiculizado el Tc, variarán las características tanto de velocidad de transporte como de permanencia en el ganglio.
Entre los radiofármacos más empleados se encuentran el 99mTc-nanocoloide de albúmina, el 99mTc-azufre coloidal filtrado y el 99mTc-sulfuro de antimonio.
Hay que tener en cuenta que para cada coloide no existe un diámetro constante de partículas, sino que se observa un rango de diámetros alrededor de un valor medio. Los más utilizados son los coloides de tamaño intermedio, entre 5-80nm, que incluyen la albúmina nanocoloidal, sulfuro coloidal y sulfuro de renio, que muestran menor penetración sistémica y buena delimitación de ganglios de drenaje
DetecciónSe realiza una detección preoperatoria mediante:
- 1.
Gammagrafía dinámica: permite visualizar la dirección y el número de trayectos de salida.
- 2.
Gammagrafía estática: permite ver la localización final del trazador, marcando la zona «caliente» con tinta en la piel.
En los últimos años se están realizando estudios con nuevos trazadores como los siguientes2–6:
- 1.
Fluorescencia con verde indocianina (Dianogreen®) detectado mediante cámaras de infrarrojos. Consiste en la inyección de un trazador fluorescente que puede ser visualizado mediante cámaras específicas para la detección del mismo: sistema de detección a tiempo real.
Las ventajas de este método son: a) no depende de gammacamaras ni de detectores radioisotópicos; b) permite la detección del ganglio linfático con más facilidad que con el radiotrazador; c) es más útil para la detección de ganglios cercanos al tumor; y d) no existe riesgo de radiación para el paciente ni para el operador.
Las desventajas de este método son: a) sólo detecta ganglios linfáticos hasta 2cm de profundidad; y b) el estudio cuantitativo de la fluorescencia en los tejidos es difícil, por lo que existe el riesgo de dejar ganglios centinela al extirpar otros de mayor tamaño.
- 2.
Nanojaulas de oro detectadas mediante sistemas fotoacústicos. Son fácilmente conjugables con anticuerpos para receptores específicos4.
La técnica histopatológica utilizada para el estudio de los ganglios extraídos consiste en realizar secciones múltiples en la totalidad del ganglio. A partir de una sección central a lo largo del eje mayor del mismo (cortes cada 2mm y secciones cada 200μm).
Se debe realizar estudio con hematoxilina-eosina (H-E) y con técnicas de inmunohistoquímica (IHQ) cuando la H-E sea negativa. Las IHQ que se usan en el caso del melanoma son S-100, MELAN–A y HMB-45.
Indicaciones de la técnicaEn la actualidad esta técnica ha demostrado su utilidad pronóstica y se realiza en el manejo de numerosos tipos de neoplasias sólidas con tendencia a la diseminación ganglionar, como melanoma7, mama8, pene9, vulva10, carcinoma de tiroides11, pulmón12, colorrectal13, próstata14 y gástrico15, entre otras.
Ganglio centinela en cáncer cutáneo no melanomaAparte de las indicaciones establecidas, hay una serie de tumores cutáneos no melanoma en los cuales se está tratando de conocer el posible beneficio que esta técnica puede aportar en su manejo.
De momento no existen series lo suficientemente grandes como para marcar indicaciones claras.
Ganglio centinela en carcinoma escamoso cutáneoEl carcinoma escamoso cutáneo (CEC) supone aproximadamente un 20% de las neoplasias cutáneas, y representa la segunda causa más frecuente de cáncer cutáneo en caucásicos16–18.
Este tipo de tumores pueden crecer hasta formar grandes masas y volverse invasivos. A diferencia de los carcinomas basocelulares, los CEC tienen mayor potencial para diseminarse a ganglios linfáticos regionales y a distancia, considerándose una tasa de metástasis global de un 5%.La supervivencia a los 5 años, cuando el CE ha metastatizado, es del 26%18.
Las metástasis suelen producirse en los dos primeros años desde el diagnóstico (80%)16,19–21; sin embargo se han descrito casos de metástasis de presentación más tardía22.
Los puntos fundamentales a analizar en el tema que nos interesa son: ¿qué consideramos CEC de alto riesgo?; ¿cómo manejamos a los pacientes con CEC de alto riesgo sin evidencia clínica ni radiológica de afectación ganglionar (N0)?
- 1.
¿Qué consideramos CE de alto riesgo? Entendemos como CE de alto riesgo aquel que tiene un riesgo > 5% de presentar metástasis, basado en factores desfavorables dependientes, tanto del paciente (por ejemplo inmunosupresión) como del propio tumor 23.
Existen numerosos estudios en los cuales se evalúan estos factores16,24,25, sin embargo nos parece importante destacar el estudio realizado por Breuninger et al25, en el que estudian a 615 pacientes a los que se les realiza cirugía de CE. Se realiza un estudio multivariante analizando el grosor del tumor, tamaño, localización, grado de diferenciación histológica, subtipo histológico desmoplásico e historia de múltiples CEC e inmunosupresión.
El objetivo principal del estudio fue el de evaluar el tiempo en el que se producían las metástasis y/o el tiempo de recurrencia local (definido como el tiempo que transcurría desde el diagnóstico del tumor hasta que se diagnosticaba la metástasis o la recurrencia). El seguimiento medio de los pacientes fue de 43 meses.
De los 615 pacientes 26 (4%) desarrollaron metástasis y 20 pacientes (3%) recurrencia local. De los pacientes que desarrollaron metástasis 19 lo hicieron en el primer año desde el diagnóstico. No se encontró ningún paciente que las desarrollara más tarde de los 4 años.
Estos autores encontraron que los CEC < 2mm de grosor no metastatizaban, los CEC con 2-6mm de grosor se asociaban a un riesgo intermedio de desarrollar metástasis (4%) y aquellos > 6mm de grosor presentaron un riesgo elevado de desarrollar las mismas (16%). En las conclusiones propusieron que se debería revisar la actual clasificación de CEC según la TNM, e incluir el grosor del tumor a la hora de establecer la clasificación.
- 2.
¿Cómo manejamos los CEC de alto riesgo sin evidencia clínica ni radiológica de afectación ganglionar (N0)? El problema radica en el manejo de los CEC de alto riesgo que no tienen evidencia clínica ni radiológica de afectación ganglionar (N0). Hasta el momento no existen unas guías globalmente aceptadas, siendo posibles varias alternativas: a) seguimiento estrecho; b) asociar radioterapia posoperatoria; c)linfadenectomía regional profiláctica; y d) linfadenectomía ± radioterapia.
En los últimos años se están realizando numerosos estudios para evaluar la utilidad de la BGC en este tipo de pacientes. Al revisar los estudios realizados hasta el momento destaca la dificultad de interpretación de los resultados y la dificultad para sacar conclusiones, ya que con frecuencia se mezclan CEC de distintas localizaciones (por ejemplo: CEC localizados en la cara con CE de lengua).
La mayor parte de estudios son llevados a cabo por otorrinolaringólogos, cirujanos plásticos y cirujanos maxilofaciales, no habiendo encontrado ningún estudio que evalúe la utilidad de esta técnica en tumores exclusivamente cutáneos de la región facial, por ejemplo.
En las Guías prácticas de Oncología de 2010 (NCCN: The National Comprehensive Cancer Network)26 se señala que se debe considerar la realización de BGC en «ciertos» tumores de alto riesgo, aunque el beneficio de esta técnica aún no ha sido probado.
En CE de cavidad oral, orofaringe y genitales se lleva realizando durante varios años, y pueden encontrarse varios estudios en los que se señala que esta técnica muestra resultados prometedores en el manejo de estos tumores al tener una alta sensibilidad en la detección de metástasis ganglionares27–30.
Las ventajas que ofrecería la realización de BGC en este grupo de pacientes sería:
- 1.
Aportar información sobre el estadiaje de CEC, identificando los ganglios de drenaje y metástasis subclínicas.
El sistema linfático superficial de la cabeza y el cuello se caracteriza por sus impredecibles vías de drenaje. Se ha demostrado en anteriores estudios que la realización de linfadenectomía electiva, sin la realización previa de linfoscintigrafía preoperatoria, podría estar mal dirigida hasta en un 50% de los casos.
- 2.
Aportar información pronóstica.
- 3.
Ayudar a la toma de decisiones terapéuticas posteriores: realización de linfadenectomía o administración de radioterapia o quimioterapia en pacientes con ganglio centinela positivo.
- 4.
Evitar morbilidad asociada a la radioterapia o la linfadenectomía profiláctica (linfedema secundario y daño neural).
- 5.
Podría tener repercusión en la supervivencia de estos pacientes, ya que identificando metástasis tempranas y tratando las mismas se podría hacer un abordaje terapéutico más dirigido, y en teoría en estadios más tempranos.
Distintos autores señalan que es posible que haya más capacidad de control de la enfermedad metastásica en el CEC que en el melanoma, por la mayor propensión del CEC a diseminarse ordenadamente y su mayor radiosensibilidad31. Por otro lado, la extirpación de micrometástasis podría aportar beneficios en cuanto a la supervivencia por sí misma.
Nos parece interesante destacar los siguientes estudios, ya que son los que mayor número de pacientes han estudiado: Renzi C et al32 publican un estudio en el que se realiza BGC en 22 pacientes con CEC de alto grado clínicamente N0.
Los autores entienden como CEC de alto riesgo aquel que tiene alguno de los factores siguientes: tamaño > 2cm, localización (labio, preauricular), recurrencia local o que aparece sobre piel previamente dañada, tipo histológico poco diferenciado, invasión perineural, profundidad > 4mm, afectación de dermis reticular o grasa subcutánea, afectación de hueso, músculo o cartílago e inmunosupresión.
De los 22 pacientes a los que se les realizó, se encontró ganglio centinela positivo solamente en uno (4,5%). Este presentó recurrencia local de la enfermedad, mientras que el resto de pacientes con ganglio centinela negativo no presentaron recurrencia durante el seguimiento (media de 17 meses).
Los autores reconocen que el estudio tiene limitaciones, como el escaso número de pacientes, la duración del seguimiento y la ausencia de uniformidad de criterios a la hora de incluir a los pacientes con CEC de alto riesgo.
Reschly MJ et al31 publican un estudio en el que realizan escisión y BGC a 9 pacientes con CEC de alto riesgo, localizados tanto en la región facial como en las extremidades.
Consideran CEC de alto riesgo a los pacientes que cumplen al menos un criterio de los 9 siguientes: tratamiento utilizado, tumor recurrente (tratamientos previos), tamaño > 2cm, localización (labio, preauricular), invasión en profundidad, pobre diferenciación histológica, evidencia histológica de invasión perineural, factores precipitantes distintos a la radiación ultravioleta e inmunodepresión.
El ganglio centinela es positivo en 4 pacientes (44%). Dos de los 4 pacientes con ganglio centinela positivo fallecieron de enfermedad metastásica en los dos años siguientes. Los 5 pacientes con ganglio centinela negativo seguían vivos y sin datos de enfermedad recurrente a los 8 meses de seguimiento.
Las tasas de ganglio centinela positivo de estos autores son tan altas como las que se encuentran en CEC de alto riesgo de genitales o cavidad orofaríngea, lo cual podría deberse al escaso número de pacientes y a la falta de uniformidad de criterios para definir los CEC de alto riesgo. Estos autores concluyen que esta técnica es útil en el manejo de estos pacientes.
Conclusión en carcinoma escamoso cutáneoA pesar de que los estudios realizados hasta el momento se han llevado a cabo en un número escaso de pacientes, la mayoría señalan que esta técnica podría ser útil en CEC de alto riesgo, de tal forma que permitiría incluir a los pacientes con ganglio centinela positivo en tratamientos más agresivos y protocolos de seguimiento, lo que podría tener beneficios en términos de supervivencia.
En los pacientes con ganglio centinela negativo se disminuiría la morbilidad, al evitar la realización de tratamientos más agresivos e innecesarios.
La principal dificultad nos la encontramos a la hora de establecer la indicación, es decir, cuando tenemos que definir qué es un CEC de alto riesgo, dada la falta de unidad de criterios en los distintos estudios. Un punto de partida podría ser el estudio de Brantsch et al25, y a partir de ahí diseñar estudios con criterios unificados.
Con los datos que disponemos actualmente la realización de BGC parece lógica en los CEC, con una probabilidad de diseminación linfática superior al 5%, esto es, según la bibliografía revisada en pacientes con CEC de más de 6mm de profundidad.
Creemos también que es importante no perder de vista el contexto en el que nos encontramos y los pacientes con los que tratamos: pacientes de edad muy avanzada, en los cuales la realización de este tipo de técnicas no tendría sentido en términos de riesgo-beneficio.
Asimismo debemos tener en cuenta el drenaje linfático errático en extremidad cefálica (localización frecuente de CEC), lo cual también podría limitar la utilidad de la técnica.
Ganglio centinela en carcinoma de células de MerkelEl carcinoma de células de Merkel (CCM) es un tumor neuroendocrino raro, clínicamente agresivo y con tendencia a la diseminación local y a distancia.
Este tumor afecta a personas de edad avanzada y se ha demostrado un incremento de la incidencia en pacientes inmunodeprimidos, así como en los pacientes VIH positivos y los que son receptores de trasplante de órganos.
Más recientemente se ha implicado en la etiología de este tumor a un poliomavirus (MCPyV), encontrándose en más de un 80% de los casos integrado en el genoma celular33–35.
Es un tumor cuya incidencia se está incrementando, posiblemente debido a un incremento de registro del mismo, al aumento de población > 70 años, así como por el uso en su diagnóstico de la citoqueratina 20, que es un marcador muy específico de CCM36.
Es mucho más frecuente en la raza blanca (93% de los casos), siendo excepcional en la raza negra, con un ligero predominio de los hombres sobre las mujeres (2-3:1).
La localización más frecuente es la cabeza y el cuello (fundamentalmente en la zona periocular y peribucal), seguido de las extremidades y más raro en el tronco.
Clínicamente se manifiestan como lesiones nodulares, eritemato-azuladas. Pueden tener telangiectasias en su superficie, por lo que es posible confundirlos con relativa frecuencia con carcinomas basocelulares. El tamaño de los tumores oscila entre 0,2 y 20cm, aunque la mayoría son < 2cm de diámetro.
En el momento del diagnóstico se encuentra afectación ganglionar en un 15-60% de los pacientes y metástasis a distancia en 1-6% de los pacientes.
El estudio inmunohistoquímico es útil para distinguir el CCM de otros tumores. De forma típica es positivo el marcaje con citoqueratina 20 y negativo con TTF-1 (lo cual sirve para excluir el carcinoma de células pequeñas de pulmón). Otros marcadores que pueden ayudar al diagnóstico son la enolasa neuronal específica, cromogranina y sinaptofisina, entre otros37.
Estadiaje del carcinoma de células de MerkelNo existe una estadificación aceptada globalmente; de hecho, hasta el año 2009 se utilizaban 5 sistemas de estadificación que competían entre sí para describir el CCM. Por esto el American Joint Committee on Cancer (AJCC)38 estableció un nuevo sistema de estadificación de consenso específico, como se puede ver en la tabla 1.
Estadiaje actual del carcinoma de células de Merkel
| Tumor primario (T) | |
| TX | El tumor primario no se puede evaluar |
| T0 | No hay prueba de un tumor primario (por ejemplo, presentación ganglionar o metastásica sin tumor primario asociado) |
| Tis | Tumor primario in situ |
| T1 | Dimensión máxima del tumor: ≤ 2 cm |
| T2 | Dimensión máxima del tumor: ≤ 2 cm, pero ≤ 5 cm |
| T3 | Dimensión máxima del tumor >5 cm |
| T4 | El tumor primario invade el hueso, el músculo, la fascia o el cartílago |
| Ganglios linfáticos regionales (N) | |
| NX | Los ganglios linfáticos regionales no se pueden evaluar |
| N0 | No hay metástasis en los ganglios linfáticos regionales |
| cN0 | Ganglios linfáticos negativos en el examen clínicoa (no se realizó un examen patológico) |
| pN0 | Ganglios linfáticos negativos en el examen patológico |
| N1 | Metástasis en el/los ganglio(s) linfático(s) regional(es) |
| N1a | Micrometástasisb |
| N1b | Macrometástasisc |
| N2 | Metástasis en tránsitod |
| Metástasis a distancia (M) | |
| M0 | Sin metástasis a distancia |
| M1 | Metástasis más allá de los ganglios linfáticos regionales |
| M1a | Metástasis hasta la piel, los tejidos subcutáneos o ganglios linfáticos lejanos |
| M1b | Metástasis hasta el pulmón |
| M1c | Metástasis hasta todos los otros sitios viscerales |
Reproducida de AJCC: Merkel cell carcinoma38.
La detección clínica de la enfermedad ganglionar se puede realizar mediante inspección, palpación o pruebas de imagen.
Las micrometástasis se diagnostican después de una linfadenectomía de ganglio linfático centinela o una linfadenectomía programada.
El estadio clínico se considera el factor pronóstico más importante; así, la supervivencia a los 5 años es del 81% en estadio Ia, del 67% en el estadio Ib, del 52% en estadio II y de un 11% a los dos años en el estadio III39.
Se describen tasas de recurrencia entre el 40-45%, alcanzándose tasas de hasta el 77% cuando los tumores se localizan en la cabeza y el cuello. El tiempo medio de recurrencia son 8 meses y el 90% recurre en los dos primeros años40.
A los pacientes con CCM se les debe realizar un examen minucioso, buscar lesiones cutáneas satélites, palpar ganglios y realizar una TAC, aunque Sheela et al41 concluyen en su revisión que la TAC tiene una baja sensibilidad en detectar afectación ganglionar, así como una baja especificidad en detectar metástasis a distancia.
De hecho, cuando la afectación tumoral es visible en una TAC desaparecen las posibilidades de tratamiento curativo. Sin embargo, hay varios estudios recientes que hablan de la realización de PET-TAC en el seguimiento y manejo posterior de estos pacientes42.
Se consideran factores de mal pronóstico para el CCM el género masculino, lesiones de > 2cm y la presencia de recurrencia local o metástasis a distancia. Algunos autores han encontrado que también son factores de mal pronóstico los tipos histológicos con células pequeñas o intermedias y con un alto índice mitótico.
Otros autores, sin embargo, no han encontrado significado pronóstico en el tipo histológico (sólido, trabecular o difuso) o en el tamaño de la célula (pequeña, mediana o grande)43,44.
Sin embargo, el factor pronóstico más importante en la actualidad es la presencia de afectación ganglionar; por esto la BGC se convierte en una valiosa técnica diagnóstica45.
Biopsia del ganglio centinela en el carcinoma de células de MerkelLa presencia de afectación ganglionar y la presencia de metástasis a distancia son los peores factores pronósticos de supervivencia en el CCM. La realización de linfadenectomía regional profiláctica está en discusión por la morbilidad que conlleva y porque no se ha demostrado que consiga un aumento de la supervivencia.
La disección ganglionar completa se ha propuesto para tumores de gran tamaño, los localizados en la cabeza y el cuello, el subtipo histológico de células pequeñas y en aquellos en los que el primario tenga afectación linfática o vascular36.
La realización de BGC representa una alternativa atractiva a la linfadenectomía completa electiva. Esta permite seleccionar mejor los pacientes a los que hay que realizarles la misma, y permite una detección precoz de afectación ganglionar.
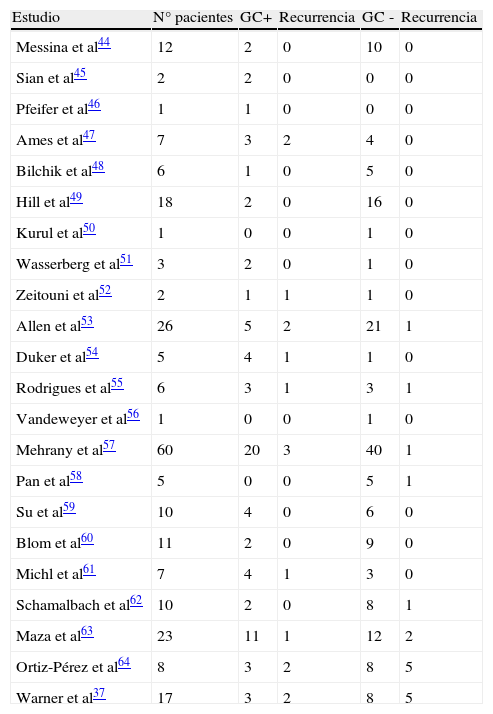
La contribución de la BGC para el CCM se acepta de forma general46–49. En la tabla 237,45–64 resumimos los trabajos que se han realizado al respecto hasta el momento.
Estudios realizados hasta la actualidad de ganglio centinela en carcinoma de células de Merkel
| Estudio | N° pacientes | GC+ | Recurrencia | GC - | Recurrencia |
| Messina et al44 | 12 | 2 | 0 | 10 | 0 |
| Sian et al45 | 2 | 2 | 0 | 0 | 0 |
| Pfeifer et al46 | 1 | 1 | 0 | 0 | 0 |
| Ames et al47 | 7 | 3 | 2 | 4 | 0 |
| Bilchik et al48 | 6 | 1 | 0 | 5 | 0 |
| Hill et al49 | 18 | 2 | 0 | 16 | 0 |
| Kurul et al50 | 1 | 0 | 0 | 1 | 0 |
| Wasserberg et al51 | 3 | 2 | 0 | 1 | 0 |
| Zeitouni et al52 | 2 | 1 | 1 | 1 | 0 |
| Allen et al53 | 26 | 5 | 2 | 21 | 1 |
| Duker et al54 | 5 | 4 | 1 | 1 | 0 |
| Rodrigues et al55 | 6 | 3 | 1 | 3 | 1 |
| Vandeweyer et al56 | 1 | 0 | 0 | 1 | 0 |
| Mehrany et al57 | 60 | 20 | 3 | 40 | 1 |
| Pan et al58 | 5 | 0 | 0 | 5 | 1 |
| Su et al59 | 10 | 4 | 0 | 6 | 0 |
| Blom et al60 | 11 | 2 | 0 | 9 | 0 |
| Michl et al61 | 7 | 4 | 1 | 3 | 0 |
| Schamalbach et al62 | 10 | 2 | 0 | 8 | 1 |
| Maza et al63 | 23 | 11 | 1 | 12 | 2 |
| Ortiz-Pérez et al64 | 8 | 3 | 2 | 8 | 5 |
| Warner et al37 | 17 | 3 | 2 | 8 | 5 |
Estudio total de pacientes GC + recurrencia GG - recurrencia.
Fuente: Gupta SG et al36, Messina JL et al44, Sian KU et al45, Pfeifer T et al46, Ames SE et al47, Bilchik AJ et al48, Hill AD et al49, Kurul S et al50,Wasserberg N et al51, Zeitouni NC et al52, Allen PJ et al53, Duker I et al54, Rodrigues LK et al55, Vandeweyer E et al56, Mehrany K et al57, Pan D et al58, Su LD et al59, Blom A et al60, Michl C et al61, Schmalbach CE62 et al y Maza S63 et al.
Varios autores han llegado a la conclusión de que si la BGC es positiva hay un incremento del riesgo de recurrencia y de enfermedad metastásica, mientras que si es negativa predice mejor pronóstico en cuanto a supervivencia a corto plazo36.
Es importante señalar que el CCM es una entidad bastante rara, por lo que la experiencia en la realización de ganglio centinela en estos pacientes es pequeña.
Gupta SG et al36 describieron su experiencia en 61 pacientes con biopsia de CCM, a 30 de los cuales se le realizó BGC y además realizaron un metaanálisis de otros 92 pacientes diagnosticados de CCM en la literatura, a los que se les realizó BGC.
Fueron estudiados un total de 122 pacientes con CCM sin evidencia clínica de diseminación ganglionar. Se les realizó BGC, encontrándose positividad en 39 pacientes (32%). Encontraron también que la incidencia de ganglio centinela positivo se incrementaba con el tamaño del tumor primario, de forma que en los pacientes con CCM >2cm el 52% tenían ganglio centinela positivo en comparación con el 29% de los pacientes con tamaño de tumor < 2cm (aunque no se encontraron diferencias estadísticamente significativas p=0,23). A los tres años la tasa de recurrencia de los pacientes con ganglio centinela positivo (32%) fue del 60%, tres veces superior que el que se encontró en los pacientes con ganglio centinela negativo (20%).
Este artículo demuestra la alta frecuencia de positividad de ganglio centinela en pacientes sin evidencia clínica ni radiológica de afectación de los territorios ganglionares; desde un punto de vista pronóstico, los autores encuentran un beneficio en la supervivencia de los pacientes que son ganglio centinela positivo cuando se les realiza linfadenectomía precoz, con respecto a los que no se les realiza.
Estos autores concluyen que debe realizarse BGC en los pacientes con CCM N0 para establecer el pronóstico y el tratamiento.
En la serie más larga descrita hasta el momento se incluyeron 251 pacientes. En este grupo los investigadores describen una supervivencia a los 5 años de un 97% en los pacientes sin afectación ganglionar, frente a una supervivencia del 52% en los que presentaban ganglios linfáticos afectos40.
Conclusión de la realización de biopsia del ganglio centinela en el carnicoma de células de MerkelComo conclusión, y según las guías NCCN 2010 (Nacional Comprehensive Cancer Network) se debe incluir la realización de BGC en el manejo de los pacientes con CCM (independientemente del tamaño del mismo) que no tengan evidencia clínica o radiológica de afectación ganglionar, salvo que haya otras circunstancias médicas que contraindiquen la realización de la técnica.
Una excepción serían los CCM localizados en la cabeza y el cuello, localización en la cual la tasa de falsos negativos es muy alta, por lo que no se recomienda de rutina, aunque puede tener valor pronóstico.
Ganglio centinela en otros tumores cutáneosGanglio centinela en enfermedad de Paget extramamariaLa enfermedad de Paget extramamaria es una enfermedad rara que habitualmente se localiza a nivel genital, aunque se ha descrito en muchas otras localizaciones.
Clínicamente se manifiesta como una placa con eritema e hipo o hiperpigmentación, con bordes mal delimitados, por lo que la tasa de recurrencia local es elevada.
En general se trata de un tumor de buen pronóstico, ya que las células tumorales tienden a permanecer en la epidermis y rara vez metastatizan; aun así se han descrito tasas de metástasis ganglionares de hasta el 26% cuando el tumor primario es invasivo65.
El manejo de los pacientes con enfermedad de Paget extramamaria, sin evidencia clínica de afectación ganglionar, es controvertido. En los casos con tumor primario invasivo sin evidencia clínica de afectación ganglionar se recomienda la realización de linfadenectomía electiva. En estos pacientes es en los que podría ser útil la realización de BGC.
Hatta et al66,67 publican en 2008 una serie de 76 pacientes a 24 de los cuales se les realiza BGC. En 12 pacientes se encontró positividad y se les realizó disección ganglionar completa.
Entre los parámetros que analizan en este estudio se encuentra el grado de invasión del tumor, y conforme a este los dividen en intraepidérmicos (IE), microinvasión de la dermis papilar (MID) e invasión de la dermis reticular o tejido celular subcutáneo (DI). Los autores encuentran que de los 76 pacientes estudiados 43 (57%) tienen tumor IE, 22 (29%) MID y 22 (14%) DI.
En el análisis univariante encuentran que los pacientes con tumores DI tienen un incremento de riesgo de mortalidad con respecto a los IE o MID (p=0,01). Los autores concluyen en este estudio y en otro realizado en 13 pacientes que la realización de BGC estaría indicada en todos los casos de enfermedad de Paget extramamaria invasiva, ya que la frecuencia de afectación ganglionar, aunque no sea clínicamente evidente, es mayor que en la no invasiva.
La técnica que se realiza habitualmente para la detección del ganglio centinela es menos sensible para la detección de ganglios que se localizan cerca del tumor en la enfermedad de Paget extramamaria, por el solapamiento con la radiactividad del tumor primario; en estos casos hay autores que han sugerido que el uso de la fluorescencia con verde indocianina, detectado mediante cámara de infrarrojos, podría ser de utilidad6.
Ganglio centinela en carcinoma de glándulas sudoríparasLos adenocarcinomas de glándulas sudoríparas engloban un grupo heterogéneo de tumores que derivan de las glándulas sudoríparas ecrinas o apocrinas.
Dada la baja frecuencia de esta serie de neoplasias es difícil la realización de estudios controlados y aleatorizados. Varios estudios han señalado una tendencia a diseminar a ganglios linfáticos regionales, fundamentalmente el adenocarcinoma digital papilar agresivo y los hidradenocarcinomas.
En general los adenocarcinomas anexiales no tienen una presentación clínica típica, los pacientes en general refieren la aparición de un tumor de rápido crecimiento. El sangrado y la ulceración son frecuentes y en general se requiere la realización de una biopsia para el diagnóstico.
Hay muy poco descrito acerca de la BGC en estos pacientes68–70. El más amplio es un estudio en el que se realiza BGC a 6 pacientes con adenocarcinomas de glándulas sudoríparas (tres hidradenocarcinomas, dos carcinomas de células ductales eccrinas y un porocarcinoma)71. El ganglio centinela fue positivo en 4 pacientes; a dos de ellos se les realizó linfadenectomía regional, mientras que en los otros dos no se realizó por razones médicas. Todos los pacientes estaban vivos y libres de enfermedad durante el seguimiento, que oscilaba entre 2 y 19 meses, con una media de 12 meses.
Los autores señalan que aunque la realización de BGC puede ser de utilidad para estadiar a estos pacientes, el valor pronóstico o la utilidad a la hora de plantear un tratamiento requiere la realización de estudios con mayor número de pacientes.
Ganglio centinela en carcinoma sebáceoEl carcinoma sebáceo es una neoplasia poco frecuente que deriva del epitelio anexial de las glándulas sebáceas. Su localización más frecuente es en la zona palpebral (75%), aunque también se ha descrito en localización extraocular.
El diagnóstico clínico es difícil y puede ser fácilmente confundido con otros tumores cutáneos o patología inflamatoria crónica.
La presentación ocular más frecuente es en forma de un nódulo solitario, pequeño, firme y sobreelevado de coloración amarillento-anaranjada.
A nivel extraocular la localización más frecuente es la cabeza y el cuello en forma de nódulo amarillo-anaranjado.
Se trata de una neoplasia agresiva con una alta tasa de mortalidad y de metástasis. Las tasas de mortalidad oscilan entre un 9-50%, sin embargo parece que con el diagnóstico precoz estas tasas están disminuyendo72.
Las tasas de mortalidad del carcinoma sebáceo ocular oscilan entre el 11-30% con metástasis a distancia en un 3-25%. En un principio se pensaba que el carcinoma sebáceo extraocular tenía mejor pronóstico que el ocular, pero un estudio de 91 pacientes con carcinoma sebáceo extraocular demostró una tasa de recurrencia del 29% y una tasa de metástasis del 21%73.
Existen varios artículos que hablan sobre la realización de BGC en carcinomas sebáceos a nivel ocular, sugiriendo que la técnica es segura, sencilla y que puede ser útil para la mejor estadificación y manejo de estos pacientes.
Estos autores realizan un estudio en el que realizan BGC a 10 pacientes con carcinoma sebáceo localizado en el párpado (4 enfermedad primaria y 6 enfermedad recurrente); la técnica de ganglio centinela fue negativa en todos ellos y en 2 de 10 pacientes se encontraron metástasis ganglionares durante el seguimiento. A pesar de estos datos, los autores concluyen que la BGC es una técnica segura y que debe considerarse en carcinomas sebáceos con alto riesgo de metástasis (recurrentes, de gran tamaño o aquellos que afecten estructuras post-septales)74,75.
Nijhawan et al estudian a 6 pacientes con carcinoma sebáceo de párpado con ganglios clínicamente negativos, y a 5 de ellos les realizan BGC, siendo negativa en todos. Los autores concluyen que, a pesar de esto, la técnica podría ser de utilidad dada la alta frecuencia de afectación ganglionar que se describe en estos pacientes76.
Como conclusión podemos decir que con los datos de los que disponemos actualmente no se puede concluir la utilidad de esta técnica en el carcinoma sebáceo.
Ganglio centinela en linfomas cutáneosLa BGC podría tener un papel importante en el estadiaje de los linfomas cutáneos primarios. Distintos autores señalan que, de acuerdo a su experiencia, la afectación ganglionar es el primer estadio de diseminación extracutáneo.
Existen muy pocos artículos al respecto, por lo que serían necesarios estudios con mayor número de pacientes y bien diseñados para validar las teorías que se exponen en los mismos63,77–79. Hasta el momento no hemos encontrado en la bibliografía revisada ningún estudio en el que se concluya que la realización de BGC permita saber si la afectación ganglionar es primaria o extensión de un linfoma cutáneo, de forma que sólo nos permite saber si hay afectación ganglionar.
ConclusionesCon los datos que disponemos en la actualidad la BGC se puede recomendar en determinados tumores agresivos, como son el CEC de más de 6mm de grosor, el CCM, la enfermedad de Paget extramamaria invasiva y quizás en los casos de carcinomas de glándulas sudoríparas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.