Actualmente existe un aumento mundial de la incidencia de melanoma. Su pronóstico depende entre otros factores de la existencia de metástasis en los ganglios linfáticos regionales. La realización de la biopsia del ganglio centinela persigue la identificación de metástasis ganglionares subclínicas como factor pronóstico de la enfermedad. El presente estudio tiene por objetivo estudiar las diferencias entre los pacientes con melanoma, positivos y negativos a la biopsia del ganglio centinela, y analizar el impacto de esta técnica en su pronóstico.
Material y métodosSe realizó biopsia del ganglio centinela a los pacientes con melanomas de espesor Breslow ≥1mm o con Breslow <1mm y ulceración, nivel de Clark IV–V o regresión. Aquellos con biopsia positiva fueron sometidos a linfadenectomía.
Además, se recogieron las siguientes variables: sexo, edad, fototipo, localización y tipo de melanoma, niveles Breslow y Clark, ulceración, regresión, estadio inicial, TNM, cambio de estadio y fallecimiento por melanoma.
ResultadosEl 19,44% de los pacientes presentó ganglios positivos. Esta positividad se presentó asociada con el melanoma nodular (odds ratio cruda [ORc]: 3,44; intervalo de confianza al 95% [IC 95%]: 1,33–8,90) con respecto al melanoma de extensión superficial Breslow superior a 2,0 (nivel 2,1–4,0: ORc: 21,14; IC 95%: 2,60–172,03, nivel >4,0: ORc: 23,25; IC 95%: 2,44–221,73), nivel Clark IV (ORc: 8,73; IC 95% 1,03–74,12), ulceración (ORc: 4,86; IC 95%: 1,58–14,90), estadios T3 y T4 (T3: ORc: 4,20; IC 95%: 1,52–11,63; T4: ORc: 4,67; IC 95% 1,27–17,15), cambio de estadio (ORc: 7,20; IC 95%: 2,25–22,99) y fallecimiento por melanoma (ORc: 8,67; IC 95%: 3,62–96,15).
ConclusionesEstos resultados confirman la importancia pronóstica de la biopsia del ganglio centinela, que permite identificar a los pacientes con mayor tendencia a la progresión de la enfermedad y fallecimiento por melanoma.
The incidence of melanoma is currently increasing worldwide. One of the factors influencing disease prognosis is the presence of regional lymph node metastases. Sentinel lymph node biopsy attempts to identify subclinical lymph node metastasis as a prognostic factor in the disease. The aim of this study was to analyze differences between patients with melanoma for whom positive or negative results were obtained in sentinel lymph node biopsy and to assess the impact of the technique on disease prognosis.
Material and methodsSentinel lymph node biopsy was carried out in patients with melanoma of the following characteristics: Breslow thickness ≥1mm, Breslow thickness <1mm with ulceration, Clark level IV–V, or regression. Lymphadenectomy was performed in patients with positive sentinel node biopsy. Data were also collected on the following variables: sex, age, skin phototype, site and type of melanoma, Breslow depth, Clark level, ulceration, regression, cancer stage at diagnosis, TNM classification, change in cancer stage during follow-up, and death due to melanoma.
ResultsPositive sentinel node biopsies were recorded in 19.44% of patients. Positive results were associated with the following variables: nodular melanoma (crude odds ratio [ORc] compared with superficial spreading melanoma, 3.44; 95% confidence interval [CI], 1.33–8.90); Breslow thickness >2.0, for a thickness of 2.1–4.0 (ORc, 21.12; 95% CI, 2.60–172.03) and for a thickness >4.0 (ORc, 23.25; 95% CI, 2.44–221.73); Clark level IV (ORc, 8.73; 95% CI, 1.03–74.12); ulceration (ORc, 4.86; 95% CI, 1.58–14.90); T3 (ORc, 4.20; 95% CI, 1.52–11.63) and T4 (ORc, 4.67; 95% CI, 1.27–17.15) in the TNM classification; change in cancer stage during follow-up (ORc, 7.20; 95% CI, 2.25–22.99); and death due to melanoma (ORc, 8.67; 95% CI, 3.62–96.15).
ConclusionsThese results confirm the prognostic importance of sentinel lymph node biopsy, which facilitates identification of patients with a greater tendency towards disease progression and death due to melanoma.
El melanoma es un tumor que presenta índices epidemiológicos diferentes a cualquier otro1. El aumento anual de las tasas de incidencia varía entre el 3 - 7% en los diferentes países de población de piel caucásica2. Con este incremento se estima que cada 10 o 20 años se duplique su incidencia. Este aumento ha permitido la catalogación a nivel mundial de «epidemia de melanoma»3, constituyendo un problema importante de salud pública en todo el mundo4.
En cuanto a la incidencia por continentes destaca en primer lugar Oceanía, con Australia y Nueva Zelanda. En estos países el melanoma es el cuarto cáncer más frecuente en los hombres y el tercero en las mujeres. El segundo lugar lo ocupa América del Norte; Europa está en tercer lugar5.
En Europa se diagnostican aproximadamente 60.000 nuevos casos al año (26.100 en varones y 33.300 en mujeres), lo que representa el 1% de todos los cánceres diagnosticados en un año. Las cifras de incidencia en Europa son ligeramente superiores en mujeres que en varones, 7 y 6 casos por 100.000 personas y año respectivamente, tendencia contraria a la del resto del mundo (en los países con mayores tasas de incidencia, Australia, Nueva Zelanda y Estados Unidos, las cifras son mayores en hombres que en mujeres). Además, las cifras siguen un gradiente Norte-Sur, de forma que las mayores tasas de incidencia corresponden a los países nórdicos, con 15 casos por 100.000 habitantes y año aproximadamente5. Por el contrario, son los países de la cuenca mediterránea, entre ellos España, los que presentan tasas más bajas, entre 5–7 casos por 100.000 habitantes y año concretamente6, aunque también en estos países se ha producido un aumento importante en los últimos años7.
Paralelo al incremento en la incidencia de melanoma se ha producido en las últimas décadas un aumento de las líneas de investigación en torno a este agresivo tumor. El comportamiento biológico del melanoma maligno (MM) está determinado por la interacción de una serie de factores que marcarán el pronóstico del paciente y, en consecuencia, su manejo terapéutico. Mucho se ha avanzado en la genética del tumor para intentar determinar sus bases moleculares8, aunque en la actualidad todavía no existe ningún marcador molecular, cromosómico, inmunohistoquímico o histopatológico conocido en el tumor primario que pueda predecir cómo va a comportarse9.
En lo que todos los expertos se ponen de acuerdo es en afirmar que el pronóstico de un paciente diagnosticado de melanoma maligno dependerá fundamentalmente de dos factores: el espesor del tumor primario (medido a través del grosor micrométrico de Breslow) y la presencia o ausencia de metástasis en los ganglios linfáticos regionales10.
Para determinar el estado histológico de los ganglios linfáticos regionales la realización de la biopsia del ganglio centinela (BGC) se ha convertido en el procedimiento diagnóstico más preciso que existe. Se trata de una técnica diagnóstica introducida recientemente que persigue la identificación de metástasis ganglionares subclínicas con una morbilidad mínima11. Esta técnica ha superando a otras no invasivas convencionales, como la ecografía ganglionar o la tomografía por emisión de positrones (PET), que requieren mayor volumen tumoral para detectar metástasis y, por tanto, ofrecen un diagnóstico más tardío. Actualmente el estado histológico del ganglio centinela (GC) se ha convertido en el factor pronóstico más importante en términos de supervivencia, y ha sido ampliamente utilizado para estandarizar criterios y resultados entre los distintos grupos de trabajo12. Además, la utilidad de la BGC como factor pronóstico en la supervivencia de los pacientes con melanoma ha sido ya avalada por algunos estudios13,14.
El objetivo del presente estudio es determinar las características de los pacientes con melanoma en los que la BCG ha detectado ganglios positivos, diferenciándolos de aquellos en los que el resultado fue negativo, así como analizar el impacto de esta técnica en su pronóstico.
Material y métodoPoblación de estudioIncluimos en el estudio descriptivo a los pacientes atendidos en el Servicio de Dermatología del Hospital Universitario Dr. Peset de Valencia, diagnosticados con informe histopatológico de melanoma, a los que se realizó BGC entre 1998 y 2008 (144 pacientes).
MetodologíaBiopsia del ganglio centinelaSe realizó BGC a todos aquellos pacientes a los que se les habían extirpado melanomas con espesor tumoral (Breslow) superior o igual a 1mm y que no presentasen adenopatías palpables al diagnóstico. Además, debido a que un porcentaje importante de pacientes (6%) con melanomas de menos de 1mm de espesor han demostrado tener metástasis subclínicas al efectuarse la BGC15, se incluyeron de forma individualizada pacientes con menor espesor acompañados de algún otro criterio de riesgo como la ulceración, un nivel de Clark IV o V y signos histológicos de regresión, según indican los nuevos protocolos de actuación en la prevención y tratamiento del melanoma10,16.
Para ello, en primer lugar, se detectaron los GC mediante marcaje con isótopos radiactivos; se determinaron y marcaron los ganglios linfáticos regionales mediante una linfografía isotópica dinámica tras la inyección intradérmica perilesional de contraste (0,5–1mCi de sulfuro de antimonio coloidal marcado con 99mTc), con la dosis fragmentada en 2–4 inyecciones. Posteriormente se localizaron y biopsiaron los GC.
Se realizó un estudio anatomopatológico para determinar la existencia de células tumorales. Para ello los ganglios fueron fijados con formaldehído al 5% y embebidos posteriormente en parafina para ser analizados mediante un estudio histopatológico rutinario con hematoxilina-eosina, e inmunohistoquímico con S100 y HMB45, y realización de cortes seriados hasta agotar la pieza.
Los pacientes con BGC positiva para células tumorales fueron sometidos a una segunda intervención quirúrgica para la realización de una linfadenectomía de la cadena ganglionar afecta.
El seguimiento posterior de los pacientes se realizó de acuerdo con los protocolos establecidos para el melanoma en función del estadio TNM del tumor17.
Paralelamente a las BGC de los pacientes se realizó un estudio retrospectivo recogiendo de forma protocolizada información a partir de la revisión de sus historias clínicas. Se recogió el sexo (hombre/mujer), edad en el momento del diagnóstico (≤25, 26–45, 46–65, >65 años), fototipo (I, II, III), localización del melanoma (cabeza, tronco, miembro superior, miembro inferior, mucosa), tipo histológico del melanoma (melanoma de extensión superficial [MES], nodular, lentigo maligno melanoma [LMM], melanoma lentiginoso acral [MLA], polipoide, amelanótico), nivel Breslow (mm) (≤1,0; 1,1–2,0; 2,1–4,0; >4,0), nivel de Clark (I, II, III, IV, V), ulceración histológica (sí, no), regresión histológica (sí/no), estadio inicial (IA, IB, IIA, IIB, IIC, III), TNM (T1, T2, T3, T4), cambio de estadio (sí/no) y fallecimiento por melanoma (sí/no).
Análisis estadísticoLas variables cuantitativas se estudiaron en función de las medidas de distribución y dispersión (media, desviación estándar) y las cualitativas mediante su frecuencia absoluta y relativa. Las variables estudiadas se compararon aplicando una prueba de homogeneidad utilizando el estadístico Chi-cuadrado de Pearson para variables cualitativas y la t de Student para variables cuantitativas. En caso de existir celdas con n<5 se aplicó una prueba exacta por métodos condicionados (Fisher), con un nivel de significación bilateral alfa de 0,05.
ResultadosUn total de 144 pacientes diagnosticados de melanoma entre 1998 y 2008 fueron sometidos a la realización BGC e incluidos en el estudio. El seguimiento medio de estos pacientes fue de 58,45 meses.
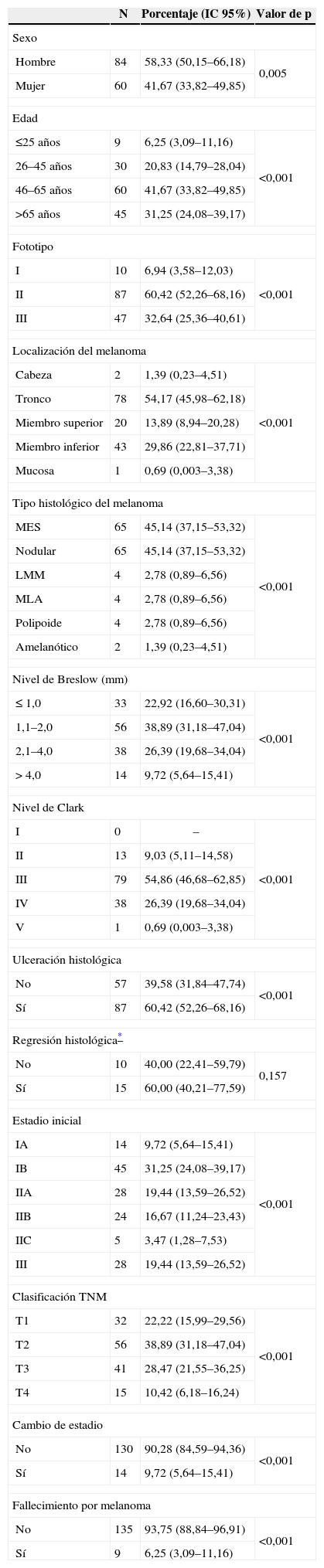
La tabla 1 muestra las características generales de estos pacientes. En ella observamos que el 58,33% son varones y que existe un predominio de pacientes mayores de 45 años (edad media 55,10±15,89 años).
Características generales y clínicas de la población objeto de estudio (n=144)
| N | Porcentaje (IC 95%) | Valor de p | |
| Sexo | |||
| Hombre | 84 | 58,33 (50,15–66,18) | 0,005 |
| Mujer | 60 | 41,67 (33,82–49,85) | |
| Edad | |||
| ≤25 años | 9 | 6,25 (3,09–11,16) | <0,001 |
| 26–45 años | 30 | 20,83 (14,79–28,04) | |
| 46–65 años | 60 | 41,67 (33,82–49,85) | |
| >65 años | 45 | 31,25 (24,08–39,17) | |
| Fototipo | |||
| I | 10 | 6,94 (3,58–12,03) | <0,001 |
| II | 87 | 60,42 (52,26–68,16) | |
| III | 47 | 32,64 (25,36–40,61) | |
| Localización del melanoma | |||
| Cabeza | 2 | 1,39 (0,23–4,51) | <0,001 |
| Tronco | 78 | 54,17 (45,98–62,18) | |
| Miembro superior | 20 | 13,89 (8,94–20,28) | |
| Miembro inferior | 43 | 29,86 (22,81–37,71) | |
| Mucosa | 1 | 0,69 (0,003–3,38) | |
| Tipo histológico del melanoma | |||
| MES | 65 | 45,14 (37,15–53,32) | <0,001 |
| Nodular | 65 | 45,14 (37,15–53,32) | |
| LMM | 4 | 2,78 (0,89–6,56) | |
| MLA | 4 | 2,78 (0,89–6,56) | |
| Polipoide | 4 | 2,78 (0,89–6,56) | |
| Amelanótico | 2 | 1,39 (0,23–4,51) | |
| Nivel de Breslow (mm) | |||
| ≤ 1,0 | 33 | 22,92 (16,60–30,31) | <0,001 |
| 1,1–2,0 | 56 | 38,89 (31,18–47,04) | |
| 2,1–4,0 | 38 | 26,39 (19,68–34,04) | |
| > 4,0 | 14 | 9,72 (5,64–15,41) | |
| Nivel de Clark | |||
| I | 0 | – | <0,001 |
| II | 13 | 9,03 (5,11–14,58) | |
| III | 79 | 54,86 (46,68–62,85) | |
| IV | 38 | 26,39 (19,68–34,04) | |
| V | 1 | 0,69 (0,003–3,38) | |
| Ulceración histológica | |||
| No | 57 | 39,58 (31,84–47,74) | <0,001 |
| Sí | 87 | 60,42 (52,26–68,16) | |
| Regresión histológica* | |||
| No | 10 | 40,00 (22,41–59,79) | 0,157 |
| Sí | 15 | 60,00 (40,21–77,59) | |
| Estadio inicial | |||
| IA | 14 | 9,72 (5,64–15,41) | <0,001 |
| IB | 45 | 31,25 (24,08–39,17) | |
| IIA | 28 | 19,44 (13,59–26,52) | |
| IIB | 24 | 16,67 (11,24–23,43) | |
| IIC | 5 | 3,47 (1,28–7,53) | |
| III | 28 | 19,44 (13,59–26,52) | |
| Clasificación TNM | |||
| T1 | 32 | 22,22 (15,99–29,56) | <0,001 |
| T2 | 56 | 38,89 (31,18–47,04) | |
| T3 | 41 | 28,47 (21,55–36,25) | |
| T4 | 15 | 10,42 (6,18–16,24) | |
| Cambio de estadio | |||
| No | 130 | 90,28 (84,59–94,36) | <0,001 |
| Sí | 14 | 9,72 (5,64–15,41) | |
| Fallecimiento por melanoma | |||
| No | 135 | 93,75 (88,84–96,91) | <0,001 |
| Sí | 9 | 6,25 (3,09–11,16) | |
Valor de p: prueba de Chi cuadrado (p<0,05). LMM: lentigo maligno melanoma; MES: melanoma de extensión superficial; MLA: melanoma lentiginoso acral; TNM: tumor, adenopatía, metástasis.
El fototipo de piel predominante fue el II, no encontrándose en nuestra serie ningún paciente con fototipo IV.
La localización anatómica mayoritaria del melanoma fue el tronco (54,17%), seguido del miembro inferior (29,86%) y del superior (13,89%). Tan solo encontramos dos casos en la cabeza y uno en la mucosa genital vulvar.
Respecto a las características histológicas destacamos que el melanoma nodular (45,14%%) y el MES (45,14%) supusieron más del 90% de los tipos histológicos encontrados.
El espesor tumoral de Breslow predominante fue de 1,1 a 2,0mm (nivel medio, 2,16±1,66mm).
En la mayoría de los melanomas encontramos un nivel de Clark de III (54,86%) o IV (26,39%). La ulceración estuvo presente en el 60,42% de los melanomas estudiados.
En 119 de los 144 casos no constaba la existencia de regresión en la historia clínica (119 de 144); en 15 de los 25 pacientes en que constaba este dato hubo regresión histológica, lo que supone el 60%.
El estadio inicial predominante fue el IB (31,25%) y el T de la estadificación TNM predominante el T2 (38,89%). Durante el periodo de seguimiento la estadificación inicial no se modificó en la mayoría de los pacientes (90,28%); tan solo ocurrió en 14 sujetos (9,72%).
Finalmente fallecieron a causa del melanoma 9 de los 144 pacientes (6,25%).
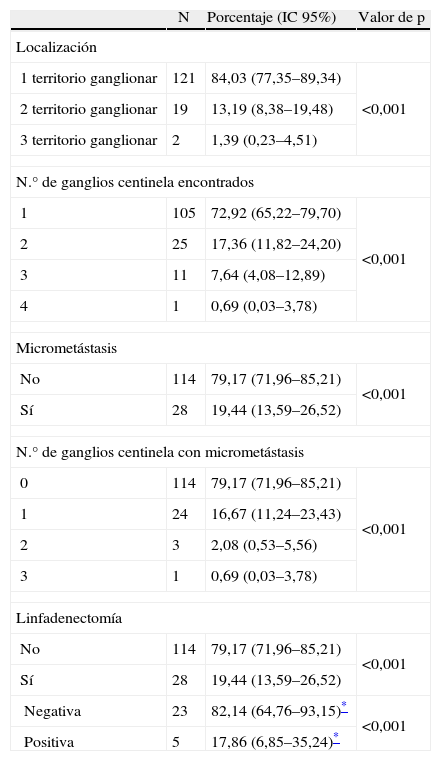
El GC se encontró en 142 pacientes de los 144 sometidos a la técnica (98,61%). En los dos pacientes restantes (1,39%) el contraste no migró y no se pudo identificar la localización del GC. En la tabla 2 podemos observar las características de los GC encontrados en los 142 pacientes.
Características de los ganglios centinela (n=142)
| N | Porcentaje (IC 95%) | Valor de p | |
| Localización | |||
| 1 territorio ganglionar | 121 | 84,03 (77,35–89,34) | <0,001 |
| 2 territorio ganglionar | 19 | 13,19 (8,38–19,48) | |
| 3 territorio ganglionar | 2 | 1,39 (0,23–4,51) | |
| N.° de ganglios centinela encontrados | |||
| 1 | 105 | 72,92 (65,22–79,70) | <0,001 |
| 2 | 25 | 17,36 (11,82–24,20) | |
| 3 | 11 | 7,64 (4,08–12,89) | |
| 4 | 1 | 0,69 (0,03–3,78) | |
| Micrometástasis | |||
| No | 114 | 79,17 (71,96–85,21) | <0,001 |
| Sí | 28 | 19,44 (13,59–26,52) | |
| N.° de ganglios centinela con micrometástasis | |||
| 0 | 114 | 79,17 (71,96–85,21) | <0,001 |
| 1 | 24 | 16,67 (11,24–23,43) | |
| 2 | 3 | 2,08 (0,53–5,56) | |
| 3 | 1 | 0,69 (0,03–3,78) | |
| Linfadenectomía | |||
| No | 114 | 79,17 (71,96–85,21) | <0,001 |
| Sí | 28 | 19,44 (13,59–26,52) | |
| Negativa | 23 | 82,14 (64,76–93,15)* | <0,001 |
| Positiva | 5 | 17,86 (6,85–35,24)* | |
Valor de p: prueba de Chi cuadrado (p<0,05).
El 84,03% de los pacientes tenía localizado el GC en una única cadena ganglionar. El 13,192% presentaba GC en dos cadenas ganglionares distintas y solamente en el 1,39% de los pacientes se detectó GC en tres cadenas ganglionares.
En cuanto al número de GC encontrados observamos que en la mayoría de los pacientes (72,92%) se localizó un único ganglio.
Se observaron micrometástasis (detectadas mediante estudio histopatológico e inmunohistoquímico) en 28 de los 142 pacientes (19,44%), que afectaba en el 85,71% de ellos a un solo ganglio. Estos 28 pacientes con micrometástasis de melanoma fueron sometidos a linfadenectomía electiva en el territorio ganglionar afecto, y en 5 de estos 28 pacientes (17,86%) la linfadenectomía electiva detectó más ganglios afectos por metástasis de melanoma.
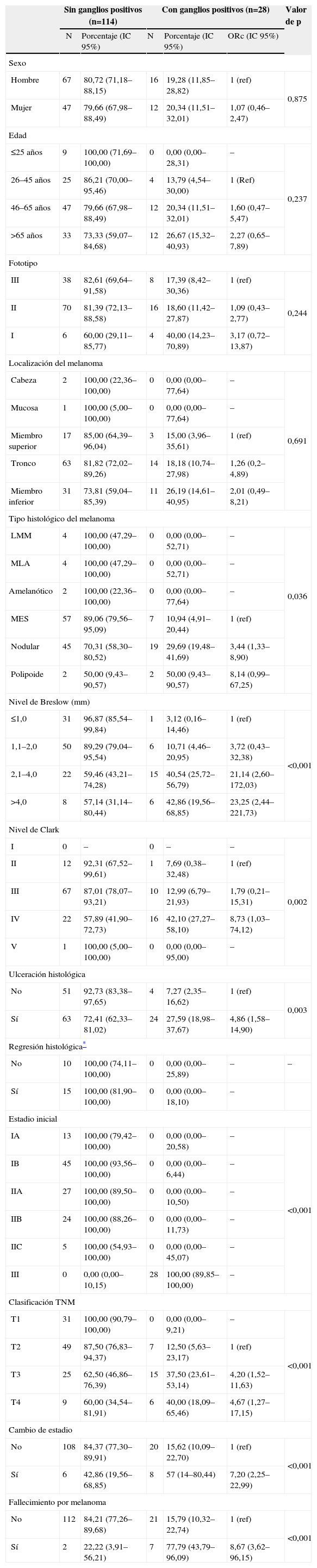
La tabla 3 muestra las características de los pacientes con ganglios positivos (28) y sin ganglios positivos (114).
Pacientes con ganglios positivos y negativos (n=144)
| Sin ganglios positivos (n=114) | Con ganglios positivos (n=28) | Valor de p | ||||
| N | Porcentaje (IC 95%) | N | Porcentaje (IC 95%) | ORc (IC 95%) | ||
| Sexo | ||||||
| Hombre | 67 | 80,72 (71,18–88,15) | 16 | 19,28 (11,85–28,82) | 1 (ref) | 0,875 |
| Mujer | 47 | 79,66 (67,98–88,49) | 12 | 20,34 (11,51–32,01) | 1,07 (0,46–2,47) | |
| Edad | ||||||
| ≤25 años | 9 | 100,00 (71,69–100,00) | 0 | 0,00 (0,00–28,31) | – | 0,237 |
| 26–45 años | 25 | 86,21 (70,00–95,46) | 4 | 13,79 (4,54–30,00) | 1 (Ref) | |
| 46–65 años | 47 | 79,66 (67,98–88,49) | 12 | 20,34 (11,51–32,01) | 1,60 (0,47–5,47) | |
| >65 años | 33 | 73,33 (59,07–84,68) | 12 | 26,67 (15,32–40,93) | 2,27 (0,65–7,89) | |
| Fototipo | ||||||
| III | 38 | 82,61 (69,64–91,58) | 8 | 17,39 (8,42–30,36) | 1 (ref) | 0,244 |
| II | 70 | 81,39 (72,13–88,58) | 16 | 18,60 (11,42–27,87) | 1,09 (0,43–2,77) | |
| I | 6 | 60,00 (29,11–85,77) | 4 | 40,00 (14,23–70,89) | 3,17 (0,72–13,87) | |
| Localización del melanoma | ||||||
| Cabeza | 2 | 100,00 (22,36–100,00) | 0 | 0,00 (0,00–77,64) | – | 0,691 |
| Mucosa | 1 | 100,00 (5,00–100,00) | 0 | 0,00 (0,00–77,64) | – | |
| Miembro superior | 17 | 85,00 (64,39–96,04) | 3 | 15,00 (3,96–35,61) | 1 (ref) | |
| Tronco | 63 | 81,82 (72,02–89,26) | 14 | 18,18 (10,74–27,98) | 1,26 (0,2–4,89) | |
| Miembro inferior | 31 | 73,81 (59,04–85,39) | 11 | 26,19 (14,61–40,95) | 2,01 (0,49–8,21) | |
| Tipo histológico del melanoma | ||||||
| LMM | 4 | 100,00 (47,29–100,00) | 0 | 0,00 (0,00–52,71) | – | 0,036 |
| MLA | 4 | 100,00 (47,29–100,00) | 0 | 0,00 (0,00–52,71) | – | |
| Amelanótico | 2 | 100,00 (22,36–100,00) | 0 | 0,00 (0,00–77,64) | – | |
| MES | 57 | 89,06 (79,56–95,09) | 7 | 10,94 (4,91–20,44) | 1 (ref) | |
| Nodular | 45 | 70,31 (58,30–80,52) | 19 | 29,69 (19,48–41,69) | 3,44 (1,33–8,90) | |
| Polipoide | 2 | 50,00 (9,43–90,57) | 2 | 50,00 (9,43–90,57) | 8,14 (0,99–67,25) | |
| Nivel de Breslow (mm) | ||||||
| ≤1,0 | 31 | 96,87 (85,54–99,84) | 1 | 3,12 (0,16–14,46) | 1 (ref) | <0,001 |
| 1,1–2,0 | 50 | 89,29 (79,04–95,54) | 6 | 10,71 (4,46–20,95) | 3,72 (0,43–32,38) | |
| 2,1–4,0 | 22 | 59,46 (43,21–74,28) | 15 | 40,54 (25,72–56,79) | 21,14 (2,60–172,03) | |
| >4,0 | 8 | 57,14 (31,14–80,44) | 6 | 42,86 (19,56–68,85) | 23,25 (2,44–221,73) | |
| Nivel de Clark | ||||||
| I | 0 | – | 0 | – | – | 0,002 |
| II | 12 | 92,31 (67,52–99,61) | 1 | 7,69 (0,38–32,48) | 1 (ref) | |
| III | 67 | 87,01 (78,07–93,21) | 10 | 12,99 (6,79–21,93) | 1,79 (0,21–15,31) | |
| IV | 22 | 57,89 (41,90–72,73) | 16 | 42,10 (27,27–58,10) | 8,73 (1,03–74,12) | |
| V | 1 | 100,00 (5,00–100,00) | 0 | 0,00 (0,00–95,00) | – | |
| Ulceración histológica | ||||||
| No | 51 | 92,73 (83,38–97,65) | 4 | 7,27 (2,35–16,62) | 1 (ref) | 0,003 |
| Sí | 63 | 72,41 (62,33–81,02) | 24 | 27,59 (18,98–37,67) | 4,86 (1,58–14,90) | |
| Regresión histológica* | ||||||
| No | 10 | 100,00 (74,11–100,00) | 0 | 0,00 (0,00–25,89) | – | – |
| Sí | 15 | 100,00 (81,90–100,00) | 0 | 0,00 (0,00–18,10) | – | |
| Estadio inicial | ||||||
| IA | 13 | 100,00 (79,42–100,00) | 0 | 0,00 (0,00–20,58) | – | <0,001 |
| IB | 45 | 100,00 (93,56–100,00) | 0 | 0,00 (0,00–6,44) | – | |
| IIA | 27 | 100,00 (89,50–100,00) | 0 | 0,00 (0,00–10,50) | – | |
| IIB | 24 | 100,00 (88,26–100,00) | 0 | 0,00 (0,00–11,73) | – | |
| IIC | 5 | 100,00 (54,93–100,00) | 0 | 0,00 (0,00–45,07) | – | |
| III | 0 | 0,00 (0,00–10,15) | 28 | 100,00 (89,85–100,00) | – | |
| Clasificación TNM | ||||||
| T1 | 31 | 100,00 (90,79–100,00) | 0 | 0,00 (0,00–9,21) | – | <0,001 |
| T2 | 49 | 87,50 (76,83–94,37) | 7 | 12,50 (5,63–23,17) | 1 (ref) | |
| T3 | 25 | 62,50 (46,86–76,39) | 15 | 37,50 (23,61–53,14) | 4,20 (1,52–11,63) | |
| T4 | 9 | 60,00 (34,54–81,91) | 6 | 40,00 (18,09–65,46) | 4,67 (1,27–17,15) | |
| Cambio de estadio | ||||||
| No | 108 | 84,37 (77,30–89,91) | 20 | 15,62 (10,09–22,70) | 1 (ref) | <0,001 |
| Sí | 6 | 42,86 (19,56–68,85) | 8 | 57 (14–80,44) | 7,20 (2,25–22,99) | |
| Fallecimiento por melanoma | ||||||
| No | 112 | 84,21 (77,26–89,68) | 21 | 15,79 (10,32–22,74) | 1 (ref) | <0,001 |
| Sí | 2 | 22,22 (3,91–56,21) | 7 | 77,79 (43,79–96,09) | 8,67 (3,62–96,15) | |
Valor de p: prueba de Chi cuadrado (p<0,05). LMM: lentigo maligno melanoma; MES: melanoma de extensión superficial; MLA: melanoma lentiginoso acral; Ref.: nivel de referencia; TNM: tumor, adenopatía, metástasis.
No encontramos asociación estadísticamente significativa entre el sexo, la edad, el fototipo de piel ni la localización del melanoma con la presencia de ganglios positivos. Sin embargo, encontramos asociación entre la presencia de ganglios positivos y el tipo histológico de melanoma, concretamente se observa una asociación entre el melanoma nodular y la presencia de ganglios positivos (odds ratio cruda [ORc]: 3,44; IC 95%: 1,33–8,90, con respecto al MES).
También encontramos asociación entre el espesor tumoral y la presencia de ganglios positivos; observamos una asociación entre un nivel de Breslow superior a 2,0 y la presencia de ganglios positivos (nivel 2,1–4,0: ORc: 21,14; IC 95%: 2,60–172,03; nivel >4,0: ORc: 23,25; IC 95%: 2,44–221,73).
Asimismo, en relación con el índice de Clark observamos una asociación entre los niveles más altos del melanoma (IV concretamente) y la presencia de ganglios positivos (ORc: 8,73; IC 95%: 1,03–74,12). La asociación con el nivel V no se pudo valorar debido a que tan solo había un paciente con este nivel.
La ulceración también se asoció con la positividad del ganglio centinela, de forma que la posibilidad de tener un ganglio centinela positivo era 4 veces superior si el melanoma estaba ulcerado (ORc: 4,86; IC 95%: 1,58–14,90).
La regresión histológica se pudo consignar tan solo en 25 pacientes, todos ellos sin ganglios positivos, por lo que su asociación con la positividad del GC no se pudo valorar.
En cuanto al estadio inicial del melanoma no pudimos encontrar una asociación estadísticamente significativa con la presencia de ganglios positivos, pero observamos que los 28 pacientes con ganglios positivos presentaban melanomas en estadio III, mientras que los 114 sin ganglios positivos presentaban melanomas en estadios I o II.
El T de la estadificación TNM también aparece asociado a la presencia de ganglios positivos, concretamente los estadios T3 y T4 se asocian con una mayor positividad (T3: ORc: 4,20; IC 95%: 1,52–11,63; T4: ORc: 4,67; IC 95%: 1,27–17,15).
Los pacientes con GC presentaron mayor tendencia a la progresión de la enfermedad a lo largo del tiempo de seguimiento, y por tanto un cambio de estadio (ORc: 7,20; IC 95%: 2,25–22,99).
Por último se observa una asociación entre el fallecimiento por melanoma y la positividad del ganglio centinela (ORc: 8,67; IC 95%: 3,62–9).
DiscusiónEl presente estudio retrospectivo abarca una experiencia de 10 años. Debemos tener en cuenta que la BGC es una práctica introducida para el cáncer cutáneo melanoma en 199218, y que por tanto la mayor parte de los estudios retrospectivos abarcan una experiencia de menor tiempo. Por ejemplo, Avilés-Izquierdo et al analizaron los resultados obtenidos durante 7 años recopilando una serie de 155 pacientes19.
En nuestra serie recogimos 144 pacientes que cumplían como principal premisa un diagnóstico de melanoma con un espesor tumoral de Breslow ≥1mm; en 33 de estos pacientes (22,92%) los criterios fueron la ulceración o el nivel de Clark ≥IV con Breslow menor de 1mm. Aunque a lo largo de estos años se ha modificado algún criterio de inclusión para la realización de la BGC, siguen sin estar perfectamente definidos. Si consideramos los nuevos criterios del National Comprehensive Cancer Network (NCCN)10 para el manejo del melanoma (espesor tumoral ≥1mm, alto índice mitótico o espesor tumoral de Breslow ≥0,75mm con Clark IV/V)20,21, todos nuestros pacientes seguirían teniendo indicación para la realización la BGC.
Las tasas estandarizadas para la población mundial por 100.000 habitantes conceden una incidencia de melanoma discretamente superior para mujeres que para hombres (5,50 y 5,30, respectivamente)22. En nuestro estudio encontramos un predominio de hombres. En cualquier caso debemos tener presente que estamos trabajando con un subgrupo de pacientes con diagnóstico de melanoma que estará sesgado, al excluir sólo los melanomas de mayor grado, que son los que con menor frecuencia se detectan en mujeres23.
La localización anatómica fundamental del melanoma primario fue el tronco, lo que coincide con el notable incremento de melanomas en el tronco observado en otros estudios, sobre todo los realizados en países con alta incidencia de melanoma23.
El tipo histológico nodular aparece en la misma frecuencia que el MES, lo cual difiere con los datos obtenidos de otros estudios. Por ejemplo, Avilés-Izquierdo et al19 encontraron una frecuencia muy superior de MES (44,70%) respecto del melanoma nodular (18,80%).
El espesor tumoral medio de Breslow en los pacientes estudiados fue de 2,160±1,6593mm, similar al detectado por otros autores19.
De los 144 pacientes a los que se les realizó la biopsia selectiva del ganglio centinela, en 28 (19,44%) se detectaron micrometástasis de melanoma, porcentaje similar a los encontrados por Morton et al20 (16%) y por Avilés-Izquierdo et al19 (21,30%).
Al analizar las variables histológicas del melanoma primario en relación con la positividad del GC encontramos un predominio del melanoma nodular y polipoide en pacientes con ganglios positivos. Por el contrario, no se encontró ningún ganglio positivo en casos de LMM ni de MLA. Este hallazgo contrasta en parte con los resultados obtenidos por Avilés-Izquierdo et al19, que detectaron, además de los melanomas nodulares, los acrolentiginosos como los tipos histológicos más frecuentes en pacientes con ganglios positivos. Esta diferencia podría deberse al bajo número de pacientes con melanomas lentiginosos acrales en nuestro estudio (tan solo 4 de los 144 pacientes estudiados).
También encontramos asociación entre un espesor tumoral de Breslow elevado (>2,0) y una biopsia selectiva del GC positiva. Tan solo un paciente con espesor tumoral ≤1mm presentó ganglios positivos, coincidiendo con los resultados obtenidos por Cuéllar et al13. Esto confirma la poca utilidad de la técnica en melanomas de espesor inferior a 1mm.
Además, debemos tener en cuenta que la asociación entre BGC positiva y melanomas nodulares podría estar sesgada en parte por el mayor espesor tumoral de Breslow que suelen tener estos tumores en el momento del diagnóstico.
También detectamos que la proporción de melanomas con GC positivos aumenta en función del nivel histológico de Clark para II, III y IV; el único paciente de nuestra serie con un Clark V tuvo un resultado del GC negativo; este resultado podría deberse a un fallo en la técnica, o cabe considerar que la vía de diseminación de este tumor no fuera linfática, ya que el paciente presentaba múltiples metástasis cutáneas en tránsito sin adenopatías 12 meses después del diagnóstico.
La presencia de ulceración en pacientes con BGC positiva fue significativamente superior que en aquellos con BGC negativa, de forma que un melanoma ulcerado presentaba un riesgo 4,86 veces superior de tener una BGC positiva que uno no ulcerado.
Además, los estadios T3 y T4 de la clasificación TNM para el melanoma (que engloba el espesor tumoral de Breslow y la ulceración) se asociaron también con la positividad del GC.
Si hablamos en términos de supervivencia y estado vital de los pacientes al final del estudio, comprobamos que existe una asociación entre la presencia de GC positivo y el cambio de estadio del melanoma. Además, se confirma la asociación entre la positividad del GC y el fallecimiento por melanoma ya detectada por otros autores14. En nuestro trabajo se confirma la importancia pronóstica que otorga la BGC respecto a la esperanza de no fallecer por melanoma. Por todo lo anteriormente expuesto podemos considerar que un resultado positivo en la BGC permite identificar, en pacientes con espesor tumoral de Breslow >1mm, a aquellos que van a presentar mayor tendencia a la progresión de la enfermedad y fallecimiento por esta causa, lo que otorga a la técnica una utilidad pronóstica clara, como otros estudios ya habían apuntado14.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.