La alopecia areata es una enfermedad inflamatoria autoinmune que afecta al pelo. Actualmente se estudia si las bacterias patógenas y las inmunizaciones son inductores de la respuesta autoinmune en pacientes con susceptibilidad genética.
ObjetivoEl objetivo de este estudio fue determinar si las bacterias patógenas en la faringe y el antecedente de haber recibido inmunizaciones están asociados a la enfermedad.
Materiales y métodosEn el Centro Dermatológico «Dr. Ladislao de la Pascua», desde septiembre de 2008 a febrero de 2009, se estudiaron 65 pacientes con alopecia areata y 65 controles con otras dermatosis, excluyendo las del cuero cabelludo. Se incluyeron pacientes de 18 a 59 años de edad y de ambos sexos. A todos se les interrogó sobre inmunizaciones recibidas 6 meses antes y se les realizó un cultivo de exudado faríngeo.
ResultadosHaber recibido inmunizaciones, la presencia de bacterias patógenas en la faringe y ser portador de S. pyogenes se comportaron como factores de riesgo para la alopecia areata, con una razón de probabilidades de 3,3 (IC 95% 1,6–6,7; p=0,001), 2,6 (IC 95%: 1,1–6,2; p=0,033) y 2,1 (IC 95% 1,7–2,5; p=0,042), respectivamente. Las bacterias aisladas fueron Klebiella penumoniae, Streptococcus pyogenes, Pseudomonas aeruginosa, Streptococcus pneumoniae, Serratia marcescens y Escherichia coli.
ConclusionesEste es el primer estudio que apoya los hallazgos de estado de portador de bacterias patógenas en la faringe y la aplicación de inmunizaciones como factores de riesgo para desarrollar alopecia areata. Por las características de nuestra población, esta asociación es válida para los pacientes con menos del 25% de pérdida de pelo y con una evolución inferior a un año.
Alopecia areata is an autoimmune inflammatory disease affecting the hair follicles. Researchers are currently interested in whether the presence of bacterial pathogens and/or a history of immunization can trigger an autoimmune response in patients who are genetically predisposed.
ObjectivesThis study aimed to determine whether there is an association between the development of alopecia areata and throat carriage of bacterial pathogens or a history of immunization.
Material and methodsSixty-five men and women with alopecia areata and 65 control patients with other skin diseases were studied at the Dr Ladislao de la Pascua Dermatology Clinic between September 2008 and February 2009. The patients ranged in age from 18–59 years. Patients with scalp diseases were excluded from the control group. In all cases, the patient was questioned about immunizations received in the previous 6 months, and a throat swab was cultured.
ResultsA history of immunization (odds ratio [OR], 3.3; 95% confidence interval [CI], 1.6–6.7; P=.001), the presence of bacterial pathogens in the oropharynx (OR, 2.6; 95% CI, 1.1–6.2; P=.033), and being a carrier of Streptococcus pyogenes (OR, 2.1; 95% CI, 1.7–2.5; P=.042) were risk factors for alopecia areata. Klebsiella pneumoniae, S. pyogenes, Pseudomonas aeruginosa, Streptococcus pneumoniae, Serratia marcescens and Escherichia coli were isolated from cultures.
ConclusionsThis is the first study to show an association between alopecia areata and throat carriage of bacterial pathogens or history of immunization, as risk factors for development of the disease. Given the characteristics of our study population, the association appears valid for patients with less than 25% hair loss and a course of disease under 1 year.
La alopecia areata (AA) es una enfermedad inflamatoria autoinmune frente al folículo piloso y las láminas ungueales1,2. Tiene una incidencia de 20,2 casos por 100.000 personas/año (0,57% en México) y una prevalencia del 1,7%3. En México, en el Centro Dermatológico «Dr. Ladislao de la Pascua», se atendieron 460 pacientes con AA durante el año 2007, de los cuales 257 fueron casos nuevos (Registro de la Consulta Externa del Centro Dermatológico «Dr. Ladislao de la Pascua», 2007).
La AA se origina por el ataque del sistema inmunológico, principalmente de linfocitos T contra el pelo4. En condiciones normales el folículo piloso se encuentra en un ambiente de privilegio inmunológico, en el que sus antígenos no se reconocen ni como propios ni como extraños. Actualmente se sabe que el colapso de este ambiente es de origen multifactorial. Se ha comprobado que existe una susceptibilidad genética5 y que esta entidad está relacionada con enfermedades psiquiátricas6.
Los agentes infecciosos causan enfermedades autoinmunes por diferentes mecanismos, que se dividen en dos categorías: específicos y no específicos en relación con el antígeno7. En la primera categoría los antígenos del patógeno son los responsables, como sucede con los superantígenos y en el mimetismo molecular8, mientras que en la segunda categoría el patógeno crea un ambiente de inflamación que origina aumento del procesamiento y presentación de autoantígenos, incremento de la expresión de las moléculas del complejo mayor de histocompatibilidad (CMH), liberación de citocinas y activación del sistema inmunitario, principalmente de los linfocitos T9.
En la AA se ha investigado el papel de algunos agentes infecciosos como inductores de la respuesta autoinmune, principalmente virus. La relación de la AA con el citomegalovirus fue estudiada por Jackow10 en humanos, con detección de anticuerpos, por McElwee11 en ratones C3H/HeJ y por Ofdiani12 en biopsias de piel del cuero cabelludo utilizando la técnica de reacción en cadena de la polimerasa (PCR), todos con resultados negativos. Este último buscó sin éxito la presencia del virus de Epstein Barr (VEB) y herpes en sus pacientes. Rodríguez encontró que el 25% de los pacientes del Registro Nacional de Alopecia Areata de EE.UU. atribuía el inicio de la enfermedad a factores ambientales, pero al buscar la asociación con el VEB se obtuvieron resultados negativos, tanto para el virus como para el antecedente de mononucleosis infecciosa13. Otros agentes infecciosos que se han investigado son el virus de la hepatitis C14 y el Helicobacter pylori15, sin encontrar asociación con la enfermedad.
El patógeno más asociado como inductor de autoinmunidad es el Streptococcus pyogenes16. El S. pyogenes o estreptococo del grupo A es una bacteria gram positiva de 0,6 a 1,0 micras de diámetro, catalasa negativa y anaerobia facultativa. Se estima que la prevalencia global de portadores del S. pyogenes es del 15–20% en las vías respiratorias17–19. Es causante de infecciones supurativas y no supurativas. La prueba diagnóstica más utilizada es el cultivo, aunque también se puede realizar la detección de anticuerpos y de antígenos20.
En la AA no se ha estudiado si el estado de portador de bacterias patógenas en la faringe actúa como inductor de la respuesta autoinmune. Es importante señalar que el estado de portador es cuando se recuperan o aíslan bacterias que no forman parte de la flora normal, de la naso y orofaringe en ausencia de evidencia de infección aguda21. Las bacterias que forman parte de la flora normal de la naso y orofaringe son: estreptococos alfa-hemolíticos (S. mutans, S. sanguis, S. mitis, S. salivarius), Actinomyces sp., Lactobacillus sp., Bacteroides sp., Fusobacterium sp., Peptococcus sp., Peptostreptococcus sp., Ruminococcus sp., Micoplasma sp. y Candida sp.22.
La administración de vacunas puede desencadenar respuestas autoinmunes, principalmente la de la hepatitis B recombinante, por los antígenos que contiene. Las vacunas que actualmente se administran a la población adulta son las siguientes: hepatitis A, hepatitis B, triple vírica (sarampión, rubéola y parotiditis), toxoide tetánico, varicela, neumococo, meningococo, gripe, fiebre tifoidea, fiebre amarilla, cólera y antirrábica. El esquema de vacunación para la población adulta en México sólo comprende las siguientes vacunas: gripe (mayores de 60 años), neumocócica (mayores de 60 años) y tétanos y difteria (un refuerzo cada 10 años). El resto de las vacunas tienen indicaciones específicas y la triple vírica se administra en campañas, principalmente a mujeres en edad reproductiva23.
Material y métodosEl estudio se realizó en el Centro Dermatológico «Dr. Ladislao de la Pascua», en México D.F., desde septiembre de 2008 a febrero de 2009, con un diseño transversal comparativo.
En el grupo de estudio se incluyeron pacientes con diagnóstico clínico de AA activa y con evolución inferior a un año, de ambos sexos y de 18 a 59 años de edad.
El criterio diagnóstico fue clínico al encontrar placas alopécicas circulares, de superficie lisa y brillante con pelos peládicos en la periferia o repoblación con pelo velloso. Otro dato adicional fue la sensación de «acolchado» al palpar las placas.
Dos dermatólogos, de forma independiente, valoraron a cada paciente y se incluyeron sólo aquellos en los que ambas evaluaciones certificaron la AA. Se consideró episodio activo la presencia de placas alopécicas sin repoblación o con repoblación inferior al 50% en cada una, con pelo velloso.
En el grupo control se incluyeron pacientes que acudieron a la consulta dermatológica con entidades no relacionadas con la AA, de 18–59 años de edad y de ambos sexos.
Se excluyeron del grupo de estudio a los pacientes con episodio de AA en resolución: repoblación igual o superior al 50% con pelo terminal en cada una de las placas de alopecia areata, los que presentaron dermatosis coexistente en la piel del cuero cabelludo que pudiera causar alopecia cicatricial, por ejemplo lupus eritematoso, foliculitis decalvante y liquen plano folicular, y los que estaban con tratamiento antibiótico en el momento del estudio o durante las 4 semanas previas.
Se excluyeron del grupo control a los pacientes con dermatosis del cuero cabelludo, psoriasis, enfermedades bacterianas o autoinmunes y los que estaban con tratamiento antibiótico en el momento del estudio o durante las 4 semanas previas.
El tamaño de la muestra se calculó con la fórmula para comparar dos proporciones, con alfa de 0,05 y potencia del 80%, considerando una prevalencia del 20% de portadores de bacterias patógenas en la faringe, de acuerdo a lo reportado para S. pyogenes y con la hipótesis de al menos un 20% de diferencia, lo que resultó en 63,8 pacientes por grupo. Se utilizó un muestreo no probabilístico de casos consecutivos para el grupo de estudio y aleatorio simple para el grupo control.
Descripción de los métodos empleadosLa extensión de la AA se determinó utilizando el índice SALT (Severity of Alopecia Tool)24.
Para determinar el estado de portador de bacterias patógenas en la faringe se realizó un cultivo de exudado faríngeo en medio agar-sangre de carnero al 5%, con incubación a 35°C hasta las 72h, y para la identificación de S. pyogenes se utilizó la prueba de bacitracina, la detección de pirrolidonilarilamidasa (PYR) y la detección del antígeno A de Lancefield, así como antibiograma de todas las bacterias patógenas encontradas. Todas las muestras se transportaron en medio Amies.
Para averiguar los antecedentes de inmunizaciones se interrogó de forma directa sobre la administración de inmunizaciones durante los 6 meses previos al inicio del episodio de AA; en el grupo control se interrogó en relación con los 6 meses previos. Se consideraron las inmunizaciones indicadas en los adultos (hepatitis A, hepatitis B, triple vírica, toxoide tetánico, varicela, neumococo, gripe, fiebre tifoidea y fiebre amarilla).
Respecto de los antecedentes de faringoamigdalitis se interrogó de forma directa sobre la presencia de cuadros de faringoamigdalitis en los 6 meses previos al inicio de la AA en el grupo de estudio; en el grupo control fue también en los 6 meses previos a la fecha. Se preguntó por los hallazgos clínicos comunes: tos, dolor faríngeo que impide la deglución, fiebre y síntomas generales como mialgias, artralgias, anorexia y cefalea. Se consideró positivo si además del cuadro clínico el paciente fue diagnosticado y tratado por un médico.
En relación con las consideraciones éticas para el presente estudio, de acuerdo con la norma oficial de investigación en personas, en su artículo 17, lo clasifican como una investigación con riesgo mínimo. El protocolo del estudio fue registrado y aprobado por el comité de investigación y ética correspondiente y los pacientes otorgaron su consentimiento informado por escrito (número de registro 07–10).
Análisis estadísticoLas variables cuantitativas se describieron con medidas de tendencia central y dispersión y las variables cualitativas con porcentajes. Se utilizaron pruebas de significación estadística para determinar las diferencias entre los grupos; en las variables cuantitativas se empleó la «t» de Student y en las cualitativas la Chi cuadrado. Para explorar los factores de riesgo se determinó la razón de probabilidades con intervalos de confianza y significación estadística. Se utilizó el programa estadístico SPSS versión 17.0.
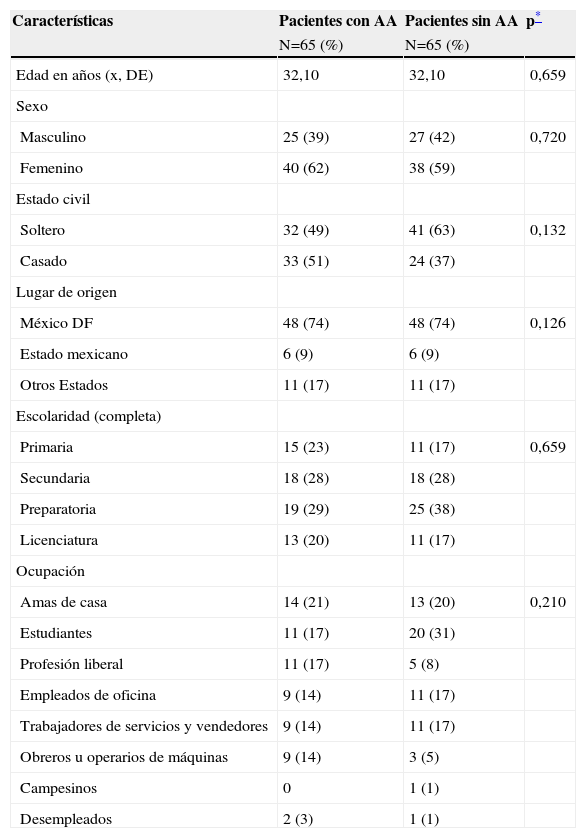
ResultadosParticiparon 65 personas por grupo, sin diferencias significativas entre los grupos en cuanto a edad media, sexo, lugar de origen y escolaridad (tabla 1). En ambos grupos el 74% de los pacientes fue originario de México DF.
Características sociodemográficas de los pacientes
| Características | Pacientes con AA | Pacientes sin AA | p* |
| N=65 (%) | N=65 (%) | ||
| Edad en años (x, DE) | 32,10 | 32,10 | 0,659 |
| Sexo | |||
| Masculino | 25 (39) | 27 (42) | 0,720 |
| Femenino | 40 (62) | 38 (59) | |
| Estado civil | |||
| Soltero | 32 (49) | 41 (63) | 0,132 |
| Casado | 33 (51) | 24 (37) | |
| Lugar de origen | |||
| México DF | 48 (74) | 48 (74) | 0,126 |
| Estado mexicano | 6 (9) | 6 (9) | |
| Otros Estados | 11 (17) | 11 (17) | |
| Escolaridad (completa) | |||
| Primaria | 15 (23) | 11 (17) | 0,659 |
| Secundaria | 18 (28) | 18 (28) | |
| Preparatoria | 19 (29) | 25 (38) | |
| Licenciatura | 13 (20) | 11 (17) | |
| Ocupación | |||
| Amas de casa | 14 (21) | 13 (20) | 0,210 |
| Estudiantes | 11 (17) | 20 (31) | |
| Profesión liberal | 11 (17) | 5 (8) | |
| Empleados de oficina | 9 (14) | 11 (17) | |
| Trabajadores de servicios y vendedores | 9 (14) | 11 (17) | |
| Obreros u operarios de máquinas | 9 (14) | 3 (5) | |
| Campesinos | 0 | 1 (1) | |
| Desempleados | 2 (3) | 1 (1) |
La distribución por tipo de AA fue: 93,8% variedad en placas, 40% total en placa única, 53,8% en placas múltiples y 6,2% tipo ofiásica total o universal.
En relación con la extensión de la AA, de acuerdo con el índice SALT, el 92,3% de los pacientes se clasificó como S1 (extensión inferior al 25%), el 3,1% como S2 (extensión del 25–49%), el 1,5% como S3 (extensión del 50–74%) y el 3,1% como S5 (extensión del 100%). El tiempo de evolución de la AA fue de 3±2,8 meses.
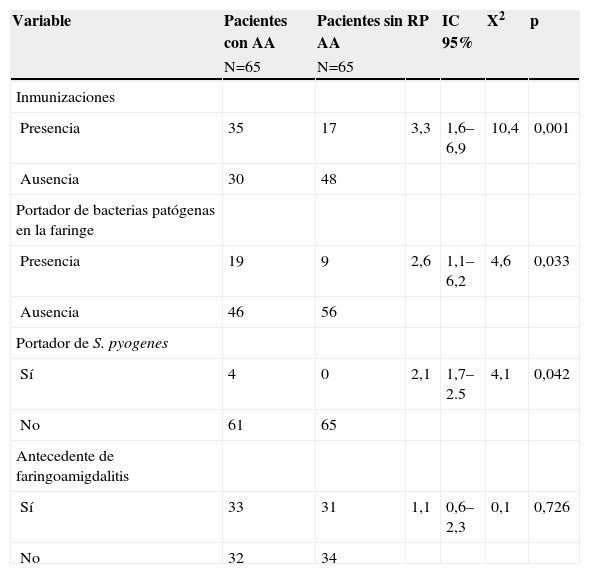
Mediante el análisis bivariante el antecedente de haber recibido inmunizaciones, la presencia de bacterias patógenas en la faringe y el aislamiento S. pyogenes se comportaron como factores de riesgo con significación estadística. No se observaron diferencias significativas en relación con el antecedente de faringoamigdalitis (tabla 2).
Análisis bivariante de las variables de estudio de la alopecia areata
| Variable | Pacientes con AA | Pacientes sin AA | RP | IC 95% | X2 | p |
| N=65 | N=65 | |||||
| Inmunizaciones | ||||||
| Presencia | 35 | 17 | 3,3 | 1,6–6,9 | 10,4 | 0,001 |
| Ausencia | 30 | 48 | ||||
| Portador de bacterias patógenas en la faringe | ||||||
| Presencia | 19 | 9 | 2,6 | 1,1–6,2 | 4,6 | 0,033 |
| Ausencia | 46 | 56 | ||||
| Portador de S. pyogenes | ||||||
| Sí | 4 | 0 | 2,1 | 1,7–2.5 | 4,1 | 0,042 |
| No | 61 | 65 | ||||
| Antecedente de faringoamigdalitis | ||||||
| Sí | 33 | 31 | 1,1 | 0,6–2,3 | 0,1 | 0,726 |
| No | 32 | 34 |
AA: alopecia areata; IC 95%: intervalos de confianza del 95%; RP: razón de probabilidades; X2=Chi cuadrado.
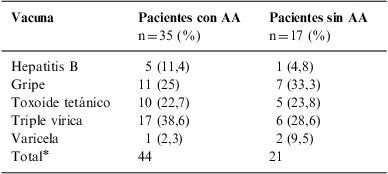
De los pacientes que refirieron haber recibido inmunizaciones en el grupo de estudio el 7,7% recibió dos inmunizaciones y el 3,1% tres; en el grupo control el 31,1% recibió dos inmunizaciones (tabla 3).
Antecedente de inmunizaciones en los grupos de estudio
| Vacuna | Pacientes con AA | Pacientes sin AA |
| n=35 (%) | n=17 (%) | |
| Hepatitis B | 5 (11,4) | 1 (4,8) |
| Gripe | 11 (25) | 7 (33,3) |
| Toxoide tetánico | 10 (22,7) | 5 (23,8) |
| Triple vírica | 17 (38,6) | 6 (28,6) |
| Varicela | 1 (2,3) | 2 (9,5) |
| Total* | 44 | 21 |
AA: alopecia areata.
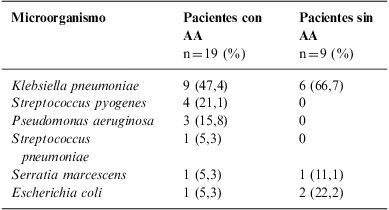
El desarrollo de bacterias patógenas en el cultivo del exudado faríngeo fue positivo en el 29,2% de los pacientes con AA y en el 13,8% de los sujetos sin AA (tabla 4).
Bacterias patógenas aisladas en los grupos de estudio
| Microorganismo | Pacientes con AA | Pacientes sin AA |
| n=19 (%) | n=9 (%) | |
| Klebsiella pneumoniae | 9 (47,4) | 6 (66,7) |
| Streptococcus pyogenes | 4 (21,1) | 0 |
| Pseudomonas aeruginosa | 3 (15,8) | 0 |
| Streptococcus pneumoniae | 1 (5,3) | 0 |
| Serratia marcescens | 1 (5,3) | 1 (11,1) |
| Escherichia coli | 1 (5,3) | 2 (22,2) |
AA: alopecia areata.
En cuanto a las bacterias que forman parte de la flora normal de la faringe se aisló S. aureus en el 47,7% del grupo de estudio y en el 43,1% del grupo control, estreptococos alfa hemolíticos en el 30,8 y 40% respectivamente, así como levaduras del género Candida en 23,1 y 26,2%, respectivamente.
DiscusiónEste es el primer estudio que encuentra una asociación entre la AA y el estado de portador asintomático de bacterias patógenas en la faringe, así como con el antecedente de administración de inmunizaciones.
La distribución de los pacientes con AA en relación con el sexo (38,5% hombres y 61,5% mujeres) fue similar a lo reportado por Safavi (49 frente a 51%)3, García-Hernández (1:1,1)25 y Guzmán-Sánchez (42,3 frente a 57,7%)26, con un ligero predominio del sexo femenino, en contraposición a lo reportado por Sharma27 en la población hindú, donde predomina el sexo masculino con un 64,6%. Las otras variables demográficas no pueden compararse, ya que en ningún estudio previo se han descrito, pero son similares en ambos grupos del estudio.
En cuanto a la extensión de la enfermedad el 95,4% fue clasificado como leve, que corresponde a la categoría S1 y S2 del índice SALT, y solo el 4,6% se clasificó como grave, categorías S3, S4 y S5. La proporción es diferente a lo reportado por Tosti28, con un 67% con AA leve y un 33% con AA grave. Sin embargo, es similar a lo comunicado por Guzmán-Sánchez26 en la población mexicana, en donde la mayoría de los pacientes tiene enfermedad leve y sólo un caso fue de AA universal, como en nuestro estudio.
Cabe mencionar que nuestra población no es homogénea, es decir, la mayoría de los pacientes tiene una extensión o gravedad de la enfermedad definida como leve. Aunque la población estudiada no representa de forma equitativa todos los grados de gravedad de la enfermedad, sí es representativa de lo observado en la población mexicana, ya que la mayoría de los casos entran en la categoría S1 y S2, clasificada como leve de acuerdo al índice SALT3.
El antecedente más relevante sobre el papel de las infecciones en la inducción de la AA es el estudio de Guzmán-Sánchez, quien describió las características de 90 pacientes con AA en el Instituto Dermatológico de Jalisco «Dr. José Barba Rubio»26. En este grupo de pacientes se documentaron 73 infecciones previas (amigdalitis, sinusitis, otitis y abscesos dentales) por historia clínica; sin embargo, algunos pacientes presentaron más de una, por lo que no reportan la proporción real de sujetos con el antecedente, lo que contrasta con lo encontrado por nosotros, donde el 51% de los pacientes con AA referían el antecedente solo de faringoamigdalitis. Ellos documentaron 56 cuadros infecciosos en el momento del estudio; algunos presentaron más de uno simultáneamente, lo cual es una limitación en nuestro estudio, ya que no se realizó una exploración dirigida a las fosas nasales, la orofaringe, el oído y los dientes para documentar otros cuadros infecciosos y poder realizar cultivo de otros sitios, en cuyo caso la prevalencia del desarrollo de bacterias patógenas hubiera sido más elevado. En este estudio Guzmán-Sánchez menciona que la frecuencia de cuadros infecciosos en pacientes con AA es similar a lo que ocurre en la población general, lo que concuerda con nuestros datos sobre el antecedente de faringoamigdalitis, que fue similar en ambos grupos, del 51% en pacientes con AA y del 48% en sujetos sin la enfermedad.
Los microorganismos patógenos que pueden desencadenar una respuesta autoinmune por superantígenos y mimetismo molecular son los siguientes: bacterias (S. pyogenes y Staphylococcus aureus), hongos (Malassezia sp. y Candida albicans) y virus (virus del papiloma humano y retrovirus). Sin embargo, el patógeno más asociado es el S. pyogenes16, ya que al ser absorbido por las células epiteliales de las amígdalas constituye un reservorio de superantígenos (toxinas activadoras de los linfocitos T) que activan a los linfocitos T autorreactivos, los cuales migran a la piel desencadenando la respuesta inflamatoria. También, al ocasionar daño tisular, exponen los antígenos crípticos del huésped, es decir, los antígenos propios que no fueron presentados a los linfocitos T para inducir una tolerancia inmunológica, los cuales son reconocidos como extraños.
No existen estudios previos que documenten o confirmen el papel de las bacterias patógenas en la faringe como inductoras del ataque autoinmune en la AA. Sin embargo, en nuestro estudio, los pacientes portadores de bacterias patógenas tenían un riesgo 1,6 veces mayor de presentar AA. El número de pacientes no permitió estimar con precisión el grado de asociación, lo cual se ve reflejado en los intervalos de confianza, aunque está claro que esta existe.
El estado de portador de S. pyogenes fue menor a lo reportado en la literatura, que es del 15 al 20%17–19, ya que en el grupo control ninguno desarrolló esta bacteria y sólo 4 pacientes con AA la tenían, obteniéndose una diferencia estadísticamente significativa entre ambos grupos. Esto se debe en parte a que los estudios que reportan el porcentaje de portadores asintomáticos de S. pyogenes están realizados en su mayoría en población pediátrica, y a mayor edad la prevalencia desciende29. Sin embargo, el estado de portador fue similar a lo reportado por Raza en 40 pacientes con psoriasis en placas, de los cuales 5 fueron portadores de S. pyogenes, en contraposición a los 40 controles que no desarrollaron la bacteria en el cultivo del exudado faríngeo30. Las bacterias aisladas en pacientes con AA fueron: Klebsiella pneumoniae, S. pyogenes, Pseudomonas aeruginosa y Streptococcus pneumoniae; las tres últimas no se aislaron en el grupo control. Es importante señalar que, a excepción del S. pyogenes, ninguna se había relacionado con mecanismos de autoinmunidad, por lo que se necesitan más estudios para establecer esta relación causal si es que existe.
Otra de las bacterias que pueden desencadenar una respuesta autoinmune por mimetismo molecular es el S. aureus, aunque no se ha comprobado su participación porque es un colonizante normal de la faringe en personas sanas. De hecho, en nuestro estudio la proporción de aislamiento de S. aureus fue similar en ambos grupos: del 48% en pacientes con AA y del 43% en pacientes sin la enfermedad, al igual que las proporciones de otros microorganismos de la flora normal, como los estreptococos alfa hemolíticos y las levaduras del género Candida.
Las inmunizaciones se consideran una causa de alopecia súbita desde el estudio de Wise et al, quienes identificaron 60 casos de alopecia difusa relacionados con vacunas en pacientes con edades comprendidas entre los 2 meses a los 67 años, de los cuales 46 recibieron la de la hepatitis B recombinante y el 84% presentó la alopecia un mes después31. El mecanismo propuesto inicialmente fue el efluvio anágeno y telógeno; sin embargo, esta vacuna contiene HBsAg (antígenos de superficie del virus de hepatitis B), aluminio (adyuvante), mercurio (timerosal como conservador) y levaduras que trabajan de forma sinérgica para generar respuestas autoinmunes32,33.
La asociación entre la vacuna de la hepatitis B recombinante y las enfermedades autoinmunes fue confirmada por Geier en su estudio de casos y controles, en donde las personas vacunadas tenían mayor riesgo de presentar esclerosis múltiple, neuritis óptica, vasculitis, artritis reumatoide, lupus eritematoso, trombocitopenia y alopecia, esta última con un riesgo 6 veces mayor que en la población general34.
El primer estudio que sugirió que la administración de inmunizaciones está asociada a la AA fue el de Guzmán-Sánchez, en donde el 66,6% de los pacientes había recibido una inmunización 6 meses antes del inicio de la AA26. Este dato contrasta con el de nuestro estudio, en donde el porcentaje fue menor, del 54%, pero fue superior a lo encontrado en nuestro grupo control, que fue del 26%. El antecedente de inmunizaciones representa un riesgo 2,3 veces mayor para los pacientes con AA. No se encontró asociación con ninguna vacuna específica, pero las más frecuentes fueron la triple vírica y el toxoide tetánico. Sólo 6 pacientes, 5 con AA y uno en el grupo control, recibieron la vacuna recombinante para la hepatitis B, lo cual no fue estadísticamente significativo, teniendo en cuenta que esta se creía relacionada con la AA.
Posteriormente, Sundberg et al realizaron un experimento en ratones C3H/HeJ para probar si la administración de la vacuna recombinante para la hepatitis B actúa como iniciadora o activadora de la AA. Los ratones que recibieron la vacuna desarrollaron de forma más temprana el episodio de AA que en el grupo control; sin embargo, no se comprobó una diferencia estadísticamente significativa entre ambos grupos35.
Por las características de la población estudiada, que proviene de un centro de referencia de enfermedades dermatológicas, los resultados de este estudio pueden extrapolarse a los pacientes con evolución de la enfermedad inferior a un año, de la variedad en placas, única o múltiples, y con una extensión de la alopecia inferior al 25% de la superficie del cuero cabelludo; es decir, tanto el estado de portador de bacterias patógenas como la aplicación de inmunizaciones son factores de riesgo para pacientes con AA localizada y de evolución corta, lo que apoya la teoría de que pudieran ser inductores de la respuesta autoinmune contra el folículo piloso.
Aunque el diseño de nuestro estudio no nos permite establecer una relación causal entre el estado de portador de bacterias patógenas en la faringe y las inmunizaciones con la AA, sí podemos inferir la participación de estas dos características en el desarrollo de la respuesta autoinmune. La importancia de este descubrimiento radica en sugerir una evaluación más amplia del paciente con AA enfocada a detectar cuadros infecciosos. No se recomienda la suspensión de la administración de inmunizaciones, ya que brindan beneficios para la salud que sobrepasan el probable efecto adverso que sucede en la AA y que debe estudiarse de forma exhaustiva.
FinanciaciónSoporte financiero parcial de los estudios bacteriológicos por parte del laboratorio farmacéutico de productos dermatológicos Representaciones Méx-América.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al laboratorio farmacéutico Representaciones Mex-América por la financiación parcial de este estudio de investigación y al Dr. César Alfonso Maldonado García, por su colaboración en la evaluación de la extensión de la alopecia areata en los pacientes del estudio.